黑龙江省哈尔滨市德强高级中学2024-2025学年高三上学期10月试题 化学(含答案)
文档属性
| 名称 | 黑龙江省哈尔滨市德强高级中学2024-2025学年高三上学期10月试题 化学(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 873.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 18:32:10 | ||
图片预览

文档简介
德强高级中学2024-2025学年度上学期10月月考
化学试题(一卷)
答题时间:75min 满分:100分
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 Cl:35.5 Co:59
一、选题题:共15小题,每小题3分,共45分。每小题的四个选项中,只有一项符合题目要求。
1. 化学与生活、生产密切相关,下列说法正确的是
A. 华为手机mate60使用的麒麟芯片,其主要成分是二氧化硅
B. 煤的干馏可以提高煤的利用率,该过程属于物理变化
C. 利用X射线衍射实验,可对玻璃制的假玉石进行无损鉴定
D. Si粉与反应生成的是一种传统无机非金属材料
2. 下列化学用语表示错误的是
A. 的结构式:
B. F2的共价键电子云轮廓图:
C. 原子核内有8个中子碳原子:
D. 熔融状态下NaHSO4的电离方程式:NaHSO4=Na++
3. 利用烟气中的SO2可回收废水中的I-,实现I2的再生,其反应原理如下图所示。下列说法正确的是
A. 反应①~⑤均是氧化还原反应
B. NH3溶于水能导电,NH3属于电解质
C. 中Co的化合价为+2价
D. 总离子反应方程式为:
4. 利用可将废水中的转化为对环境无害的物质后排放。反应原理为:(未配平)。下列说法正确的是
A. X表示
B. 可用替换
C. 氧化剂与还原剂物质的量之比为
D. 若生成标准状况下的气体,则反应转移的电子数为(表示阿伏加德罗常数的值)
5. 化学实验是化学学科的重要组成部分,下列实验操作正确的是
A.钾元素的焰色试验 B.实验室制备氯气
C.配制一定物质的量浓度的溶液 D.中和反应反应热的测定
A A B. B C. C D. D
6. 下列物质转化错误的是
A. 工业制硝酸:
B. 侯氏制碱法:饱和
C. 工业制硫酸:黄铁矿
D. 工业制高纯硅:
7. 下列各组离子在给定溶液中能大量共存的是
A. 澄清透明的溶液中:Fe3+、Mg2+、SO、Br-
B. 使甲基橙变红色的溶液:Na+、NH、Cl-、ClO-
C. 在0.1mol·L-1氨水中:Ag+、Ba2+、NO、CH3COO-
D. 常温下,的溶液:K+、Na+、[Al(OH)4]-、NO
8. 为阿伏加德罗常数的值。下列有关说法正确的是
A. 标准状况下,的分子数为
B. 含水分子的冰晶体中氢键的数目为
C. 标准状况下,溶于水,溶液中和的微粒数之和为
D. ,当放出热量时,生成的数目为
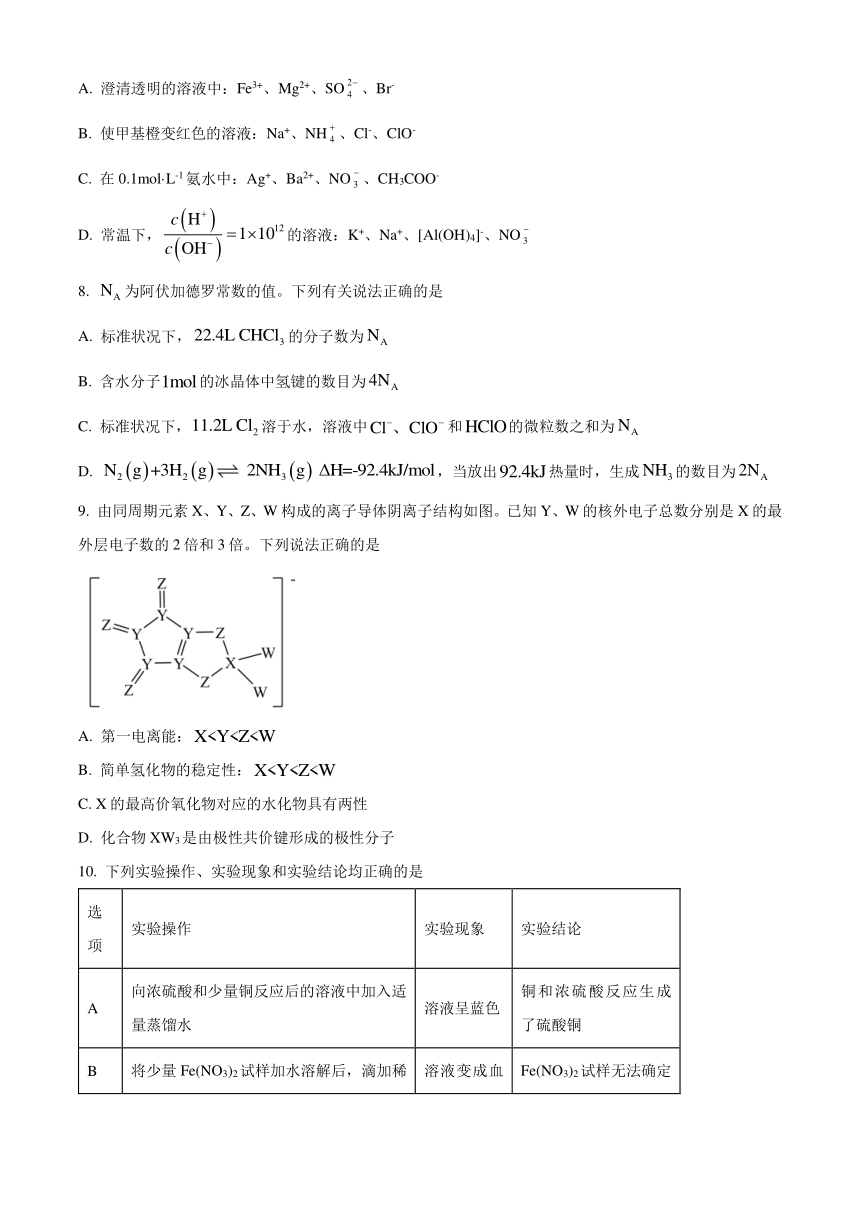
9. 由同周期元素X、Y、Z、W构成的离子导体阴离子结构如图。已知Y、W的核外电子总数分别是X的最外层电子数的2倍和3倍。下列说法正确的是
A. 第一电离能:
B. 简单氢化物的稳定性:
C. X的最高价氧化物对应的水化物具有两性
D. 化合物XW3是由极性共价键形成的极性分子
10. 下列实验操作、实验现象和实验结论均正确的是
选项 实验操作 实验现象 实验结论
A 向浓硫酸和少量铜反应后的溶液中加入适量蒸馏水 溶液呈蓝色 铜和浓硫酸反应生成了硫酸铜
B 将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 溶液变成血红色 Fe(NO3)2试样无法确定是否变质
C 向某溶液中加入浓NaOH溶液并加热,用湿润的蓝色石蕊试纸靠近试管口 试纸不变色 某溶液中一定不含有
D 向某溶液中加入稀盐酸,产生的气体通入到品红溶液中 品红溶液褪色 该溶液中一定含有
A. A B. B C. C D. D
11. 下列热化学方程式或叙述正确的是
A. 使用高效催化剂能降低反应焓变,提高反应速率
B. 同温同压下,在光照和点燃条件下的相同
C. 稀硫酸与溶液反应:
D. 在101kPa下的燃烧热,则水分解的热化学方程式为
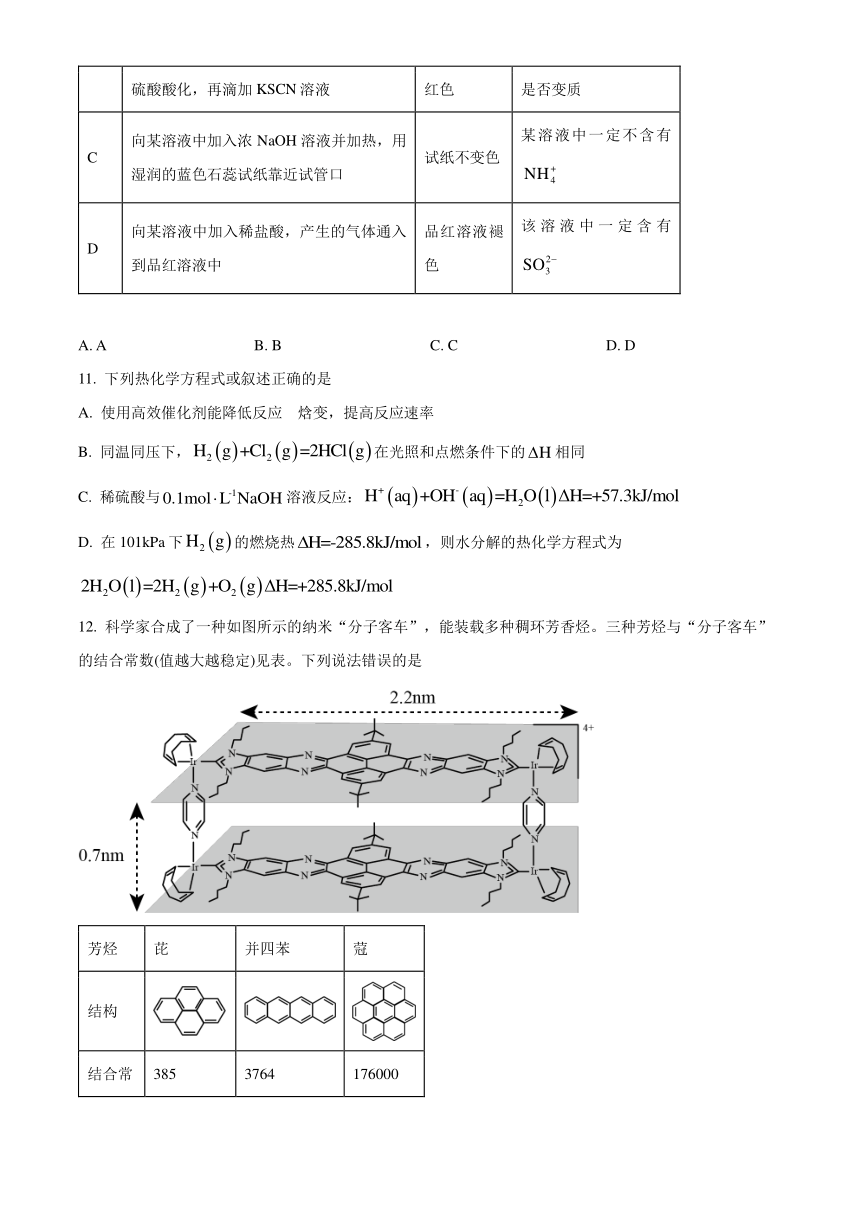
12. 科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见表。下列说法错误的是
芳烃 芘 并四苯 蒄
结构
结合常数 385 3764 176000
A. 芳烃与“分子客车”可通过分子间相互作用形成超分子
B. 并四苯直立装载与平躺装载的稳定性基本相同
C. 从分子大小适配看“分子客车”可装载2个芘
D. 芳烃π电子数越多越有利于和“分子客车”的结合
13. 实验室由环己醇制备环己酮的流程如图所示。
已知:主反应为为放热反应;环己酮可被强氧化剂氧化;环己酮沸点为155℃,能与水形成沸点为95℃的共沸混合物。
下列说法错误的是
A. 反应后加入少量草酸的目的是调节
B. 分批次加入重铬酸钠可防止副产物增多
C. ①、②、③分别是含有硫酸和Cr3+的水相、含NaCl的水相、K2CO3水合物
D. 操作1为蒸馏,收集150~156℃的馏分;获取③的操作为过滤
14. 下列有关离子方程式错误的是
A. 向FeI2溶液中通入少量
B. Ca(OH)2溶液中加入少量的Mg(HCO3)2溶液:
C. K3[Fe(CN)6]溶液滴入FeCl2溶液中:
D. TiCl4加入水中:
15. 硫化锌是一种优良的宽带隙半导体锂离子电池的负极材料,具有在充电的同时发生合金化反应的特点。在充电过程中负极材料晶胞的组成变化如图所示,下列说法正确的是
A.
B. 晶体中的配位数是12
C. 若的晶胞参数为anm,则E、F间的距离为
D. 当完全转化为时,和转化为LiZn(合金相),每转移理论上生成
二、非选择题:本题共4小题,共55分
16. 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,易潮解,易溶于水。某实验室制备亚硝酸钠装置如下图(部分夹持装置略,气密性已检验):
已知:①
②酸性条件下,NO或,都能与反应生成和。
(1)仪器a的名称为___________。反应开始前,先通入N2至装置F中产生大量气泡,其目的是___________。
(2)装置B中盛放的试剂为水,其目的用化学方程式表示是___________。
(3)当Na2O2完全反应后,D中的固体除NaNO2外,还可能有NaNO3。测定NaNO2纯度的步骤如下:
i.配制0.1000mol/LKMnO4标准溶液,并进行酸化。
ⅱ.称取4.0g样品溶于水配成250mL溶液,取其中25.00mL于锥形瓶中进行滴定,消耗20.00mL酸性KMnO4标准液
①步骤ⅱ中达到滴定终点的标志为___________。
②混合固体中NaNO2的质量分数为___________。(保留三位有效数字)
③若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得NaNO2的纯度___________。(填“偏高”、“偏低”或“无影响”)
17. I.
(1)下列变化属于吸热反应的是___________(填序号)。
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤NH4NO3固体溶于水 ⑥盐酸与碳酸氢钠反应
(2)已知:25℃、101kPa时,
①
②
③
则___________。
Ⅱ.黄铜矿是工业炼铜,炼铁和制硫酸的重要原料。回答下列问题:
(3)基态Fe2+的价层电子轨道表示式为___________。
(4)①Cu2+可以形成多种配合物。将稀氨水逐滴滴加到CuSO4溶液中,出现蓝色沉淀,滴加一定量氨水后蓝色沉淀溶解,得深蓝色溶液,沉淀溶解的化学方程式为___________;阴离子中心原子是___________杂化方式。
②氨是一种极易溶于水的气体。氨气极易溶于水的主要原因是___________。
③所形成含铜配离子中键角___________(填“大于”、“小于”或“等于”)单个氨气分子中键角。
(5)改性是一种优良的磁性材料,晶胞的的结构如图所示,研究发现结构中的只可能出现在图中某一“▲”所示位置上,请确定在晶胞中的位置是___________(填“a”或“b”或“c”)。
18. 草酸钴在化学中应用广泛,可以用于制取催化剂和指示剂。以钴矿[主要成分是CoO、、,还含有少量、CuO、FeO及杂质]制取草酸钴晶体的工艺流程如图所示:
常温下,有关沉淀数据如表(完全沉淀时,金属离子浓度)。
沉淀
恰好完全沉淀时 10.1 9.4 6.7 2.8 5.2
回答下列问题:
(1)“浸取”前,需要对钴矿进行粉碎处理的目的是___________;浸出液中主要含有、和离子,写出“浸取”时,发生反应的化学方程式:___________。
(2)“氧化”时,发生反应的离子方程式为___________。
(3)常温下,“调节”得到的沉淀X的主要成分是___________。
(4)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂,发生反应:。反萃取时,应加入的物质是___________(填溶液名称)。
(5)钴的氧化物常用作颜料或反应催化剂,可以由草酸钴晶体在空气中加热制取,取草酸钴晶体,在空气中加热至恒重,得到CoO与的混合物,该混合物中CoO与的物质的量之比为___________。
19. 某研究小组按以下路线对内酰胺F的合成进行了探索:
回答下列问题:
(1)C的名称为___________,它在酸溶液中用甲醇处理,可得到制备___________(填标号)的原料。
a.涤纶 b.尼龙 c.维纶 d.有机玻璃
(2)下列反应中不属于加成反应的有___________(填标号)。
a.A→B b.B→C c.E→F
(3)写出C→D化学方程式___________。
(4)已知(亚胺)。然而,E在室温下主要生成,原因是___________。
(5)已知亚胺易被还原。D→E中,催化加氢需在酸性条件下进行的原因是___________,若催化加氢时,不加入酸,则生成分子式为的化合物H,其结构简式为___________。
德强高级中学2024-2025学年度上学期10月月考
化学试题(一卷)
答题时间:75min 满分:100分
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 Cl:35.5 Co:59
一、选题题:共15小题,每小题3分,共45分。每小题的四个选项中,只有一项符合题目要求。
【1题答案】
【答案】C
【2题答案】
【答案】C
【3题答案】
【答案】D
【4题答案】
【答案】C
【5题答案】
【答案】A
【6题答案】
【答案】A
【7题答案】
【答案】A
【8题答案】
【答案】D
【9题答案】
【答案】AB
【10题答案】
【答案】B
【11题答案】
【答案】B
【12题答案】
【答案】B
【13题答案】
【答案】A
【14题答案】
【答案】B
【15题答案】
【答案】C
二、非选择题:本题共4小题,共55分
【16题答案】
【答案】(1) ①. 三颈烧瓶 ②. 排尽装置内空气,防止产物不纯
(2)将A装置中生成的NO2转化为NO
(3) ①. 滴入最后半滴酸性高锰酸钾标准溶液后,溶液由无色变为淡紫红色,且半分钟内不褪色 ②. 86.3% ③. 偏高
【17题答案】
【答案】(1)②③⑥ (2)-248kJ/mol
(3) (4) ①. Cu(OH)2+4NH3= ②. sp3 ③. NH3与H2O之间能够形成氢键 ④. 大于
(5)c
【18题答案】
【答案】(1) ①. 增大接触面积,加快反应速率,提高浸出率 ②.
(2)
(3)、、
(4)稀硫酸 (5)
【19题答案】
【答案】(1) ①. 2-甲基丙烯腈 ②. d
(2)bc (3)+ CH3COCH2COOCH2CH3
(4)亚胺不稳定,易发生重排反应而生成G
(5) ①. —CN与氢气发生加成反应的—NH2能和氢离子反应生成,不易与羰基反应生成亚胺 ②.
化学试题(一卷)
答题时间:75min 满分:100分
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 Cl:35.5 Co:59
一、选题题:共15小题,每小题3分,共45分。每小题的四个选项中,只有一项符合题目要求。
1. 化学与生活、生产密切相关,下列说法正确的是
A. 华为手机mate60使用的麒麟芯片,其主要成分是二氧化硅
B. 煤的干馏可以提高煤的利用率,该过程属于物理变化
C. 利用X射线衍射实验,可对玻璃制的假玉石进行无损鉴定
D. Si粉与反应生成的是一种传统无机非金属材料
2. 下列化学用语表示错误的是
A. 的结构式:
B. F2的共价键电子云轮廓图:
C. 原子核内有8个中子碳原子:
D. 熔融状态下NaHSO4的电离方程式:NaHSO4=Na++
3. 利用烟气中的SO2可回收废水中的I-,实现I2的再生,其反应原理如下图所示。下列说法正确的是
A. 反应①~⑤均是氧化还原反应
B. NH3溶于水能导电,NH3属于电解质
C. 中Co的化合价为+2价
D. 总离子反应方程式为:
4. 利用可将废水中的转化为对环境无害的物质后排放。反应原理为:(未配平)。下列说法正确的是
A. X表示
B. 可用替换
C. 氧化剂与还原剂物质的量之比为
D. 若生成标准状况下的气体,则反应转移的电子数为(表示阿伏加德罗常数的值)
5. 化学实验是化学学科的重要组成部分,下列实验操作正确的是
A.钾元素的焰色试验 B.实验室制备氯气
C.配制一定物质的量浓度的溶液 D.中和反应反应热的测定
A A B. B C. C D. D
6. 下列物质转化错误的是
A. 工业制硝酸:
B. 侯氏制碱法:饱和
C. 工业制硫酸:黄铁矿
D. 工业制高纯硅:
7. 下列各组离子在给定溶液中能大量共存的是
A. 澄清透明的溶液中:Fe3+、Mg2+、SO、Br-
B. 使甲基橙变红色的溶液:Na+、NH、Cl-、ClO-
C. 在0.1mol·L-1氨水中:Ag+、Ba2+、NO、CH3COO-
D. 常温下,的溶液:K+、Na+、[Al(OH)4]-、NO
8. 为阿伏加德罗常数的值。下列有关说法正确的是
A. 标准状况下,的分子数为
B. 含水分子的冰晶体中氢键的数目为
C. 标准状况下,溶于水,溶液中和的微粒数之和为
D. ,当放出热量时,生成的数目为
9. 由同周期元素X、Y、Z、W构成的离子导体阴离子结构如图。已知Y、W的核外电子总数分别是X的最外层电子数的2倍和3倍。下列说法正确的是
A. 第一电离能:
B. 简单氢化物的稳定性:
C. X的最高价氧化物对应的水化物具有两性
D. 化合物XW3是由极性共价键形成的极性分子
10. 下列实验操作、实验现象和实验结论均正确的是
选项 实验操作 实验现象 实验结论
A 向浓硫酸和少量铜反应后的溶液中加入适量蒸馏水 溶液呈蓝色 铜和浓硫酸反应生成了硫酸铜
B 将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 溶液变成血红色 Fe(NO3)2试样无法确定是否变质
C 向某溶液中加入浓NaOH溶液并加热,用湿润的蓝色石蕊试纸靠近试管口 试纸不变色 某溶液中一定不含有
D 向某溶液中加入稀盐酸,产生的气体通入到品红溶液中 品红溶液褪色 该溶液中一定含有
A. A B. B C. C D. D
11. 下列热化学方程式或叙述正确的是
A. 使用高效催化剂能降低反应焓变,提高反应速率
B. 同温同压下,在光照和点燃条件下的相同
C. 稀硫酸与溶液反应:
D. 在101kPa下的燃烧热,则水分解的热化学方程式为
12. 科学家合成了一种如图所示的纳米“分子客车”,能装载多种稠环芳香烃。三种芳烃与“分子客车”的结合常数(值越大越稳定)见表。下列说法错误的是
芳烃 芘 并四苯 蒄
结构
结合常数 385 3764 176000
A. 芳烃与“分子客车”可通过分子间相互作用形成超分子
B. 并四苯直立装载与平躺装载的稳定性基本相同
C. 从分子大小适配看“分子客车”可装载2个芘
D. 芳烃π电子数越多越有利于和“分子客车”的结合
13. 实验室由环己醇制备环己酮的流程如图所示。
已知:主反应为为放热反应;环己酮可被强氧化剂氧化;环己酮沸点为155℃,能与水形成沸点为95℃的共沸混合物。
下列说法错误的是
A. 反应后加入少量草酸的目的是调节
B. 分批次加入重铬酸钠可防止副产物增多
C. ①、②、③分别是含有硫酸和Cr3+的水相、含NaCl的水相、K2CO3水合物
D. 操作1为蒸馏,收集150~156℃的馏分;获取③的操作为过滤
14. 下列有关离子方程式错误的是
A. 向FeI2溶液中通入少量
B. Ca(OH)2溶液中加入少量的Mg(HCO3)2溶液:
C. K3[Fe(CN)6]溶液滴入FeCl2溶液中:
D. TiCl4加入水中:
15. 硫化锌是一种优良的宽带隙半导体锂离子电池的负极材料,具有在充电的同时发生合金化反应的特点。在充电过程中负极材料晶胞的组成变化如图所示,下列说法正确的是
A.
B. 晶体中的配位数是12
C. 若的晶胞参数为anm,则E、F间的距离为
D. 当完全转化为时,和转化为LiZn(合金相),每转移理论上生成
二、非选择题:本题共4小题,共55分
16. 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,易潮解,易溶于水。某实验室制备亚硝酸钠装置如下图(部分夹持装置略,气密性已检验):
已知:①
②酸性条件下,NO或,都能与反应生成和。
(1)仪器a的名称为___________。反应开始前,先通入N2至装置F中产生大量气泡,其目的是___________。
(2)装置B中盛放的试剂为水,其目的用化学方程式表示是___________。
(3)当Na2O2完全反应后,D中的固体除NaNO2外,还可能有NaNO3。测定NaNO2纯度的步骤如下:
i.配制0.1000mol/LKMnO4标准溶液,并进行酸化。
ⅱ.称取4.0g样品溶于水配成250mL溶液,取其中25.00mL于锥形瓶中进行滴定,消耗20.00mL酸性KMnO4标准液
①步骤ⅱ中达到滴定终点的标志为___________。
②混合固体中NaNO2的质量分数为___________。(保留三位有效数字)
③若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得NaNO2的纯度___________。(填“偏高”、“偏低”或“无影响”)
17. I.
(1)下列变化属于吸热反应的是___________(填序号)。
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤NH4NO3固体溶于水 ⑥盐酸与碳酸氢钠反应
(2)已知:25℃、101kPa时,
①
②
③
则___________。
Ⅱ.黄铜矿是工业炼铜,炼铁和制硫酸的重要原料。回答下列问题:
(3)基态Fe2+的价层电子轨道表示式为___________。
(4)①Cu2+可以形成多种配合物。将稀氨水逐滴滴加到CuSO4溶液中,出现蓝色沉淀,滴加一定量氨水后蓝色沉淀溶解,得深蓝色溶液,沉淀溶解的化学方程式为___________;阴离子中心原子是___________杂化方式。
②氨是一种极易溶于水的气体。氨气极易溶于水的主要原因是___________。
③所形成含铜配离子中键角___________(填“大于”、“小于”或“等于”)单个氨气分子中键角。
(5)改性是一种优良的磁性材料,晶胞的的结构如图所示,研究发现结构中的只可能出现在图中某一“▲”所示位置上,请确定在晶胞中的位置是___________(填“a”或“b”或“c”)。
18. 草酸钴在化学中应用广泛,可以用于制取催化剂和指示剂。以钴矿[主要成分是CoO、、,还含有少量、CuO、FeO及杂质]制取草酸钴晶体的工艺流程如图所示:
常温下,有关沉淀数据如表(完全沉淀时,金属离子浓度)。
沉淀
恰好完全沉淀时 10.1 9.4 6.7 2.8 5.2
回答下列问题:
(1)“浸取”前,需要对钴矿进行粉碎处理的目的是___________;浸出液中主要含有、和离子,写出“浸取”时,发生反应的化学方程式:___________。
(2)“氧化”时,发生反应的离子方程式为___________。
(3)常温下,“调节”得到的沉淀X的主要成分是___________。
(4)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂,发生反应:。反萃取时,应加入的物质是___________(填溶液名称)。
(5)钴的氧化物常用作颜料或反应催化剂,可以由草酸钴晶体在空气中加热制取,取草酸钴晶体,在空气中加热至恒重,得到CoO与的混合物,该混合物中CoO与的物质的量之比为___________。
19. 某研究小组按以下路线对内酰胺F的合成进行了探索:
回答下列问题:
(1)C的名称为___________,它在酸溶液中用甲醇处理,可得到制备___________(填标号)的原料。
a.涤纶 b.尼龙 c.维纶 d.有机玻璃
(2)下列反应中不属于加成反应的有___________(填标号)。
a.A→B b.B→C c.E→F
(3)写出C→D化学方程式___________。
(4)已知(亚胺)。然而,E在室温下主要生成,原因是___________。
(5)已知亚胺易被还原。D→E中,催化加氢需在酸性条件下进行的原因是___________,若催化加氢时,不加入酸,则生成分子式为的化合物H,其结构简式为___________。
德强高级中学2024-2025学年度上学期10月月考
化学试题(一卷)
答题时间:75min 满分:100分
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 Cl:35.5 Co:59
一、选题题:共15小题,每小题3分,共45分。每小题的四个选项中,只有一项符合题目要求。
【1题答案】
【答案】C
【2题答案】
【答案】C
【3题答案】
【答案】D
【4题答案】
【答案】C
【5题答案】
【答案】A
【6题答案】
【答案】A
【7题答案】
【答案】A
【8题答案】
【答案】D
【9题答案】
【答案】AB
【10题答案】
【答案】B
【11题答案】
【答案】B
【12题答案】
【答案】B
【13题答案】
【答案】A
【14题答案】
【答案】B
【15题答案】
【答案】C
二、非选择题:本题共4小题,共55分
【16题答案】
【答案】(1) ①. 三颈烧瓶 ②. 排尽装置内空气,防止产物不纯
(2)将A装置中生成的NO2转化为NO
(3) ①. 滴入最后半滴酸性高锰酸钾标准溶液后,溶液由无色变为淡紫红色,且半分钟内不褪色 ②. 86.3% ③. 偏高
【17题答案】
【答案】(1)②③⑥ (2)-248kJ/mol
(3) (4) ①. Cu(OH)2+4NH3= ②. sp3 ③. NH3与H2O之间能够形成氢键 ④. 大于
(5)c
【18题答案】
【答案】(1) ①. 增大接触面积,加快反应速率,提高浸出率 ②.
(2)
(3)、、
(4)稀硫酸 (5)
【19题答案】
【答案】(1) ①. 2-甲基丙烯腈 ②. d
(2)bc (3)+ CH3COCH2COOCH2CH3
(4)亚胺不稳定,易发生重排反应而生成G
(5) ①. —CN与氢气发生加成反应的—NH2能和氢离子反应生成,不易与羰基反应生成亚胺 ②.
同课章节目录
