3.1.1弱电解质的电离平衡(教学课件)(共28张PPT)—高中化学苏教版(2019)选择性必修一
文档属性
| 名称 | 3.1.1弱电解质的电离平衡(教学课件)(共28张PPT)—高中化学苏教版(2019)选择性必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-01 22:04:29 | ||
图片预览







文档简介
(共28张PPT)
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
第一课时 弱电解质的电离平衡
课前导入
盐酸主要用于卫生清洁,如洁厕剂的主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)?
课前导入
电解质:在水溶液中或熔融状态下能导电的化合物。如:酸、碱、盐、活泼金属氧化物、H2O。
电离:电解质溶于水或受热融化时,形成自由移动的离子的过程。
非电解质:在水溶液和熔融状态下都不能导电的化合物。如:多数有机化合物、非金属氧化物和氨等。
课前导入
疑点突破:
1.电解质、非电解质的前提必须为化合物,故单质、混合物既不是电解质也不是非电解质;
2.电解质必须是化合物本身能电离出离子,否则不属于电解质。例:NH3、SO2、CO2 ;
3.电解质的导电:导电的条件是溶于水或熔融状态;
4.导电的本质是自由离子的定向移动;
5.导电能力与离子浓度和离子所带电荷有关。
强电解质和弱电解质
探究盐酸和醋酸的电离程度
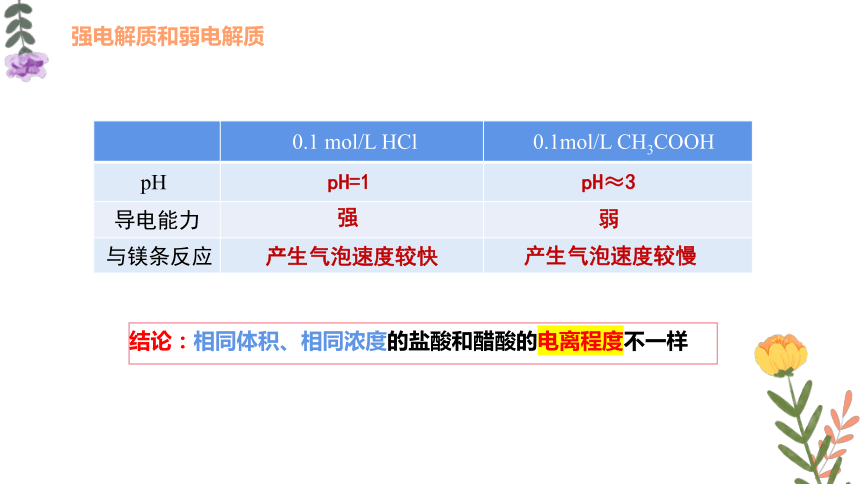
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
pH
导电能力
与镁条反应
0.1 mol/L HCl
0.1mol/L CH3COOH
不同的电解质在水溶液中的电离程度是否有差异呢?
强电解质和弱电解质
强电解质和弱电解质
pH
导电能力
与镁条反应
0.1 mol/L HCl
0.1mol/L CH3COOH
pH=1
pH≈3
强
弱
产生气泡速度较快
产生气泡速度较慢
结论:相同体积、相同浓度的盐酸和醋酸的电离程度不一样
强电解质和弱电解质
微观分析
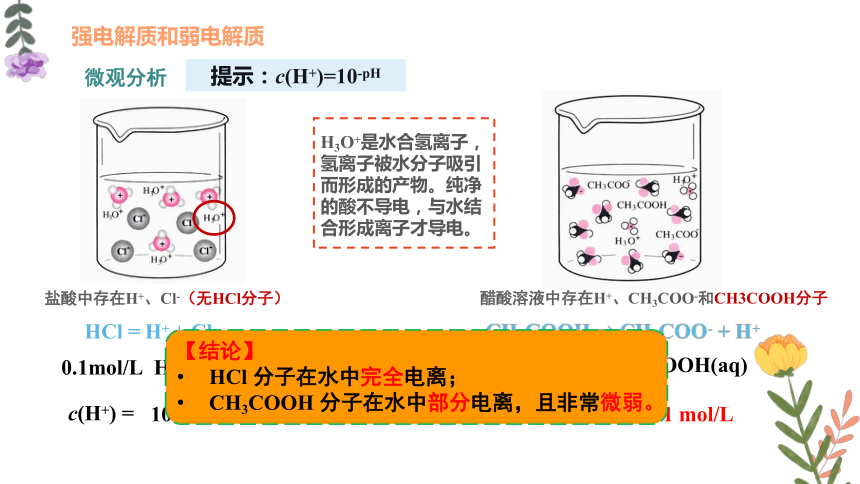
盐酸中存在H+、Cl-(无HCl分子)
醋酸溶液中存在H+、CH3COO-和CH3COOH分子
0.1mol/L HCl(aq)
c(H+) =
10-1
=0.1 mol/L
HCl = H+ + Cl-
提示:c(H+)=10-pH
0.1mol/L CH3COOH(aq)
c(H+) ≈
0.001 mol/L
CH3COOH CH3COO- + H+
H3O+是水合氢离子,氢离子被水分子吸引而形成的产物。纯净的酸不导电,与水结合形成离子才导电。
【结论】
HCl 分子在水中完全电离;
CH3COOH 分子在水中部分电离,且非常微弱。
强电解质和弱电解质
强电解质
弱电解质
电解质
在水溶液里全部电离成离子
在水溶液里只有部分分子电离成离子
①强酸:HCl、H2SO4等;②强碱:NaOH、Ca(OH)2等
③绝大多数盐:如NaCl、BaSO4等
④活泼金属氧化物:Na2O、CaO等
①弱酸:HF、HClO、CH3COOH、H2CO3、H2S、H2SO3、H3PO4 等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
③水是极弱的电解质。
④少数盐:(CH3COO)2Pb
强电解质、弱电解质与其溶解性无关
弱电解质的电离平衡
电离方程式的书写
强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸分步电离,分步书写电离方程式,多元弱碱也是分步电离,但可按一步电离写出。
强电解质
强酸
强碱
正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl == H+ + Cl-
完全电离,如Ba(OH)2 == Ba2+ + 2OH-
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- ;HCO3- H++CO32-
NaHSO4 (熔融) =Na++HSO4- (熔融态)
弱电解质的电离平衡
我们将冰醋酸加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
为什么醋酸的电离用“ ”表示?能否从微观角度给出解释?
弱电解质的电离平衡
CH3COOH CH3COO-+H+
电离过程是可逆的,故存在电离平衡。
左→右:弱电解质电离成离子
右←左:离子结合成弱电解质
CH3COOH
液 面
CH3COO-
H3O+
CH3COOH
CH3COO-
H3O+
电离
结合
H2O
H2O
CH3COOH+H2O CH3COO-+H3O+
醋酸在水溶液中电离的化学方程式可表示为:
在水溶液中,分子或离子通常与一定数目的水分子结合在一起,其中水合氢离子中的H2O可省略不写,用氢离子表示,则其电离方程式可表示为:
弱电解质的电离平衡
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
电离平衡也是一种化学平衡
在一定温度下,当弱电解质在水溶液中的电离达到最大限度时,电离过程并未停止。此时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中弱电解质分子和离子的浓度都不再发生变化,弱电解质的电离达到了电离平衡状态。
弱电解质的电离平衡
弱
等
动
定
变
——研究对象为弱电解质
——v电离= v结合≠0
——弱电解质分子电离成离子的速率和离子重新结合成弱电解质分子的
速率相等
——平衡时,溶液中离子浓度和分子浓度都保持不变
——外界条件改变,电离平衡发生改变
电离平衡特征:
弱电解质的电离平衡
如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。
1.电离过程是吸热的。
2.弱电解质的电离属于可逆过程,分子、离子共存。
3.弱电解质在溶液中的电离都是微弱的。
4.电离方向是微粒数增多的过程。
弱电解质电离的特点
弱电解质的电离平衡
影响弱电解质电离平衡的因素有哪些
电离平衡移动方向又有什么规律呢
电离平衡移动也遵循勒夏特列原理
影响因素 平衡移动方向
温度
浓度
影响因素:温度、浓度、压强
升温电离平衡向吸热方向移动
增大某粒子浓度电离平衡向该粒子浓度减小的方向移动
×
弱电解质的电离平衡
改变 条件 电离平衡移动方向 C(H+) C(Ac-) C(HAc) 导电能力 电离程度
(电离度)
通HCl气体
加NaOH(s)
加NaAc(s)
加冰醋酸
加Na2CO3
逆向
增大
减小
正向
减小
增大
减小
逆向
减小
增大
增大
增大
减小
增大
减小
增大
增大
减小
正向
增大
对0.1mol/L的CH3COOH溶液进行下列操作,请判断填空
正向
减小
减小
增强
增大
增大
增强
增强
增强
增强
弱电解质的电离平衡
通常电解质越弱电离程度越小。
内因:
①温度
②浓度
③其他因素
外因:
电离平衡是动态平衡,遵循勒夏特列原理
特别说明:电离程度相当于化学反应中反应物的转化率
已电离弱电解质分子数
原弱电解质分子数
×100%
电离度 =
已电离的溶质浓度
溶质的初始浓度
= ————————×100%
弱电解质的电离平衡
①加水稀释:平衡向右移动,电离程度增大。(越稀越电离)
②增大弱电解质浓度:平衡向右移动,电离程度减小;(越稀越电离)
③同离子效应:在弱电解质溶液中加入同弱电解质具有相同离子的
强电解质,使电离平衡逆向移动。(同粒抑电离)
④化学反应:在弱电解质溶液中加入能与弱电解质电离出的某种离子
反应的物质时,使电离平衡正向移动。(反应促电离)
(1)浓度的影响:
弱电解质的电离平衡
【结论】由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡逆向移动,电离程度减小。
CH3COOH CH3COO- + H+
【思考】c(CH3COO-)和c(H+)怎样变化?
增大
△H>0
“越热越电离”
【特别注意】易挥发或易分解的弱电解质的电离平衡,温度过高,使分子浓度减小,平衡向逆向移动。
(2)温度的影响:
弱电解质的电离平衡
CO2、H2CO3?
思考:小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬的情况。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
人体血液的pH需维持在7.35~7.45。
当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
小孩大哭后出现的生理症状,与上述平衡相关,是随着哭泣,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
弱电解质的电离平衡
分析问题的化学本质
直接吸入大量CO2合理吗?
需要控制条件,使上述平衡正向移动
【思考】出现轻微碱中毒后,如何缓解中毒症状呢?
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度
严重时需及时就医
H2O + CO2 H2CO3 H+ + HCO3-
随堂训练
1.下列物质的分类组合全部正确的是( )
选项 强电解质 弱电解质 非电解质
A NaCl HF Cl2
B NaHSO4 NaHCO3 CCl4
C Ba(OH)2 HCl Cu
D AgCl H2S C2H5OH
D
随堂训练
2.将1 mol冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是( )
A.CH3COOH的浓度达到1 mol·L-1
B.H+的浓度达到0.5 mol·L-1
C.CH3COOH的浓度、CH3COO-的浓度、H+的浓度均为0.5 mol·L-1
D.CH3COOH分子电离成离子的速率和离子重新结合成CH3COOH分子的速率相等
D
随堂训练
3.醋酸是电解质,下列能说明醋酸的是( )
A. 醋酸与水能以任意比例互溶
B. 0.1 mol·L-1醋酸的pH比0.1 mol·L-1的盐酸的pH大
C. 蛋壳浸入白醋中有气体放出
D. 大小相同的锌粒与盐酸和醋酸反应,醋酸产生H2的速率慢
B
随堂训练
4.在氨水中存在下列电离平衡:NH3·H2O NH4++OH-,下列情况能引起电离平衡向正向移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl
④加CH3COOH溶液 ⑤加水 ⑥加压
A.①③⑤ B.①④⑥ C.③④⑤ D.①②④
C
随堂训练
5.【双选】c(H+)相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,则下列说法正确的是( )
A.反应开始时的速率:甲>乙
B.反应结束时的c(H+):甲<乙
C.反应开始时的酸的物质的量浓度:甲=乙
D.反应所需时间:甲>乙
BD
谢谢观看
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
第一课时 弱电解质的电离平衡
课前导入
盐酸主要用于卫生清洁,如洁厕剂的主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)?
课前导入
电解质:在水溶液中或熔融状态下能导电的化合物。如:酸、碱、盐、活泼金属氧化物、H2O。
电离:电解质溶于水或受热融化时,形成自由移动的离子的过程。
非电解质:在水溶液和熔融状态下都不能导电的化合物。如:多数有机化合物、非金属氧化物和氨等。
课前导入
疑点突破:
1.电解质、非电解质的前提必须为化合物,故单质、混合物既不是电解质也不是非电解质;
2.电解质必须是化合物本身能电离出离子,否则不属于电解质。例:NH3、SO2、CO2 ;
3.电解质的导电:导电的条件是溶于水或熔融状态;
4.导电的本质是自由离子的定向移动;
5.导电能力与离子浓度和离子所带电荷有关。
强电解质和弱电解质
探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
pH
导电能力
与镁条反应
0.1 mol/L HCl
0.1mol/L CH3COOH
不同的电解质在水溶液中的电离程度是否有差异呢?
强电解质和弱电解质
强电解质和弱电解质
pH
导电能力
与镁条反应
0.1 mol/L HCl
0.1mol/L CH3COOH
pH=1
pH≈3
强
弱
产生气泡速度较快
产生气泡速度较慢
结论:相同体积、相同浓度的盐酸和醋酸的电离程度不一样
强电解质和弱电解质
微观分析
盐酸中存在H+、Cl-(无HCl分子)
醋酸溶液中存在H+、CH3COO-和CH3COOH分子
0.1mol/L HCl(aq)
c(H+) =
10-1
=0.1 mol/L
HCl = H+ + Cl-
提示:c(H+)=10-pH
0.1mol/L CH3COOH(aq)
c(H+) ≈
0.001 mol/L
CH3COOH CH3COO- + H+
H3O+是水合氢离子,氢离子被水分子吸引而形成的产物。纯净的酸不导电,与水结合形成离子才导电。
【结论】
HCl 分子在水中完全电离;
CH3COOH 分子在水中部分电离,且非常微弱。
强电解质和弱电解质
强电解质
弱电解质
电解质
在水溶液里全部电离成离子
在水溶液里只有部分分子电离成离子
①强酸:HCl、H2SO4等;②强碱:NaOH、Ca(OH)2等
③绝大多数盐:如NaCl、BaSO4等
④活泼金属氧化物:Na2O、CaO等
①弱酸:HF、HClO、CH3COOH、H2CO3、H2S、H2SO3、H3PO4 等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
③水是极弱的电解质。
④少数盐:(CH3COO)2Pb
强电解质、弱电解质与其溶解性无关
弱电解质的电离平衡
电离方程式的书写
强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸分步电离,分步书写电离方程式,多元弱碱也是分步电离,但可按一步电离写出。
强电解质
强酸
强碱
正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl == H+ + Cl-
完全电离,如Ba(OH)2 == Ba2+ + 2OH-
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- ;HCO3- H++CO32-
NaHSO4 (熔融) =Na++HSO4- (熔融态)
弱电解质的电离平衡
我们将冰醋酸加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
为什么醋酸的电离用“ ”表示?能否从微观角度给出解释?
弱电解质的电离平衡
CH3COOH CH3COO-+H+
电离过程是可逆的,故存在电离平衡。
左→右:弱电解质电离成离子
右←左:离子结合成弱电解质
CH3COOH
液 面
CH3COO-
H3O+
CH3COOH
CH3COO-
H3O+
电离
结合
H2O
H2O
CH3COOH+H2O CH3COO-+H3O+
醋酸在水溶液中电离的化学方程式可表示为:
在水溶液中,分子或离子通常与一定数目的水分子结合在一起,其中水合氢离子中的H2O可省略不写,用氢离子表示,则其电离方程式可表示为:
弱电解质的电离平衡
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
电离平衡也是一种化学平衡
在一定温度下,当弱电解质在水溶液中的电离达到最大限度时,电离过程并未停止。此时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中弱电解质分子和离子的浓度都不再发生变化,弱电解质的电离达到了电离平衡状态。
弱电解质的电离平衡
弱
等
动
定
变
——研究对象为弱电解质
——v电离= v结合≠0
——弱电解质分子电离成离子的速率和离子重新结合成弱电解质分子的
速率相等
——平衡时,溶液中离子浓度和分子浓度都保持不变
——外界条件改变,电离平衡发生改变
电离平衡特征:
弱电解质的电离平衡
如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。
1.电离过程是吸热的。
2.弱电解质的电离属于可逆过程,分子、离子共存。
3.弱电解质在溶液中的电离都是微弱的。
4.电离方向是微粒数增多的过程。
弱电解质电离的特点
弱电解质的电离平衡
影响弱电解质电离平衡的因素有哪些
电离平衡移动方向又有什么规律呢
电离平衡移动也遵循勒夏特列原理
影响因素 平衡移动方向
温度
浓度
影响因素:温度、浓度、压强
升温电离平衡向吸热方向移动
增大某粒子浓度电离平衡向该粒子浓度减小的方向移动
×
弱电解质的电离平衡
改变 条件 电离平衡移动方向 C(H+) C(Ac-) C(HAc) 导电能力 电离程度
(电离度)
通HCl气体
加NaOH(s)
加NaAc(s)
加冰醋酸
加Na2CO3
逆向
增大
减小
正向
减小
增大
减小
逆向
减小
增大
增大
增大
减小
增大
减小
增大
增大
减小
正向
增大
对0.1mol/L的CH3COOH溶液进行下列操作,请判断填空
正向
减小
减小
增强
增大
增大
增强
增强
增强
增强
弱电解质的电离平衡
通常电解质越弱电离程度越小。
内因:
①温度
②浓度
③其他因素
外因:
电离平衡是动态平衡,遵循勒夏特列原理
特别说明:电离程度相当于化学反应中反应物的转化率
已电离弱电解质分子数
原弱电解质分子数
×100%
电离度 =
已电离的溶质浓度
溶质的初始浓度
= ————————×100%
弱电解质的电离平衡
①加水稀释:平衡向右移动,电离程度增大。(越稀越电离)
②增大弱电解质浓度:平衡向右移动,电离程度减小;(越稀越电离)
③同离子效应:在弱电解质溶液中加入同弱电解质具有相同离子的
强电解质,使电离平衡逆向移动。(同粒抑电离)
④化学反应:在弱电解质溶液中加入能与弱电解质电离出的某种离子
反应的物质时,使电离平衡正向移动。(反应促电离)
(1)浓度的影响:
弱电解质的电离平衡
【结论】由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡逆向移动,电离程度减小。
CH3COOH CH3COO- + H+
【思考】c(CH3COO-)和c(H+)怎样变化?
增大
△H>0
“越热越电离”
【特别注意】易挥发或易分解的弱电解质的电离平衡,温度过高,使分子浓度减小,平衡向逆向移动。
(2)温度的影响:
弱电解质的电离平衡
CO2、H2CO3?
思考:小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬的情况。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
人体血液的pH需维持在7.35~7.45。
当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
小孩大哭后出现的生理症状,与上述平衡相关,是随着哭泣,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
弱电解质的电离平衡
分析问题的化学本质
直接吸入大量CO2合理吗?
需要控制条件,使上述平衡正向移动
【思考】出现轻微碱中毒后,如何缓解中毒症状呢?
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度
严重时需及时就医
H2O + CO2 H2CO3 H+ + HCO3-
随堂训练
1.下列物质的分类组合全部正确的是( )
选项 强电解质 弱电解质 非电解质
A NaCl HF Cl2
B NaHSO4 NaHCO3 CCl4
C Ba(OH)2 HCl Cu
D AgCl H2S C2H5OH
D
随堂训练
2.将1 mol冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是( )
A.CH3COOH的浓度达到1 mol·L-1
B.H+的浓度达到0.5 mol·L-1
C.CH3COOH的浓度、CH3COO-的浓度、H+的浓度均为0.5 mol·L-1
D.CH3COOH分子电离成离子的速率和离子重新结合成CH3COOH分子的速率相等
D
随堂训练
3.醋酸是电解质,下列能说明醋酸的是( )
A. 醋酸与水能以任意比例互溶
B. 0.1 mol·L-1醋酸的pH比0.1 mol·L-1的盐酸的pH大
C. 蛋壳浸入白醋中有气体放出
D. 大小相同的锌粒与盐酸和醋酸反应,醋酸产生H2的速率慢
B
随堂训练
4.在氨水中存在下列电离平衡:NH3·H2O NH4++OH-,下列情况能引起电离平衡向正向移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl
④加CH3COOH溶液 ⑤加水 ⑥加压
A.①③⑤ B.①④⑥ C.③④⑤ D.①②④
C
随堂训练
5.【双选】c(H+)相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,则下列说法正确的是( )
A.反应开始时的速率:甲>乙
B.反应结束时的c(H+):甲<乙
C.反应开始时的酸的物质的量浓度:甲=乙
D.反应所需时间:甲>乙
BD
谢谢观看
