3.4.2 沉淀溶解平衡原理的应用 课件 (共36张PPT)2024-2025学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 3.4.2 沉淀溶解平衡原理的应用 课件 (共36张PPT)2024-2025学年高二上学期化学苏教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-03 20:59:52 | ||
图片预览











文档简介
(共36张PPT)
专题3 水溶液中的离子反应
第四单元 沉淀溶解平衡
沉淀溶解平衡原理的应用
1.能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2.学会用沉淀溶解平衡的移动解决生产、生活中的实际问题。
【学习目标】
交流讨论
可溶性钡盐(如BaCl2等)当作食盐食用,会造成钡中毒。中毒患者常用5.0%的Na2SO4溶液洗胃的原因是什么?
中毒后服用Na2SO4溶液(5.0%)洗胃,此时SO42-与Ba2+结合生成BaSO4沉淀,可缓解Ba2+对人体的毒害。
实验探究
沉淀的转化实验
实验现象 化学方程式
实验1
实验2
实验3
有白色沉淀生成
Ag++Cl-=AgCl↓
白色沉淀转化黄色沉淀
黄色沉淀转化为黑色沉淀
AgCl(s)+I-(aq) AgI(s)+Cl-(aq)
2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq)
NaCl一定过量
实验关键:第一步中Ag+的必须反应完全!!
◢注意事项◣
①滴加NaCl溶液需过量。如果Ag+过量,残留的Ag+与I-直接结合生成AgI沉淀,不能保证一定有AgCl转化成AgI。
②本实验不能证明Ksp(AgI)>Ksp(Ag2S),因为二者表达式不同。
③比较Ksp(AgCl)>Ksp(AgI),也可在等物质的量浓度的NaCl、KI混合溶液中逐滴滴加AgNO3溶液,先生成黄色的AgI沉淀。
交流讨论
1.若将实验2加少量KI溶液后的试管静置,再向上层清液中滴加AgNO3溶液,请预测观察到的现象,并分析该现象产生的原因?
实验2中,加入KI溶液,发生的反应为AgCl(s)+I-(aq) AgI(s)+Cl-(aq),上层清液中c(Cl-)较大,滴加AgNO3溶液,Ag+与Cl-生成AgCl白色沉淀。
2.20℃时,AgCl、AgI、Ag2S的溶解度分别为1.4×10-4g,2.1×10-7g,6.3×10-16g,根据它们溶解能力的差异,说明产生上述现象的原因。
AgCl>AgI>Ag2S
AgCl(s) Ag+(aq) + Cl-(s)
KI = I- + K+
+
AgI(s)
2AgI(s) 2Ag+ (aq) + 2I-(aq)
Na2S = S2- + 2Na+
+
Ag2S(s)
加入KI溶液,生成更难溶的AgI,促使AgCl的沉淀溶解平衡向溶解方向移动。
加入Na2S溶液,生成更难溶的Ag2S,促使AgI的沉淀溶解平衡向溶解方向移动。
AgCl(s)+I-(aq) AgI(s)+Cl-(aq)
2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq)
向AgCl沉淀中滴加KI溶液时,溶液中的Ag+和I-结合生成了更难溶解的AgI,溶液中Ag+浓度减小,促使AgCl的沉淀溶解平衡向其溶解的方向移动,最终AgCl完全转化为AgI。AgI转化为Ag2S的原理相同。
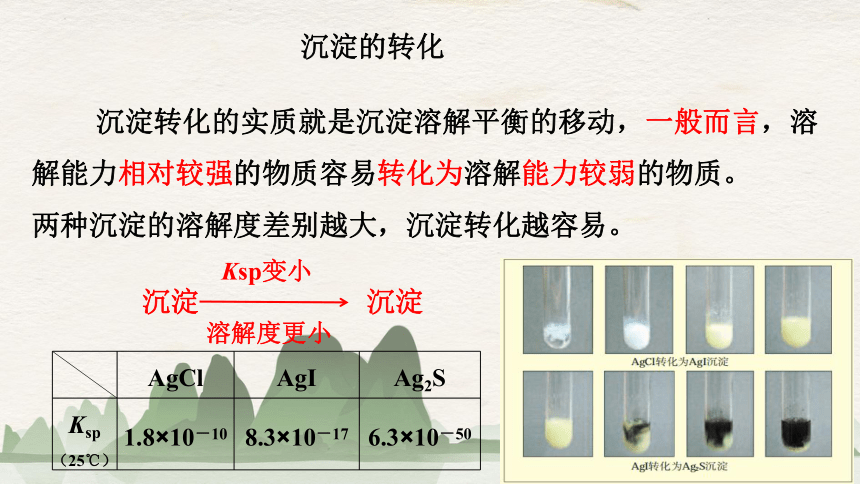
沉淀转化的实质就是沉淀溶解平衡的移动,一般而言,溶解能力相对较强的物质容易转化为溶解能力较弱的物质。
两种沉淀的溶解度差别越大,沉淀转化越容易。
沉淀的转化
沉淀
沉淀
Ksp变小
溶解度更小
AgCl AgI Ag2S
Ksp(25℃) 1.8×10-10 8.3×10-17 6.3×10-50
(1)一般来说,当溶液中有多种可以沉淀的离子且生成相同类型的沉淀时,Ksp越小的越先沉淀。
(2)当离子浓度小于1×10-5 mol·L-1时,认为已完全沉淀。
沉淀转化原理
注意事项
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
AgCl AgI Ag2S
Ksp 1.8×10-10 8.3×10-17 6.3×10-50
C
说明:a.同离子效应对平衡的影响。
b.在含相同离子不同难溶物的饱和体系中,Ksp不同,其同一离 子的浓度大小不同。
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
ZnS
或PbS
CuS
硫化物中硫的化合价为-2,均具有还原性
D
ZnS(s)+Cu2+ (aq) CuS(s)+Zn2+(aq)
Cu2+(aq) + PbS(s) CuS(s)+Pb2+(aq)
3.已知:Ksp(CuS)=1.3×10-36,Ksp(MnS)=2.6×10-13。工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列说法错误的是( )
AC
A.反应达平衡后,继续加入MnS,废水中的Cu2+的去除率增加
B.该反应可将工业废水中的Cu2+沉淀完全
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变小
D.该反应的平衡常数K=2.0×1023
当离子浓度≤10-5mol/L时,可视为沉淀完全。
4.试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中
(1)在FeS的饱和溶液中,存在沉淀溶解平衡FeS(s) Fe2++S2-,当加入稀盐酸时,2H++S2- H2S↑,使c()减小,从而平衡右移,使FeS最终溶解。
答题模板:
在FeS的饱和溶液中,存在沉淀溶解平衡FeS(s) Fe2++S2-,当加入稀盐酸时,2H++S2- H2S↑,使c()减小,从而平衡右移,使FeS最终溶解
4.试利用平衡移动原理解释下列事实:
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中
答题模板
在FeS的饱和溶液中,存在沉淀溶解平衡FeS(s) Fe2++S2-,当加入稀盐酸时,2H++S2- H2S↑,使c()减小,从而平衡右移,使FeS最终溶解
(2)CaCO3的溶解度小于CaSO4,在CaCO3的饱和溶液中,存在沉淀溶解平衡:CaCO3(s) Ca2++C,当加入稀硫酸时,生成的CaSO4微溶,又沉积在CaCO3表面,阻碍反应的进一步进行,从而使CaCO3难溶于稀硫酸;
当加入CH3COOH时,2CH3COOH+C H2O+CO2↑+2CH3COO-,使C浓度减小,且(CH3COO)2Ca溶于水,从而使CaCO3的沉淀溶解平衡右移,使CaCO3慢慢溶于醋酸中。
学以致用
锅炉形成的水垢中常含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去。
1.除去CaSO4水垢的原理是什么?
2 .写出除去水垢中的CaSO4的化学方程式和离子方程式。
CaSO4(s)+Na2CO3(aq) CaCO3(s)+Na2SO4(aq)
CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq)
加入Na2CO3溶液,使CaSO4的沉淀溶解平衡向溶解方向进行,生成更难溶的CaCO3。
烧水壶的水垢
锅炉及其管道内的水垢
CaCO3(s) CO32- (aq) + Ca2+ (aq)
H2CO3 H2O + CO2↑
+ H+
HCO3- (aq)
+ H+
沉淀溶解平衡解释稀盐酸除CaCO3的原理:
CO2气体的生成和逸出,使CO32- 的浓度不断减小,
Q < Ksp,
平衡向沉淀溶解的方向移动
只要盐酸足够,沉淀完全溶解。
沉淀转化的应用
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但是BaSO4不溶于水也不溶于酸、碱,难以直接利用。
沉淀转化在生产和科研中具有极其重要的应用。在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液。
沉淀转化的应用
处理方法
用饱和Na2CO3溶液处理,可将其转化为易溶于酸的BaCO3。
Na2CO3 CO32- + 2Na+
BaSO4(s) Ba2+(aq) + SO42-(aq)
+
BaCO3(s)
BaSO4(s)+CO32- BaCO3(s)+SO42-;
沉淀转化的离子方程式:
沉淀转化的应用
重晶石
(主要成分是BaSO4)
多次重复
饱和Na2CO3溶液
BaCO3(s)
盐酸
Ba2+(aq)
转化过程是用饱和Na2CO3溶液处理BaSO4沉淀,一段时间后移走上层溶液;再加入饱和Na2CO3溶液,重复处理多次,可使大部分BaSO4转化为BaCO3,最后加入盐酸,Ba2+便转入到溶液中。
沉淀的溶解
如: CaCO3 、FeS、Al(OH)3、 Mg(OH)2、 Cu(OH)2等
① 酸溶解法:
沉淀溶解的方法
③盐溶液溶解法:
②配位溶解法:
如——AgCl溶于氨水
AgCl + 2NH3·H2O = [Ag(NH3)2]+ + Cl- + 2H2O
如:Mg(OH)2溶于NH4Cl溶液
Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3·H2O
课堂探究
已知Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。向BaSO4中加入Na2CO3溶液,一段时间后达到平衡状态。
(1)写出有关的离子方程式:_____________________________。
(2)计算该反应的平衡常数K=____________________。
(3)讨论BaSO4能转化为BaCO3的条件是什么?
BaSO4(s)+CO32- (aq) BaCO3(s)+SO42-(aq)
要使BaSO4转化为BaCO3,则必须满足c(CO32-)>24c(SO42-),在BaSO4饱和溶液中,c(SO42-)≈1.0×10-5mol·L-1,故当c(CO32-)>2.4×10-4 mol·L-1时,BaSO4转化为BaCO3。
当同类型的难溶物(如AB型)Ksp相差不大时,一定条件下可以相互转化。
沉淀转化的应用
龋齿与含氟牙膏
20世纪50年代,流行病学研究发现,氟化物具有预防龋齿的作用。1955年,含有氟化亚锡(SnF2)的牙膏问世。后来单氟磷酸钠(Na2PO3F)代替了氟化亚锡。此外,预防龋齿的牙膏中的氟化物还有氟化钠(NaF)和氟化锶(SrF2)等。
龋齿的成因可能是食物在口腔细菌和酶的作用下产生的有机酸(例如糖类分解产生的乳酸)穿透牙釉质表面,使牙齿表面的矿物质羟基磷灰石[Ca5(PO4)3(OH)]溶解。由于细菌在牙齿表面形成一层黏膜——齿斑(或称菌斑),有机酸能够长时间与牙齿表面密切接触,羟基磷灰石持续溶解,最终形成龋齿。
沉淀溶解平衡在生活中的应用
龉齿的形成原因及防治方法:牙齿表面由一层硬的组成Ca5(PO4)3OH(羟基磷灰石)的物质保护着,它在唾液中存在如下平衡:
Ca5(PO4)3OH(s) 5Ca2+ (aq)+3PO43-(aq)+OH-(aq)。
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
(2)根据羟基磷灰石的平衡体系,你能想到用什么方法保护牙齿?
(3)已知Ca5(PO4)3F(氟磷酸钙)的溶解度比Ca5(PO4)3OH(羟基磷灰石)更小,请用离子方程式表示含氟牙膏能防止龉齿的原因: 。
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)
牙膏中的F-能和Ca2+和PO43-反应生成更难溶的Ca5(PO4)3F使牙齿更坚固。
牙膏中的Ca2+使平衡向逆反应方向移动。
Ca5(PO4)3F
F-
含钙、氟牙膏能防止蛀牙,使牙齿更坚固,你知道为什么吗?
氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀,并且氟离子还能抑制口腔细菌产生有机酸。含氟牙膏的使用显著降低了龋齿的发生率,使人们的牙齿更健康。
课堂探究
已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。如果某溶液中分别含有0.1mol·L-1的Fe3+和Cu2+。分别计算Fe3+和Cu2+开始沉淀和完全沉淀时的pH。(当离子浓度为1×10-5mol·L-1时,认为该离子完全沉淀)
Fe3+开始沉淀,必须满足c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3],将c(Fe3+)= 0.1mol·L-1代入,计算可得c(OH-)=7.4×10-13 mol·L-1,计算pH=1.9,即pH=1.9时,Fe3+开始沉淀;Fe3+完全沉淀,必须满足c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3],将c(Fe3+)= 1.0×10-5mol·L-1代入,计算可得c(OH-)=1.6×10-11 mol·L-1,计算pH=3.2,即pH=3.2时,Fe3+完全沉淀。用同样的方法,计算可得Cu2+开始沉淀的pH为4.7,完全沉淀的pH为6.7。
M(OH)n完全沉淀的pH:Ksp=c(Mn+)·cn(OH-)=10-5×(10pH-14)n
除去CuSO4溶液中混有
的Fe3+的方法
CuSO4(aq)
(含Fe3+)
CuO、Cu(OH)2或
Cu2(OH)2CO3
调节溶液
pH=3~4
Cu2+
Fe(OH)3↓(除去Fe3+)
由于Fe(OH)3的溶解度比Cu(OH)2小得多,调节溶液的pH至3~4时,Cu2+留在溶液中, Fe3+水解生成Fe(OH)3而析出,达到除去Fe3+的目的。
Cu(OH)2 Fe(OH)2 Fe(OH)3
Ksp(25℃) 2.2×10-20 8.0×10-16 4.0×10-38
金属离子 Fe2+ Fe3+ Cu2+
开始沉淀的pH 6.3 1.9 4.7
沉淀完全的pH 8.3 3.2 6.7
(1)除去Cu2+中的Fe3+,应调节pH的范围为: 。
(2)如何除去Cu2+中的Fe2+: 。
已知:
3.2≤pH<4.7
先将Fe2+氧化为Fe3+,再调节pH在3.2≤pH<4.7之间
Fe(OH)2
Fe(OH)3
Cu(OH)2
1.9
开始
沉淀
沉淀
完全
沉淀
完全
沉淀
完全
开始
沉淀
开始
沉淀
3.2
4.7
6.7
6.3
8.3
氧化剂可用:双氧水、氧气等(不引入杂质)
2Fe2+ +H2O2+2H+ =2Fe3++2H2O
沉淀的生成
1.应用:在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
2.方法
实例 操作及原理
调节 pH法
除去NH4Cl中的FeCl3
溶于水,加氨水调节pH
Fe3++3NH3·H2O === Fe(OH)3↓+3
除去CuCl2中的FeCl3
Fe3+ + 3H2O Fe(OH)3 + 3H+
加Cu(OH)2:Cu(OH)2 + 2H+ === Cu2+ + 2H2O
加CuO:CuO + 2H+ === Cu2+ + 2H2O
沉淀的生成
1.应用:在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
2.方法
实例 操作及原理
沉淀剂法
除去废水中的Hg2+
加入Na2S:S2- + Hg2+ === HgS↓
除去废水中的Cu2+
通入H2S:H2S + Cu2+=== CuS↓ + 2H+
黑色
工业废水
重金属离子(如Cu2+、Hg2+等)转化成沉淀
沉淀的转化在工业废水处理上的应用
加入Na2S、(NH4)2S等
加入FeS等
在工业废水处理过程中,以硫化钠作沉淀剂,使得废水中的重金属离子如Cu2+、Hg2+等,生成极难溶的CuS、HgS等沉淀而出去,是分离、除去杂质常用的方法。
学以致用
用沉淀溶解平衡原理解决下列问题:
1.除去NH4Cl溶液中的少量FeCl3。
2.除去MgCl2溶液中的少量CuCl2。
加入氨水,调节溶液pH=3~4,过滤。
加入MgO或Mg(OH)2,调节溶液pH=7,过滤。
沉淀溶解平衡
沉淀的溶解
沉淀的转化
沉淀的生成
向沉淀溶解的方向进行
向沉淀生成的方向进行
QC>K
QC课堂练习
1.除去NaCl中的FeCl3需加入的试剂是( )
A.NaOH B.石灰水 C.铜片 D.氨水
答案:A
解析:在除去FeCl3时,不能引入新的杂质离子。
2.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11 mol·L-1
3.化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:
Cu2+(aq)+MnS(s)??CuS(s)+Mn2+(aq)
下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp
②达到平衡时c(Mn2+)=c(Cu2+)
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变
④该反应平衡常数K=
A.①④ B.②③
C.①②③ D.②③④
说明: a .难溶电解质不一定是弱电解质,如BaSO4、AgCl等都是强电解质。
b.用沉淀法除杂不可能将杂质离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已经完全。
A
医学上救治可溶性钡盐中毒,一般用5.0%的Na2SO4溶液给患者洗胃。已知:Ksp(BaSO4)=1.1×10-10,5.0%的Na2SO4溶液中c(SO42-)=0.38mol·L-1,请通过计算说明:当胃液中SO42-浓度达到该数值时,能否有效解毒?
(根据资料,当胃液中的Ba2+浓度约小于10-4mol·L-1时,可以达到解毒目的)
c(Ba2+)=1.1×10-10/0.38=2.9×10-10mol·L-1
因为剩余的c(Ba2+)<10-4mol·L-1,所以有效除去了误食的Ba2+
专题3 水溶液中的离子反应
第四单元 沉淀溶解平衡
沉淀溶解平衡原理的应用
1.能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2.学会用沉淀溶解平衡的移动解决生产、生活中的实际问题。
【学习目标】
交流讨论
可溶性钡盐(如BaCl2等)当作食盐食用,会造成钡中毒。中毒患者常用5.0%的Na2SO4溶液洗胃的原因是什么?
中毒后服用Na2SO4溶液(5.0%)洗胃,此时SO42-与Ba2+结合生成BaSO4沉淀,可缓解Ba2+对人体的毒害。
实验探究
沉淀的转化实验
实验现象 化学方程式
实验1
实验2
实验3
有白色沉淀生成
Ag++Cl-=AgCl↓
白色沉淀转化黄色沉淀
黄色沉淀转化为黑色沉淀
AgCl(s)+I-(aq) AgI(s)+Cl-(aq)
2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq)
NaCl一定过量
实验关键:第一步中Ag+的必须反应完全!!
◢注意事项◣
①滴加NaCl溶液需过量。如果Ag+过量,残留的Ag+与I-直接结合生成AgI沉淀,不能保证一定有AgCl转化成AgI。
②本实验不能证明Ksp(AgI)>Ksp(Ag2S),因为二者表达式不同。
③比较Ksp(AgCl)>Ksp(AgI),也可在等物质的量浓度的NaCl、KI混合溶液中逐滴滴加AgNO3溶液,先生成黄色的AgI沉淀。
交流讨论
1.若将实验2加少量KI溶液后的试管静置,再向上层清液中滴加AgNO3溶液,请预测观察到的现象,并分析该现象产生的原因?
实验2中,加入KI溶液,发生的反应为AgCl(s)+I-(aq) AgI(s)+Cl-(aq),上层清液中c(Cl-)较大,滴加AgNO3溶液,Ag+与Cl-生成AgCl白色沉淀。
2.20℃时,AgCl、AgI、Ag2S的溶解度分别为1.4×10-4g,2.1×10-7g,6.3×10-16g,根据它们溶解能力的差异,说明产生上述现象的原因。
AgCl>AgI>Ag2S
AgCl(s) Ag+(aq) + Cl-(s)
KI = I- + K+
+
AgI(s)
2AgI(s) 2Ag+ (aq) + 2I-(aq)
Na2S = S2- + 2Na+
+
Ag2S(s)
加入KI溶液,生成更难溶的AgI,促使AgCl的沉淀溶解平衡向溶解方向移动。
加入Na2S溶液,生成更难溶的Ag2S,促使AgI的沉淀溶解平衡向溶解方向移动。
AgCl(s)+I-(aq) AgI(s)+Cl-(aq)
2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq)
向AgCl沉淀中滴加KI溶液时,溶液中的Ag+和I-结合生成了更难溶解的AgI,溶液中Ag+浓度减小,促使AgCl的沉淀溶解平衡向其溶解的方向移动,最终AgCl完全转化为AgI。AgI转化为Ag2S的原理相同。
沉淀转化的实质就是沉淀溶解平衡的移动,一般而言,溶解能力相对较强的物质容易转化为溶解能力较弱的物质。
两种沉淀的溶解度差别越大,沉淀转化越容易。
沉淀的转化
沉淀
沉淀
Ksp变小
溶解度更小
AgCl AgI Ag2S
Ksp(25℃) 1.8×10-10 8.3×10-17 6.3×10-50
(1)一般来说,当溶液中有多种可以沉淀的离子且生成相同类型的沉淀时,Ksp越小的越先沉淀。
(2)当离子浓度小于1×10-5 mol·L-1时,认为已完全沉淀。
沉淀转化原理
注意事项
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
AgCl AgI Ag2S
Ksp 1.8×10-10 8.3×10-17 6.3×10-50
C
说明:a.同离子效应对平衡的影响。
b.在含相同离子不同难溶物的饱和体系中,Ksp不同,其同一离 子的浓度大小不同。
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
ZnS
或PbS
CuS
硫化物中硫的化合价为-2,均具有还原性
D
ZnS(s)+Cu2+ (aq) CuS(s)+Zn2+(aq)
Cu2+(aq) + PbS(s) CuS(s)+Pb2+(aq)
3.已知:Ksp(CuS)=1.3×10-36,Ksp(MnS)=2.6×10-13。工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列说法错误的是( )
AC
A.反应达平衡后,继续加入MnS,废水中的Cu2+的去除率增加
B.该反应可将工业废水中的Cu2+沉淀完全
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变小
D.该反应的平衡常数K=2.0×1023
当离子浓度≤10-5mol/L时,可视为沉淀完全。
4.试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中
(1)在FeS的饱和溶液中,存在沉淀溶解平衡FeS(s) Fe2++S2-,当加入稀盐酸时,2H++S2- H2S↑,使c()减小,从而平衡右移,使FeS最终溶解。
答题模板:
在FeS的饱和溶液中,存在沉淀溶解平衡FeS(s) Fe2++S2-,当加入稀盐酸时,2H++S2- H2S↑,使c()减小,从而平衡右移,使FeS最终溶解
4.试利用平衡移动原理解释下列事实:
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中
答题模板
在FeS的饱和溶液中,存在沉淀溶解平衡FeS(s) Fe2++S2-,当加入稀盐酸时,2H++S2- H2S↑,使c()减小,从而平衡右移,使FeS最终溶解
(2)CaCO3的溶解度小于CaSO4,在CaCO3的饱和溶液中,存在沉淀溶解平衡:CaCO3(s) Ca2++C,当加入稀硫酸时,生成的CaSO4微溶,又沉积在CaCO3表面,阻碍反应的进一步进行,从而使CaCO3难溶于稀硫酸;
当加入CH3COOH时,2CH3COOH+C H2O+CO2↑+2CH3COO-,使C浓度减小,且(CH3COO)2Ca溶于水,从而使CaCO3的沉淀溶解平衡右移,使CaCO3慢慢溶于醋酸中。
学以致用
锅炉形成的水垢中常含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去。
1.除去CaSO4水垢的原理是什么?
2 .写出除去水垢中的CaSO4的化学方程式和离子方程式。
CaSO4(s)+Na2CO3(aq) CaCO3(s)+Na2SO4(aq)
CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq)
加入Na2CO3溶液,使CaSO4的沉淀溶解平衡向溶解方向进行,生成更难溶的CaCO3。
烧水壶的水垢
锅炉及其管道内的水垢
CaCO3(s) CO32- (aq) + Ca2+ (aq)
H2CO3 H2O + CO2↑
+ H+
HCO3- (aq)
+ H+
沉淀溶解平衡解释稀盐酸除CaCO3的原理:
CO2气体的生成和逸出,使CO32- 的浓度不断减小,
Q < Ksp,
平衡向沉淀溶解的方向移动
只要盐酸足够,沉淀完全溶解。
沉淀转化的应用
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但是BaSO4不溶于水也不溶于酸、碱,难以直接利用。
沉淀转化在生产和科研中具有极其重要的应用。在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液。
沉淀转化的应用
处理方法
用饱和Na2CO3溶液处理,可将其转化为易溶于酸的BaCO3。
Na2CO3 CO32- + 2Na+
BaSO4(s) Ba2+(aq) + SO42-(aq)
+
BaCO3(s)
BaSO4(s)+CO32- BaCO3(s)+SO42-;
沉淀转化的离子方程式:
沉淀转化的应用
重晶石
(主要成分是BaSO4)
多次重复
饱和Na2CO3溶液
BaCO3(s)
盐酸
Ba2+(aq)
转化过程是用饱和Na2CO3溶液处理BaSO4沉淀,一段时间后移走上层溶液;再加入饱和Na2CO3溶液,重复处理多次,可使大部分BaSO4转化为BaCO3,最后加入盐酸,Ba2+便转入到溶液中。
沉淀的溶解
如: CaCO3 、FeS、Al(OH)3、 Mg(OH)2、 Cu(OH)2等
① 酸溶解法:
沉淀溶解的方法
③盐溶液溶解法:
②配位溶解法:
如——AgCl溶于氨水
AgCl + 2NH3·H2O = [Ag(NH3)2]+ + Cl- + 2H2O
如:Mg(OH)2溶于NH4Cl溶液
Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3·H2O
课堂探究
已知Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。向BaSO4中加入Na2CO3溶液,一段时间后达到平衡状态。
(1)写出有关的离子方程式:_____________________________。
(2)计算该反应的平衡常数K=____________________。
(3)讨论BaSO4能转化为BaCO3的条件是什么?
BaSO4(s)+CO32- (aq) BaCO3(s)+SO42-(aq)
要使BaSO4转化为BaCO3,则必须满足c(CO32-)>24c(SO42-),在BaSO4饱和溶液中,c(SO42-)≈1.0×10-5mol·L-1,故当c(CO32-)>2.4×10-4 mol·L-1时,BaSO4转化为BaCO3。
当同类型的难溶物(如AB型)Ksp相差不大时,一定条件下可以相互转化。
沉淀转化的应用
龋齿与含氟牙膏
20世纪50年代,流行病学研究发现,氟化物具有预防龋齿的作用。1955年,含有氟化亚锡(SnF2)的牙膏问世。后来单氟磷酸钠(Na2PO3F)代替了氟化亚锡。此外,预防龋齿的牙膏中的氟化物还有氟化钠(NaF)和氟化锶(SrF2)等。
龋齿的成因可能是食物在口腔细菌和酶的作用下产生的有机酸(例如糖类分解产生的乳酸)穿透牙釉质表面,使牙齿表面的矿物质羟基磷灰石[Ca5(PO4)3(OH)]溶解。由于细菌在牙齿表面形成一层黏膜——齿斑(或称菌斑),有机酸能够长时间与牙齿表面密切接触,羟基磷灰石持续溶解,最终形成龋齿。
沉淀溶解平衡在生活中的应用
龉齿的形成原因及防治方法:牙齿表面由一层硬的组成Ca5(PO4)3OH(羟基磷灰石)的物质保护着,它在唾液中存在如下平衡:
Ca5(PO4)3OH(s) 5Ca2+ (aq)+3PO43-(aq)+OH-(aq)。
(1)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
(2)根据羟基磷灰石的平衡体系,你能想到用什么方法保护牙齿?
(3)已知Ca5(PO4)3F(氟磷酸钙)的溶解度比Ca5(PO4)3OH(羟基磷灰石)更小,请用离子方程式表示含氟牙膏能防止龉齿的原因: 。
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)
牙膏中的F-能和Ca2+和PO43-反应生成更难溶的Ca5(PO4)3F使牙齿更坚固。
牙膏中的Ca2+使平衡向逆反应方向移动。
Ca5(PO4)3F
F-
含钙、氟牙膏能防止蛀牙,使牙齿更坚固,你知道为什么吗?
氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀,并且氟离子还能抑制口腔细菌产生有机酸。含氟牙膏的使用显著降低了龋齿的发生率,使人们的牙齿更健康。
课堂探究
已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。如果某溶液中分别含有0.1mol·L-1的Fe3+和Cu2+。分别计算Fe3+和Cu2+开始沉淀和完全沉淀时的pH。(当离子浓度为1×10-5mol·L-1时,认为该离子完全沉淀)
Fe3+开始沉淀,必须满足c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3],将c(Fe3+)= 0.1mol·L-1代入,计算可得c(OH-)=7.4×10-13 mol·L-1,计算pH=1.9,即pH=1.9时,Fe3+开始沉淀;Fe3+完全沉淀,必须满足c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3],将c(Fe3+)= 1.0×10-5mol·L-1代入,计算可得c(OH-)=1.6×10-11 mol·L-1,计算pH=3.2,即pH=3.2时,Fe3+完全沉淀。用同样的方法,计算可得Cu2+开始沉淀的pH为4.7,完全沉淀的pH为6.7。
M(OH)n完全沉淀的pH:Ksp=c(Mn+)·cn(OH-)=10-5×(10pH-14)n
除去CuSO4溶液中混有
的Fe3+的方法
CuSO4(aq)
(含Fe3+)
CuO、Cu(OH)2或
Cu2(OH)2CO3
调节溶液
pH=3~4
Cu2+
Fe(OH)3↓(除去Fe3+)
由于Fe(OH)3的溶解度比Cu(OH)2小得多,调节溶液的pH至3~4时,Cu2+留在溶液中, Fe3+水解生成Fe(OH)3而析出,达到除去Fe3+的目的。
Cu(OH)2 Fe(OH)2 Fe(OH)3
Ksp(25℃) 2.2×10-20 8.0×10-16 4.0×10-38
金属离子 Fe2+ Fe3+ Cu2+
开始沉淀的pH 6.3 1.9 4.7
沉淀完全的pH 8.3 3.2 6.7
(1)除去Cu2+中的Fe3+,应调节pH的范围为: 。
(2)如何除去Cu2+中的Fe2+: 。
已知:
3.2≤pH<4.7
先将Fe2+氧化为Fe3+,再调节pH在3.2≤pH<4.7之间
Fe(OH)2
Fe(OH)3
Cu(OH)2
1.9
开始
沉淀
沉淀
完全
沉淀
完全
沉淀
完全
开始
沉淀
开始
沉淀
3.2
4.7
6.7
6.3
8.3
氧化剂可用:双氧水、氧气等(不引入杂质)
2Fe2+ +H2O2+2H+ =2Fe3++2H2O
沉淀的生成
1.应用:在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
2.方法
实例 操作及原理
调节 pH法
除去NH4Cl中的FeCl3
溶于水,加氨水调节pH
Fe3++3NH3·H2O === Fe(OH)3↓+3
除去CuCl2中的FeCl3
Fe3+ + 3H2O Fe(OH)3 + 3H+
加Cu(OH)2:Cu(OH)2 + 2H+ === Cu2+ + 2H2O
加CuO:CuO + 2H+ === Cu2+ + 2H2O
沉淀的生成
1.应用:在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
2.方法
实例 操作及原理
沉淀剂法
除去废水中的Hg2+
加入Na2S:S2- + Hg2+ === HgS↓
除去废水中的Cu2+
通入H2S:H2S + Cu2+=== CuS↓ + 2H+
黑色
工业废水
重金属离子(如Cu2+、Hg2+等)转化成沉淀
沉淀的转化在工业废水处理上的应用
加入Na2S、(NH4)2S等
加入FeS等
在工业废水处理过程中,以硫化钠作沉淀剂,使得废水中的重金属离子如Cu2+、Hg2+等,生成极难溶的CuS、HgS等沉淀而出去,是分离、除去杂质常用的方法。
学以致用
用沉淀溶解平衡原理解决下列问题:
1.除去NH4Cl溶液中的少量FeCl3。
2.除去MgCl2溶液中的少量CuCl2。
加入氨水,调节溶液pH=3~4,过滤。
加入MgO或Mg(OH)2,调节溶液pH=7,过滤。
沉淀溶解平衡
沉淀的溶解
沉淀的转化
沉淀的生成
向沉淀溶解的方向进行
向沉淀生成的方向进行
QC>K
QC
1.除去NaCl中的FeCl3需加入的试剂是( )
A.NaOH B.石灰水 C.铜片 D.氨水
答案:A
解析:在除去FeCl3时,不能引入新的杂质离子。
2.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11 mol·L-1
3.化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:
Cu2+(aq)+MnS(s)??CuS(s)+Mn2+(aq)
下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp
②达到平衡时c(Mn2+)=c(Cu2+)
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变
④该反应平衡常数K=
A.①④ B.②③
C.①②③ D.②③④
说明: a .难溶电解质不一定是弱电解质,如BaSO4、AgCl等都是强电解质。
b.用沉淀法除杂不可能将杂质离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已经完全。
A
医学上救治可溶性钡盐中毒,一般用5.0%的Na2SO4溶液给患者洗胃。已知:Ksp(BaSO4)=1.1×10-10,5.0%的Na2SO4溶液中c(SO42-)=0.38mol·L-1,请通过计算说明:当胃液中SO42-浓度达到该数值时,能否有效解毒?
(根据资料,当胃液中的Ba2+浓度约小于10-4mol·L-1时,可以达到解毒目的)
c(Ba2+)=1.1×10-10/0.38=2.9×10-10mol·L-1
因为剩余的c(Ba2+)<10-4mol·L-1,所以有效除去了误食的Ba2+
