四川省部分学校2024-2025学年高三上学期10月联考化学试卷 (PDF版,含答案)
文档属性
| 名称 | 四川省部分学校2024-2025学年高三上学期10月联考化学试卷 (PDF版,含答案) |

|
|
| 格式 | |||
| 文件大小 | 706.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-03 21:47:37 | ||
图片预览


文档简介
四川省 2025 届高三上学期 10 月阶段检测考 C 科学家利用Si制作各种芯片 Si的熔点高、硬度大
D 工人利用铝热反应焊接钢轨 铝热反应放出大量的热
化学试卷 4.下列选项中的相邻两种物质能按图示路径实现一步转化的是( )
试卷共 8 页,18 小题,满分 100 分。考试用时 75 分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如 选项 X Y Z
需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡 A NH3 N2 NO2
上。写在本试卷上无效。
3.考生必须保持答题卡的整洁。考试结束后,请将答题卡交回。 B SO2 SO3 H2SO4
可能用到的相对原子质量:H 1 N 14 O 16 F 19 Cl 35.5 Co 59 Cu 64
C Fe
Au 197 Fe(NO3 )3 Fe(NO3 )2
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只 D C CO CO2
有一项是最符合题目要求的。
1.文物是历史的产物,记录了人类历史的发展过程。下列文物属于硅酸盐材料的是( ) 5.下列离子方程式书写错误的是( )
A.泡沫灭火器工作原理:Al3 3HCO 3 Al(OH)3 3CO2
B.工业上,用漂白精溶液吸收尾气中SO 2 2:Ca 2ClO SO2 H2O CaSO3 2HClO
C.实验室用氨水浸泡试管中AgCl:Ca 2 2ClO SO 2 H 2O CaSO3 2HClO
A.纳西族羊皮披肩 B.三支俑铜灯 C.木雕窗棂 D.鸡形陶壶
2.化学与美丽中国息息相关。下列说法中错误的是( ) △D.实验室制备 Fe(OH) 胶体: Fe3 3 3H2O Fe(OH)3(胶体) 3H
A.化学让天更蓝:催化剂作用下,汽车尾气中的CO可氧化NO得到无污染气体
B.化学让水更净:污水中加入聚合氯化铝经沉淀、过滤,可使水质清澈
6.已知 NH3 极易溶于水,HCl易溶于乙醇。某同学用收集满的 NH3 或HCl进行喷泉实验,设计了多
C.化学变废为宝:可用 FeCl3溶液回收废旧电路板中的铜
个装置如下,图 1装置实验前先关闭止水夹。下列说法错误的是( )
D.化学美化生活:SO2漂白纸浆可使生产的纸更白
3.“光荣属于劳动者,幸福属于劳动者”。下列劳动过程中,没有运用相应化学原理的是( )
选项 劳动过程 化学原理
A 技师向模具注入钢水前将模具充分干燥 铁高温下会与水蒸气反应
B
农民夏天用NH4HCO3 施肥后,用土盖住化肥 NH4HCO3 温度高时易分解
A.标准状况下图 1 1喷泉试验后,烧瓶内氨水的物质的量浓度约为 mol L 1 9.设 NA 为阿伏加德罗常数的值。部分含氮的物质有如图转化关系。下列叙述正确的是( )22.4
B.利用图 1进行喷泉实验,将胶头滴管中的水挤入烧瓶,立即形成喷泉
C.利用图 2进行喷泉实验,用冰冷的毛巾覆盖烧瓶可引发形成喷泉
D.图 3锥形瓶内盛有乙醇,水槽中加入热水加热可引发喷泉
7.焦亚硫酸钠 (Na2S2O5 )是常用的抗氧化剂,常加入葡萄酒中以防止酒中的一些成分被氧化,起到保
质作用。以工业废气中回收SO2为原料制备焦亚硫酸钠的微型流程如图所示。已知:常温下,H2SO3
A.常温常压下, 2.24LN 含原子数为 0.2N
的电离平衡常数 Ka 1.54 10
2, Ka 1.02 10
7 2 A。下列叙述错误的是( )
1 2
B.3.7gNH4F固体含离子总数为 0.1NA
C.3.2gN2H4 中含极性键总数为 0.5NA
D.反应①中,生成 0.1mol还原产物,则需要HNO2 分子数为 0.3NA
10.溴化物介导的以水为氧源的烯烃光电化学环氧化反应,转化效率和选择性高达 100%,反应过程
A.上述过程没有发生氧化还原反应
中未使用含贵金属的催化剂或有毒氧化剂,为生产增值化学品和太阳能燃料发电提供了一种节能环
B.反应①表明H2SO3 酸性比H2CO3强 保的方法,其工作原理如图所示。下列叙述正确的是( )
C.饱和NaHSO3溶液呈碱性
D.“脱水、结晶”后采用“过滤、洗涤、干燥”的操作获得产品
8.含 Na 或Al元素的部分物质的“价—类”关系如图所示。下列叙述正确的是( )
A.添加的溴化物只起导电作用
B. Pt极附近溶液 pH降低
C.BiVO4极的电极反应式为 2Br
2e Br2
A.d、e与 c反应的产物相同
B.若常温下可用 a的单质制作的容器来盛放浓硝酸,说明 a与浓硝酸不反应
D.生成 0.5mol 时外电路理论上转移1mol电子
C.若 b在常温下为淡黄色固体,则向酚酞溶液中加入 b,溶液变红
11.某溶液可能含 Fe2 、Cl 、Br 、 I 、S2 中的若干种离子,标准状况下,向 400mL该混合液中缓
D.能与水反应生成 c的物质只有 b
慢通入Cl2 ,混合溶液中部分离子的物质的量与氯气通入体积的关系如图所示。下列叙述正确的是
( )
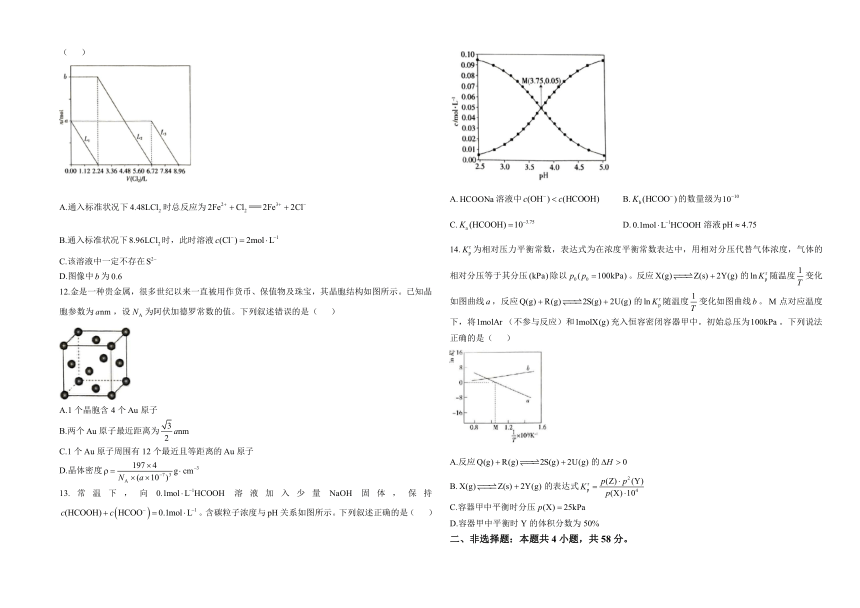
A.HCOONa溶液中 c(OH ) c(HCOOH) B. Kb (HCOO
)的数量级为10 10
A.通入标准状况下 4.48LCl2 时总反应为 2Fe
2 Cl 2Fe3 2 2Cl
C. K (HCOOH) 10 3.75a D. 0.1mol L
1HCOOH 溶液 pH 4.75
B.通入标准状况下8.96LCl2时,此时溶液 c(Cl
) 2mol L 1
14. K rp 为相对压力平衡常数,表达式为在浓度平衡常数表达中,用相对分压代替气体浓度,气体的
C.该溶液中一定不存在S2
1
D.图像中 b为 0.6 相对分压等于其分压 (kPa)除以 p0 ( p0 100kPa)。反应X(g) Z(s) 2Y(g) 的 lnK
r
p 随温度 变化T
12.金是一种贵金属,很多世纪以来一直被用作货币、保值物及珠宝,其晶胞结构如图所示。已知晶
如图曲线 a,反应Q(g) R(g) 2S(g) 2U(g) 的 lnK r
1
p 随温度 变化如图曲线 b。M 点对应温度
胞参数为 anm ,设 NA 为阿伏加德罗常数的值。下列叙述错误的是( )
T
下,将1molAr (不参与反应)和1molX(g)充入恒容密闭容器甲中。初始总压为100kPa。下列说法
正确的是( )
A.1个晶胞含 4个Au原子
B. 3两个Au原子最近距离为 anm
2
C.1个Au原子周围有 12个最近且等距离的Au原子
D. 197 4
A.反应Q(g) R(g) 2S(g) 2U(g) 的 H 0
晶体密度 3
N (a 10 7
g cm
A )
3
2
1 B.X(g) Z(s) 2Y(g)
p(Z) p (Y)
的表达式 K r
13. 常 温 下 , 向 0.1mol L HCOOH 溶 液 加 入 少 量 NaOH p固 体 , 保 持 p(X) 104
c(HCOOH) c HCOO 0.1mol L 1 pH C.容器甲中平衡时分压 p(X) 25kPa。含碳粒子浓度与 关系如图所示。下列叙述正确的是( )
D.容器甲中平衡时 Y的体积分数为 50%
二、非选择题:本题共 4 小题,共 58 分。
15.(14分)氮化锂 (Li3N)常用作固体电解质、催化剂等,某实验小组利用锂的氮气的反应设计实验 (5)向装有足量稀硫酸的试管中加入少量 Li3N样品,若________(填实验现象),则产品混有锂。
制备氮化锂并探究某些物质性质,实验装置如图所示。
(6)为了测定实验后 B中固体 (CoCl2 xH2O)组成,进行如下实验:
取 2.38gB中固体溶于去离子水,配制成 250mL溶液,准确量取 25.00mL配制的溶液于锥形瓶,向其
中加入 0.1mol L 1AgNO3溶液,测得消耗AgNO3 溶液体积为 20.00mL。
①实验室中用棕色试剂瓶盛放AgNO3 溶液,其原因是________。
② x ________。
已知部分信息如下:
16.(15分)五氟化锑 (SbF5 )是一种高能氟化剂,用于制药业;硼化钛 (TiB2 )是新型无机非金属材料
①几种含铬的化合物颜色如下表所示:
物 Cr O (s) Na[Cr(OH) ](aq) Cr (SO ) (aq) (NH ) Cr O (s) K Cr O (aq) 用于机械制造业。工业上,以一种含钛的矿渣(主要含TiO2、Sb2O3、ZnO、PbO、NiO和CoO等)2 3 4 2 4 3 4 2 2 7 2 2 7
质
颜 绿色 绿色 棕红色 橘黄色 橙红色 为原料制取TiB2和SbF5,流程如图所示。
色
②Li3N极易潮解。
回答下列问题:
(1)D装置的名称是________;实验室将锂贮存于________中。
(2)实验时,先点燃 A处酒精灯,后点燃 C处酒精灯,这样操作的目的是________。
(3)当 A装置中黄色粉末全部变为绿色时熄灭 A处酒精灯,写出该反应的化学方程式:________。
(4)实验完毕后,取 A装置中绿色粉末 X进行如下实验:
序号 操作 现象 已知:①TiO2性质较稳定,加热时可溶于浓硫酸中形成TiO
2 ;②高温下,B2O3易挥发;③常温
Ⅰ 向 X中加入稀硫酸,振荡 溶液变为棕红色
24 28
Ⅱ 向 X中加入NaOH溶液,振荡 溶液变为绿色 下, Ksp (ZnS) 2.0 10 , Ksp (PbS) 8.0 10 。
Ⅲ X KMnO 绿色粉末溶解,产生黑色沉淀 Y,溶液变为橙红色向 中加入 溶液,煮沸 回答下列问题:4
(1)“酸解”中,浓硫酸表现出的性质是________(填字母)。
①根据上述实验推知,Cr2O3 性质与下列物质最相似的是________(填字母)。 A.强氧化性 B.强酸性 C.脱水性 D.吸水性
(2)“水解”中,为了提高水解率宜选择下列措施________(填字母)。
a. Fe2O3 b.Al2O3 c.MgO d. P2O5 A.加入稀硫酸 B.通入水蒸气 C.加入少量氨水
②已知:黑色固体 Y常用于实验室制备Cl2 和O2 。写出实验Ⅲ中离子方程式:________,由此推 “水解”中离子方程式为________。
(3)“电解”中,在________极析出Sb;另一极上生成的气体可以循环用于________工序。
知,该反应中氧化性:KMnO4 ________K2Cr2O7(填“ ”“ ”或“ ”)。 (4)“热还原”中反应的化学方程式为________。
(5)“氟化”中,不选用玻璃仪器,其原因是________。
( 6)已知:“除 Co 、 Ni ”后,滤液含 c(Zn2 ) c(Pb2 ) 0.1mol L 1 。当金属离子浓度
滴定终点,三次平行实验,平均消耗Na S O 溶液体积为 bmL。已知: 2Cu2 4I 2 2 3 2CuI I2 ,
c(Mn+) 1.0 10 5mol L 1时表明金属已完全沉淀。“除 Zn、Pb”中,当 PbS刚好完全沉淀时,ZnS
2 2
沉淀率为________%。 ClO4 8I 8H 4I2 Cl 4H2O, I2 2S2O3 2I S4O6 。
17(. 14分)高氯酸铜 [Cu(ClO4 )2 ]应用于电子工业、催化剂制备。以铜屑为原料制备 [Cu(ClO4 )2 6H2O] (5)滴定终点标志是________。
并测定其纯度。 (6)该产品纯度为________(列出计算表达式即可);如果加入硫酸过多,测定结果偏高,其原因
是________(用离子方程式表示)。
实验(一)制备Cu(ClO4 )2 6H2O。
18.(15分)G作为一种医药中间体,在药物合成中扮演着重要角色,以甲苯为原料制备 G的流程
步骤 1按如图装置制备CuCl2。已知:CuCl2熔点为 620℃,易潮解。 如下:
请回答下列问题:
(1)A B的反应试剂与条件是________;X的名称为________。
步骤 2 将1.35gCuCl2 转入150mL烧杯中,加 50mL水溶解,在搅拌下加入15mL2.0mol L
1NaOH 溶
(2)D中官能团的名称是________;E F的反应类型是________。
液,中火(电陶炉温度约为 300℃)加热至沉淀完全变黑,不断搅拌,煮沸。稍冷后,抽滤(减压
(3)D E发生反应时的另一产物为 P(OH)Br2 ,写出该反应的化学方程式:________。
过滤),用少量去离子水淋洗沉淀。
步骤 3用玻璃棒将氧化铜和滤纸一起转移到盛有10mL水的100mL蒸发血中,滴加 3.30g高氯酸,微 (4)下列叙述正确的是________(填字母)。
热至氧化铜溶解后将滤纸完整挑出(避免将滤纸捣碎),小火(电陶炉温度约为 200℃)蒸发至表面 a.A、B、C都能使酸性KMnO4溶液褪色 b.E、F中碳原子都有 2种杂化类型
形成一层膜为止。冷却、抽滤,得到浅蓝色六水合高氯酸铜。
c.D、G均可形成分子间氢键 d. F G的副产物为氨气
(1)步骤 1中,B装置中试剂是________(填名称)。D装置的作用是________。
(5)A的二氯代物有________种,其中在核磁共振氢谱上有 3组峰的结构简式为________(写出一
(2)写出 A装置中化学方程式:________。
种即可)。
(3)步骤 2中,相对普通过滤,抽滤的优点是________(答一条)。
(4)步骤 3中,“蒸发至表面形成一层膜”,这样操作的目的是________。
(6)根据上述流程,以 和 为原料合成 ,设计合成路线:
实验(二)测定 [Cu(ClO4 )2 6H2O]产品纯度。
________(其他无机试剂自选)。
取 3.30g产品溶于水配制100mL溶液,准确量取 25.00mL配制溶液于锥形瓶中,加入适量稀硫酸和
过量的KI,塞紧瓶塞,放置在暗室中充分反应。滴入 2滴淀粉溶液,用 amol L 1Na2S2O3 标准溶液
四川省 2025 3 1 100届高三上学期 10 月阶段检测考 ab 10 371
(6) 17 25 100%(2分) 2H S 2 2O3 S SO2 H O(2分)3.3 2
化学参考答案
18.(1)Cl2、光照(2分) 环氧乙烷(1分)
一、选择题
(2)羟基(1分) 取代反应(1分)
1-5.DACDB 6-10.BCADD 11-14.CBCC
15.(1)球形干燥管(1分) 石蜡油或石蜡(1分) (3) PBr3 P(OH)Br2 (2分)
(2)排尽装置内空气(1分) (4)ac(2分)
△
(3) (NH4 )2Cr2O7 N2 Cr2O3 4H2O(2分)
(5)10(2分) (1分)
(4)①b(1分) ②Cr2O3 2MnO
4 MnO2 Cr2O
2
7 (2分) >(1分)
(5)产生气泡(2分) (6)
(3分)
(6)①AgNO3见光易分解(1分) ②6(2分)
16.(1)B(1分)
(2)BC(2分) TiO2 (x 1)H2O TiO2 xH2O 2H
(2分)
(3)阴(2分) 氯化(2分)
高温
(4)TiO2 xH2O B2O3 5C TiB2 5CO xH2O (2分)
(5)玻璃中的SiO2和HF反应(2分)
(6)75(2分)
17.(1)浓硫酸(1分) 吸收尾气中的Cl2 和HCl,防止污染环境,防止外界的水蒸气进入装置 C
中(2分)
(2)Ca(ClO)2 4HCl(浓) CaCl2 2Cl2 2H2O(2分)
(3)过滤较快、固体较干燥、固体和液体易分离等(1分)
(4)制备热饱和溶液,防止过度蒸发导致目标产物损失(2分)
(5)滴入最后半滴溶液,溶液刚好由蓝色变为无色且半分钟不褪色(2分)
D 工人利用铝热反应焊接钢轨 铝热反应放出大量的热
化学试卷 4.下列选项中的相邻两种物质能按图示路径实现一步转化的是( )
试卷共 8 页,18 小题,满分 100 分。考试用时 75 分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如 选项 X Y Z
需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡 A NH3 N2 NO2
上。写在本试卷上无效。
3.考生必须保持答题卡的整洁。考试结束后,请将答题卡交回。 B SO2 SO3 H2SO4
可能用到的相对原子质量:H 1 N 14 O 16 F 19 Cl 35.5 Co 59 Cu 64
C Fe
Au 197 Fe(NO3 )3 Fe(NO3 )2
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只 D C CO CO2
有一项是最符合题目要求的。
1.文物是历史的产物,记录了人类历史的发展过程。下列文物属于硅酸盐材料的是( ) 5.下列离子方程式书写错误的是( )
A.泡沫灭火器工作原理:Al3 3HCO 3 Al(OH)3 3CO2
B.工业上,用漂白精溶液吸收尾气中SO 2 2:Ca 2ClO SO2 H2O CaSO3 2HClO
C.实验室用氨水浸泡试管中AgCl:Ca 2 2ClO SO 2 H 2O CaSO3 2HClO
A.纳西族羊皮披肩 B.三支俑铜灯 C.木雕窗棂 D.鸡形陶壶
2.化学与美丽中国息息相关。下列说法中错误的是( ) △D.实验室制备 Fe(OH) 胶体: Fe3 3 3H2O Fe(OH)3(胶体) 3H
A.化学让天更蓝:催化剂作用下,汽车尾气中的CO可氧化NO得到无污染气体
B.化学让水更净:污水中加入聚合氯化铝经沉淀、过滤,可使水质清澈
6.已知 NH3 极易溶于水,HCl易溶于乙醇。某同学用收集满的 NH3 或HCl进行喷泉实验,设计了多
C.化学变废为宝:可用 FeCl3溶液回收废旧电路板中的铜
个装置如下,图 1装置实验前先关闭止水夹。下列说法错误的是( )
D.化学美化生活:SO2漂白纸浆可使生产的纸更白
3.“光荣属于劳动者,幸福属于劳动者”。下列劳动过程中,没有运用相应化学原理的是( )
选项 劳动过程 化学原理
A 技师向模具注入钢水前将模具充分干燥 铁高温下会与水蒸气反应
B
农民夏天用NH4HCO3 施肥后,用土盖住化肥 NH4HCO3 温度高时易分解
A.标准状况下图 1 1喷泉试验后,烧瓶内氨水的物质的量浓度约为 mol L 1 9.设 NA 为阿伏加德罗常数的值。部分含氮的物质有如图转化关系。下列叙述正确的是( )22.4
B.利用图 1进行喷泉实验,将胶头滴管中的水挤入烧瓶,立即形成喷泉
C.利用图 2进行喷泉实验,用冰冷的毛巾覆盖烧瓶可引发形成喷泉
D.图 3锥形瓶内盛有乙醇,水槽中加入热水加热可引发喷泉
7.焦亚硫酸钠 (Na2S2O5 )是常用的抗氧化剂,常加入葡萄酒中以防止酒中的一些成分被氧化,起到保
质作用。以工业废气中回收SO2为原料制备焦亚硫酸钠的微型流程如图所示。已知:常温下,H2SO3
A.常温常压下, 2.24LN 含原子数为 0.2N
的电离平衡常数 Ka 1.54 10
2, Ka 1.02 10
7 2 A。下列叙述错误的是( )
1 2
B.3.7gNH4F固体含离子总数为 0.1NA
C.3.2gN2H4 中含极性键总数为 0.5NA
D.反应①中,生成 0.1mol还原产物,则需要HNO2 分子数为 0.3NA
10.溴化物介导的以水为氧源的烯烃光电化学环氧化反应,转化效率和选择性高达 100%,反应过程
A.上述过程没有发生氧化还原反应
中未使用含贵金属的催化剂或有毒氧化剂,为生产增值化学品和太阳能燃料发电提供了一种节能环
B.反应①表明H2SO3 酸性比H2CO3强 保的方法,其工作原理如图所示。下列叙述正确的是( )
C.饱和NaHSO3溶液呈碱性
D.“脱水、结晶”后采用“过滤、洗涤、干燥”的操作获得产品
8.含 Na 或Al元素的部分物质的“价—类”关系如图所示。下列叙述正确的是( )
A.添加的溴化物只起导电作用
B. Pt极附近溶液 pH降低
C.BiVO4极的电极反应式为 2Br
2e Br2
A.d、e与 c反应的产物相同
B.若常温下可用 a的单质制作的容器来盛放浓硝酸,说明 a与浓硝酸不反应
D.生成 0.5mol 时外电路理论上转移1mol电子
C.若 b在常温下为淡黄色固体,则向酚酞溶液中加入 b,溶液变红
11.某溶液可能含 Fe2 、Cl 、Br 、 I 、S2 中的若干种离子,标准状况下,向 400mL该混合液中缓
D.能与水反应生成 c的物质只有 b
慢通入Cl2 ,混合溶液中部分离子的物质的量与氯气通入体积的关系如图所示。下列叙述正确的是
( )
A.HCOONa溶液中 c(OH ) c(HCOOH) B. Kb (HCOO
)的数量级为10 10
A.通入标准状况下 4.48LCl2 时总反应为 2Fe
2 Cl 2Fe3 2 2Cl
C. K (HCOOH) 10 3.75a D. 0.1mol L
1HCOOH 溶液 pH 4.75
B.通入标准状况下8.96LCl2时,此时溶液 c(Cl
) 2mol L 1
14. K rp 为相对压力平衡常数,表达式为在浓度平衡常数表达中,用相对分压代替气体浓度,气体的
C.该溶液中一定不存在S2
1
D.图像中 b为 0.6 相对分压等于其分压 (kPa)除以 p0 ( p0 100kPa)。反应X(g) Z(s) 2Y(g) 的 lnK
r
p 随温度 变化T
12.金是一种贵金属,很多世纪以来一直被用作货币、保值物及珠宝,其晶胞结构如图所示。已知晶
如图曲线 a,反应Q(g) R(g) 2S(g) 2U(g) 的 lnK r
1
p 随温度 变化如图曲线 b。M 点对应温度
胞参数为 anm ,设 NA 为阿伏加德罗常数的值。下列叙述错误的是( )
T
下,将1molAr (不参与反应)和1molX(g)充入恒容密闭容器甲中。初始总压为100kPa。下列说法
正确的是( )
A.1个晶胞含 4个Au原子
B. 3两个Au原子最近距离为 anm
2
C.1个Au原子周围有 12个最近且等距离的Au原子
D. 197 4
A.反应Q(g) R(g) 2S(g) 2U(g) 的 H 0
晶体密度 3
N (a 10 7
g cm
A )
3
2
1 B.X(g) Z(s) 2Y(g)
p(Z) p (Y)
的表达式 K r
13. 常 温 下 , 向 0.1mol L HCOOH 溶 液 加 入 少 量 NaOH p固 体 , 保 持 p(X) 104
c(HCOOH) c HCOO 0.1mol L 1 pH C.容器甲中平衡时分压 p(X) 25kPa。含碳粒子浓度与 关系如图所示。下列叙述正确的是( )
D.容器甲中平衡时 Y的体积分数为 50%
二、非选择题:本题共 4 小题,共 58 分。
15.(14分)氮化锂 (Li3N)常用作固体电解质、催化剂等,某实验小组利用锂的氮气的反应设计实验 (5)向装有足量稀硫酸的试管中加入少量 Li3N样品,若________(填实验现象),则产品混有锂。
制备氮化锂并探究某些物质性质,实验装置如图所示。
(6)为了测定实验后 B中固体 (CoCl2 xH2O)组成,进行如下实验:
取 2.38gB中固体溶于去离子水,配制成 250mL溶液,准确量取 25.00mL配制的溶液于锥形瓶,向其
中加入 0.1mol L 1AgNO3溶液,测得消耗AgNO3 溶液体积为 20.00mL。
①实验室中用棕色试剂瓶盛放AgNO3 溶液,其原因是________。
② x ________。
已知部分信息如下:
16.(15分)五氟化锑 (SbF5 )是一种高能氟化剂,用于制药业;硼化钛 (TiB2 )是新型无机非金属材料
①几种含铬的化合物颜色如下表所示:
物 Cr O (s) Na[Cr(OH) ](aq) Cr (SO ) (aq) (NH ) Cr O (s) K Cr O (aq) 用于机械制造业。工业上,以一种含钛的矿渣(主要含TiO2、Sb2O3、ZnO、PbO、NiO和CoO等)2 3 4 2 4 3 4 2 2 7 2 2 7
质
颜 绿色 绿色 棕红色 橘黄色 橙红色 为原料制取TiB2和SbF5,流程如图所示。
色
②Li3N极易潮解。
回答下列问题:
(1)D装置的名称是________;实验室将锂贮存于________中。
(2)实验时,先点燃 A处酒精灯,后点燃 C处酒精灯,这样操作的目的是________。
(3)当 A装置中黄色粉末全部变为绿色时熄灭 A处酒精灯,写出该反应的化学方程式:________。
(4)实验完毕后,取 A装置中绿色粉末 X进行如下实验:
序号 操作 现象 已知:①TiO2性质较稳定,加热时可溶于浓硫酸中形成TiO
2 ;②高温下,B2O3易挥发;③常温
Ⅰ 向 X中加入稀硫酸,振荡 溶液变为棕红色
24 28
Ⅱ 向 X中加入NaOH溶液,振荡 溶液变为绿色 下, Ksp (ZnS) 2.0 10 , Ksp (PbS) 8.0 10 。
Ⅲ X KMnO 绿色粉末溶解,产生黑色沉淀 Y,溶液变为橙红色向 中加入 溶液,煮沸 回答下列问题:4
(1)“酸解”中,浓硫酸表现出的性质是________(填字母)。
①根据上述实验推知,Cr2O3 性质与下列物质最相似的是________(填字母)。 A.强氧化性 B.强酸性 C.脱水性 D.吸水性
(2)“水解”中,为了提高水解率宜选择下列措施________(填字母)。
a. Fe2O3 b.Al2O3 c.MgO d. P2O5 A.加入稀硫酸 B.通入水蒸气 C.加入少量氨水
②已知:黑色固体 Y常用于实验室制备Cl2 和O2 。写出实验Ⅲ中离子方程式:________,由此推 “水解”中离子方程式为________。
(3)“电解”中,在________极析出Sb;另一极上生成的气体可以循环用于________工序。
知,该反应中氧化性:KMnO4 ________K2Cr2O7(填“ ”“ ”或“ ”)。 (4)“热还原”中反应的化学方程式为________。
(5)“氟化”中,不选用玻璃仪器,其原因是________。
( 6)已知:“除 Co 、 Ni ”后,滤液含 c(Zn2 ) c(Pb2 ) 0.1mol L 1 。当金属离子浓度
滴定终点,三次平行实验,平均消耗Na S O 溶液体积为 bmL。已知: 2Cu2 4I 2 2 3 2CuI I2 ,
c(Mn+) 1.0 10 5mol L 1时表明金属已完全沉淀。“除 Zn、Pb”中,当 PbS刚好完全沉淀时,ZnS
2 2
沉淀率为________%。 ClO4 8I 8H 4I2 Cl 4H2O, I2 2S2O3 2I S4O6 。
17(. 14分)高氯酸铜 [Cu(ClO4 )2 ]应用于电子工业、催化剂制备。以铜屑为原料制备 [Cu(ClO4 )2 6H2O] (5)滴定终点标志是________。
并测定其纯度。 (6)该产品纯度为________(列出计算表达式即可);如果加入硫酸过多,测定结果偏高,其原因
是________(用离子方程式表示)。
实验(一)制备Cu(ClO4 )2 6H2O。
18.(15分)G作为一种医药中间体,在药物合成中扮演着重要角色,以甲苯为原料制备 G的流程
步骤 1按如图装置制备CuCl2。已知:CuCl2熔点为 620℃,易潮解。 如下:
请回答下列问题:
(1)A B的反应试剂与条件是________;X的名称为________。
步骤 2 将1.35gCuCl2 转入150mL烧杯中,加 50mL水溶解,在搅拌下加入15mL2.0mol L
1NaOH 溶
(2)D中官能团的名称是________;E F的反应类型是________。
液,中火(电陶炉温度约为 300℃)加热至沉淀完全变黑,不断搅拌,煮沸。稍冷后,抽滤(减压
(3)D E发生反应时的另一产物为 P(OH)Br2 ,写出该反应的化学方程式:________。
过滤),用少量去离子水淋洗沉淀。
步骤 3用玻璃棒将氧化铜和滤纸一起转移到盛有10mL水的100mL蒸发血中,滴加 3.30g高氯酸,微 (4)下列叙述正确的是________(填字母)。
热至氧化铜溶解后将滤纸完整挑出(避免将滤纸捣碎),小火(电陶炉温度约为 200℃)蒸发至表面 a.A、B、C都能使酸性KMnO4溶液褪色 b.E、F中碳原子都有 2种杂化类型
形成一层膜为止。冷却、抽滤,得到浅蓝色六水合高氯酸铜。
c.D、G均可形成分子间氢键 d. F G的副产物为氨气
(1)步骤 1中,B装置中试剂是________(填名称)。D装置的作用是________。
(5)A的二氯代物有________种,其中在核磁共振氢谱上有 3组峰的结构简式为________(写出一
(2)写出 A装置中化学方程式:________。
种即可)。
(3)步骤 2中,相对普通过滤,抽滤的优点是________(答一条)。
(4)步骤 3中,“蒸发至表面形成一层膜”,这样操作的目的是________。
(6)根据上述流程,以 和 为原料合成 ,设计合成路线:
实验(二)测定 [Cu(ClO4 )2 6H2O]产品纯度。
________(其他无机试剂自选)。
取 3.30g产品溶于水配制100mL溶液,准确量取 25.00mL配制溶液于锥形瓶中,加入适量稀硫酸和
过量的KI,塞紧瓶塞,放置在暗室中充分反应。滴入 2滴淀粉溶液,用 amol L 1Na2S2O3 标准溶液
四川省 2025 3 1 100届高三上学期 10 月阶段检测考 ab 10 371
(6) 17 25 100%(2分) 2H S 2 2O3 S SO2 H O(2分)3.3 2
化学参考答案
18.(1)Cl2、光照(2分) 环氧乙烷(1分)
一、选择题
(2)羟基(1分) 取代反应(1分)
1-5.DACDB 6-10.BCADD 11-14.CBCC
15.(1)球形干燥管(1分) 石蜡油或石蜡(1分) (3) PBr3 P(OH)Br2 (2分)
(2)排尽装置内空气(1分) (4)ac(2分)
△
(3) (NH4 )2Cr2O7 N2 Cr2O3 4H2O(2分)
(5)10(2分) (1分)
(4)①b(1分) ②Cr2O3 2MnO
4 MnO2 Cr2O
2
7 (2分) >(1分)
(5)产生气泡(2分) (6)
(3分)
(6)①AgNO3见光易分解(1分) ②6(2分)
16.(1)B(1分)
(2)BC(2分) TiO2 (x 1)H2O TiO2 xH2O 2H
(2分)
(3)阴(2分) 氯化(2分)
高温
(4)TiO2 xH2O B2O3 5C TiB2 5CO xH2O (2分)
(5)玻璃中的SiO2和HF反应(2分)
(6)75(2分)
17.(1)浓硫酸(1分) 吸收尾气中的Cl2 和HCl,防止污染环境,防止外界的水蒸气进入装置 C
中(2分)
(2)Ca(ClO)2 4HCl(浓) CaCl2 2Cl2 2H2O(2分)
(3)过滤较快、固体较干燥、固体和液体易分离等(1分)
(4)制备热饱和溶液,防止过度蒸发导致目标产物损失(2分)
(5)滴入最后半滴溶液,溶液刚好由蓝色变为无色且半分钟不褪色(2分)
同课章节目录
