2.2电解质的电离离子反应 课件(共38张PPT)高中化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2电解质的电离离子反应 课件(共38张PPT)高中化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-04 14:49:23 | ||
图片预览








文档简介
(共38张PPT)
第二节 电解质的电离 离子反应
思考:
你所知道的能导电的物质有哪些?
金属单质、石墨、氯化钠溶液、氢氧化钠溶液等都能导电。
这些物质为什么可以导电?
反思:固态氯化钠、熔融状态的氯化钠、氯化钠溶液,有的导电,有的不导电,原因是什么?
研究氯化钠的导电性
样品 固态氯化钠 熔融状态的氯化钠 氯化钠溶液
能否导电 不能 能 能
观察固态氯化钠、熔融状态的氯化钠、氯化钠溶液的导电性实验,认识氯化钠在什么情况下能够导电。
固体NaCl
溶于水
熔融
自由移动的离子
一、电离
化合物溶于水或受热熔化时,解离成自由移动的离子的过程。
1. 定义:
2. 电离条件:
溶于水或受热熔化
思考:
a. 电离需要通电吗?
b. 电离是物理变化还是化学变化?
不需要
物理变化
3.物质导电
的原因
金属、石墨:存在自由移动的电子
溶液:存在自由移动的离子
主:自由移动离子的浓度
次:离子带电荷数
4.溶液导电性强弱
5. 表示方式--电离方程式
用化学式和离子符号来表示电离过程的式子。
NaCl = Na+ + Cl-
注意遵循电荷守恒和质量守恒原则
【学以致用】
书写下列物质的电离方程式:
HCl = H+ + Cl-
(1) H2SO4、HNO3
(2) NaOH、Ba(OH)2
(3) Na2CO3、NH4Cl
酸:阳全H+ (只溶-导电)
碱:阴全OH–(溶、熔-导电)
盐: 金属阳离子(或铵根离子)和酸根阴离子
(溶、熔导电)
少数- NH4Cl、NaHCO3受热分解(只溶于水导电)
活泼金属氧化物:只能熔融导电
物质
混合物
纯净物
化合物
单质
电解质
非电解质
1.电解质:
定义:水溶液或熔融状态下能导电的化合物
二、电解质、非电解质
常见电解质:
酸、碱、盐(含难溶)、
活泼金属氧化物、水
有自由移动的离子
纯净物
2.非电解质:
定义:……和……都不能………化合物。
非金属
氧化物
CO2
CO
NO2
NO
SO2
部分
氢化
物
CH4
NH3
多数有机物
C2H5OH
C6H12O6
苯C6H6
……
常见非电解质:
3. 注意:
①单质、混合物既不是电解质,也不是非电解质。
②纯净电解质不一定导电。
固体NaCl,液体HCl(无自由移动离子)
③电解质必须自身能电离产生离子
NH3 SO2 SO3 CO2
NH3·H2O H2SO3 H2SO4 H2CO3
…. 非电解质
….电解质
三、强、弱电解质
1.强电解质:在水溶液里完全电离
强酸
HCl
H2SO4
HNO3
HBr
HI
HClO4
HMnO4
强碱
NaOH
KOH
Ba(OH)2
Ca(OH)2
绝大多数盐
2.弱电解质:在水溶液里部分电离
弱酸、弱碱、水(极弱)
※强弱电解质与溶解度和导电能力无关
※强弱电解质区分依据:是否 完全 电离
少数盐(CH3COO)2Pb 、 Fe(SCN)3
①H2O,②CH3COOH,③Fe,④石墨,
⑤H2SO4,⑥NaCl,⑦NaOH, ⑧蔗糖,
⑨酒精(纯净物)中属于电解质的是____________;属于非电解质的是______ ;属于强电解质的是_____;属于弱电解质的是______ (填序号)
① ② ⑤ ⑥ ⑦
⑤ ⑥ ⑦
⑧ ⑨
① ②
练:H2SO4 CH3COOH HClO NH3·H2O Ba(OH)2 BaSO4 Na2CO3 H2O
H2SO4=2H++SO42-
CH3COOH CH3COO-+H+
HClO H++ClO- NH3·H2O NH4++OH-
Ba(OH)2=Ba2++2OH- BaSO4= Ba2++SO42-
Na2CO3=2Na++CO32- H2O OH-+H+
3、电离方程式:
①强电解质: 〓(百分百) 弱电解质: (部分)
②多元弱酸分步电离(以第一步为主)
H2CO3
H+ + HCO3- (主)
HCO3-
H++CO32- (次)
③多元弱碱一步写成
Al(OH)3
Al3+ +3OH-
④盐中弱酸酸式酸根 不拆:
NaHCO3=Na++HCO3-
⑤盐中 强酸酸式酸根 注意!
水溶液里拆开:
NaHSO4=Na++H++SO42-
熔融不拆: NaHSO4=Na++HSO4-
四、电解质在水溶液中的反应
(1)定义:在溶液中,有离子参加的反应。
例: HCl+NaOH=NaCl+H2O
1.离子反应
课本P55
(2)反应实质:
现象
②溶液颜色由红变无
①有白色沉淀
③电流表指针读数先减小为0,然后增大
使某些离子浓度减小
(3)反应发生条件:
难溶 ( ↓ )
易挥发( ↑ )
难电离(弱电解质)
生成
2、离子方程式
(1)定义:用实际参加反应的离子符号来表示离子反应的式子。
【活动一】探究离子反应的实质
写出化学反应方程式
写
拆
删
(2)离子反应方程式书写程序 —— 以NaOH和H2SO4的反应为例
2NaOH + H2SO4 = Na2SO4 + 2H2O
将易溶于水的强电解质拆成离子
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
删去”=”两边未反应的离子
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
查
2OH- + 2H+ = 2H2O
OH- + H+ = H2O
检查方程式是否配平,原子守恒,电荷守恒
不拆:单质.氧化物.弱酸、弱碱、↓↑、水
写出下列反应的离子方程式
写
拆
删
查
BaCl2溶液和Na2SO4
CaCO3和稀HCl
NaOH溶液和稀HCl
KOH溶液和稀H2SO4
Ba(NO3)2溶液和Na2SO4
OH- + H+ = H2O
OH- + H+ = H2O
SO42- + Ba2+ = BaSO4
SO42- + Ba2+ = BaSO4
CaCO3 + 2H+ = Ca2+ + CO2+H2O
(3)特点
①表示一个反应本质
②表示一类反应
H++OH- = H2O代表: ?
强酸、可溶性强碱生成可溶性盐的中和反应
※注意:
1、Ca(OH)2
石灰乳→Ca(OH)2
澄清石灰水→Ca2++2OH-
2、NH4++OH-
=NH3+H2O
△
=NH3·H2O
3、浓酸
不拆:浓硫酸(98%以上)
拆:浓盐酸(最高37%)
浓硝酸(最高65%)
3、NH3·H2O+CH3COOH
8、MnO2+4HCl(浓) = MnCl2+Cl2+2H2O
△
6、Cl2+NaOH
5、Cl2+H2O
1、HClO+NaOH
7、NaHCO3+NaOH
4、Na+H2O
2、HNO3+KOH/Ca(OH)2 (清、浊)
练
一
练
3、离子检验
(2)Cl- 、Br-、I- :
(3)SO42- :
先加盐酸酸化,再加BaCl2(加现象)
HNO3 、AgNO3
排除Ag+ SO32- CO32-干扰
HNO3不行:SO32-→SO42-
(1)NH4+: ①滴加碱溶液 ②加热 ③湿润的红色石蕊试纸。
4、离子共存(大量共存)
即:共存离子间不能发生化学反应
1、生成难溶、微溶物(熟记盐类溶解规律)
(1)Cl-:Ag+
(2)SO42-: Ca2+ 、 Ag+、Ba2+
(3)CO32-: 除K+ Na+ NH4+,其它均为难溶(微溶)物
(4)OH-: 除K+ Na+ Ba2+ ,…………
(5)NO3-: 全溶
2、生成弱电解质
(1) H+ :ClO-;CH3COO-;CO32- ,HCO3- ;
SO32- ,HSO3-; S2- ,HS-
(2)OH-: NH4+
(3)H2O:
H+ : OH-
HCO3- HSO3- ,HS-
OH-: H+
小结:H+.OH-: HCO3- HSO3- HS-
HCO3-+OH-=H2O+CO32-
HCO3-+H+=CO2+H2O
3、生成挥发物
4、发生氧化还原反应
5、有色:Fe2+(浅绿)Fe3+(黄色)
Cu2+(蓝色)MnO4-(紫色)
H+: CO32-; SO32-; S2-
【例】判断下列澄清透明溶液中离子能否大量共存
① Ca2+ Na+ CO32- NO3-
② Ba2+ Na+ SO42- NO3-
③ H+ K+ Cl- HCO3-
④ H+ K+ Cu2+ SO42-
⑤ Na+ K+ HCO3- OH-
(× )
(× )
( )
(× )
(×)
煮
海
为
盐
盐场工人在晒盐
海水
盐田
析出粗盐
引入
风吹日晒
H2O蒸发
海水晒盐
粗盐提纯(除Mg2+,Ca2+ ,SO42-)
③Na2CO3:
④HCl:
加入试剂的顺序?
①NaOH: Mg2+ +2OH- =Mg(OH)2
②BaCl2:Ba2+ + SO42- = BaSO4
H++OH- = H2O
2H+ +CO32- =H2O+CO2
Ca2++CO32- = CaCO3
Ba2++CO32- = BaCO3
5、反应物量的问题
(1)CO2 和碱
①向澄清石灰水通少量CO2
Ca(OH)2+CO2=CaCO3+H2O
②继续通CO2
CaCO3+H2O+CO2=Ca(HCO3)2
③通大量CO2
Ca(OH)2+2CO2=Ca(HCO3)2
少量——正盐(CO32-)
过量——酸式盐( HCO3- )
小结:酸性气体通入碱中
CO2通入NaOH中
少量
过量
Na2CO3
NaHCO3
( 2 )酸式盐+碱(少定多变法)
1、NaOH+Ca(HCO3)2
本质:酸碱中和
①NaOH不足
②NaOH过量
2、Ca(OH)2+NaHCO3
3、NaHSO4+Ba(OH)2
谁少量,定系数为1
※
HCO3-+OH-=H2O+CO32-
(3) 酸式盐
强酸酸式盐:NaHSO4=?
弱酸酸式盐:NaHCO3=?
思考:将这两种酸式盐的水溶液混合后,
实际参加反应的离子是什么?
NaHSO4 = Na+ + H+ + SO42-
NaHCO3 = Na+ + HCO3-
H+ + HCO3- = H2O+CO2
小结:Na+和SO42-参加反应了吗?
2、NH3·H2O+CH3COOH
3、MnO2+4HCl(浓) = MnCl2+Cl2+2H2O
△
4、Cl2+NaOH
5、Cl2+H2O
练:1、HClO+NaOH
6、NaHCO3+NaOH
7、Na+H2O
HClO+OH-=ClO-+H2O
NH3·H2O+CH3COOH=CH3COO-+NH4++H2O
MnO2+4H++2Cl- = Mn2++Cl2+2H2O
Cl2+2OH-= ClO-+Cl- +H2O
Cl2+H2O=HClO+H++Cl-
HCO3-+OH-=CO32-+H2O
2Na+2H2O=2Na++2OH-+H2
第二节 电解质的电离 离子反应
思考:
你所知道的能导电的物质有哪些?
金属单质、石墨、氯化钠溶液、氢氧化钠溶液等都能导电。
这些物质为什么可以导电?
反思:固态氯化钠、熔融状态的氯化钠、氯化钠溶液,有的导电,有的不导电,原因是什么?
研究氯化钠的导电性
样品 固态氯化钠 熔融状态的氯化钠 氯化钠溶液
能否导电 不能 能 能
观察固态氯化钠、熔融状态的氯化钠、氯化钠溶液的导电性实验,认识氯化钠在什么情况下能够导电。
固体NaCl
溶于水
熔融
自由移动的离子
一、电离
化合物溶于水或受热熔化时,解离成自由移动的离子的过程。
1. 定义:
2. 电离条件:
溶于水或受热熔化
思考:
a. 电离需要通电吗?
b. 电离是物理变化还是化学变化?
不需要
物理变化
3.物质导电
的原因
金属、石墨:存在自由移动的电子
溶液:存在自由移动的离子
主:自由移动离子的浓度
次:离子带电荷数
4.溶液导电性强弱
5. 表示方式--电离方程式
用化学式和离子符号来表示电离过程的式子。
NaCl = Na+ + Cl-
注意遵循电荷守恒和质量守恒原则
【学以致用】
书写下列物质的电离方程式:
HCl = H+ + Cl-
(1) H2SO4、HNO3
(2) NaOH、Ba(OH)2
(3) Na2CO3、NH4Cl
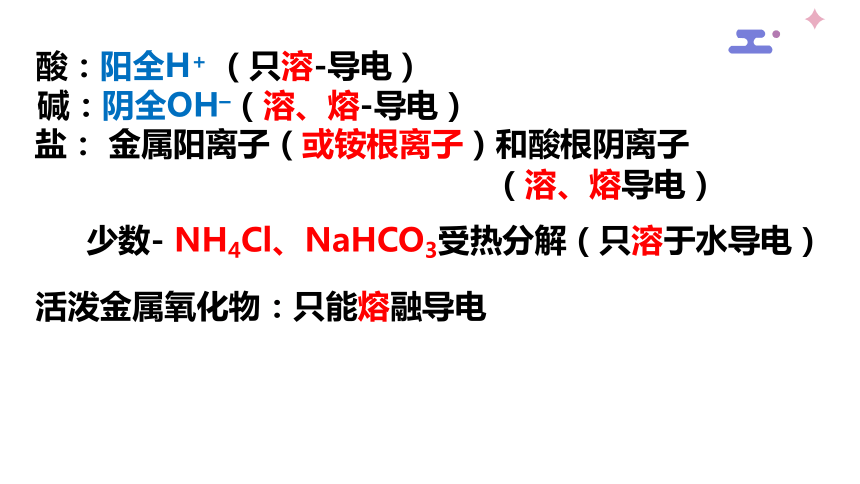
酸:阳全H+ (只溶-导电)
碱:阴全OH–(溶、熔-导电)
盐: 金属阳离子(或铵根离子)和酸根阴离子
(溶、熔导电)
少数- NH4Cl、NaHCO3受热分解(只溶于水导电)
活泼金属氧化物:只能熔融导电
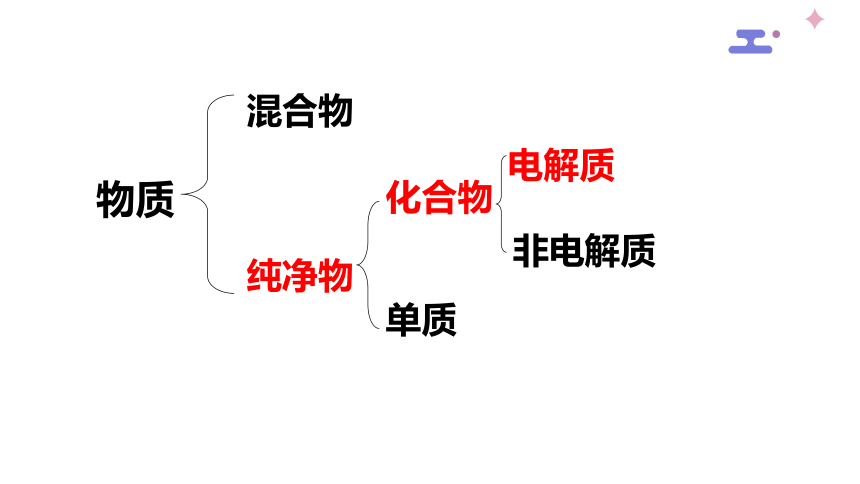
物质
混合物
纯净物
化合物
单质
电解质
非电解质
1.电解质:
定义:水溶液或熔融状态下能导电的化合物
二、电解质、非电解质
常见电解质:
酸、碱、盐(含难溶)、
活泼金属氧化物、水
有自由移动的离子
纯净物
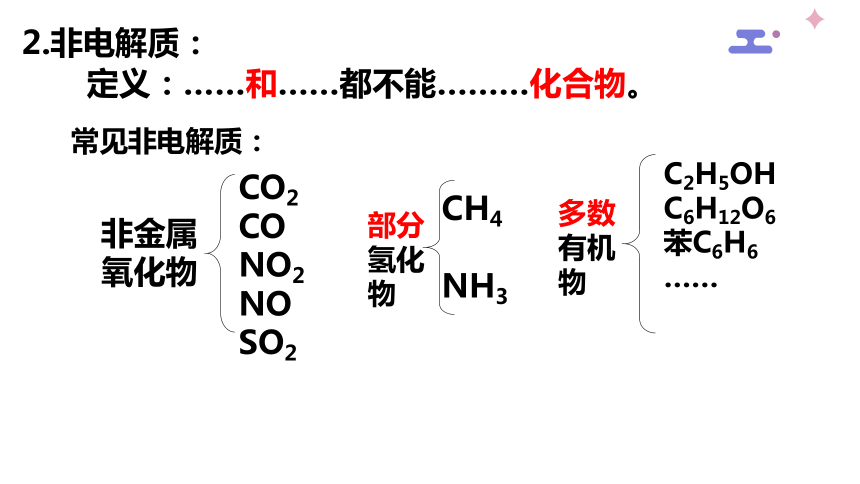
2.非电解质:
定义:……和……都不能………化合物。
非金属
氧化物
CO2
CO
NO2
NO
SO2
部分
氢化
物
CH4
NH3
多数有机物
C2H5OH
C6H12O6
苯C6H6
……
常见非电解质:
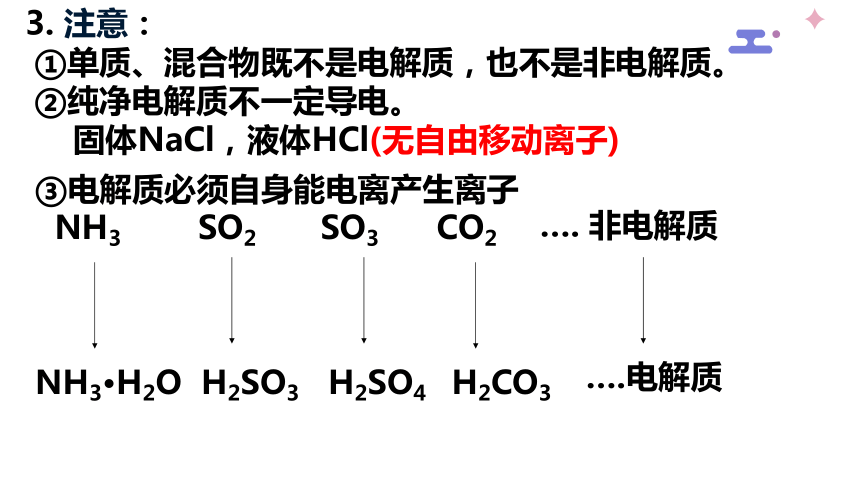
3. 注意:
①单质、混合物既不是电解质,也不是非电解质。
②纯净电解质不一定导电。
固体NaCl,液体HCl(无自由移动离子)
③电解质必须自身能电离产生离子
NH3 SO2 SO3 CO2
NH3·H2O H2SO3 H2SO4 H2CO3
…. 非电解质
….电解质
三、强、弱电解质
1.强电解质:在水溶液里完全电离
强酸
HCl
H2SO4
HNO3
HBr
HI
HClO4
HMnO4
强碱
NaOH
KOH
Ba(OH)2
Ca(OH)2
绝大多数盐
2.弱电解质:在水溶液里部分电离
弱酸、弱碱、水(极弱)
※强弱电解质与溶解度和导电能力无关
※强弱电解质区分依据:是否 完全 电离
少数盐(CH3COO)2Pb 、 Fe(SCN)3
①H2O,②CH3COOH,③Fe,④石墨,
⑤H2SO4,⑥NaCl,⑦NaOH, ⑧蔗糖,
⑨酒精(纯净物)中属于电解质的是____________;属于非电解质的是______ ;属于强电解质的是_____;属于弱电解质的是______ (填序号)
① ② ⑤ ⑥ ⑦
⑤ ⑥ ⑦
⑧ ⑨
① ②
练:H2SO4 CH3COOH HClO NH3·H2O Ba(OH)2 BaSO4 Na2CO3 H2O
H2SO4=2H++SO42-
CH3COOH CH3COO-+H+
HClO H++ClO- NH3·H2O NH4++OH-
Ba(OH)2=Ba2++2OH- BaSO4= Ba2++SO42-
Na2CO3=2Na++CO32- H2O OH-+H+
3、电离方程式:
①强电解质: 〓(百分百) 弱电解质: (部分)
②多元弱酸分步电离(以第一步为主)
H2CO3
H+ + HCO3- (主)
HCO3-
H++CO32- (次)
③多元弱碱一步写成
Al(OH)3
Al3+ +3OH-
④盐中弱酸酸式酸根 不拆:
NaHCO3=Na++HCO3-
⑤盐中 强酸酸式酸根 注意!
水溶液里拆开:
NaHSO4=Na++H++SO42-
熔融不拆: NaHSO4=Na++HSO4-
四、电解质在水溶液中的反应
(1)定义:在溶液中,有离子参加的反应。
例: HCl+NaOH=NaCl+H2O
1.离子反应
课本P55
(2)反应实质:
现象
②溶液颜色由红变无
①有白色沉淀
③电流表指针读数先减小为0,然后增大
使某些离子浓度减小
(3)反应发生条件:
难溶 ( ↓ )
易挥发( ↑ )
难电离(弱电解质)
生成
2、离子方程式
(1)定义:用实际参加反应的离子符号来表示离子反应的式子。
【活动一】探究离子反应的实质
写出化学反应方程式
写
拆
删
(2)离子反应方程式书写程序 —— 以NaOH和H2SO4的反应为例
2NaOH + H2SO4 = Na2SO4 + 2H2O
将易溶于水的强电解质拆成离子
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
删去”=”两边未反应的离子
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42- + 2H2O
查
2OH- + 2H+ = 2H2O
OH- + H+ = H2O
检查方程式是否配平,原子守恒,电荷守恒
不拆:单质.氧化物.弱酸、弱碱、↓↑、水
写出下列反应的离子方程式
写
拆
删
查
BaCl2溶液和Na2SO4
CaCO3和稀HCl
NaOH溶液和稀HCl
KOH溶液和稀H2SO4
Ba(NO3)2溶液和Na2SO4
OH- + H+ = H2O
OH- + H+ = H2O
SO42- + Ba2+ = BaSO4
SO42- + Ba2+ = BaSO4
CaCO3 + 2H+ = Ca2+ + CO2+H2O
(3)特点
①表示一个反应本质
②表示一类反应
H++OH- = H2O代表: ?
强酸、可溶性强碱生成可溶性盐的中和反应
※注意:
1、Ca(OH)2
石灰乳→Ca(OH)2
澄清石灰水→Ca2++2OH-
2、NH4++OH-
=NH3+H2O
△
=NH3·H2O
3、浓酸
不拆:浓硫酸(98%以上)
拆:浓盐酸(最高37%)
浓硝酸(最高65%)
3、NH3·H2O+CH3COOH
8、MnO2+4HCl(浓) = MnCl2+Cl2+2H2O
△
6、Cl2+NaOH
5、Cl2+H2O
1、HClO+NaOH
7、NaHCO3+NaOH
4、Na+H2O
2、HNO3+KOH/Ca(OH)2 (清、浊)
练
一
练
3、离子检验
(2)Cl- 、Br-、I- :
(3)SO42- :
先加盐酸酸化,再加BaCl2(加现象)
HNO3 、AgNO3
排除Ag+ SO32- CO32-干扰
HNO3不行:SO32-→SO42-
(1)NH4+: ①滴加碱溶液 ②加热 ③湿润的红色石蕊试纸。
4、离子共存(大量共存)
即:共存离子间不能发生化学反应
1、生成难溶、微溶物(熟记盐类溶解规律)
(1)Cl-:Ag+
(2)SO42-: Ca2+ 、 Ag+、Ba2+
(3)CO32-: 除K+ Na+ NH4+,其它均为难溶(微溶)物
(4)OH-: 除K+ Na+ Ba2+ ,…………
(5)NO3-: 全溶
2、生成弱电解质
(1) H+ :ClO-;CH3COO-;CO32- ,HCO3- ;
SO32- ,HSO3-; S2- ,HS-
(2)OH-: NH4+
(3)H2O:
H+ : OH-
HCO3- HSO3- ,HS-
OH-: H+
小结:H+.OH-: HCO3- HSO3- HS-
HCO3-+OH-=H2O+CO32-
HCO3-+H+=CO2+H2O
3、生成挥发物
4、发生氧化还原反应
5、有色:Fe2+(浅绿)Fe3+(黄色)
Cu2+(蓝色)MnO4-(紫色)
H+: CO32-; SO32-; S2-
【例】判断下列澄清透明溶液中离子能否大量共存
① Ca2+ Na+ CO32- NO3-
② Ba2+ Na+ SO42- NO3-
③ H+ K+ Cl- HCO3-
④ H+ K+ Cu2+ SO42-
⑤ Na+ K+ HCO3- OH-
(× )
(× )
( )
(× )
(×)
煮
海
为
盐
盐场工人在晒盐
海水
盐田
析出粗盐
引入
风吹日晒
H2O蒸发
海水晒盐
粗盐提纯(除Mg2+,Ca2+ ,SO42-)
③Na2CO3:
④HCl:
加入试剂的顺序?
①NaOH: Mg2+ +2OH- =Mg(OH)2
②BaCl2:Ba2+ + SO42- = BaSO4
H++OH- = H2O
2H+ +CO32- =H2O+CO2
Ca2++CO32- = CaCO3
Ba2++CO32- = BaCO3
5、反应物量的问题
(1)CO2 和碱
①向澄清石灰水通少量CO2
Ca(OH)2+CO2=CaCO3+H2O
②继续通CO2
CaCO3+H2O+CO2=Ca(HCO3)2
③通大量CO2
Ca(OH)2+2CO2=Ca(HCO3)2
少量——正盐(CO32-)
过量——酸式盐( HCO3- )
小结:酸性气体通入碱中
CO2通入NaOH中
少量
过量
Na2CO3
NaHCO3
( 2 )酸式盐+碱(少定多变法)
1、NaOH+Ca(HCO3)2
本质:酸碱中和
①NaOH不足
②NaOH过量
2、Ca(OH)2+NaHCO3
3、NaHSO4+Ba(OH)2
谁少量,定系数为1
※
HCO3-+OH-=H2O+CO32-
(3) 酸式盐
强酸酸式盐:NaHSO4=?
弱酸酸式盐:NaHCO3=?
思考:将这两种酸式盐的水溶液混合后,
实际参加反应的离子是什么?
NaHSO4 = Na+ + H+ + SO42-
NaHCO3 = Na+ + HCO3-
H+ + HCO3- = H2O+CO2
小结:Na+和SO42-参加反应了吗?
2、NH3·H2O+CH3COOH
3、MnO2+4HCl(浓) = MnCl2+Cl2+2H2O
△
4、Cl2+NaOH
5、Cl2+H2O
练:1、HClO+NaOH
6、NaHCO3+NaOH
7、Na+H2O
HClO+OH-=ClO-+H2O
NH3·H2O+CH3COOH=CH3COO-+NH4++H2O
MnO2+4H++2Cl- = Mn2++Cl2+2H2O
Cl2+2OH-= ClO-+Cl- +H2O
Cl2+H2O=HClO+H++Cl-
HCO3-+OH-=CO32-+H2O
2Na+2H2O=2Na++2OH-+H2
