2.3氧化剂和还原剂 课件(共41张PPT)高中化学 鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3氧化剂和还原剂 课件(共41张PPT)高中化学 鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 27.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-04 14:51:24 | ||
图片预览









文档简介
(共41张PPT)
第3节 氧化剂和 还原剂
2
查阅资料,解释生活中的一些现象:
苹果咬一口变黄
酒精检测仪测酒驾
一、认识氧化还原反应
角度一:得氧失氧
氧化反应和还原反应同时发生:氧化还原反应
H2 + CuO = H2O + Cu
△
得氧,被氧化,氧化反应
失氧,被还原,还原反应
角度二:化合价的变化
H2 + CuO = H2O + Cu
△
0
+1
+2
0
化合价升高,被氧化,氧化反应
化合价降低,被还原,还原反应
1、结论:反应过程中有化合价变化的反应叫做氧化还原反应。 (判定标准)
氧化反应: 反应物所含元素化合价升高的反应。
还原反应: 反应物所含元素化合价降低的反应。
2Na + Cl2 = 2NaCl
0
+1
0
-1
化合价降低,被还原,还原反应
化合价升高,被氧化,氧化反应
点燃
C + 2CuO = 2Cu + CO2
△
C + O2 = CO2
△
CaCO3 = CaO + CO2
△
CaCO3+ 2HCl = CaCl2 + CO2 + H2O
判断下列反应是否是氧化还原反应?
置换
复分解
化合
分解
是
是
2.与四种基本反应类型间的关系:
①置换反应
②复分解反应
③化合反应
④分解反应
有单质参加的反应就是氧化还原反应?
×
都是
都不是 …
部分是 …
部分是 …
有单质参加或生成
你能用图形表示这种关系吗?
氧化还原反应。
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
Na
+11
2
8
1
+17
2
8
7
+11
2
8
+17
2
8
8
Na+
Cl
Cl-
NaCl
e-
化合价升降的原因:电子的得失
3.实质:???
(Na+Cl2)
www.sghxy.com
H Cl
H Cl
化合价升降的原因:
电子对的偏移
电子转移(电子得失和共用电子对偏移)
外在表现:化合价变化
(H2+Cl 2)
实质:
练一练:
1.下列叙述正确的是 ( )
A.在氧化还原反应中 ,失去电子的物质,所含元素化合价降低
B.凡是有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的转移
BD
1.表示方法:
①双线桥:
2Na + Cl2 2NaCl
点燃
化合价升高,失 1e-×2,氧化反应
化合价降低,得1e-×2 ,还原反应
0
+1
0
-1
标变价.
划线桥.
注得失和数目
二、分析氧化还原反应
②单线桥(在反应物中,由失电子元素
指向得电子元素注明转移电子总数)
2Na + Cl2 = 2NaCl
点燃
2e-
Cl2 + H2O = HCl + HClO
0
+1
-1
失1×e-
得1×e-
1e-
2.化合价、电子转移、反应之间的关系
— — —
— — —
升↑失氧 降↓得还
n失=n得
※电子守恒:
价↑=价↓
(Na+)
(Na)
(Cl)
(Cl-)
失电子
得电子
价↑
价↓
被氧化
被还原
氧化反应
还原反应
2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O
酒精检测仪测酒驾
下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中的氢元素化合价发生变化的是( )
A. MnO2 + 4HCl(浓)= MnCl2 + Cl2 + 2H2O
B. NaOH + HCl = NaCl + H2O
C. Zn + 2HCl = ZnCl2 + H2
D. CuO + 2HCl = CuCl2 + H2O
A
C
二、氧化剂 还原剂
1、氧化剂:
化合价↓的反应物
还原剂:
………↑…………
2Na + Cl2 = 2NaCl
0
+1
0
-1
化合价降低,被还原,还原反应
化合价升高,被氧化,氧化反应
点燃
氧化剂
还原剂
2.氧化产物:还原剂被氧化生成的物质↑
还原产物:氧化剂被还原生成的物质↓
氧化剂--价↓--得电子--被还原--还原反应—还原产物
还原剂--价↑--失电子--被氧化--氧化反应—氧化产物
氧化剂+还原剂=氧化产物+还原产物
降得还
升失氧
Zn + FeSO4 = Fe + ZnSO4
还
氧
还产
氧产
练
2、2Na+2H2O=2NaOH+H2
4、Cl2+H2O=HCl+HClO
3、Fe +Cu2+=Fe2++Cu
5、2FeCl2+Cl2=2FeCl3
6、3NO2+H2O=2HNO3+NO
7、2Na2O2+2H2O=4NaOH+O2
1、H2+CuO=Cu+H2O
△
还
氧
还
氧
还
氧
还
氧
还
氧
还
氧
还
氧
-2 -2
还产
氧产
还产
还产
还产
还产
还产
还产
氧产
氧产
氧产
氧产
氧产
氧产
20
非金属单质:O2 、 Cl2
高价含氧酸:HNO3 、浓H2SO4 、HClO4
高价盐:KMnO4 、KClO3 、FeCl3
强氧化剂: Na2O2 、HClO 、H2O2
3、(1)常见氧化剂
(化合价能降低)
0 -2
0 -1
+6 -2
+7 -1
+5 -3
(2)常见还原剂(化合价能升高)
金属单质:
K﹥Ca﹥Na…
(只作还原剂)
非金属单质:
H2 C
0 +1
0 +2、+4
低价酸:
HCl H2S
S( -2、0、+4、+6)
低价氧化物:
CO SO2
+4 +6
KI Na2SO3 Fe2+
低价盐:
Cl2+H2O HCl+HClO
Fe+4HNO3(稀) Fe(NO3)3+2H2O+NO
0
-1
+1
0
+5
+3
+2
还原剂
(氧化剂)
氧化剂
还原剂
还原剂:氧化剂=
1:1
氧化性:酸性=
1:3
还产
氧产
氧产
还产
4.物质氧化性、还原性
(1)氧化性、还原性判断
得电子能力
失电子能力
元素为最高价时: 只有氧化性。
… 为最低价时: 只有还原性。
… 为中间价时: 既有氧化性又有还原性。
(2)强弱判断
氧化性:氧化剂﹥氧化产物
①
还原性:还原剂﹥还原产物
Zn + Fe2+= Fe + Zn2+
还
氧
还产
氧产
Zn> Fe
氧化性:
还原性:
Fe2+>Zn2+
还原性:
K>Ca>Na>…Fe…
氧化性:
K+<Ca2+<Na+<… Fe2+… < Cu2+< Fe3+< Ag+< Au+
②
还原性:
氧化性:
F2>Cl2>Br2>Fe3+ > I2
F-<Cl-<Br-<Fe2+ < I-
结论
单质氧化性越强,阴离子还原性越弱。
… 还原性… , 阳离子 氧化性… …
③与同一物质反应
2Fe +3Cl2 2FeCl3
点 燃
Fe + S FeS
氧化性:
Cl2
S
④比较反应条件:
MnO2+4HCl(浓) = MnCl2+Cl2+2H2O
2KMnO4+16HCl (浓) = 2KCl+2MnCl2+5Cl2+8H2O
氧化性:KMnO4 MnO2
5、几个规律
若无中间价,不反应
若有中间价,价态“只靠拢,不交叉”。
例:H2SO4+H2S=S+SO2+2H2O
例:浓H2SO4、SO2
KClO3+6HCl=KCl+3Cl2+3H2O
(1)优先规律: 氧化性强的先反应。
同种元素不同价态反应
(2)归中规律:
H2O2 H2O + O2
Fe2O3 + CO Fe + CO2
催 化 剂
高 温
-1
-2
0
+3
0
+2
+4
ClO2+H2O2+OH-=ClO2-+O2+H2O
Cu+H++NO3-=NO2+Cu2+
Cu+H++NO3-=NO+Cu2+
配平:
C+H2SO4(浓) = CO2+SO2
S+NaOH = Na2S+Na2SO3+H2O
配平原则:1.升 = 降
2.电荷守恒
3.元素守恒
C
h
m
i
s
t
r
化学课
e
y
2.3 氧化还原反应
第二课时 氧化还原反应的应用
氧化还原反应的应用
2、预测物质的性质:
H2O2
+1
-1
H2O2
+1
H2O2
-1
氧化性
氧化性
还原剂
氧化剂
酸性KMnO4溶液
淀粉-KI试纸
还原性
1、观察外部特征:无色、无味透明液体
氧化还原反应的应用
实验验证:
① 实验一
实验内容:取1 mL KMnO4溶液于试管中, 滴加几滴稀硫酸,逐滴加入5%的H2O2溶液。
实验现象:溶液紫红色变浅直到褪去,有气泡产生
5H2O2+2MnO4-+6H+ = 2Mn2++8H2O+5O2
1.为什么加稀硫酸来酸化高锰酸钾,其他酸可以吗?
HCl HNO3
思考
2.为什么要加稀硫酸,不加可否达到预期实验现象
② 实验二
实验内容:取1 mL KMnO4溶液于试管中, 逐滴加入5%的H2O2溶液至过量
实验现象:溶液紫红色色变浅直到褪去,出现黑色沉淀
2MnO4-+3H2O2 = 2OH- + 2MnO2 + 2H2O + 3O2
5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2
氧化剂
还原产物
还原剂
氧化产物
氧化剂
还原剂
还原产物
氧化产物
结论:H2O2 具有还原性
环境条件影响物质氧化性的强弱
2MnO4-+3H2O2 = 2OH- + 2MnO2 + 2H2O + 3O2
② 实验三
实验内容:将淀粉-KI试纸放在表面皿上,滴加5%的H2O2溶液
实验现象:淀粉碘化钾试纸变蓝
2I - + H2O2 = I2 + 2OH-
氧化剂
还原产物
还原剂
氧化产物
结论:H2O2 具有氧化性
氧化还原反应的应用
2、实现物质转化与获得能量
冶炼金属:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
电解法
热还原法
热分解法
将金属从其化合物中还原出来的过程。
MgCl2 (熔融) === Mg + Cl2 ↑
电解
2Al2O3 (熔融) === 4Al + 3O2 ↑
电解
冰晶石
2NaCl (熔融) === 2Na + Cl2 ↑
电解
金属离子
金属单质
CuO +H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2
高温
2HgO==2Hg+O2↑
2Ag2O==4Ag+O2↑
氧化还原反应的应用
获得能量的重要方式
联氨(N2H4)可作火箭的燃料,燃烧时反应为
2NO2 + 2N2H4 = 3N2 + 4H2O
氧化剂
还原产物
还原剂
氧化产物
Fe+Cu2+ = Fe2++Cu
氧化还原反应的应用
实验室制Cl2
MnO2+4HCl(浓) = MnCl2+2H2O+Cl2↑
实验原理:
实验装置:
饱和食盐水
浓硫酸
NaOH溶液
固+液加热装置
浓硫酸作用:
饱和食盐水作用:
除去Cl2中的HCl
干燥Cl2
Cl2检验:
淀粉-KI试纸
发生装置:
收集装置:
向上排空气法;
排饱和食盐水
吸收装置:
NaOH溶液
MnO2+4H++2Cl- = Mn2++Cl2+2H2O
舍勒 研究软锰矿矿石(主要成分是MnO2)时发现氯气。
KMnO4
KClO3
KClO
…
思考:
1. 每生成1 mol Cl2,转移电子的物质的量为 ;
2. 每消耗1 mol MnO2,起还原剂作用的HCl消耗 mol ;
3. 若用含0.4 mol HCl的浓盐酸与足量MnO2反应,在标准状况下生成Cl2的体积 ;
A. =2.24 L ; B. <2.24 L C.>2.24L ; D. 无法确定
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
2 mol
2
B
2.实现物质的转化与获取能量
SiO2+2C 2CO+Si(粗硅)
高温
硅的冶炼
石英(主要成分SiO2)
粗硅
高纯硅
①Si+2Cl2 SiCl4
②SiCl4+2H2 Si+4HCl
还原
粗硅提纯
钛的冶炼
金红石(TiO2)、
碳单质、氯气
TiCl4
Ti
TiO2+2C+2Cl2 TiCl4+2CO
高温
TiCl4+2Mg Ti+2MgCl2
或TiCl4+4Na Ti+4NaCl
加热
加热
800℃
800℃
粗硅提纯
第3节 氧化剂和 还原剂
2
查阅资料,解释生活中的一些现象:
苹果咬一口变黄
酒精检测仪测酒驾
一、认识氧化还原反应
角度一:得氧失氧
氧化反应和还原反应同时发生:氧化还原反应
H2 + CuO = H2O + Cu
△
得氧,被氧化,氧化反应
失氧,被还原,还原反应
角度二:化合价的变化
H2 + CuO = H2O + Cu
△
0
+1
+2
0
化合价升高,被氧化,氧化反应
化合价降低,被还原,还原反应
1、结论:反应过程中有化合价变化的反应叫做氧化还原反应。 (判定标准)
氧化反应: 反应物所含元素化合价升高的反应。
还原反应: 反应物所含元素化合价降低的反应。
2Na + Cl2 = 2NaCl
0
+1
0
-1
化合价降低,被还原,还原反应
化合价升高,被氧化,氧化反应
点燃
C + 2CuO = 2Cu + CO2
△
C + O2 = CO2
△
CaCO3 = CaO + CO2
△
CaCO3+ 2HCl = CaCl2 + CO2 + H2O
判断下列反应是否是氧化还原反应?
置换
复分解
化合
分解
是
是
2.与四种基本反应类型间的关系:
①置换反应
②复分解反应
③化合反应
④分解反应
有单质参加的反应就是氧化还原反应?
×
都是
都不是 …
部分是 …
部分是 …
有单质参加或生成
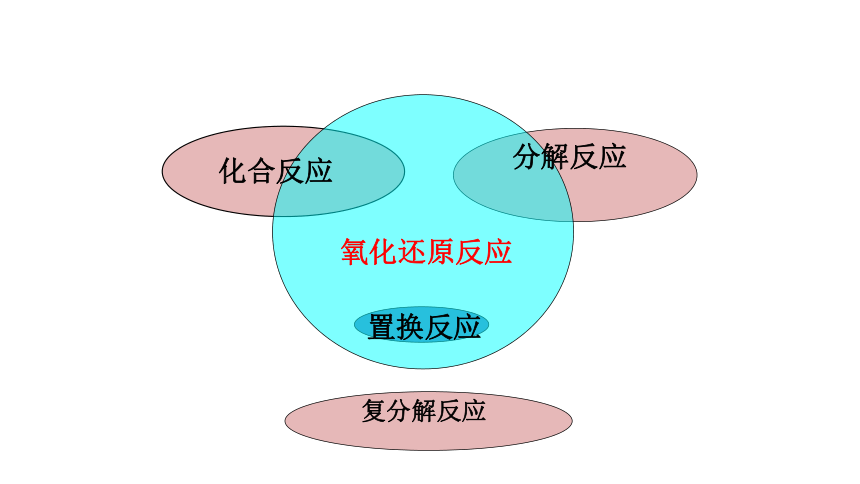
你能用图形表示这种关系吗?
氧化还原反应。
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
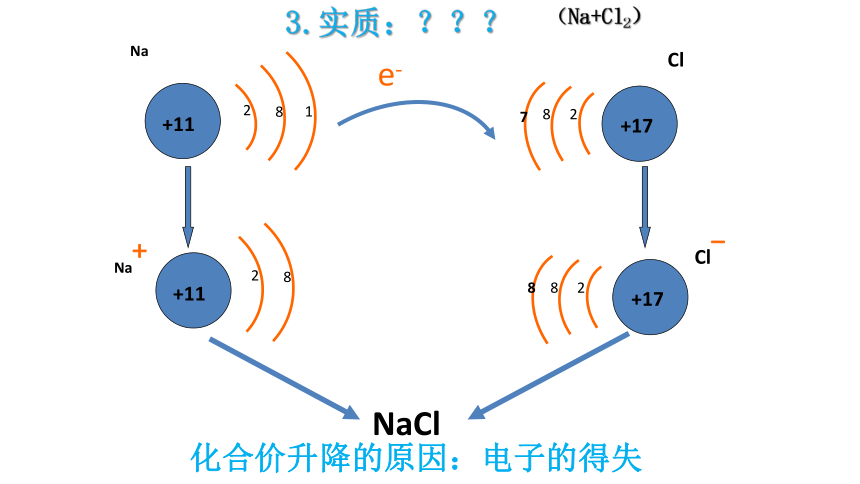
Na
+11
2
8
1
+17
2
8
7
+11
2
8
+17
2
8
8
Na+
Cl
Cl-
NaCl
e-
化合价升降的原因:电子的得失
3.实质:???
(Na+Cl2)
www.sghxy.com
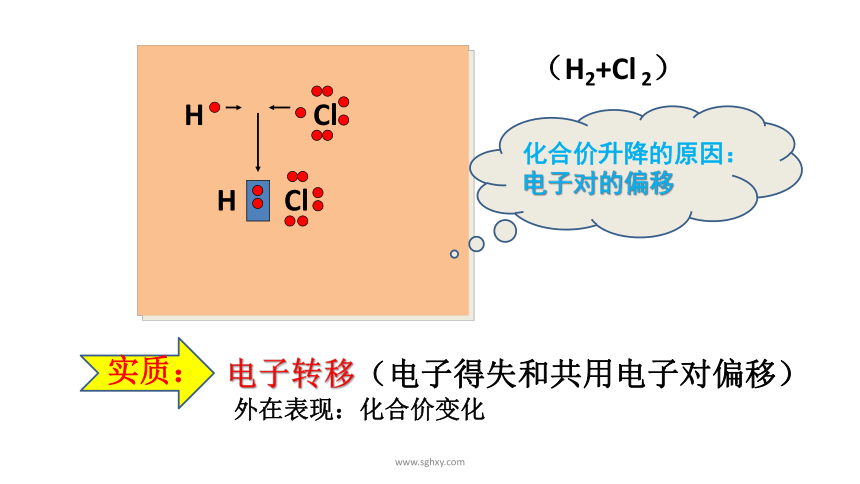
H Cl
H Cl
化合价升降的原因:
电子对的偏移
电子转移(电子得失和共用电子对偏移)
外在表现:化合价变化
(H2+Cl 2)
实质:
练一练:
1.下列叙述正确的是 ( )
A.在氧化还原反应中 ,失去电子的物质,所含元素化合价降低
B.凡是有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的转移
BD
1.表示方法:
①双线桥:
2Na + Cl2 2NaCl
点燃
化合价升高,失 1e-×2,氧化反应
化合价降低,得1e-×2 ,还原反应
0
+1
0
-1
标变价.
划线桥.
注得失和数目
二、分析氧化还原反应
②单线桥(在反应物中,由失电子元素
指向得电子元素注明转移电子总数)
2Na + Cl2 = 2NaCl
点燃
2e-
Cl2 + H2O = HCl + HClO
0
+1
-1
失1×e-
得1×e-
1e-
2.化合价、电子转移、反应之间的关系
— — —
— — —
升↑失氧 降↓得还
n失=n得
※电子守恒:
价↑=价↓
(Na+)
(Na)
(Cl)
(Cl-)
失电子
得电子
价↑
价↓
被氧化
被还原
氧化反应
还原反应
2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O
酒精检测仪测酒驾
下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中的氢元素化合价发生变化的是( )
A. MnO2 + 4HCl(浓)= MnCl2 + Cl2 + 2H2O
B. NaOH + HCl = NaCl + H2O
C. Zn + 2HCl = ZnCl2 + H2
D. CuO + 2HCl = CuCl2 + H2O
A
C
二、氧化剂 还原剂
1、氧化剂:
化合价↓的反应物
还原剂:
………↑…………
2Na + Cl2 = 2NaCl
0
+1
0
-1
化合价降低,被还原,还原反应
化合价升高,被氧化,氧化反应
点燃
氧化剂
还原剂
2.氧化产物:还原剂被氧化生成的物质↑
还原产物:氧化剂被还原生成的物质↓
氧化剂--价↓--得电子--被还原--还原反应—还原产物
还原剂--价↑--失电子--被氧化--氧化反应—氧化产物
氧化剂+还原剂=氧化产物+还原产物
降得还
升失氧
Zn + FeSO4 = Fe + ZnSO4
还
氧
还产
氧产
练
2、2Na+2H2O=2NaOH+H2
4、Cl2+H2O=HCl+HClO
3、Fe +Cu2+=Fe2++Cu
5、2FeCl2+Cl2=2FeCl3
6、3NO2+H2O=2HNO3+NO
7、2Na2O2+2H2O=4NaOH+O2
1、H2+CuO=Cu+H2O
△
还
氧
还
氧
还
氧
还
氧
还
氧
还
氧
还
氧
-2 -2
还产
氧产
还产
还产
还产
还产
还产
还产
氧产
氧产
氧产
氧产
氧产
氧产
20
非金属单质:O2 、 Cl2
高价含氧酸:HNO3 、浓H2SO4 、HClO4
高价盐:KMnO4 、KClO3 、FeCl3
强氧化剂: Na2O2 、HClO 、H2O2
3、(1)常见氧化剂
(化合价能降低)
0 -2
0 -1
+6 -2
+7 -1
+5 -3
(2)常见还原剂(化合价能升高)
金属单质:
K﹥Ca﹥Na…
(只作还原剂)
非金属单质:
H2 C
0 +1
0 +2、+4
低价酸:
HCl H2S
S( -2、0、+4、+6)
低价氧化物:
CO SO2
+4 +6
KI Na2SO3 Fe2+
低价盐:
Cl2+H2O HCl+HClO
Fe+4HNO3(稀) Fe(NO3)3+2H2O+NO
0
-1
+1
0
+5
+3
+2
还原剂
(氧化剂)
氧化剂
还原剂
还原剂:氧化剂=
1:1
氧化性:酸性=
1:3
还产
氧产
氧产
还产
4.物质氧化性、还原性
(1)氧化性、还原性判断
得电子能力
失电子能力
元素为最高价时: 只有氧化性。
… 为最低价时: 只有还原性。
… 为中间价时: 既有氧化性又有还原性。
(2)强弱判断
氧化性:氧化剂﹥氧化产物
①
还原性:还原剂﹥还原产物
Zn + Fe2+= Fe + Zn2+
还
氧
还产
氧产
Zn> Fe
氧化性:
还原性:
Fe2+>Zn2+
还原性:
K>Ca>Na>…Fe…
氧化性:
K+<Ca2+<Na+<… Fe2+… < Cu2+< Fe3+< Ag+< Au+
②
还原性:
氧化性:
F2>Cl2>Br2>Fe3+ > I2
F-<Cl-<Br-<Fe2+ < I-
结论
单质氧化性越强,阴离子还原性越弱。
… 还原性… , 阳离子 氧化性… …
③与同一物质反应
2Fe +3Cl2 2FeCl3
点 燃
Fe + S FeS
氧化性:
Cl2
S
④比较反应条件:
MnO2+4HCl(浓) = MnCl2+Cl2+2H2O
2KMnO4+16HCl (浓) = 2KCl+2MnCl2+5Cl2+8H2O
氧化性:KMnO4 MnO2
5、几个规律
若无中间价,不反应
若有中间价,价态“只靠拢,不交叉”。
例:H2SO4+H2S=S+SO2+2H2O
例:浓H2SO4、SO2
KClO3+6HCl=KCl+3Cl2+3H2O
(1)优先规律: 氧化性强的先反应。
同种元素不同价态反应
(2)归中规律:
H2O2 H2O + O2
Fe2O3 + CO Fe + CO2
催 化 剂
高 温
-1
-2
0
+3
0
+2
+4
ClO2+H2O2+OH-=ClO2-+O2+H2O
Cu+H++NO3-=NO2+Cu2+
Cu+H++NO3-=NO+Cu2+
配平:
C+H2SO4(浓) = CO2+SO2
S+NaOH = Na2S+Na2SO3+H2O
配平原则:1.升 = 降
2.电荷守恒
3.元素守恒
C
h
m
i
s
t
r
化学课
e
y
2.3 氧化还原反应
第二课时 氧化还原反应的应用
氧化还原反应的应用
2、预测物质的性质:
H2O2
+1
-1
H2O2
+1
H2O2
-1
氧化性
氧化性
还原剂
氧化剂
酸性KMnO4溶液
淀粉-KI试纸
还原性
1、观察外部特征:无色、无味透明液体
氧化还原反应的应用
实验验证:
① 实验一
实验内容:取1 mL KMnO4溶液于试管中, 滴加几滴稀硫酸,逐滴加入5%的H2O2溶液。
实验现象:溶液紫红色变浅直到褪去,有气泡产生
5H2O2+2MnO4-+6H+ = 2Mn2++8H2O+5O2
1.为什么加稀硫酸来酸化高锰酸钾,其他酸可以吗?
HCl HNO3
思考
2.为什么要加稀硫酸,不加可否达到预期实验现象
② 实验二
实验内容:取1 mL KMnO4溶液于试管中, 逐滴加入5%的H2O2溶液至过量
实验现象:溶液紫红色色变浅直到褪去,出现黑色沉淀
2MnO4-+3H2O2 = 2OH- + 2MnO2 + 2H2O + 3O2
5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2
氧化剂
还原产物
还原剂
氧化产物
氧化剂
还原剂
还原产物
氧化产物
结论:H2O2 具有还原性
环境条件影响物质氧化性的强弱
2MnO4-+3H2O2 = 2OH- + 2MnO2 + 2H2O + 3O2
② 实验三
实验内容:将淀粉-KI试纸放在表面皿上,滴加5%的H2O2溶液
实验现象:淀粉碘化钾试纸变蓝
2I - + H2O2 = I2 + 2OH-
氧化剂
还原产物
还原剂
氧化产物
结论:H2O2 具有氧化性
氧化还原反应的应用
2、实现物质转化与获得能量
冶炼金属:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
电解法
热还原法
热分解法
将金属从其化合物中还原出来的过程。
MgCl2 (熔融) === Mg + Cl2 ↑
电解
2Al2O3 (熔融) === 4Al + 3O2 ↑
电解
冰晶石
2NaCl (熔融) === 2Na + Cl2 ↑
电解
金属离子
金属单质
CuO +H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2
高温
2HgO==2Hg+O2↑
2Ag2O==4Ag+O2↑
氧化还原反应的应用
获得能量的重要方式
联氨(N2H4)可作火箭的燃料,燃烧时反应为
2NO2 + 2N2H4 = 3N2 + 4H2O
氧化剂
还原产物
还原剂
氧化产物
Fe+Cu2+ = Fe2++Cu
氧化还原反应的应用
实验室制Cl2
MnO2+4HCl(浓) = MnCl2+2H2O+Cl2↑
实验原理:
实验装置:
饱和食盐水
浓硫酸
NaOH溶液
固+液加热装置
浓硫酸作用:
饱和食盐水作用:
除去Cl2中的HCl
干燥Cl2
Cl2检验:
淀粉-KI试纸
发生装置:
收集装置:
向上排空气法;
排饱和食盐水
吸收装置:
NaOH溶液
MnO2+4H++2Cl- = Mn2++Cl2+2H2O
舍勒 研究软锰矿矿石(主要成分是MnO2)时发现氯气。
KMnO4
KClO3
KClO
…
思考:
1. 每生成1 mol Cl2,转移电子的物质的量为 ;
2. 每消耗1 mol MnO2,起还原剂作用的HCl消耗 mol ;
3. 若用含0.4 mol HCl的浓盐酸与足量MnO2反应,在标准状况下生成Cl2的体积 ;
A. =2.24 L ; B. <2.24 L C.>2.24L ; D. 无法确定
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
2 mol
2
B
2.实现物质的转化与获取能量
SiO2+2C 2CO+Si(粗硅)
高温
硅的冶炼
石英(主要成分SiO2)
粗硅
高纯硅
①Si+2Cl2 SiCl4
②SiCl4+2H2 Si+4HCl
还原
粗硅提纯
钛的冶炼
金红石(TiO2)、
碳单质、氯气
TiCl4
Ti
TiO2+2C+2Cl2 TiCl4+2CO
高温
TiCl4+2Mg Ti+2MgCl2
或TiCl4+4Na Ti+4NaCl
加热
加热
800℃
800℃
粗硅提纯
