第三章 金属及其化合物 第一节 钠及其化合物 2025年高考化学基础专项复习(共53张PPT)
文档属性
| 名称 | 第三章 金属及其化合物 第一节 钠及其化合物 2025年高考化学基础专项复习(共53张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-06 18:41:15 | ||
图片预览










文档简介
(共53张PPT)
第三章 金属及其化合物
2025年高考化学专项复习
第一节 钠及其化合物
目录
钠
壹
氧化钠和过氧化钠
贰
碳酸钠和碳酸氢钠
叁
碱金属 焰色试验
肆
钠
第一章
教材知识萃取
1.钠的物理性质
[
密度比水的
2.从
现出还原性。
银白
柔软
低
小
大
还原性 与氧气反应:
常温
加热或点燃
与水反应:
与强酸(如硫酸)反应:
与盐溶液反应:
第一步,钠与水反应生成
应,则发生的是
与含羟基或羧基的有机物发生置换反应:
①与乙醇反应,
②与丙酸反应,
3.钠的制取、保存与应用
制取
保存 密封保存,通常保存在
用途 ①
②用作电光源,制作高压钠灯;
③冶炼某些金属:
金属钠具有强还原性,熔融状态下可以用于制取金属,如
石蜡或煤油
教材素材变式
类型1 钠的性质
1.[人教版必修第一册P43第3题变式]下列关于金属钠的叙述正确的是( )
B
A.钠具有强还原性,可制成高压钠灯 B.钠在空气中燃烧,发出黄色火焰
C.钠长期露置于空气中,最终产物为 D.钠投入 溶液中剧烈反应生成红色固体
【解析】制成高压钠灯,利用的是钠的焰色试验,与钠的强还原性无关,A项错误;钠的焰色为黄色,钠在空气中
燃烧时发出黄色火焰,B项正确;钠长期露置在空气中,依次发生:(变暗) (白色固体)
表面形成溶液(白色固体)(白色粉末),C项错误;投入 溶液中,
依次发生 、 ,不能置换出铜(【易错】钠
和熔融的 可发生置换反应生成单质铜。),D项错误。
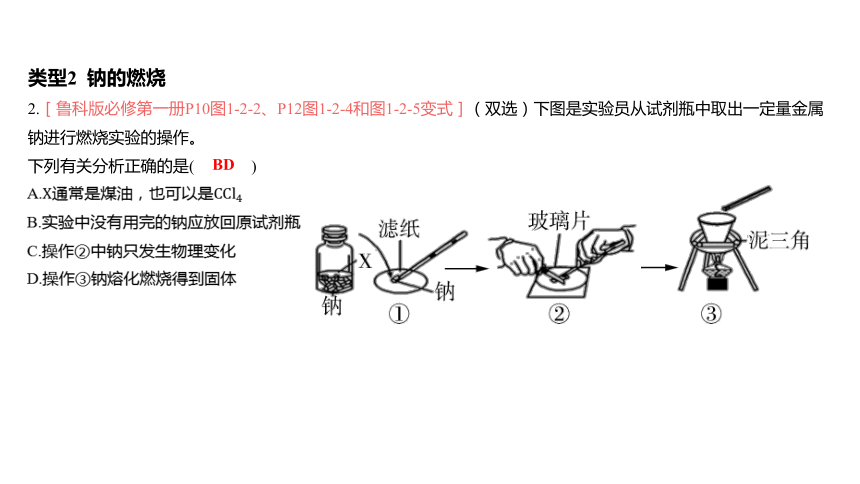
类型2 钠的燃烧
2.[鲁科版必修第一册P10图1-2-2、P12图1-2-4和图1-2-5变式](双选)下图是实验员从试剂瓶中取出一定量金属钠进行燃烧实验的操作。
下列有关分析正确的是( )
BD
A.通常是煤油,也可以是
B.实验中没有用完的钠应放回原试剂瓶
C.操作②中钠只发生物理变化
D.操作③钠熔化燃烧得到固体
【解析】 的密度比钠的大,钠浮在上面,A项错误;没有用完的钠应放回原试剂瓶中,B项正确;钠的化学性
质活泼,操作②中,钠会与空气中的氧气反应,C项错误;钠熔点较低,受热后易熔化,稍后会燃烧生成
(淡黄色固体),D项正确。
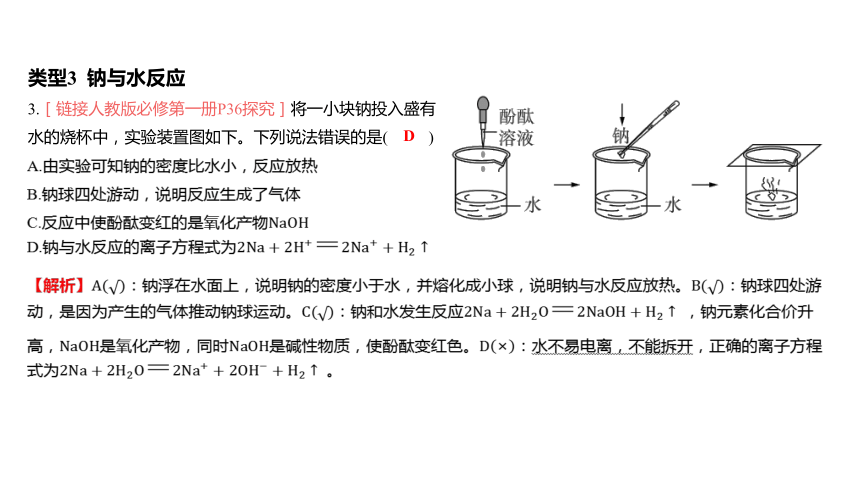
类型3 钠与水反应
3.[链接人教版必修第一册P36探究]将一小块钠投入盛有
水的烧杯中,实验装置图如下。下列说法错误的是( )
D
A.由实验可知钠的密度比水小,反应放热
B.钠球四处游动,说明反应生成了气体
C.反应中使酚酞变红的是氧化产物
D.钠与水反应的离子方程式为
【解析】钠浮在水面上,说明钠的密度小于水,并熔化成小球,说明钠与水反应放热。 钠球四处游
动,是因为产生的气体推动钠球运动。钠和水发生反应 ,钠元素化合价升
高,是氧化产物,同时是碱性物质,使酚酞变红色。 水不易电离,不能拆开,正确的离子方程
式为 。
拓展设问 判正误:完全反应,转移的电子数为(设 为阿伏加德罗常数的值)( )
√
【解析】 钠和水发生反应 ,钠元素化合价由0升高为, 钠完全反
应转移的电子数为 。
类型4 钠与二氧化碳反应
4.[链接人教版必修第一册P34等]某同学探究金属与 的反应,实验如下:
实验Ⅰ 实验Ⅱ
操作 将点燃的金属钠伸到盛有 的集气瓶中 将集气瓶用水冲洗,过滤。取黑色滤渣灼烧;向滤液中滴加
氯化钡溶液
现象 ①火焰呈黄色 #b# ②瓶内有黑色固体及另一种固体 ①黑色滤渣可燃
#b#
②滴加后有白色沉淀 生成
下列说法错误的是( )
C
A.生成黑色固体的反应为
B.是
C.是
D.金属着火不能用 灭火
【解析】由实验Ⅱ黑色固体的性质知其是单质C,由实验Ⅱ中现象②知是,中含有,故是 ,A、
B项正确,C项错误;因钠着火生成过氧化钠,过氧化钠会与反应,且在加热时钠也可与 直接反应,故金属
着火不能用 灭火,可用沙土覆盖灭火,D项正确。
氧化钠和过氧化钠
第二章
教材知识萃取
氧化钠和过氧化钠的比较
氧化钠 过氧化钠 (可作漂白剂、供氧剂、消毒剂)
类别 碱性氧化物 过氧化物
电子 式 ______________________________________________________
#b#
(由与构成,氧元素为 价)
化学 性质 ; #b# ②与、、 反应分别生 成、和 ①与水、二氧化碳反应( 表现氧化性和还原性)
、
;
#b#
②遇酚酞溶液:溶液先变红后褪色,同时产生无色气泡;
#b#
③与反应(表现氧化性)
氧化钠
色、态
热稳定性 不稳定,在空气中加热时转变为
氧元素的化 合价
组成 由
白色
淡黄色
-2
-1
氧化钠
阴、阳离子 个数比
电子式 ___________________________________ __________________________________________
化学键 离子键 离子键和非极性共价键
与水反应
___
与
____
续表
氧化钠
与盐酸反应
___________
氧化物分类 碱性氧化物 过氧化物(不是碱性氧化物)
转化关系 _______________________________________________________ 用途 可用于制备烧碱 可作强氧化剂、漂白剂、供氧剂
续表
教材素材变式
类型1 过氧化钠与水反应
1.[链接人教版必修第一册P37,2023北京卷]离子化合物和 与水的反应分别为
; 。下列说法正确的是( )
C
A.、 中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.中阴、阳离子个数比为,中阴、阳离子个数比为
D.当反应①和②中转移的电子数相同时,产生的和 的物质的量相同
【解析】的电子式为 ,既含离子键也含非极性键, 的电子式为
,只含离子键,A错误;①中水中的、 化合价均未发生变化,既不作氧化剂也不作还原剂,②中
水中的部分化合价降低,发生还原反应,B错误;由A中分析可知,C正确;①中转移,②中转移 ,则转
移电子数相同时,生成的氧气和氢气的物质的量之比为 ,D错误。
2.[链接人教版必修第一册P37实验【2-3】]某实验小组通过下图所示实验,探究 与水的反应:
下列说法正确的是( )
C
A.②中大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质
D.⑤中 的主要作用是降低了水中氧气的溶解度
【解析】实验分析
与水反应能生成氢氧化钠和氧气,②中产生的气体使溶液中产生大量的气泡,气泡消失后,滴入酚酞溶液,
酚酞在碱性溶液中变红,所以③中溶液变红,轻轻振荡试管,④中红色褪去,说明有强氧化性的物质,⑤中加
后有气泡产生,说明强氧化性物质是过氧化氢。
中大量气泡的主要成分是氧气。 酚酞遇碱显红色,③中溶液变红,说明有碱性物质生成。
中红色褪去,应该是溶液中的强氧化性物质氧化了酚酞。中加入 产生较多气泡,说明溶液
中存在, 的主要作用是作催化剂,使过氧化氢分解。
解后反思
过氧化钠与水反应后的溶液中含有过氧化氢,具有强氧化性、漂白性,掌握反应原理是解题的关键。
类型2 过氧化钠与二氧化碳反应
3.[链接鲁科版必修第一册P12](双选)为证明过氧化钠可在呼吸面具和潜水艇中作供氧剂,实验装置图如下,
其中是实验室制备二氧化碳的装置, 中盛放的是过氧化钠。下列说法错误的是( )
BC
A.中可以用和稀盐酸来制备
B.中是饱和溶液,作用是除去中产生的
C.中只发生
D. 中收集的气体可使带火星的木条复燃
【解析】碳酸钠与盐酸反应生成二氧化碳、氯化钠和水。 中的盐酸易挥发,制得的二氧化碳中含有
,故中应盛放饱和溶液,其作用是除去中产生的 ,不能盛放碳酸钠溶液,因为碳酸钠也会与二氧
化碳反应。从中出来的气体未干燥,二氧化碳中混有水蒸气, 中不仅发生反应
,还发生反应。 中用排水法收集的气
体主要是 ,氧气可使带火星的木条复燃。
拓展设问 判正误:过氧化钠固体在实验室中应密封保存( )
√
【解析】 过氧化钠固体容易吸收空气中的二氧化碳和水而变质,需要密封保存。
类型3 钠及其氧化物的有关计算
4.[链接苏教版必修第一册P68~69]在一定条件下,将钠与氧气反应的生成物 溶于水,所得溶液恰好能被
浓度为的 溶液中和,则该生成物的成分是( )
C
A. B. C.和 D.和
【解析】中和后的产物是,结合钠元素守恒可知 ,若生
成物只有,则,若生成物只有 ,则
,而题干中生成物的质量在和 之间,可得出原生成物
是与 的混合物,C项正确。
碳酸钠和碳酸氢钠
第三章
教材知识萃取
碳酸钠和碳酸氢钠的比较
碳酸钠(纯碱或苏打)(制玻璃、肥皂, 造纸) 碳酸氢钠(小苏打)(制药、发酵粉,作灭火器原
料)
主要化学性质 与酸反应: (逐滴滴加时) ①热稳定性:
#b#
②与酸反应: (较快)
相互转化 常用鉴别方法 ①加热法(固体时);②气体法(溶液中加酸);③同浓度时测定 法 常用除杂方法 .粉末时,加热法; #b# .溶液时,滴加适量 溶液 溶液通入过量
1.碳酸钠与碳酸氢钠的比较
化学式
俗名 纯碱或苏打 小苏打
主 要 性 质 色、态 白色粉末 白色细小晶体
水溶性 易溶于水
热稳定性 稳定,但晶体
____________________________
__________
化学式
主 要 性 质 与
与
____________________________
__________
______________________
续表
化学式
主 要 性 质 与极稀
与
__________
续表
相互转化
续表
2.碳酸钠溶液与盐酸的互滴
(1)向盐酸中逐滴加入碳酸钠溶液:
(开始就有气泡)。
(2)向碳酸钠溶液中逐滴加入盐酸
开始时,酸不足:
再加酸:
3.联合制碱法——侯氏制碱法
(1)制备原料:食盐、氨气、二氧化碳。
(2)工艺流程
(3)反应原理
[
[
(4)绿色思想:循环使用的物质为
教材素材变式
类型1 碳酸钠和碳酸氢钠的性质
1.[链接人教版必修第一册P38~39]下列关于与 的说法不正确的是( )
B
A.的热稳定性大于
B. 粉末露置在空气中质量会减少
C.可用于去除物品表面的油污, 可用于治疗胃酸过多
D.用加热法可除去粉末中少量的
【解析】受热不分解,受热分解,热稳定性:,A项正确; 性质稳定,
露置在空气中质量不会减少,B项错误;溶液呈碱性,可用于去除油污, 能与胃酸反应,且碱性较
弱,可用于治疗胃酸过多,C项正确;受热分解生成,可通过加热法除去 粉末中的少量
(【注意】用加热法不仅能除去粉末中少量的,还能鉴别和 两种粉末。),
D项正确。
2.[人教版必修第一册P43第5题变式]下列实验方案中,不能测定和混合物中 的质量分数
的是( )
A
A.取混合物与足量稀硫酸充分反应,逸出的气体用碱石灰吸收,质量增加
B.取混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 固体
C.取混合物充分加热,质量减少
D.取混合物与足量溶液充分反应,过滤、洗涤、烘干,得到 固体
【解析】逸出的气体未经干燥,含有水蒸气,不能测定 的质量分数(【提醒】若逸出的气体先用浓硫酸干
燥,再用碱石灰吸收,则可测出的质量分数。),A项符合题意;最后得到的固体为 ,根据反应方
程式和数据等可测定的质量分数,B项不符合题意;混合物充分加热,减少的是 和水蒸气的质量,根据
可计算出的质量,从而可求出 的质量分数,C项不符合题意;
得到的固体为,根据反应方程式和数据等可测定 的质量分数,D项不符合题意。
3.[链接人教版必修第一册P38~39]某小组同学进行了以下3个实验:
实验1 实验2 实验3
操作
现象 无沉淀及气体产生 有沉淀及气体产生 现象
下列说法正确的是( )
B
A.实验1中发生了反应
B.实验2中促进了 的电离平衡
C.实验3中现象 可能是:有沉淀及气体产生
D.推测:可用溶液鉴别浓度均为的溶液和 溶液
【解析】实验1中没有沉淀生成,故没有发生反应。 实验2中有沉淀及气体
产生,说明发生了反应,促进了的电离平衡。 碳酸钠溶
液饱和,实验3中现象可能是有沉淀生成,无气体生成。 离子浓度过低不能生成沉淀,故不能用
溶液鉴别浓度均为的溶液和 溶液。
类型2 侯氏制碱法
4.[链接人教版必修第一册P40科学史话]侯氏制碱法以、、 为原料制取纯碱,将制碱技术发展到一个
新的水平。下列实验室模拟侯氏制碱法制取纯碱的步骤对应的装置或操作错误的是
A.制取 B.制取 C.过滤 #b# 固体 D.灼烧分解
#b#
【答案】D
【解析】 氯化铵和氢氧化钙共热可制备氨气。 碳酸氢钠的溶解度较小,向饱和食盐水中先通入氨气、
后通入二氧化碳可制备(【注意】向饱和食盐水中先通入,后通入时,为了防止倒吸, 从短
管通入,从长管通入。)。碳酸氢钠析出后,通过过滤从混合物中分离出来。 灼烧碳酸氢钠可
转化为纯碱,但加热碳酸氢钠时试管口需要略向下倾斜,否则可能会有水蒸气回流试管底部引起炸裂。
碱金属 焰色试验
第四章
教材知识萃取
碱 金 属 ①包括、、、、(除 外,都呈银白色)等,均为ⅠA族元素;
#b#
②递变性 原子半径增大、失电子能力增强,金属性增强,单质的熔、沸点降低;单质的密度逐渐
增大(但反常);单质与、等反应越来越剧烈, 的碱性依次增强
焰 色 试 验 ①某些金属或它们的化合物在灼烧时火焰呈现出特征颜色,属于物理性质,如(黄色), (紫色,透过
蓝色钴玻璃);
#b#
②实验操作:将用盐酸洗净后的铂丝(或光洁无锈的铁丝)(本身灼烧时火焰不产生特征颜色)灼烧至与原
来的火焰颜色相同后,蘸取试样(可以是单质或化合物,可以是固体或液体)在火焰上灼烧,观察火焰的颜
色
1.碱金属的一般性
相似性 递变性(由
原子结构 价电子排布式为
大,原子半径逐渐
元素性质 都具有较强的金属性,最高 正价均为
逐渐
__
增大
+1
增强
减小
减 小
单质 性质 物理性 质 都呈银白色(除
逐渐降低
化学性 质 都具有较强的还原性 还原性逐渐
来越剧烈,产物越来越复杂;与
反应的剧烈程度逐渐
增强
续表
增强
第一章
2.焰色试验
(1)概念
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
(2)焰色试验的操作
(3)常见元素的焰色
金属元素
焰色 黄色 紫色(透过蓝色 钴玻璃) 紫红 色 砖红 色 黄绿 色 绿色 洋红 色 紫色
3.碱金属的化合物
(1)
①
②
③碱金属氢化物均为白色固体,都是离子晶体,有两个基本特征:一是大多数氢化
物不稳定,加热分解放出氢气,因此可作储氢材料;另一特征是均具有还原性,
、
(2)
①
成
4
②
教材素材变式
类型1 碱金属
1.[链接人教版必修第一册P99~101]下列关于碱金属元素的说法正确的是( )
B
A.ⅠA族元素都是碱金属元素 B.在常温下 与水反应会发生爆炸
C.锂在氧气中燃烧,生成过氧化锂 D.实验室可用煤油液封保存锂,避免其被氧化
【解析】ⅠA族元素中的不属于碱金属元素。 根据碱金属元素性质的递变规律,从上至下,随着原子序
数的增大,金属性越强,与水反应越剧烈,铯的金属性比较强,在常温下与水反应会发生爆炸。 锂在氧气中燃
烧只能生成氧化锂,不能生成过氧化锂。 锂的密度比煤油小,无法保存在煤油中,应保存在石蜡油中。
2.[链接人教版必修第一册P99~101,2022海南卷]钠和钾是两种常见金属。下列说法正确的是( )
A
A.钠元素的第一电离能大于钾 B.基态钾原子价层电子轨道表示式为&2&
C.钾能置换出 溶液中的钠 D.钠元素与钾元素的原子序数相差18
【解析】同主族元素从上到下第一电离能逐渐减小,A项正确;基态钾原子价层电子轨道表示式为 ,B项错误;
钾遇水反应生成和,不能置换出 溶液中的钠,C项错误;钠元素、钾元素的原子序数分别为11、19,相
差8,D项错误。
类型2 焰色试验
3.[链接人教版必修第一册P40~41]燃放烟花是中华民族庆祝春节的传统方式,烟花绽放时能释放五光十色的光芒。
下列关于烟花燃放的化学原理说法错误的是( )
C
A.燃放时发生了氧化还原反应 B.发出黄色光芒,可见烟花中含有钠元素
C.未能观察到紫色光芒,可见烟花中不含钾元素 D.很多金属在灼烧时都会使火焰呈现出特征颜色
【解析】烟花燃放时氧气参与反应,发生了氧化还原反应。 钠元素的焰色为黄色,发出黄色光芒,
可见烟花中含有钠元素。 钾元素的焰色需要透蓝色钴玻璃观察,没有透过蓝色钴玻璃观察,未能观察到紫
色光芒,不能确定烟花中是否含钾元素。 很多金属在灼烧时都会使火焰呈现出特征颜色,如钙的焰色为砖
红色、钡的焰色为黄绿色、锂的焰色为紫红色。
4.[链接人教版必修第一册P41]某白色固体混合物由、、、 中的两种组成,进行如下实验:
( )
①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉
淀。根据实验现象可判断其组成为
B
A.、 B.、 C.、 D.、
【解析】根据实验①混合物溶于水,得到澄清透明溶液,而难溶于水,可知白色固体中一定不含 ;根
据实验②做焰色反应时焰色呈紫色(透过蓝色钴玻璃)可确定含有钾元素,即白色固体中含有 ;结合实验③向
溶液中加碱产生白色沉淀,可知溶液中含有能与反应生成白色沉淀的离子,只能为 ,即白色固体的另一
成分为 。结合上述分析,可知B项正确。
5.[链接人教版必修第一册P41、人教版选择性必修3 P37探究]为了探究化合物A(含三种元素)的组成和性质,设计并进行如下实验:
已知:气体B是由两种元素组成的纯净物,浓硫
酸质量增加,溶液 的焰色试验呈黄色。请
回答下列问题:
(1)组成A的元素是___________(写元素符
号)。
、C、
(2)气体B的分子式是______。
(3)固体A与足量水反应的化学方程式是________________________________。
(4)写出溶液 进行焰色试验的操作___________________________________________________________________
____________________________________。
将铂丝用稀盐酸洗净,在火焰上灼烧至与原来的火焰颜色相同后,蘸取待测液,再在火焰上灼烧,观察火焰的颜色
【解题思路】溶液的焰色试验呈黄色,说明为,由溶液D显碱性,可知D为。根据 消耗
,可知固体A中含钠原子,质量为 。气体B是由两种元素组成的纯净物,浓硫酸质量增
加,即气体B点燃生成水的质量为,说明B中含 氢原子;再根据气体C通入足量澄清石灰水,
生成白色沉淀,即,可知气体B中含 碳原子,气体B在标准状况下为
,则气体B的分子式是。固体A中 ,
,即含。综合上述分析可知组成A的元素是、C、 ,
物质的量分别为、、,据此可确定A的化学式为 。
谢谢
第三章 金属及其化合物
2025年高考化学专项复习
第一节 钠及其化合物
目录
钠
壹
氧化钠和过氧化钠
贰
碳酸钠和碳酸氢钠
叁
碱金属 焰色试验
肆
钠
第一章
教材知识萃取
1.钠的物理性质
[
密度比水的
2.从
现出还原性。
银白
柔软
低
小
大
还原性 与氧气反应:
常温
加热或点燃
与水反应:
与强酸(如硫酸)反应:
与盐溶液反应:
第一步,钠与水反应生成
应,则发生的是
与含羟基或羧基的有机物发生置换反应:
①与乙醇反应,
②与丙酸反应,
3.钠的制取、保存与应用
制取
保存 密封保存,通常保存在
用途 ①
②用作电光源,制作高压钠灯;
③冶炼某些金属:
金属钠具有强还原性,熔融状态下可以用于制取金属,如
石蜡或煤油
教材素材变式
类型1 钠的性质
1.[人教版必修第一册P43第3题变式]下列关于金属钠的叙述正确的是( )
B
A.钠具有强还原性,可制成高压钠灯 B.钠在空气中燃烧,发出黄色火焰
C.钠长期露置于空气中,最终产物为 D.钠投入 溶液中剧烈反应生成红色固体
【解析】制成高压钠灯,利用的是钠的焰色试验,与钠的强还原性无关,A项错误;钠的焰色为黄色,钠在空气中
燃烧时发出黄色火焰,B项正确;钠长期露置在空气中,依次发生:(变暗) (白色固体)
表面形成溶液(白色固体)(白色粉末),C项错误;投入 溶液中,
依次发生 、 ,不能置换出铜(【易错】钠
和熔融的 可发生置换反应生成单质铜。),D项错误。
类型2 钠的燃烧
2.[鲁科版必修第一册P10图1-2-2、P12图1-2-4和图1-2-5变式](双选)下图是实验员从试剂瓶中取出一定量金属钠进行燃烧实验的操作。
下列有关分析正确的是( )
BD
A.通常是煤油,也可以是
B.实验中没有用完的钠应放回原试剂瓶
C.操作②中钠只发生物理变化
D.操作③钠熔化燃烧得到固体
【解析】 的密度比钠的大,钠浮在上面,A项错误;没有用完的钠应放回原试剂瓶中,B项正确;钠的化学性
质活泼,操作②中,钠会与空气中的氧气反应,C项错误;钠熔点较低,受热后易熔化,稍后会燃烧生成
(淡黄色固体),D项正确。
类型3 钠与水反应
3.[链接人教版必修第一册P36探究]将一小块钠投入盛有
水的烧杯中,实验装置图如下。下列说法错误的是( )
D
A.由实验可知钠的密度比水小,反应放热
B.钠球四处游动,说明反应生成了气体
C.反应中使酚酞变红的是氧化产物
D.钠与水反应的离子方程式为
【解析】钠浮在水面上,说明钠的密度小于水,并熔化成小球,说明钠与水反应放热。 钠球四处游
动,是因为产生的气体推动钠球运动。钠和水发生反应 ,钠元素化合价升
高,是氧化产物,同时是碱性物质,使酚酞变红色。 水不易电离,不能拆开,正确的离子方程
式为 。
拓展设问 判正误:完全反应,转移的电子数为(设 为阿伏加德罗常数的值)( )
√
【解析】 钠和水发生反应 ,钠元素化合价由0升高为, 钠完全反
应转移的电子数为 。
类型4 钠与二氧化碳反应
4.[链接人教版必修第一册P34等]某同学探究金属与 的反应,实验如下:
实验Ⅰ 实验Ⅱ
操作 将点燃的金属钠伸到盛有 的集气瓶中 将集气瓶用水冲洗,过滤。取黑色滤渣灼烧;向滤液中滴加
氯化钡溶液
现象 ①火焰呈黄色 #b# ②瓶内有黑色固体及另一种固体 ①黑色滤渣可燃
#b#
②滴加后有白色沉淀 生成
下列说法错误的是( )
C
A.生成黑色固体的反应为
B.是
C.是
D.金属着火不能用 灭火
【解析】由实验Ⅱ黑色固体的性质知其是单质C,由实验Ⅱ中现象②知是,中含有,故是 ,A、
B项正确,C项错误;因钠着火生成过氧化钠,过氧化钠会与反应,且在加热时钠也可与 直接反应,故金属
着火不能用 灭火,可用沙土覆盖灭火,D项正确。
氧化钠和过氧化钠
第二章
教材知识萃取
氧化钠和过氧化钠的比较
氧化钠 过氧化钠 (可作漂白剂、供氧剂、消毒剂)
类别 碱性氧化物 过氧化物
电子 式 ______________________________________________________
#b#
(由与构成,氧元素为 价)
化学 性质 ; #b# ②与、、 反应分别生 成、和 ①与水、二氧化碳反应( 表现氧化性和还原性)
、
;
#b#
②遇酚酞溶液:溶液先变红后褪色,同时产生无色气泡;
#b#
③与反应(表现氧化性)
氧化钠
色、态
热稳定性 不稳定,在空气中加热时转变为
氧元素的化 合价
组成 由
白色
淡黄色
-2
-1
氧化钠
阴、阳离子 个数比
电子式 ___________________________________ __________________________________________
化学键 离子键 离子键和非极性共价键
与水反应
___
与
____
续表
氧化钠
与盐酸反应
___________
氧化物分类 碱性氧化物 过氧化物(不是碱性氧化物)
转化关系 _______________________________________________________ 用途 可用于制备烧碱 可作强氧化剂、漂白剂、供氧剂
续表
教材素材变式
类型1 过氧化钠与水反应
1.[链接人教版必修第一册P37,2023北京卷]离子化合物和 与水的反应分别为
; 。下列说法正确的是( )
C
A.、 中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.中阴、阳离子个数比为,中阴、阳离子个数比为
D.当反应①和②中转移的电子数相同时,产生的和 的物质的量相同
【解析】的电子式为 ,既含离子键也含非极性键, 的电子式为
,只含离子键,A错误;①中水中的、 化合价均未发生变化,既不作氧化剂也不作还原剂,②中
水中的部分化合价降低,发生还原反应,B错误;由A中分析可知,C正确;①中转移,②中转移 ,则转
移电子数相同时,生成的氧气和氢气的物质的量之比为 ,D错误。
2.[链接人教版必修第一册P37实验【2-3】]某实验小组通过下图所示实验,探究 与水的反应:
下列说法正确的是( )
C
A.②中大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质
D.⑤中 的主要作用是降低了水中氧气的溶解度
【解析】实验分析
与水反应能生成氢氧化钠和氧气,②中产生的气体使溶液中产生大量的气泡,气泡消失后,滴入酚酞溶液,
酚酞在碱性溶液中变红,所以③中溶液变红,轻轻振荡试管,④中红色褪去,说明有强氧化性的物质,⑤中加
后有气泡产生,说明强氧化性物质是过氧化氢。
中大量气泡的主要成分是氧气。 酚酞遇碱显红色,③中溶液变红,说明有碱性物质生成。
中红色褪去,应该是溶液中的强氧化性物质氧化了酚酞。中加入 产生较多气泡,说明溶液
中存在, 的主要作用是作催化剂,使过氧化氢分解。
解后反思
过氧化钠与水反应后的溶液中含有过氧化氢,具有强氧化性、漂白性,掌握反应原理是解题的关键。
类型2 过氧化钠与二氧化碳反应
3.[链接鲁科版必修第一册P12](双选)为证明过氧化钠可在呼吸面具和潜水艇中作供氧剂,实验装置图如下,
其中是实验室制备二氧化碳的装置, 中盛放的是过氧化钠。下列说法错误的是( )
BC
A.中可以用和稀盐酸来制备
B.中是饱和溶液,作用是除去中产生的
C.中只发生
D. 中收集的气体可使带火星的木条复燃
【解析】碳酸钠与盐酸反应生成二氧化碳、氯化钠和水。 中的盐酸易挥发,制得的二氧化碳中含有
,故中应盛放饱和溶液,其作用是除去中产生的 ,不能盛放碳酸钠溶液,因为碳酸钠也会与二氧
化碳反应。从中出来的气体未干燥,二氧化碳中混有水蒸气, 中不仅发生反应
,还发生反应。 中用排水法收集的气
体主要是 ,氧气可使带火星的木条复燃。
拓展设问 判正误:过氧化钠固体在实验室中应密封保存( )
√
【解析】 过氧化钠固体容易吸收空气中的二氧化碳和水而变质,需要密封保存。
类型3 钠及其氧化物的有关计算
4.[链接苏教版必修第一册P68~69]在一定条件下,将钠与氧气反应的生成物 溶于水,所得溶液恰好能被
浓度为的 溶液中和,则该生成物的成分是( )
C
A. B. C.和 D.和
【解析】中和后的产物是,结合钠元素守恒可知 ,若生
成物只有,则,若生成物只有 ,则
,而题干中生成物的质量在和 之间,可得出原生成物
是与 的混合物,C项正确。
碳酸钠和碳酸氢钠
第三章
教材知识萃取
碳酸钠和碳酸氢钠的比较
碳酸钠(纯碱或苏打)(制玻璃、肥皂, 造纸) 碳酸氢钠(小苏打)(制药、发酵粉,作灭火器原
料)
主要化学性质 与酸反应: (逐滴滴加时) ①热稳定性:
#b#
②与酸反应: (较快)
相互转化 常用鉴别方法 ①加热法(固体时);②气体法(溶液中加酸);③同浓度时测定 法 常用除杂方法 .粉末时,加热法; #b# .溶液时,滴加适量 溶液 溶液通入过量
1.碳酸钠与碳酸氢钠的比较
化学式
俗名 纯碱或苏打 小苏打
主 要 性 质 色、态 白色粉末 白色细小晶体
水溶性 易溶于水
热稳定性 稳定,但晶体
____________________________
__________
化学式
主 要 性 质 与
与
____________________________
__________
______________________
续表
化学式
主 要 性 质 与极稀
与
__________
续表
相互转化
续表
2.碳酸钠溶液与盐酸的互滴
(1)向盐酸中逐滴加入碳酸钠溶液:
(开始就有气泡)。
(2)向碳酸钠溶液中逐滴加入盐酸
开始时,酸不足:
再加酸:
3.联合制碱法——侯氏制碱法
(1)制备原料:食盐、氨气、二氧化碳。
(2)工艺流程
(3)反应原理
[
[
(4)绿色思想:循环使用的物质为
教材素材变式
类型1 碳酸钠和碳酸氢钠的性质
1.[链接人教版必修第一册P38~39]下列关于与 的说法不正确的是( )
B
A.的热稳定性大于
B. 粉末露置在空气中质量会减少
C.可用于去除物品表面的油污, 可用于治疗胃酸过多
D.用加热法可除去粉末中少量的
【解析】受热不分解,受热分解,热稳定性:,A项正确; 性质稳定,
露置在空气中质量不会减少,B项错误;溶液呈碱性,可用于去除油污, 能与胃酸反应,且碱性较
弱,可用于治疗胃酸过多,C项正确;受热分解生成,可通过加热法除去 粉末中的少量
(【注意】用加热法不仅能除去粉末中少量的,还能鉴别和 两种粉末。),
D项正确。
2.[人教版必修第一册P43第5题变式]下列实验方案中,不能测定和混合物中 的质量分数
的是( )
A
A.取混合物与足量稀硫酸充分反应,逸出的气体用碱石灰吸收,质量增加
B.取混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到 固体
C.取混合物充分加热,质量减少
D.取混合物与足量溶液充分反应,过滤、洗涤、烘干,得到 固体
【解析】逸出的气体未经干燥,含有水蒸气,不能测定 的质量分数(【提醒】若逸出的气体先用浓硫酸干
燥,再用碱石灰吸收,则可测出的质量分数。),A项符合题意;最后得到的固体为 ,根据反应方
程式和数据等可测定的质量分数,B项不符合题意;混合物充分加热,减少的是 和水蒸气的质量,根据
可计算出的质量,从而可求出 的质量分数,C项不符合题意;
得到的固体为,根据反应方程式和数据等可测定 的质量分数,D项不符合题意。
3.[链接人教版必修第一册P38~39]某小组同学进行了以下3个实验:
实验1 实验2 实验3
操作
现象 无沉淀及气体产生 有沉淀及气体产生 现象
下列说法正确的是( )
B
A.实验1中发生了反应
B.实验2中促进了 的电离平衡
C.实验3中现象 可能是:有沉淀及气体产生
D.推测:可用溶液鉴别浓度均为的溶液和 溶液
【解析】实验1中没有沉淀生成,故没有发生反应。 实验2中有沉淀及气体
产生,说明发生了反应,促进了的电离平衡。 碳酸钠溶
液饱和,实验3中现象可能是有沉淀生成,无气体生成。 离子浓度过低不能生成沉淀,故不能用
溶液鉴别浓度均为的溶液和 溶液。
类型2 侯氏制碱法
4.[链接人教版必修第一册P40科学史话]侯氏制碱法以、、 为原料制取纯碱,将制碱技术发展到一个
新的水平。下列实验室模拟侯氏制碱法制取纯碱的步骤对应的装置或操作错误的是
A.制取 B.制取 C.过滤 #b# 固体 D.灼烧分解
#b#
【答案】D
【解析】 氯化铵和氢氧化钙共热可制备氨气。 碳酸氢钠的溶解度较小,向饱和食盐水中先通入氨气、
后通入二氧化碳可制备(【注意】向饱和食盐水中先通入,后通入时,为了防止倒吸, 从短
管通入,从长管通入。)。碳酸氢钠析出后,通过过滤从混合物中分离出来。 灼烧碳酸氢钠可
转化为纯碱,但加热碳酸氢钠时试管口需要略向下倾斜,否则可能会有水蒸气回流试管底部引起炸裂。
碱金属 焰色试验
第四章
教材知识萃取
碱 金 属 ①包括、、、、(除 外,都呈银白色)等,均为ⅠA族元素;
#b#
②递变性 原子半径增大、失电子能力增强,金属性增强,单质的熔、沸点降低;单质的密度逐渐
增大(但反常);单质与、等反应越来越剧烈, 的碱性依次增强
焰 色 试 验 ①某些金属或它们的化合物在灼烧时火焰呈现出特征颜色,属于物理性质,如(黄色), (紫色,透过
蓝色钴玻璃);
#b#
②实验操作:将用盐酸洗净后的铂丝(或光洁无锈的铁丝)(本身灼烧时火焰不产生特征颜色)灼烧至与原
来的火焰颜色相同后,蘸取试样(可以是单质或化合物,可以是固体或液体)在火焰上灼烧,观察火焰的颜
色
1.碱金属的一般性
相似性 递变性(由
原子结构 价电子排布式为
大,原子半径逐渐
元素性质 都具有较强的金属性,最高 正价均为
逐渐
__
增大
+1
增强
减小
减 小
单质 性质 物理性 质 都呈银白色(除
逐渐降低
化学性 质 都具有较强的还原性 还原性逐渐
来越剧烈,产物越来越复杂;与
反应的剧烈程度逐渐
增强
续表
增强
第一章
2.焰色试验
(1)概念
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
(2)焰色试验的操作
(3)常见元素的焰色
金属元素
焰色 黄色 紫色(透过蓝色 钴玻璃) 紫红 色 砖红 色 黄绿 色 绿色 洋红 色 紫色
3.碱金属的化合物
(1)
①
②
③碱金属氢化物均为白色固体,都是离子晶体,有两个基本特征:一是大多数氢化
物不稳定,加热分解放出氢气,因此可作储氢材料;另一特征是均具有还原性,
(2)
①
成
4
②
教材素材变式
类型1 碱金属
1.[链接人教版必修第一册P99~101]下列关于碱金属元素的说法正确的是( )
B
A.ⅠA族元素都是碱金属元素 B.在常温下 与水反应会发生爆炸
C.锂在氧气中燃烧,生成过氧化锂 D.实验室可用煤油液封保存锂,避免其被氧化
【解析】ⅠA族元素中的不属于碱金属元素。 根据碱金属元素性质的递变规律,从上至下,随着原子序
数的增大,金属性越强,与水反应越剧烈,铯的金属性比较强,在常温下与水反应会发生爆炸。 锂在氧气中燃
烧只能生成氧化锂,不能生成过氧化锂。 锂的密度比煤油小,无法保存在煤油中,应保存在石蜡油中。
2.[链接人教版必修第一册P99~101,2022海南卷]钠和钾是两种常见金属。下列说法正确的是( )
A
A.钠元素的第一电离能大于钾 B.基态钾原子价层电子轨道表示式为&2&
C.钾能置换出 溶液中的钠 D.钠元素与钾元素的原子序数相差18
【解析】同主族元素从上到下第一电离能逐渐减小,A项正确;基态钾原子价层电子轨道表示式为 ,B项错误;
钾遇水反应生成和,不能置换出 溶液中的钠,C项错误;钠元素、钾元素的原子序数分别为11、19,相
差8,D项错误。
类型2 焰色试验
3.[链接人教版必修第一册P40~41]燃放烟花是中华民族庆祝春节的传统方式,烟花绽放时能释放五光十色的光芒。
下列关于烟花燃放的化学原理说法错误的是( )
C
A.燃放时发生了氧化还原反应 B.发出黄色光芒,可见烟花中含有钠元素
C.未能观察到紫色光芒,可见烟花中不含钾元素 D.很多金属在灼烧时都会使火焰呈现出特征颜色
【解析】烟花燃放时氧气参与反应,发生了氧化还原反应。 钠元素的焰色为黄色,发出黄色光芒,
可见烟花中含有钠元素。 钾元素的焰色需要透蓝色钴玻璃观察,没有透过蓝色钴玻璃观察,未能观察到紫
色光芒,不能确定烟花中是否含钾元素。 很多金属在灼烧时都会使火焰呈现出特征颜色,如钙的焰色为砖
红色、钡的焰色为黄绿色、锂的焰色为紫红色。
4.[链接人教版必修第一册P41]某白色固体混合物由、、、 中的两种组成,进行如下实验:
( )
①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉
淀。根据实验现象可判断其组成为
B
A.、 B.、 C.、 D.、
【解析】根据实验①混合物溶于水,得到澄清透明溶液,而难溶于水,可知白色固体中一定不含 ;根
据实验②做焰色反应时焰色呈紫色(透过蓝色钴玻璃)可确定含有钾元素,即白色固体中含有 ;结合实验③向
溶液中加碱产生白色沉淀,可知溶液中含有能与反应生成白色沉淀的离子,只能为 ,即白色固体的另一
成分为 。结合上述分析,可知B项正确。
5.[链接人教版必修第一册P41、人教版选择性必修3 P37探究]为了探究化合物A(含三种元素)的组成和性质,设计并进行如下实验:
已知:气体B是由两种元素组成的纯净物,浓硫
酸质量增加,溶液 的焰色试验呈黄色。请
回答下列问题:
(1)组成A的元素是___________(写元素符
号)。
、C、
(2)气体B的分子式是______。
(3)固体A与足量水反应的化学方程式是________________________________。
(4)写出溶液 进行焰色试验的操作___________________________________________________________________
____________________________________。
将铂丝用稀盐酸洗净,在火焰上灼烧至与原来的火焰颜色相同后,蘸取待测液,再在火焰上灼烧,观察火焰的颜色
【解题思路】溶液的焰色试验呈黄色,说明为,由溶液D显碱性,可知D为。根据 消耗
,可知固体A中含钠原子,质量为 。气体B是由两种元素组成的纯净物,浓硫酸质量增
加,即气体B点燃生成水的质量为,说明B中含 氢原子;再根据气体C通入足量澄清石灰水,
生成白色沉淀,即,可知气体B中含 碳原子,气体B在标准状况下为
,则气体B的分子式是。固体A中 ,
,即含。综合上述分析可知组成A的元素是、C、 ,
物质的量分别为、、,据此可确定A的化学式为 。
谢谢
同课章节目录
