题型三 物质的性质与转化——高考化学二轮复习题型归纳与解题技巧(共32张PPT)
文档属性
| 名称 | 题型三 物质的性质与转化——高考化学二轮复习题型归纳与解题技巧(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 848.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-06 16:02:49 | ||
图片预览









文档简介
(共32张PPT)
2025届高考化学二轮复习题型归纳与解题技巧
题型三 物质的性质与转化
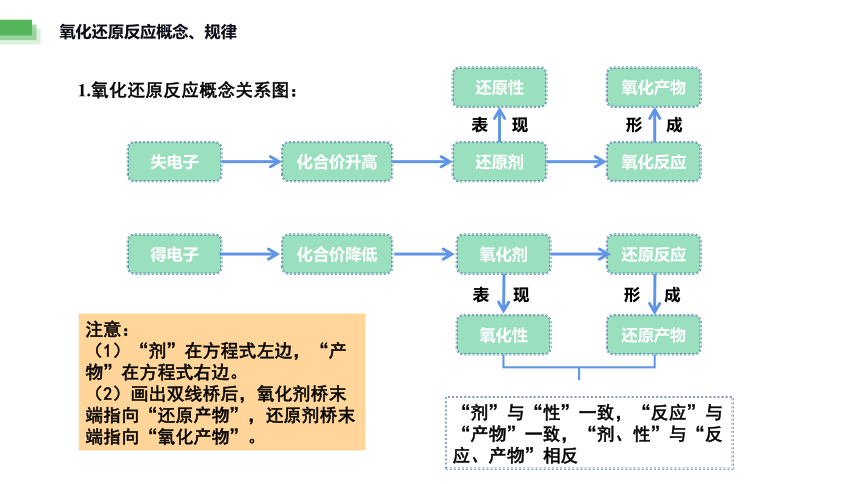
氧化还原反应概念、规律
1.氧化还原反应概念关系图:
失电子
化合价升高
还原剂
氧化反应
氧化产物
还原性
化合价降低
得电子
氧化剂
氧化性
还原反应
还原产物
表 现
表 现
形 成
形 成
“剂”与“性”一致,“反应”与“产物”一致,“剂、性”与“反应、产物”相反
注意:
(1)“剂”在方程式左边,“产物”在方程式右边。
(2)画出双线桥后,氧化剂桥末端指向“还原产物”,还原剂桥末端指向“氧化产物”。
氧化还原反应概念、规律
2.氧化还原反应包括两个过程,即“氧化反应过程”和“还原反应过程”,两个过程是不可分割的,同时发生的,故称“氧化还原反应”;但为了分析方便经常人为地分割成氧化和还原两个过程,并称之为“半反应(即电化学里的电极反应)”。氧化剂+xe-还原产物,是还原反应,还原剂-xe-氧化产物,是氧化反应。
3.氧化还原反应规律:
①性质强弱规律:即氧化剂氧化性>氧化产物氧化性、还原剂还原性>还原产物还原性(注意物质氧化性、还原性还与温度、浓度等有关系,不能生搬硬套);
②性质表现规律:最高价仅表现氧化性,最低价仅表现还原性,中间价态既可表现氧化性又可表现还原性(注意仅仅是表现这样的性质,并非性质很强);
③归中不交叉、不换位规律(此规律主要用于分析归中反应);
④守恒规律:氧化还原反应中得失电子数始终相等。
氧化还原反应概念、规律
4.元素化合价规律:
①金属仅能显正价;
②非金属既能显正价又能显负价;
③F仅能显-1价和0价;
④O一般显-2价[过氧化物、过氧酸(带“过”字的酸,比如过氧乙酸)中部分显-1价];
⑤H一般显+1价(NaH等金属氢化物,NaBH4及LiAlH4、SiH4等特殊物质中显-1价);
⑥主族元素最高价=族序数、最低负价=族序数-8(比如Cl是第ⅦA族元素,所以其典型化合价有-1、0、+1、+3、+5、+7)。
离子共存与离子方程式正误判断
1.离子方程式书写时能“拆”的常见物质
(1)六强酸(硫酸、硝酸、盐酸、高氯酸、氢溴酸、氢碘酸)。
(2)四强碱(氢氧化钠、氢氧化钙、氢氧化钡、氢氧化钾)。
(3)可溶性盐类(醋酸铅等少数物质除外)。
注意:
还要考虑实际情况,比如
①98%浓硫酸不能拆,因为水太少导致浓硫酸未完全电离;浓硝酸、浓盐酸则可以拆开。②不澄清的石灰水不能拆,因为未溶解的氢氧化钙并没有电离。
③不是溶液状态的不能拆,比如实验室制取氨气用的是氢氧化钙与氯化铵“固体”,所以均不能拆开。
不能拆的有:弱酸碱、水等弱电解质,难溶物,气体,氧化物,绝大多数有机物等。
离子共存与离子方程式正误判断
2.明确电荷守恒、得失电子守恒、原子守恒原理。
3.离子反应发生
(1)氧化还原反应型:根据氧化还原反应以强制弱规律加以判断。
(2)复分解型:
必须生成难溶物(符合沉淀转化规律:易溶→微溶→难溶→更难溶)、
易挥发性物质(难挥发性酸制易挥发性酸规律)、
弱电解质(强酸制弱酸规律)
或者发生相互促进的水解反应或生成配合物。
离子共存与离子方程式正误判断
4.离子大量共存条件
(1)基本观点是能反应则不能大量共存,不反应则可大量共存。
(2)通常的原则是
①氧化性离子与还原性离子不能大量共存(比较特殊的Fe2+与Fe3+可以大量共存);
②阴阴或阳阳离子一般不反应,可以大量共存(特殊的HCO3-与OH-可以反应生成碳酸根和水,[Al(OH)4]-与HCO3-可以反应生成碳酸根和氢氧化铝沉淀)。
(3)判断离子共存还要注意特殊条件:
①隐含离子(通过pH或指示剂或水的电离间接知道,溶液是否含有大量H+或OH-);
②有色离子(Cu2+蓝色、Fe2+浅绿色、Fe3+黄色、MnO4-紫色、Cr2O72-橙色、CrO42-黄色等)。
常见无机物的性质与转化
1.熟练掌握各类无机物之间的转化关系,重点是两类反应:
①置换反应按照金属活动性顺序表处理或者根据元素周期律分析;
②酸、碱、盐之间的复分解反应按照复分解反应规律处理。
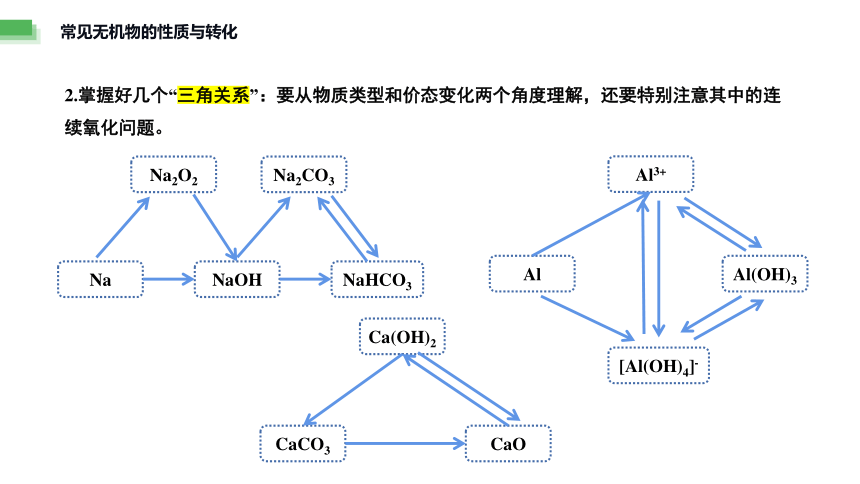
常见无机物的性质与转化
2.掌握好几个“三角关系”:要从物质类型和价态变化两个角度理解,还要特别注意其中的连续氧化问题。
Na2O2
Na
NaOH
NaHCO3
Na2CO3
CaCO3
CaO
Ca(OH)2
Al
Al3+
[Al(OH)4]-
Al(OH)3
常见无机物的性质与转化
2.掌握好几个“三角关系”:要从物质类型和价态变化两个角度理解,还要特别注意其中的连续氧化问题。
H2S
S
SO2
H2SO4
SO3
HCl
Cl2
HClO
Fe2+
Fe
Fe3+
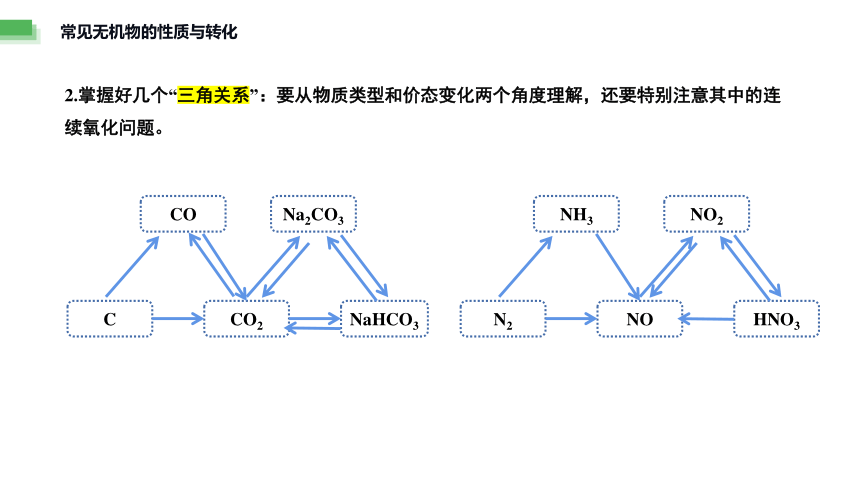
常见无机物的性质与转化
2.掌握好几个“三角关系”:要从物质类型和价态变化两个角度理解,还要特别注意其中的连续氧化问题。
CO
C
CO2
NaHCO3
Na2CO3
NH3
N2
NO
HNO3
NO2
常见无机物的性质与转化
3.掌握一些物质的特殊物理性质以及化学性质等陌生知识点:
比如特殊颜色、特殊气味、特殊性质(比如两性等)等一些较为特殊的物理、化学性质。
无机化工流程微型化
1.工艺流程题的一般规律:
①原料→产品是工艺流程的总体过程。
②要分析原料中有哪些杂质,在生产过程中要加以去除。
去除杂质方法一般有转为沉淀过滤除去,转为气体挥发除去,通过萃取、蒸馏、升华等物理方法除去。
③要考虑流程中原料的价态控制、物态控制及废物的循环利用。
④要考虑生产过程的温度、压强、pH等生产条件控制。
无机化工流程微型化
2.此类题型可以表示如图:
原料
(有用成分)
(杂质)
最终产品
①除杂(状态转化与物理去除)
②有用成分的价态控制及物态(气、液、固)控制
③废物的循环利用
④温度、压强、pH等生产条件控制
无机化工流程微型化
3.此类题目中,一般每个“方框”代表一个操作或一个反应。
分析某个过程反应的时候注意:
该反应的反应物是“进框箭头物质”,生成物是“出框箭头物质”,反应的酸碱性环境综合考虑前一步反应及产物特点进行判断。
例如:
流程中反应Ⅰ反应物应该是左边溶浸输出过来的溶液 +NaClO+NaOH,生成物是滤渣B+输入反应Ⅱ的溶液,而且根据①、②分析很有可能是发生两个反应,第一个反应发生时,因为还没加NaOH,所以此时应该是酸性环境(因为左边溶浸用的是硫酸,为了溶浸更彻底,一般硫酸应该过量),所以写离子方程式①时应该补H+。
活化能与能垒
1.活化能
上边左图中
①指正反应活化能(Ea正),②指逆反应活化能(Ea逆),③指的是反应焓变ΔH。
右图是加催化剂之后的活化能变化。
右图中代表加催化剂后反应分步进行,第二步(第二个峰)活化能①大于第一步活化能,所以第二步是决速步骤。
但总反应正向活化能是②(即从反应物到两个峰最高点的差),总反应逆向活化能是③。
活化能与能垒
2.能垒:能垒图是体现反应微观过程能量图,如图。
图中纵坐标是相对能量,横坐标是反应过程微观历程。
从左向右“实线箭头(即上坡箭头)”指的是正反应的能垒,“坡越高”代表能垒越大。
从右向左的“虚线箭头(即左至右的下坡)”代表逆反应能垒。
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
2025届高考化学二轮复习题型归纳与解题技巧
题型三 物质的性质与转化
氧化还原反应概念、规律
1.氧化还原反应概念关系图:
失电子
化合价升高
还原剂
氧化反应
氧化产物
还原性
化合价降低
得电子
氧化剂
氧化性
还原反应
还原产物
表 现
表 现
形 成
形 成
“剂”与“性”一致,“反应”与“产物”一致,“剂、性”与“反应、产物”相反
注意:
(1)“剂”在方程式左边,“产物”在方程式右边。
(2)画出双线桥后,氧化剂桥末端指向“还原产物”,还原剂桥末端指向“氧化产物”。
氧化还原反应概念、规律
2.氧化还原反应包括两个过程,即“氧化反应过程”和“还原反应过程”,两个过程是不可分割的,同时发生的,故称“氧化还原反应”;但为了分析方便经常人为地分割成氧化和还原两个过程,并称之为“半反应(即电化学里的电极反应)”。氧化剂+xe-还原产物,是还原反应,还原剂-xe-氧化产物,是氧化反应。
3.氧化还原反应规律:
①性质强弱规律:即氧化剂氧化性>氧化产物氧化性、还原剂还原性>还原产物还原性(注意物质氧化性、还原性还与温度、浓度等有关系,不能生搬硬套);
②性质表现规律:最高价仅表现氧化性,最低价仅表现还原性,中间价态既可表现氧化性又可表现还原性(注意仅仅是表现这样的性质,并非性质很强);
③归中不交叉、不换位规律(此规律主要用于分析归中反应);
④守恒规律:氧化还原反应中得失电子数始终相等。
氧化还原反应概念、规律
4.元素化合价规律:
①金属仅能显正价;
②非金属既能显正价又能显负价;
③F仅能显-1价和0价;
④O一般显-2价[过氧化物、过氧酸(带“过”字的酸,比如过氧乙酸)中部分显-1价];
⑤H一般显+1价(NaH等金属氢化物,NaBH4及LiAlH4、SiH4等特殊物质中显-1价);
⑥主族元素最高价=族序数、最低负价=族序数-8(比如Cl是第ⅦA族元素,所以其典型化合价有-1、0、+1、+3、+5、+7)。
离子共存与离子方程式正误判断
1.离子方程式书写时能“拆”的常见物质
(1)六强酸(硫酸、硝酸、盐酸、高氯酸、氢溴酸、氢碘酸)。
(2)四强碱(氢氧化钠、氢氧化钙、氢氧化钡、氢氧化钾)。
(3)可溶性盐类(醋酸铅等少数物质除外)。
注意:
还要考虑实际情况,比如
①98%浓硫酸不能拆,因为水太少导致浓硫酸未完全电离;浓硝酸、浓盐酸则可以拆开。②不澄清的石灰水不能拆,因为未溶解的氢氧化钙并没有电离。
③不是溶液状态的不能拆,比如实验室制取氨气用的是氢氧化钙与氯化铵“固体”,所以均不能拆开。
不能拆的有:弱酸碱、水等弱电解质,难溶物,气体,氧化物,绝大多数有机物等。
离子共存与离子方程式正误判断
2.明确电荷守恒、得失电子守恒、原子守恒原理。
3.离子反应发生
(1)氧化还原反应型:根据氧化还原反应以强制弱规律加以判断。
(2)复分解型:
必须生成难溶物(符合沉淀转化规律:易溶→微溶→难溶→更难溶)、
易挥发性物质(难挥发性酸制易挥发性酸规律)、
弱电解质(强酸制弱酸规律)
或者发生相互促进的水解反应或生成配合物。
离子共存与离子方程式正误判断
4.离子大量共存条件
(1)基本观点是能反应则不能大量共存,不反应则可大量共存。
(2)通常的原则是
①氧化性离子与还原性离子不能大量共存(比较特殊的Fe2+与Fe3+可以大量共存);
②阴阴或阳阳离子一般不反应,可以大量共存(特殊的HCO3-与OH-可以反应生成碳酸根和水,[Al(OH)4]-与HCO3-可以反应生成碳酸根和氢氧化铝沉淀)。
(3)判断离子共存还要注意特殊条件:
①隐含离子(通过pH或指示剂或水的电离间接知道,溶液是否含有大量H+或OH-);
②有色离子(Cu2+蓝色、Fe2+浅绿色、Fe3+黄色、MnO4-紫色、Cr2O72-橙色、CrO42-黄色等)。
常见无机物的性质与转化
1.熟练掌握各类无机物之间的转化关系,重点是两类反应:
①置换反应按照金属活动性顺序表处理或者根据元素周期律分析;
②酸、碱、盐之间的复分解反应按照复分解反应规律处理。
常见无机物的性质与转化
2.掌握好几个“三角关系”:要从物质类型和价态变化两个角度理解,还要特别注意其中的连续氧化问题。
Na2O2
Na
NaOH
NaHCO3
Na2CO3
CaCO3
CaO
Ca(OH)2
Al
Al3+
[Al(OH)4]-
Al(OH)3
常见无机物的性质与转化
2.掌握好几个“三角关系”:要从物质类型和价态变化两个角度理解,还要特别注意其中的连续氧化问题。
H2S
S
SO2
H2SO4
SO3
HCl
Cl2
HClO
Fe2+
Fe
Fe3+
常见无机物的性质与转化
2.掌握好几个“三角关系”:要从物质类型和价态变化两个角度理解,还要特别注意其中的连续氧化问题。
CO
C
CO2
NaHCO3
Na2CO3
NH3
N2
NO
HNO3
NO2
常见无机物的性质与转化
3.掌握一些物质的特殊物理性质以及化学性质等陌生知识点:
比如特殊颜色、特殊气味、特殊性质(比如两性等)等一些较为特殊的物理、化学性质。
无机化工流程微型化
1.工艺流程题的一般规律:
①原料→产品是工艺流程的总体过程。
②要分析原料中有哪些杂质,在生产过程中要加以去除。
去除杂质方法一般有转为沉淀过滤除去,转为气体挥发除去,通过萃取、蒸馏、升华等物理方法除去。
③要考虑流程中原料的价态控制、物态控制及废物的循环利用。
④要考虑生产过程的温度、压强、pH等生产条件控制。
无机化工流程微型化
2.此类题型可以表示如图:
原料
(有用成分)
(杂质)
最终产品
①除杂(状态转化与物理去除)
②有用成分的价态控制及物态(气、液、固)控制
③废物的循环利用
④温度、压强、pH等生产条件控制
无机化工流程微型化
3.此类题目中,一般每个“方框”代表一个操作或一个反应。
分析某个过程反应的时候注意:
该反应的反应物是“进框箭头物质”,生成物是“出框箭头物质”,反应的酸碱性环境综合考虑前一步反应及产物特点进行判断。
例如:
流程中反应Ⅰ反应物应该是左边溶浸输出过来的溶液 +NaClO+NaOH,生成物是滤渣B+输入反应Ⅱ的溶液,而且根据①、②分析很有可能是发生两个反应,第一个反应发生时,因为还没加NaOH,所以此时应该是酸性环境(因为左边溶浸用的是硫酸,为了溶浸更彻底,一般硫酸应该过量),所以写离子方程式①时应该补H+。
活化能与能垒
1.活化能
上边左图中
①指正反应活化能(Ea正),②指逆反应活化能(Ea逆),③指的是反应焓变ΔH。
右图是加催化剂之后的活化能变化。
右图中代表加催化剂后反应分步进行,第二步(第二个峰)活化能①大于第一步活化能,所以第二步是决速步骤。
但总反应正向活化能是②(即从反应物到两个峰最高点的差),总反应逆向活化能是③。
活化能与能垒
2.能垒:能垒图是体现反应微观过程能量图,如图。
图中纵坐标是相对能量,横坐标是反应过程微观历程。
从左向右“实线箭头(即上坡箭头)”指的是正反应的能垒,“坡越高”代表能垒越大。
从右向左的“虚线箭头(即左至右的下坡)”代表逆反应能垒。
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
题型训练
谢谢观看
同课章节目录
