物质及其变化--离子反应、离子方程式 专题练 2025年高考化学一轮复习备考
文档属性
| 名称 | 物质及其变化--离子反应、离子方程式 专题练 2025年高考化学一轮复习备考 |  | |
| 格式 | docx | ||
| 文件大小 | 574.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-07 14:54:06 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
物质及其变化--离子反应、离子方程式
专题练 2025年高考化学一轮复习备考
一、单选题(共15题)
1.不能正确表示下列反应的离子方程式的是
A.将通入NaOH溶液中:
B.硫化钠溶液加入过量亚硫酸:
C.将浓氨水滴入AgCl沉淀中:
D.NaOH溶液溶解:
2.可以正确表示下列过程的离子方程式是
A.过量的Fe与稀硝酸反应:
B.Zn与浓硫酸反应:
C.通入水中:
D.与足量NaOH溶液反应:
3.下列离子方程式错误的是
A.饱和碳酸钠溶液中通入足量:
B.硫化钠溶液与稀硝酸混合:
C.用铁氰化钾溶液检验:
D.将少量通入溶液中:
4.下列离子方程式错误的是
A.证明氧化性::
B.稀硫酸与溶液混合:
C.在酸性环境下不能稳定存在:
D.与烧碱溶液反应制水玻璃:
5.SO2是引发酸雨的主要污染物,将工业废气中的SO2吸收能有效减少对大气的污染、并实现资源化利用。下列离子方程式正确的是
A.硫酸型酸雨放置于空气中一段时间后溶液酸性增强:2H2SO3+O2=4H++2SO
B.用过量Ca(ClO)2溶液吸收废气中的SO2:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+
C.用过量氨水吸收废气中的SO2:NH3 H2O+SO2=NH+HSO
D.将SO2通入H2S溶液中:SO2+2S2-+4H+=3S↓+2H2O
6.下列化学反应与相应的离子(或化学)方程式不相符的是
A.AgCl沉淀溶于氨水:
B.将过量通入冷氨水中:
C.用盐酸处理铜器表面的铜锈:
D.氯水中加入小苏打提高漂白性:
7.对于下列实验,能正确描述其反应的离子方程式是
A.金属与溶液反应:
B.将粉末浸没在足量的蓝矾溶液中:
C.向溶液中通入:
D.(弱酸)与酸性溶液反应:
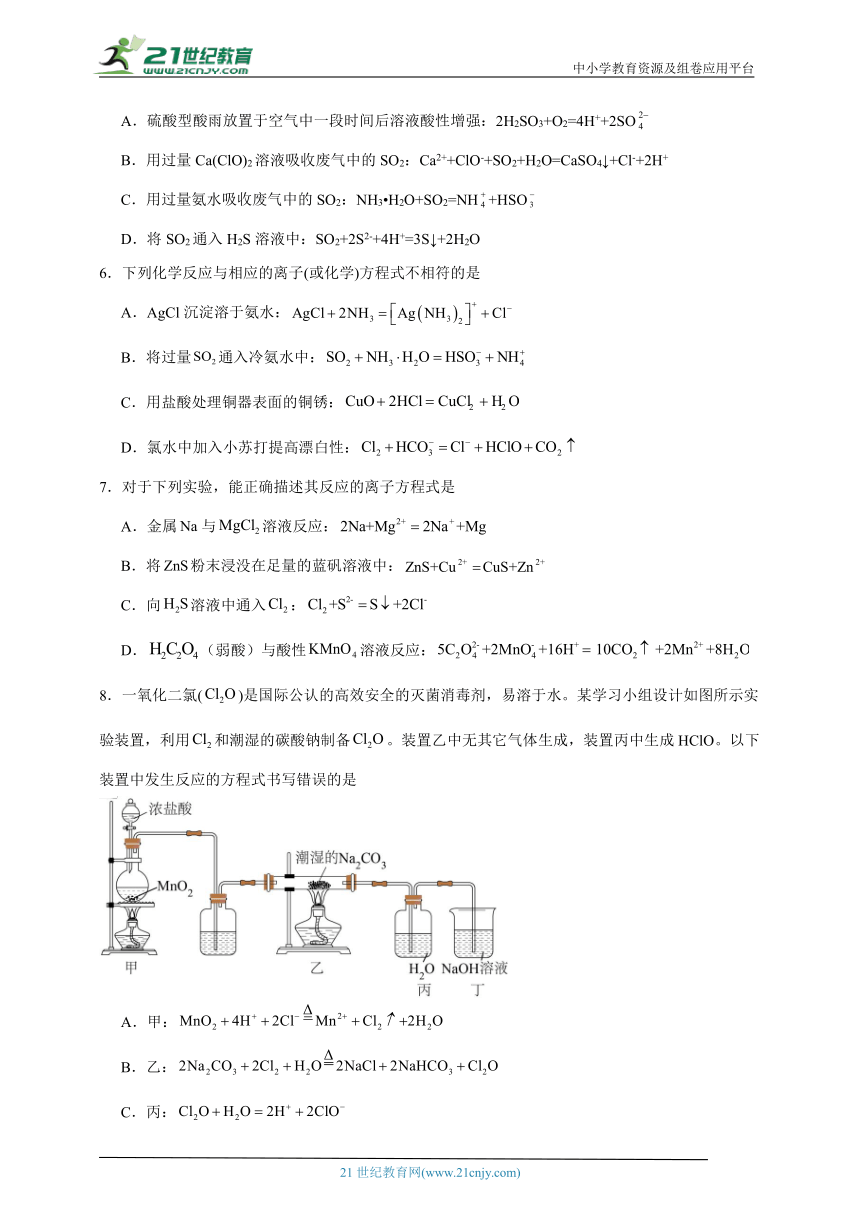
8.一氧化二氯()是国际公认的高效安全的灭菌消毒剂,易溶于水。某学习小组设计如图所示实验装置,利用和潮湿的碳酸钠制备。装置乙中无其它气体生成,装置丙中生成HClO。以下装置中发生反应的方程式书写错误的是
A.甲:
B.乙:
C.丙:
D.丁:
9.下列离子方程式,能正确解释沉淀产生原因的是
A.向溶液中加入氨水,产生红褐色沉淀:
B.向甲醛中加入足量新制悬浊液,加热,产生砖红色沉淀:
C.向饱和溶液中通入,产生白色沉淀:
D.向溶液中通入,产生白色沉淀:
10.下列离子方程式书写正确的是
A.向稀硝酸中滴加少量Na2SO3溶液:
B.用食醋除去水垢中的CaCO3:
C.用铁作电极电解饱和食盐水:
D.向NaHCO3溶液中加入过量澄清石灰水:
11.化学反应在社会发展中运用广泛。下列解释事实的离子方程式正确的是
A.明矾做净水剂:
B.用亚硫酸钠溶液吸收少量氯气:
C.以金属银为阳极电解饱和NaCl溶液:
D.用醋酸和淀粉溶液检验加碘食盐中所含的:
12.下列离子方程式或化学方程式正确的是
A.在浓硫酸、加热条件下,和制备乙酸乙酯:
B.向硝酸钡溶液中通入:
C.向溴的四氯化碳溶液中通入乙烯:
D.在NaHSO3溶液中滴加少量NaClO溶液:
13.下列离子方程式错误的是
A.和足量稀硝酸反应:
B.用溶液处理水垢中的
C.将溶液滴入溶液中:
D.用溶液除去乙炔中的少量杂质:
14.下列指定反应的离子方程式书写正确的是
A.铬酸钾溶液中滴入浓盐酸:
B.溶液与过量氨水反应:
C.向溶液中加入过量氨水:
D.向溶液中加少量溶液:
15.下列离子方程式书写正确的是
A.用高锰酸钾溶液滴定草酸:
B.电解饱和食盐水:
C.向溶液中加入足量稀硝酸:
D.将足量通入溶液中:
二、非选择题(共3题)
16.根据题目条件,写出下列反应的离子方程式。
(1)Ba(OH)2溶液与NaHSO4溶液反应
①n[Ba(OH)2]∶n(NaHSO4)=1∶1 ,此时溶液呈 性;
②n[Ba(OH)2]∶n(NaHSO4)=1∶2 ,此时溶液呈 性,若向该溶液中再加入Ba(OH)2溶液,离子方程式为 。
(2)NH4Al(SO4)2与Ba(OH)2溶液反应
①n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1 ;
②n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶2 。
17.五氧化二钽(Ta2O5)主要用作钽酸锂单晶和制造高折射低色散特种光学玻璃等。一种以含钽废料(主要成分为NaTaO3、SiO2以及少量的FeO、Fe2O3、Al2O3等)为原料制备Ta2O5的工艺流程如图所示:
已知:H2TaF7是弱酸。回答下列问题:
(1)“酸溶”时,Fe2O3发生反应的基本反应类型为 ,滤渣的主要成分是 (填化学式)。
(2)“氧化”时,发生反应的离子方程式为 。
(3)常温下,“调pH”时,若过滤出沉淀后溶液的,是否沉淀完全? (请写出简要步骤)。已知:常温下,,溶液中离子浓度小于或等于时可视为沉淀完全。
(4)“浸钽”时,加入4g/L的HF溶液,浸出时间为4h,钽的浸出率随温度的变化如图所示,浸出的最佳温度为 ℃“调pH”后,溶液中溶质主要为NaTaO3,写出“浸钽”时生成H2TaF7的离子方程式: 。
(5)“沉钽”时,生成,反应化学方程式为 。
18.草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为,含少量、、CaO、MgO、碳及有机物等)制取的工艺流程如图:
(1)“550℃焙烧”的目的是 。
(2)“碱浸”过程中浸出液主要成分是 。
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为与盐酸反应生成污染环境,该反应的离子方程式为 ,的作用是 。
(4)“净化除杂1”过程中,先在加入,再升温至,加入溶液,调pH至4.5。滤渣1的主要成分是 金属离子与反应的离子方程式为 。
(5)“净化除杂2”过程中,加入NaF以除去原溶液中(浓度为)和,若控制溶液中,则的去除率准确值为 。[已知某温度下,]
参考答案:
1.D
A.将NO2通入NaOH溶液中,生成可溶的亚硝酸钠和硝酸钠,选项所给离子方程式正确,A正确;
B.硫化钠中的硫元素为-2价,亚硫酸中的硫元素为+4价,两者反应生成硫单质,由于亚硫酸过量,生成亚硫酸氢根,选项所给离子方程式正确,B正确;
C.银离子和氨可以形成[Ag(NH3)2]+离子,配合物离子较稳定,可以通过平衡移动将氯化银沉淀溶解,选项所给离子方程式正确,C正确;
D.氧化铝是两性氧化物,可以溶于强碱,选项所给离子方程式配平不正确,正确的离子方程式为Al2O3+2OH +3H2O=2[Al(OH)4] ,D错误;
2.C
A.过量的Fe与稀硝酸反应的离子方程式为3Fe+8H++2=3Fe2++2NO↑+4H2O,A错误;
B.Zn与浓硫酸反应的离子方程式为Zn+2H2SO4(浓)=Zn2+++2H2O+SO2↑,B错误;
C.NO2通入水中,离子方程式为,C正确;
D.SO2与足量NaOH溶液反应,离子方程式为SO2+2OH-=H2O+,D错误;
3.A
A.饱和碳酸钠溶液中通入足量反应生成溶解度较小的碳酸氢钠晶体:,A错误;
B.硫化钠溶液与稀硝酸混合,硫离子被硝酸根离子氧化为硫单质,同时硝酸根离子被还原为NO,B正确;
C.亚铁离子和K3[Fe(CN)6]溶液会生成蓝色沉淀:,可以用于检验亚铁离子,C正确;
D.少量通入溶液中,次氯酸根离子过量,二氧化硫被次氯酸氧化为硫酸根离子,同时过量次氯酸根离子会生成弱酸次氯酸,D正确;
4.A
A.与反应的离子方程式应为,A项错误;
B.稀硫酸与溶液混合:,B项正确;
C.在酸性环境下不能稳定存在:,C项正确;
D.与烧碱溶液反应制水玻璃:,D项正确;
5.A
A.硫酸型酸雨放置于空气中一段时间后溶液酸性增强,是因为亚硫酸被氧化为硫酸:2H2SO3+O2=4H++2SO,A正确;
B. 因为Ca(ClO)2过量,应该是:Ca2++3ClO-+SO2+H2O=CaSO4↓+Cl-+2HClO,B错误;
C.用过量氨水吸收废气中的SO2:2NH3 H2O+SO2=2NH+SO+H2O,C错误;
D.H2S是弱酸,不能拆成离子形式:SO2+2H2S=3S↓+2H2O,D错误;
6.C
A.AgCl沉淀溶于氨水生成[Ag(NH3)2]Cl,离子方程式为:AgCl+2NH3=[Ag(NH3)2]++Cl-,A正确;
B.将过量SO2通入冷氨水中生成NH4HSO3,故离子方程式为::,B正确;
C.铜锈的主要成分是Cu2(OH)2CO3而不是CuO,故用盐酸处理铜器表面的铜锈的反应方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,C错误;
D.已知酸性:HCl>H2CO3>HClO,故氯水中加入小苏打提高漂白性的离子方程式为:,D正确;
7.B
A.金属钠与氯化镁溶液反应时,钠先与水反应生成氢氧化钠和氢气,反应生成的氢氧化钠再与氯化镁溶液反应生成氯化钠和氢氧化镁沉淀,不能发生置换反应置换出镁,故A错误;
B.硫化锌与硫酸铜溶液反应生成溶解度小的硫化铜和硫酸锌,反应的离子方程式为,故B正确;
C.氯气与氢硫酸溶液反应生成硫沉淀和盐酸,反应的离子方程式为,故C错误;
D.草酸溶液与酸性高锰酸钾溶液反应生成硫酸钾、硫酸锰、二氧化碳和水,反应的离子方程式为,故D错误;
8.C
A.二氧化锰和浓盐酸在加热条件下生成氯气、氯化锰、水:,A正确;
B.乙中碳酸钠、氯气发生氧化还原反应生成氯化钠、,同时生成碳酸氢钠,发生反应2Na2CO3+H2O+2Cl22NaCl+2NaHCO3+Cl2O,B正确;
C.溶于水,同时与水发生反应生成弱酸次氯酸,,C错误;
D.氯气和氢氧化钠生成氯化钠、次氯酸钠和水,反应为,D正确;
9.B
A.向溶液中加入氨水,产生红褐色沉淀,一水合氨是弱电解质,不能拆写成离子:,A错误;
B.向甲醛中加入足量新制悬浊液,加热,产生砖红色沉淀,甲醛被氧化生成碳酸根:,B正确;
C.向饱和溶液中通入,产生白色沉淀:,C错误;
D.向溶液中通入,发生氧化还原反应,产生白色沉淀硫酸钡:,D错误;
10.D
A.向稀硝酸中滴加少量Na2SO3溶液,反应生成硫酸钠、NO和水,反应的离子方程式为:,选项A错误;
B.用食醋除去水垢中的CaCO3,反应生成醋酸钙、二氧化碳和水,反应的离子方程式为:,选项B错误;
C.用铁作电极电解饱和食盐水,生成氢氧化亚铁和氢气,反应的离子方程式为:,选项C错误;
D.向NaHCO3溶液中加入过量澄清石灰水,反应生成碳酸钙、氢氧化钠和水,反应的离子方程式为:,选项D正确;
11.C
A.明矾做净水剂的离子方程式为:,选项A错误;
B.用亚硫酸钠溶液吸收少量氯气,反应的离子方程式为:,选项B错误;
C.以金属银为阳极电解饱和NaCl溶液生成氯化银、氢气和氢氧化钠,反应的离子方程式为:,选项C正确;
D.用醋酸和淀粉溶液检验加碘食盐中所含的,反应的离子方程式为:,选项D错误;
12.D
A.在浓硫酸、加热条件下,和制备乙酸乙酯,酸脱羟基,醇脱氢,方程式应为:,A错误;
B.向硝酸钡溶液中通入:,B错误;
C.向溴的四氯化碳溶液中通入乙烯:,C错误;
D.在NaHSO3溶液中滴加少量NaClO溶液,次氯酸根将亚硫酸氢根氧化成硫酸根,方程式为:,D正确;
13.A
A.和足量稀硝酸反应:,A错误;
B.用溶液处理水垢中的,B正确;
C.将溶液滴入溶液中:,C正确;
D.用溶液除去乙炔中的少量杂质:,D正确;
14.C
A.铬酸钾在酸性条件下转化为具有强氧化性的,将盐酸氧化为氯气,,A错误;
B.溶液与过量氨水反应:,B错误;
C.氨水中一水合氨为弱碱,不能溶解氢氧化铝,所以向溶液中加入过量氨水:,C正确;
D.向溶液中加少量溶液:,D错误;
15.B
A.草酸是弱酸,不能拆写,用高锰酸钾溶液滴定草酸:,A错误;
B.电解饱和食盐水:,B正确;
C.硝酸具有强氧化性,能氧化硫代硫酸根离子,C错误;
D.将足量通入溶液中:,D错误;
16.(1) Ba2++OH-+H++=BaSO4↓+H2O 碱 Ba2++2OH-+2H++=BaSO4↓+2H2O 中 +Ba2+=BaSO4↓
(2) 3Ba2++3+2Al3++6OH-=3BaSO4↓+2Al(OH)3↓ +Al3++2+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
(1)①Ba(OH)2和NaHSO4按照1∶1反应,生成BaSO4沉淀、NaOH和水,离子方程式为Ba2++OH-+H++=BaSO4↓+H2O,溶液呈碱性。
②Ba(OH)2和NaHSO4按照1∶2反应,生成BaSO4沉淀、Na2SO4和水,离子方程式为Ba2++2OH-+2H++=BaSO4↓+2H2O,溶液呈中性;继续再加入Ba(OH)2溶液,Na2SO4和Ba(OH)2反应生成BaSO4沉淀和NaOH,离子方程式为+Ba2+=BaSO4↓。
(2)①NH4Al(SO4)2和Ba(OH)2按照1∶1反应,生成BaSO4沉淀、Al(OH)3沉淀和硫酸铝铵,离子方程式为3Ba2++3+2Al3++6OH-=3BaSO4↓+2Al(OH)3↓。
②NH4Al(SO4)2和Ba(OH)2按照1∶2反应,生成BaSO4沉淀、Al(OH)3沉淀和NH3·H2O,离子方程式为+Al3++2+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓。
17.(1) 复分解反应 SiO2
(2)
(3)“调pH=5”时,此时溶液中,可得,沉淀完全
(4) 80
(5)或
(1)“酸溶”时,Fe2O3发生Fe2O3+3H2SO4=Fe2(SO4)3+3H8O反应,属于复分解反应,SiO2不溶于硫酸,滤渣的主要成分是SiO2;
(2)加双氧水将Fe2+氧化成Fe3+,发生反应的离子方程式为:;
(3)常温下,“调pH”时,若过滤出沉淀后溶液的,,,沉淀完全;
(4)由图可知,浸出的最佳温度为80℃,温度过低,浸出率低,温度过高,Ta浸出率变化不大,但耗能增大;“调pH”后,溶液中溶质主要为NaTaO3,“浸钽”时生成H2TaF7和水,离子方程式:;
(5)沉钽”时通入氨气,生成了一水合氨,H2TaF7与NH3 H2O反应生成Ta(OH)5,反应化学方程式为:或。
18.(1)除去碳和有机物
(2)(或和NaOH)
(3) 将和还原为和(作还原剂)
(4)
(5)90%
(1)“550℃焙烧”高温条件下通过燃烧除去碳和有机物;
(2)氢氧化钠溶液溶解了氧化铝,“浸出液”的主要成分是(或和NaOH);
(3)Co2O3在酸性条件下将氯离子氧化为氯气、自身被还原为Co2+,离子方程式为;Na2SO3具有较强还原性将Co3+、Fe3+还原为Co2+、Fe2+;
(4)根据沉淀pH范围,控制pH是为了促使完全Fe3+沉淀,而Co2+、Mg2+不沉淀,因此滤渣1的主要成分是;双氧水将Fe2+氧化为Fe3+,酸性条件下的离子方程式为;
(5)控制溶液中,,则此时溶液中,则Ca2+的去除率为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
物质及其变化--离子反应、离子方程式
专题练 2025年高考化学一轮复习备考
一、单选题(共15题)
1.不能正确表示下列反应的离子方程式的是
A.将通入NaOH溶液中:
B.硫化钠溶液加入过量亚硫酸:
C.将浓氨水滴入AgCl沉淀中:
D.NaOH溶液溶解:
2.可以正确表示下列过程的离子方程式是
A.过量的Fe与稀硝酸反应:
B.Zn与浓硫酸反应:
C.通入水中:
D.与足量NaOH溶液反应:
3.下列离子方程式错误的是
A.饱和碳酸钠溶液中通入足量:
B.硫化钠溶液与稀硝酸混合:
C.用铁氰化钾溶液检验:
D.将少量通入溶液中:
4.下列离子方程式错误的是
A.证明氧化性::
B.稀硫酸与溶液混合:
C.在酸性环境下不能稳定存在:
D.与烧碱溶液反应制水玻璃:
5.SO2是引发酸雨的主要污染物,将工业废气中的SO2吸收能有效减少对大气的污染、并实现资源化利用。下列离子方程式正确的是
A.硫酸型酸雨放置于空气中一段时间后溶液酸性增强:2H2SO3+O2=4H++2SO
B.用过量Ca(ClO)2溶液吸收废气中的SO2:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+
C.用过量氨水吸收废气中的SO2:NH3 H2O+SO2=NH+HSO
D.将SO2通入H2S溶液中:SO2+2S2-+4H+=3S↓+2H2O
6.下列化学反应与相应的离子(或化学)方程式不相符的是
A.AgCl沉淀溶于氨水:
B.将过量通入冷氨水中:
C.用盐酸处理铜器表面的铜锈:
D.氯水中加入小苏打提高漂白性:
7.对于下列实验,能正确描述其反应的离子方程式是
A.金属与溶液反应:
B.将粉末浸没在足量的蓝矾溶液中:
C.向溶液中通入:
D.(弱酸)与酸性溶液反应:
8.一氧化二氯()是国际公认的高效安全的灭菌消毒剂,易溶于水。某学习小组设计如图所示实验装置,利用和潮湿的碳酸钠制备。装置乙中无其它气体生成,装置丙中生成HClO。以下装置中发生反应的方程式书写错误的是
A.甲:
B.乙:
C.丙:
D.丁:
9.下列离子方程式,能正确解释沉淀产生原因的是
A.向溶液中加入氨水,产生红褐色沉淀:
B.向甲醛中加入足量新制悬浊液,加热,产生砖红色沉淀:
C.向饱和溶液中通入,产生白色沉淀:
D.向溶液中通入,产生白色沉淀:
10.下列离子方程式书写正确的是
A.向稀硝酸中滴加少量Na2SO3溶液:
B.用食醋除去水垢中的CaCO3:
C.用铁作电极电解饱和食盐水:
D.向NaHCO3溶液中加入过量澄清石灰水:
11.化学反应在社会发展中运用广泛。下列解释事实的离子方程式正确的是
A.明矾做净水剂:
B.用亚硫酸钠溶液吸收少量氯气:
C.以金属银为阳极电解饱和NaCl溶液:
D.用醋酸和淀粉溶液检验加碘食盐中所含的:
12.下列离子方程式或化学方程式正确的是
A.在浓硫酸、加热条件下,和制备乙酸乙酯:
B.向硝酸钡溶液中通入:
C.向溴的四氯化碳溶液中通入乙烯:
D.在NaHSO3溶液中滴加少量NaClO溶液:
13.下列离子方程式错误的是
A.和足量稀硝酸反应:
B.用溶液处理水垢中的
C.将溶液滴入溶液中:
D.用溶液除去乙炔中的少量杂质:
14.下列指定反应的离子方程式书写正确的是
A.铬酸钾溶液中滴入浓盐酸:
B.溶液与过量氨水反应:
C.向溶液中加入过量氨水:
D.向溶液中加少量溶液:
15.下列离子方程式书写正确的是
A.用高锰酸钾溶液滴定草酸:
B.电解饱和食盐水:
C.向溶液中加入足量稀硝酸:
D.将足量通入溶液中:
二、非选择题(共3题)
16.根据题目条件,写出下列反应的离子方程式。
(1)Ba(OH)2溶液与NaHSO4溶液反应
①n[Ba(OH)2]∶n(NaHSO4)=1∶1 ,此时溶液呈 性;
②n[Ba(OH)2]∶n(NaHSO4)=1∶2 ,此时溶液呈 性,若向该溶液中再加入Ba(OH)2溶液,离子方程式为 。
(2)NH4Al(SO4)2与Ba(OH)2溶液反应
①n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶1 ;
②n[NH4Al(SO4)2]∶n[Ba(OH)2]=1∶2 。
17.五氧化二钽(Ta2O5)主要用作钽酸锂单晶和制造高折射低色散特种光学玻璃等。一种以含钽废料(主要成分为NaTaO3、SiO2以及少量的FeO、Fe2O3、Al2O3等)为原料制备Ta2O5的工艺流程如图所示:
已知:H2TaF7是弱酸。回答下列问题:
(1)“酸溶”时,Fe2O3发生反应的基本反应类型为 ,滤渣的主要成分是 (填化学式)。
(2)“氧化”时,发生反应的离子方程式为 。
(3)常温下,“调pH”时,若过滤出沉淀后溶液的,是否沉淀完全? (请写出简要步骤)。已知:常温下,,溶液中离子浓度小于或等于时可视为沉淀完全。
(4)“浸钽”时,加入4g/L的HF溶液,浸出时间为4h,钽的浸出率随温度的变化如图所示,浸出的最佳温度为 ℃“调pH”后,溶液中溶质主要为NaTaO3,写出“浸钽”时生成H2TaF7的离子方程式: 。
(5)“沉钽”时,生成,反应化学方程式为 。
18.草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为,含少量、、CaO、MgO、碳及有机物等)制取的工艺流程如图:
(1)“550℃焙烧”的目的是 。
(2)“碱浸”过程中浸出液主要成分是 。
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为与盐酸反应生成污染环境,该反应的离子方程式为 ,的作用是 。
(4)“净化除杂1”过程中,先在加入,再升温至,加入溶液,调pH至4.5。滤渣1的主要成分是 金属离子与反应的离子方程式为 。
(5)“净化除杂2”过程中,加入NaF以除去原溶液中(浓度为)和,若控制溶液中,则的去除率准确值为 。[已知某温度下,]
参考答案:
1.D
A.将NO2通入NaOH溶液中,生成可溶的亚硝酸钠和硝酸钠,选项所给离子方程式正确,A正确;
B.硫化钠中的硫元素为-2价,亚硫酸中的硫元素为+4价,两者反应生成硫单质,由于亚硫酸过量,生成亚硫酸氢根,选项所给离子方程式正确,B正确;
C.银离子和氨可以形成[Ag(NH3)2]+离子,配合物离子较稳定,可以通过平衡移动将氯化银沉淀溶解,选项所给离子方程式正确,C正确;
D.氧化铝是两性氧化物,可以溶于强碱,选项所给离子方程式配平不正确,正确的离子方程式为Al2O3+2OH +3H2O=2[Al(OH)4] ,D错误;
2.C
A.过量的Fe与稀硝酸反应的离子方程式为3Fe+8H++2=3Fe2++2NO↑+4H2O,A错误;
B.Zn与浓硫酸反应的离子方程式为Zn+2H2SO4(浓)=Zn2+++2H2O+SO2↑,B错误;
C.NO2通入水中,离子方程式为,C正确;
D.SO2与足量NaOH溶液反应,离子方程式为SO2+2OH-=H2O+,D错误;
3.A
A.饱和碳酸钠溶液中通入足量反应生成溶解度较小的碳酸氢钠晶体:,A错误;
B.硫化钠溶液与稀硝酸混合,硫离子被硝酸根离子氧化为硫单质,同时硝酸根离子被还原为NO,B正确;
C.亚铁离子和K3[Fe(CN)6]溶液会生成蓝色沉淀:,可以用于检验亚铁离子,C正确;
D.少量通入溶液中,次氯酸根离子过量,二氧化硫被次氯酸氧化为硫酸根离子,同时过量次氯酸根离子会生成弱酸次氯酸,D正确;
4.A
A.与反应的离子方程式应为,A项错误;
B.稀硫酸与溶液混合:,B项正确;
C.在酸性环境下不能稳定存在:,C项正确;
D.与烧碱溶液反应制水玻璃:,D项正确;
5.A
A.硫酸型酸雨放置于空气中一段时间后溶液酸性增强,是因为亚硫酸被氧化为硫酸:2H2SO3+O2=4H++2SO,A正确;
B. 因为Ca(ClO)2过量,应该是:Ca2++3ClO-+SO2+H2O=CaSO4↓+Cl-+2HClO,B错误;
C.用过量氨水吸收废气中的SO2:2NH3 H2O+SO2=2NH+SO+H2O,C错误;
D.H2S是弱酸,不能拆成离子形式:SO2+2H2S=3S↓+2H2O,D错误;
6.C
A.AgCl沉淀溶于氨水生成[Ag(NH3)2]Cl,离子方程式为:AgCl+2NH3=[Ag(NH3)2]++Cl-,A正确;
B.将过量SO2通入冷氨水中生成NH4HSO3,故离子方程式为::,B正确;
C.铜锈的主要成分是Cu2(OH)2CO3而不是CuO,故用盐酸处理铜器表面的铜锈的反应方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,C错误;
D.已知酸性:HCl>H2CO3>HClO,故氯水中加入小苏打提高漂白性的离子方程式为:,D正确;
7.B
A.金属钠与氯化镁溶液反应时,钠先与水反应生成氢氧化钠和氢气,反应生成的氢氧化钠再与氯化镁溶液反应生成氯化钠和氢氧化镁沉淀,不能发生置换反应置换出镁,故A错误;
B.硫化锌与硫酸铜溶液反应生成溶解度小的硫化铜和硫酸锌,反应的离子方程式为,故B正确;
C.氯气与氢硫酸溶液反应生成硫沉淀和盐酸,反应的离子方程式为,故C错误;
D.草酸溶液与酸性高锰酸钾溶液反应生成硫酸钾、硫酸锰、二氧化碳和水,反应的离子方程式为,故D错误;
8.C
A.二氧化锰和浓盐酸在加热条件下生成氯气、氯化锰、水:,A正确;
B.乙中碳酸钠、氯气发生氧化还原反应生成氯化钠、,同时生成碳酸氢钠,发生反应2Na2CO3+H2O+2Cl22NaCl+2NaHCO3+Cl2O,B正确;
C.溶于水,同时与水发生反应生成弱酸次氯酸,,C错误;
D.氯气和氢氧化钠生成氯化钠、次氯酸钠和水,反应为,D正确;
9.B
A.向溶液中加入氨水,产生红褐色沉淀,一水合氨是弱电解质,不能拆写成离子:,A错误;
B.向甲醛中加入足量新制悬浊液,加热,产生砖红色沉淀,甲醛被氧化生成碳酸根:,B正确;
C.向饱和溶液中通入,产生白色沉淀:,C错误;
D.向溶液中通入,发生氧化还原反应,产生白色沉淀硫酸钡:,D错误;
10.D
A.向稀硝酸中滴加少量Na2SO3溶液,反应生成硫酸钠、NO和水,反应的离子方程式为:,选项A错误;
B.用食醋除去水垢中的CaCO3,反应生成醋酸钙、二氧化碳和水,反应的离子方程式为:,选项B错误;
C.用铁作电极电解饱和食盐水,生成氢氧化亚铁和氢气,反应的离子方程式为:,选项C错误;
D.向NaHCO3溶液中加入过量澄清石灰水,反应生成碳酸钙、氢氧化钠和水,反应的离子方程式为:,选项D正确;
11.C
A.明矾做净水剂的离子方程式为:,选项A错误;
B.用亚硫酸钠溶液吸收少量氯气,反应的离子方程式为:,选项B错误;
C.以金属银为阳极电解饱和NaCl溶液生成氯化银、氢气和氢氧化钠,反应的离子方程式为:,选项C正确;
D.用醋酸和淀粉溶液检验加碘食盐中所含的,反应的离子方程式为:,选项D错误;
12.D
A.在浓硫酸、加热条件下,和制备乙酸乙酯,酸脱羟基,醇脱氢,方程式应为:,A错误;
B.向硝酸钡溶液中通入:,B错误;
C.向溴的四氯化碳溶液中通入乙烯:,C错误;
D.在NaHSO3溶液中滴加少量NaClO溶液,次氯酸根将亚硫酸氢根氧化成硫酸根,方程式为:,D正确;
13.A
A.和足量稀硝酸反应:,A错误;
B.用溶液处理水垢中的,B正确;
C.将溶液滴入溶液中:,C正确;
D.用溶液除去乙炔中的少量杂质:,D正确;
14.C
A.铬酸钾在酸性条件下转化为具有强氧化性的,将盐酸氧化为氯气,,A错误;
B.溶液与过量氨水反应:,B错误;
C.氨水中一水合氨为弱碱,不能溶解氢氧化铝,所以向溶液中加入过量氨水:,C正确;
D.向溶液中加少量溶液:,D错误;
15.B
A.草酸是弱酸,不能拆写,用高锰酸钾溶液滴定草酸:,A错误;
B.电解饱和食盐水:,B正确;
C.硝酸具有强氧化性,能氧化硫代硫酸根离子,C错误;
D.将足量通入溶液中:,D错误;
16.(1) Ba2++OH-+H++=BaSO4↓+H2O 碱 Ba2++2OH-+2H++=BaSO4↓+2H2O 中 +Ba2+=BaSO4↓
(2) 3Ba2++3+2Al3++6OH-=3BaSO4↓+2Al(OH)3↓ +Al3++2+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
(1)①Ba(OH)2和NaHSO4按照1∶1反应,生成BaSO4沉淀、NaOH和水,离子方程式为Ba2++OH-+H++=BaSO4↓+H2O,溶液呈碱性。
②Ba(OH)2和NaHSO4按照1∶2反应,生成BaSO4沉淀、Na2SO4和水,离子方程式为Ba2++2OH-+2H++=BaSO4↓+2H2O,溶液呈中性;继续再加入Ba(OH)2溶液,Na2SO4和Ba(OH)2反应生成BaSO4沉淀和NaOH,离子方程式为+Ba2+=BaSO4↓。
(2)①NH4Al(SO4)2和Ba(OH)2按照1∶1反应,生成BaSO4沉淀、Al(OH)3沉淀和硫酸铝铵,离子方程式为3Ba2++3+2Al3++6OH-=3BaSO4↓+2Al(OH)3↓。
②NH4Al(SO4)2和Ba(OH)2按照1∶2反应,生成BaSO4沉淀、Al(OH)3沉淀和NH3·H2O,离子方程式为+Al3++2+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓。
17.(1) 复分解反应 SiO2
(2)
(3)“调pH=5”时,此时溶液中,可得,沉淀完全
(4) 80
(5)或
(1)“酸溶”时,Fe2O3发生Fe2O3+3H2SO4=Fe2(SO4)3+3H8O反应,属于复分解反应,SiO2不溶于硫酸,滤渣的主要成分是SiO2;
(2)加双氧水将Fe2+氧化成Fe3+,发生反应的离子方程式为:;
(3)常温下,“调pH”时,若过滤出沉淀后溶液的,,,沉淀完全;
(4)由图可知,浸出的最佳温度为80℃,温度过低,浸出率低,温度过高,Ta浸出率变化不大,但耗能增大;“调pH”后,溶液中溶质主要为NaTaO3,“浸钽”时生成H2TaF7和水,离子方程式:;
(5)沉钽”时通入氨气,生成了一水合氨,H2TaF7与NH3 H2O反应生成Ta(OH)5,反应化学方程式为:或。
18.(1)除去碳和有机物
(2)(或和NaOH)
(3) 将和还原为和(作还原剂)
(4)
(5)90%
(1)“550℃焙烧”高温条件下通过燃烧除去碳和有机物;
(2)氢氧化钠溶液溶解了氧化铝,“浸出液”的主要成分是(或和NaOH);
(3)Co2O3在酸性条件下将氯离子氧化为氯气、自身被还原为Co2+,离子方程式为;Na2SO3具有较强还原性将Co3+、Fe3+还原为Co2+、Fe2+;
(4)根据沉淀pH范围,控制pH是为了促使完全Fe3+沉淀,而Co2+、Mg2+不沉淀,因此滤渣1的主要成分是;双氧水将Fe2+氧化为Fe3+,酸性条件下的离子方程式为;
(5)控制溶液中,,则此时溶液中,则Ca2+的去除率为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
