1.6几种重要的盐
图片预览











文档简介
课件32张PPT。1.6 几种重要的盐一、什么是盐盐与食盐的区别:化学上的“盐”是一类物质(由金属离子和酸根
离子组成)的总称,
而“食盐”只是“盐”中的一种。工业用盐—亚硝酸钠(NaNO2)有毒,致癌。二、几种盐的性质1、碳酸钠(Na2CO3)俗称:纯碱、苏打⑴ 碳酸钠晶体(Na2CO3?10H2O)易风化常温下,在干燥的空气中,晶体失去部分或全部
结晶水的现象叫风化。风化属于化学变化。Na2CO3?10H2O = Na2CO3 + 10H2O⑵ 碳酸钠(Na2CO3)属于 类,其水溶液
呈 性。盐碱⑶ 含 CO32-或HCO3-的盐+酸=盐+H2O+CO2↑Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑NaHCO3 + HCl = NaCl + H2O + CO2↑(碳酸氢钠,俗称小苏打)⑷ 碳酸钠、碳酸氢钠的用途 碳酸钠:用于玻璃、造纸、纺织、洗涤剂、发面蒸馒头等。碳酸氢钠:用于制糕点、制饮料、医药、干粉灭火器等。2、碳酸钙(CaCO3)碳酸钙 →大理石、石灰石、汉白玉、水垢、鸡蛋壳
等的主要成分是碳酸钙。3、食盐(NaCl)⑴ 食盐主要存在于 、 、 和 。海洋盐湖盐井盐矿⑵ 用途:调味品、腌制食物、维持人的正常生
理活动、配制生理盐水(0.9%)、
重要的化工原料4、硫酸铜(CuSO4)⑴ 无水硫酸铜是一种 色 体,能溶于水,水溶液呈 色。从硫酸铜溶液里析出的晶体是 色,俗称 或 ,其化学式是 。⑵ 硫酸铜晶体与硫酸铜之间的转变CuSO4+5H2O = CuSO4·5H2O化学变化现象:(蓝色)(白色)白固蓝蓝蓝矾胆矾CuSO4?5H2O⑶ 硫酸铜的用途:它和熟石灰混合配制波尔多液CuSO4+Ca(OH)2 = Cu(OH)2↓+CaSO4写出下列物质的化学式及俗名:
化学名称 化学式 俗名:氯化钠
碳酸钠
硫酸铜
十水碳酸钠
五水硫酸铜
氢氧化钠
氢氧化钙
氧化钙
碳酸钙 NaCl Na2CO3CuSO4Na2CO3?10H2OCuSO4?5H20食 盐纯碱或苏打碳酸钠晶体 胆矾、蓝矾NaOHCa(OH)2熟石灰、消石灰CaO生石灰CaCO3石灰石、大理石火碱、烧碱、苛性钠三、盐的通性1、某些盐 + 酸 → 新盐 + 新酸练习:AgNO3 + ? == AgCl↓ + ?
? + BaCl2 == ? + 2HCl
CaCO3 + ? == Ca(NO3)2 + ? + ?
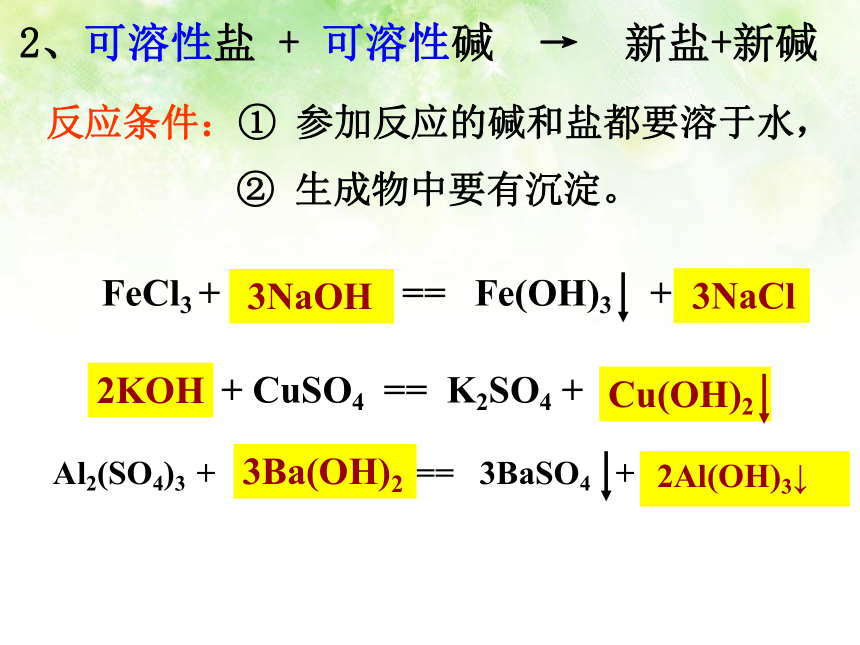
反应条件:生成物中要有沉淀或气体或水。HClHNO3H2SO42HNO3H2O2、可溶性盐 + 可溶性碱 → 新盐+新碱 3NaOH 2KOH反应条件:① 参加反应的碱和盐都要溶于水, 3NaCl ② 生成物中要有沉淀。3Ba(OH)2 2Al(OH)3↓ 3、可溶性盐 + 可溶性盐 → 新盐+新盐NaCl + ? = ? + NaNO3
Ba(NO3)2 + ? = ? + 2NaNO3
K2CO3 + ? = ? + 2KCl反应条件:① 参加反应的盐都要溶于水,② 生成物中要有沉淀。 AgNO3 AgCl↓ Na2SO4BaSO4↓CaCl2CaCO3↓有人误食氯化钡而引起中毒(可溶性的钡离子
被人体吸收会引起中毒),若及时服用硫酸钠
溶液则可以解毒,其原因是:
若及时服用碳酸钠溶液是否可以解毒?
(填“不能”或“能”)。
原因是: BaCl2 + Na2SO4 = BaSO4↓+ 2NaClBaCl2 + Na2CO3 = BaCO3↓+ 2NaClBaCO3+ 2HCl = BaCl2+ H2O+CO2↑不能演示实验:现象:铁丝表面覆盖
一层红色物质,
溶液由蓝色变
为浅绿色。铜丝表面覆盖
一层银白色物
质,溶液由无
色变为蓝色。无现象。化学方程式:Fe + CuSO4 = Cu + FeSO4Cu +Hg(NO3)2 = Hg + Cu(NO3)2Cu +NaCl — 不反应4、盐溶液+某些金属单质 → 新盐+新金属反应条件: 注:单质铁参加置换反应,只能生成亚铁盐②、金属活动顺序表中,前面的金属单质能将
后面的金属从它的盐溶液中置换出来。①、盐必须溶于水。盐的通性:⑴ 盐溶液+某些金属单质=新盐+新金属⑵ 某些盐 + 酸 = 新盐 + 新酸
反应条件:① 生成物中要有沉淀或气体或水⑶ 可溶性盐 + 可溶性碱= 新盐 + 新碱
反应条件:① 反应物都要溶于水
② 生成物中必须有沉淀⑷ 可溶性盐 +可溶性盐 = 新盐 + 新盐
反应条件:① 反应物都要溶于水
② 生成物中必须有沉淀下列反应能否进行,能的写出化学方程式,不能的说明理由。 1、ZnCO3 + HNO3 =
2、 KOH + MgSO4 =
3、NaCl + H2SO4 =
4、CuCl2 + AgNO3 =
5、Cu(OH)2 + BaCl2 =
6、 Ba(OH)2 + CuSO4 =
7、NaCl + KNO3 =
8、BaSO4 + AgNO3 =
9、FeSO4 + Ba(NO3)2 =
10、Zn + CuCl2 =
11、 Zn + AgCl =
12、 Ag + MgCl2 =×(生成物中没有↓、↑或水)×(Cu(OH)2不溶于水)×(生成物中没有↓、↑或水)Zn(NO3)2+H2O+CO2↑K2SO4+Mg(OH)2↓2AgCl↓+Cu(NO3)2BaSO4↓+Cu(OH)2↓BaSO4↓+Fe(NO3)2ZnCl2+Cu×(AgCl不溶于水)222×(BaSO4不溶于水)×(Ag在Mg的后面)四、盐的分类(按溶解性)盐可溶性盐不溶性盐(按所含阳离子或阴离子分)盐钾盐:KCl KNO3 K2SO4 等钠盐:镁盐:硝酸盐:碳酸盐:……….NaCl NaNO3 Na2SO4 等MgCl2 MgSO4 MgNO3 等KNO3 NaNO3 MgNO3 等K2CO3 Na2CO3 MgCO3 等溶碱钾钠钡钙铵大多酸溶水中间钾钠铵盐均易溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵硫酸盐微溶是银钙记忆规律: 可溶性盐:钾盐(含K+)、钠盐(含Na+)大部分碳酸盐如CaCO3、BaCO3、MgCO3等铵盐(含NH4+)、硝酸盐(含NO3-)硫酸钡BaSO4、 氯化银AgCI不可溶性盐:不溶性碱:如Fe(OH)3、Cu(OH)2、Mg(OH)2等可溶性碱:KOH 、NaOH 、Ba(OH)2
Ca(OH)2 、NH3.H2O根据溶解性口诀,判断下列物质的溶解性?1.ZnSO4: 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
11.BaCO3:_______ 12.Ba(OH)2:______溶溶溶溶溶溶溶溶不溶不溶不溶不溶制造化学肥料的原料是 。农业上主要施用的化学肥料是 。空气、水和矿物质氮肥、磷肥和钾肥㈠、氮肥
1、氮肥的作用:
2、常用的氮肥:
3、什么叫氮的固定?
4、哪一类植物无需或只需少量施用氮肥?能促使植物的茎、叶生长茂盛,
叶色浓绿。尿素[CO(NH2)2],氨水(NH3?H2O),
铵盐如NH4HCO3,硝酸盐如NH4NO3。将氮气转化为氮的化合物的方法。豆科类植物五、盐与化肥㈡、磷肥
1、磷肥的作用:
2、常用的磷肥:㈢、钾肥
1、钾肥的作用:
2、常用的钾肥:能促进植物根系发达,增强抗旱抗寒
能力,促进作物提早成熟,穗粒增多,
籽粒饱满。磷矿粉[Ca3(PO4)2],钙镁磷肥,
过磷酸钙[Ca(H2PO4)2和CaSO4]。能促进植物生长健壮,增强抗病虫害和
抗倒伏能力。K2SO4、KCl和草木灰(主要成份K2CO3)㈣、复合肥料:含有两种或两种以上营养元素的化肥。
如KNO3、KH2PO4、NH4H2PO4。㈤、农家肥:优点:营养元素种类全,肥效长,无污染。如何区分氮肥、磷肥和钾肥可燃烧,熔化
气泡或冒烟不燃烧,跳动
或有爆裂声放出具有刺激
性气味的氨气无具有刺激性
气味的气体㈥、铵根(NH4+)离子的检验取样品 ————试纸变蓝加适量碱产生刺激性气体 -——-——湿润的红色
石蕊试纸证明有NH3产生,即样品中有NH4+存在例1、能够鉴别NH4Cl,NaCl,(NH4)2SO4,Na2SO4
的一种试剂 。Ba(OH)22NH4Cl+Ba(OH)2 = BaCl2+2NH3↑+2H2ONaCl+Ba(OH)2 = 不反应(NH4)2SO4+Ba(OH)2 = BaSO4↓+2NH3↑+2H2ONa2SO4+Ba(OH)2 = BaSO4↓+2NaOH2、某溶液中含有Na+、H+、Cl-、SO42-,欲证明两种
阴离子确实存在,选用的最佳方案是:
先向溶液中滴加过量的 溶液至沉淀不再生成,再取上层清液滴加 溶液,又出现白色沉淀,则可得出结论。Ba(NO3)2AgNO33、下列各组离子能大量共存的是( )
A、H+、SO42-、OH-、Ba2+
B、 K+、Mg2+、NO3-、OH-
C、 H+、Na+、NO3-、CO32-
D、 Na+、K+、H+、SO42-D例4、如何用实验方法证明溶液中同时存在Cl-、
SO42-和CO32-?(1)加入过量稀硝酸;,(2)加入过量硝酸钡溶液、
(3)加入硝酸、(4)过滤、(5)加入硝酸银溶液5、已知某无色溶液里含有硫酸,则该溶液中还
可能含有的物质是( )
A、硫酸铜 B、碳酸钠
C、硫酸锌 D、氢氧化铜C溶液为蓝色与硫酸反应与硫酸反应无色,且与硫酸不反应6、在装有下列固体的烧杯中,加入过量的稀盐酸,
能得到澄清无色的溶液的是( )
A、AgNO3 B、Cu(OH)2
C、Mg D、Fe2O3C白色沉淀蓝色溶液黄色溶液无色溶液7、一种无色溶液能与氯化钡溶液反应,生成不溶
于稀硝酸的白色沉淀,则无色溶液( )
A、一定是稀硫酸 B、一定是硝酸银溶液
C、一定含有SO42- D、无法确定D8、检验某溶液是否呈酸性时,取少量溶液进行
如下实验,其中错误的做法是( )
A、滴入Na2CO3溶液 B、滴入紫色石蕊试液
C、加入锌粒 D、滴入NaOH溶液D有气泡产生紫色石蕊变红色有气泡产生无现象9、有一包白色粉末,可能含有KCl、CaCO3、K2CO3、Na2SO4、
无水CuSO4、CaCl2中的一种或几种,取该混合物做如下实验:
⑴加蒸馏水溶解后得到无色透明溶液;
⑵在该溶液中滴加BaCl2溶液,有白色沉淀生成;
⑶过滤后,在沉淀物里加入足量的稀HNO3,沉淀全部溶解并放
出无色气体;
⑷在滤液中加入硝酸银,生成不溶于稀硝酸的白色沉淀。
根据上述现象可知原混合物中一定有(用化学式表示)
,一定没有 ,可能有 。一定没有CaCO3(不溶)和CuSO4(溶液为蓝色),
CaCl2与K2CO3和Na2SO4不能同时存在(否则生成沉淀)。可能是BaCO3(不溶)或BaSO4(不溶)或
BaCO3(不溶)和BaSO4(不溶) ,白色沉淀是BaCO3(不溶)白色沉淀是AgCl(不溶),CaCO3、CuSO4、
Na2SO4、CaCl2Na2CO3KCl10、甲、乙两个相邻的化工厂,排放的污水虽经过处理
后,仍然各溶有以下8种离子(Ag+、Ba2+、Fe3+、Na+、
Cl-、SO42-、NO3-、OH-)中的各不相同的4种离子,若各
自单独排放污水将造成环境污染。如果将甲、乙两厂的
污水按适当比例充分混合,经再沉淀后,排放出的污水
转变为无色澄清的硝酸钠稀溶液,污染程度大为降低,
又经测定甲厂污水的PH值大于7。试推断:
⑴ 甲厂污水中含有的四种离子是 ,
⑵乙厂污水中含有的四种离子是 。OH-、Ag+、Fe3+、Cl-、SO42-、Ba2+、Na+、NO3-、
11.有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、
硫酸钠和硝酸钾中的某几种组成。为了鉴定其成分,实验如下:
(1)将少量粉末放入足量水中,搅拌、静置、过滤、得白色沉淀
和无色滤液。
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生。
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,
沉淀不溶解。
试根据以上现象推断该白色粉末中一定含有?? ????????????????????;
一定没有??????????????????????? ;可能含有???????????????。(填化学式)白色沉淀可能是AgCl、Mg(OH)2、BaCO3、BaSO4白色沉淀不是AgCl、BaCO3、BaSO4 ,是Mg(OH)2白色沉淀是AgCl,滤液中一定有Cl-,BaCl2和Mg(OH)2AgCl、Na2CO3、Na2SO4KNO3原混合物中BaCl2与Na2CO3、BaCl2与Na2SO4不能同时存在则原混合物中一定有BaCl2,一定没有Na2CO3和Na2SO4
离子组成)的总称,
而“食盐”只是“盐”中的一种。工业用盐—亚硝酸钠(NaNO2)有毒,致癌。二、几种盐的性质1、碳酸钠(Na2CO3)俗称:纯碱、苏打⑴ 碳酸钠晶体(Na2CO3?10H2O)易风化常温下,在干燥的空气中,晶体失去部分或全部
结晶水的现象叫风化。风化属于化学变化。Na2CO3?10H2O = Na2CO3 + 10H2O⑵ 碳酸钠(Na2CO3)属于 类,其水溶液
呈 性。盐碱⑶ 含 CO32-或HCO3-的盐+酸=盐+H2O+CO2↑Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑NaHCO3 + HCl = NaCl + H2O + CO2↑(碳酸氢钠,俗称小苏打)⑷ 碳酸钠、碳酸氢钠的用途 碳酸钠:用于玻璃、造纸、纺织、洗涤剂、发面蒸馒头等。碳酸氢钠:用于制糕点、制饮料、医药、干粉灭火器等。2、碳酸钙(CaCO3)碳酸钙 →大理石、石灰石、汉白玉、水垢、鸡蛋壳
等的主要成分是碳酸钙。3、食盐(NaCl)⑴ 食盐主要存在于 、 、 和 。海洋盐湖盐井盐矿⑵ 用途:调味品、腌制食物、维持人的正常生
理活动、配制生理盐水(0.9%)、
重要的化工原料4、硫酸铜(CuSO4)⑴ 无水硫酸铜是一种 色 体,能溶于水,水溶液呈 色。从硫酸铜溶液里析出的晶体是 色,俗称 或 ,其化学式是 。⑵ 硫酸铜晶体与硫酸铜之间的转变CuSO4+5H2O = CuSO4·5H2O化学变化现象:(蓝色)(白色)白固蓝蓝蓝矾胆矾CuSO4?5H2O⑶ 硫酸铜的用途:它和熟石灰混合配制波尔多液CuSO4+Ca(OH)2 = Cu(OH)2↓+CaSO4写出下列物质的化学式及俗名:
化学名称 化学式 俗名:氯化钠
碳酸钠
硫酸铜
十水碳酸钠
五水硫酸铜
氢氧化钠
氢氧化钙
氧化钙
碳酸钙 NaCl Na2CO3CuSO4Na2CO3?10H2OCuSO4?5H20食 盐纯碱或苏打碳酸钠晶体 胆矾、蓝矾NaOHCa(OH)2熟石灰、消石灰CaO生石灰CaCO3石灰石、大理石火碱、烧碱、苛性钠三、盐的通性1、某些盐 + 酸 → 新盐 + 新酸练习:AgNO3 + ? == AgCl↓ + ?
? + BaCl2 == ? + 2HCl
CaCO3 + ? == Ca(NO3)2 + ? + ?
反应条件:生成物中要有沉淀或气体或水。HClHNO3H2SO42HNO3H2O2、可溶性盐 + 可溶性碱 → 新盐+新碱 3NaOH 2KOH反应条件:① 参加反应的碱和盐都要溶于水, 3NaCl ② 生成物中要有沉淀。3Ba(OH)2 2Al(OH)3↓ 3、可溶性盐 + 可溶性盐 → 新盐+新盐NaCl + ? = ? + NaNO3
Ba(NO3)2 + ? = ? + 2NaNO3
K2CO3 + ? = ? + 2KCl反应条件:① 参加反应的盐都要溶于水,② 生成物中要有沉淀。 AgNO3 AgCl↓ Na2SO4BaSO4↓CaCl2CaCO3↓有人误食氯化钡而引起中毒(可溶性的钡离子
被人体吸收会引起中毒),若及时服用硫酸钠
溶液则可以解毒,其原因是:
若及时服用碳酸钠溶液是否可以解毒?
(填“不能”或“能”)。
原因是: BaCl2 + Na2SO4 = BaSO4↓+ 2NaClBaCl2 + Na2CO3 = BaCO3↓+ 2NaClBaCO3+ 2HCl = BaCl2+ H2O+CO2↑不能演示实验:现象:铁丝表面覆盖
一层红色物质,
溶液由蓝色变
为浅绿色。铜丝表面覆盖
一层银白色物
质,溶液由无
色变为蓝色。无现象。化学方程式:Fe + CuSO4 = Cu + FeSO4Cu +Hg(NO3)2 = Hg + Cu(NO3)2Cu +NaCl — 不反应4、盐溶液+某些金属单质 → 新盐+新金属反应条件: 注:单质铁参加置换反应,只能生成亚铁盐②、金属活动顺序表中,前面的金属单质能将
后面的金属从它的盐溶液中置换出来。①、盐必须溶于水。盐的通性:⑴ 盐溶液+某些金属单质=新盐+新金属⑵ 某些盐 + 酸 = 新盐 + 新酸
反应条件:① 生成物中要有沉淀或气体或水⑶ 可溶性盐 + 可溶性碱= 新盐 + 新碱
反应条件:① 反应物都要溶于水
② 生成物中必须有沉淀⑷ 可溶性盐 +可溶性盐 = 新盐 + 新盐
反应条件:① 反应物都要溶于水
② 生成物中必须有沉淀下列反应能否进行,能的写出化学方程式,不能的说明理由。 1、ZnCO3 + HNO3 =
2、 KOH + MgSO4 =
3、NaCl + H2SO4 =
4、CuCl2 + AgNO3 =
5、Cu(OH)2 + BaCl2 =
6、 Ba(OH)2 + CuSO4 =
7、NaCl + KNO3 =
8、BaSO4 + AgNO3 =
9、FeSO4 + Ba(NO3)2 =
10、Zn + CuCl2 =
11、 Zn + AgCl =
12、 Ag + MgCl2 =×(生成物中没有↓、↑或水)×(Cu(OH)2不溶于水)×(生成物中没有↓、↑或水)Zn(NO3)2+H2O+CO2↑K2SO4+Mg(OH)2↓2AgCl↓+Cu(NO3)2BaSO4↓+Cu(OH)2↓BaSO4↓+Fe(NO3)2ZnCl2+Cu×(AgCl不溶于水)222×(BaSO4不溶于水)×(Ag在Mg的后面)四、盐的分类(按溶解性)盐可溶性盐不溶性盐(按所含阳离子或阴离子分)盐钾盐:KCl KNO3 K2SO4 等钠盐:镁盐:硝酸盐:碳酸盐:……….NaCl NaNO3 Na2SO4 等MgCl2 MgSO4 MgNO3 等KNO3 NaNO3 MgNO3 等K2CO3 Na2CO3 MgCO3 等溶碱钾钠钡钙铵大多酸溶水中间钾钠铵盐均易溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵硫酸盐微溶是银钙记忆规律: 可溶性盐:钾盐(含K+)、钠盐(含Na+)大部分碳酸盐如CaCO3、BaCO3、MgCO3等铵盐(含NH4+)、硝酸盐(含NO3-)硫酸钡BaSO4、 氯化银AgCI不可溶性盐:不溶性碱:如Fe(OH)3、Cu(OH)2、Mg(OH)2等可溶性碱:KOH 、NaOH 、Ba(OH)2
Ca(OH)2 、NH3.H2O根据溶解性口诀,判断下列物质的溶解性?1.ZnSO4: 2.AgCl:________
3.NaNO3:________ 4.K2CO3:________
5.BaSO4:________ 6.BaCl2:________
7.CaCO3:________ 8.Na2CO3:_______
9.CuCl2:________ 10.AgNO3:_______
11.BaCO3:_______ 12.Ba(OH)2:______溶溶溶溶溶溶溶溶不溶不溶不溶不溶制造化学肥料的原料是 。农业上主要施用的化学肥料是 。空气、水和矿物质氮肥、磷肥和钾肥㈠、氮肥
1、氮肥的作用:
2、常用的氮肥:
3、什么叫氮的固定?
4、哪一类植物无需或只需少量施用氮肥?能促使植物的茎、叶生长茂盛,
叶色浓绿。尿素[CO(NH2)2],氨水(NH3?H2O),
铵盐如NH4HCO3,硝酸盐如NH4NO3。将氮气转化为氮的化合物的方法。豆科类植物五、盐与化肥㈡、磷肥
1、磷肥的作用:
2、常用的磷肥:㈢、钾肥
1、钾肥的作用:
2、常用的钾肥:能促进植物根系发达,增强抗旱抗寒
能力,促进作物提早成熟,穗粒增多,
籽粒饱满。磷矿粉[Ca3(PO4)2],钙镁磷肥,
过磷酸钙[Ca(H2PO4)2和CaSO4]。能促进植物生长健壮,增强抗病虫害和
抗倒伏能力。K2SO4、KCl和草木灰(主要成份K2CO3)㈣、复合肥料:含有两种或两种以上营养元素的化肥。
如KNO3、KH2PO4、NH4H2PO4。㈤、农家肥:优点:营养元素种类全,肥效长,无污染。如何区分氮肥、磷肥和钾肥可燃烧,熔化
气泡或冒烟不燃烧,跳动
或有爆裂声放出具有刺激
性气味的氨气无具有刺激性
气味的气体㈥、铵根(NH4+)离子的检验取样品 ————试纸变蓝加适量碱产生刺激性气体 -——-——湿润的红色
石蕊试纸证明有NH3产生,即样品中有NH4+存在例1、能够鉴别NH4Cl,NaCl,(NH4)2SO4,Na2SO4
的一种试剂 。Ba(OH)22NH4Cl+Ba(OH)2 = BaCl2+2NH3↑+2H2ONaCl+Ba(OH)2 = 不反应(NH4)2SO4+Ba(OH)2 = BaSO4↓+2NH3↑+2H2ONa2SO4+Ba(OH)2 = BaSO4↓+2NaOH2、某溶液中含有Na+、H+、Cl-、SO42-,欲证明两种
阴离子确实存在,选用的最佳方案是:
先向溶液中滴加过量的 溶液至沉淀不再生成,再取上层清液滴加 溶液,又出现白色沉淀,则可得出结论。Ba(NO3)2AgNO33、下列各组离子能大量共存的是( )
A、H+、SO42-、OH-、Ba2+
B、 K+、Mg2+、NO3-、OH-
C、 H+、Na+、NO3-、CO32-
D、 Na+、K+、H+、SO42-D例4、如何用实验方法证明溶液中同时存在Cl-、
SO42-和CO32-?(1)加入过量稀硝酸;,(2)加入过量硝酸钡溶液、
(3)加入硝酸、(4)过滤、(5)加入硝酸银溶液5、已知某无色溶液里含有硫酸,则该溶液中还
可能含有的物质是( )
A、硫酸铜 B、碳酸钠
C、硫酸锌 D、氢氧化铜C溶液为蓝色与硫酸反应与硫酸反应无色,且与硫酸不反应6、在装有下列固体的烧杯中,加入过量的稀盐酸,
能得到澄清无色的溶液的是( )
A、AgNO3 B、Cu(OH)2
C、Mg D、Fe2O3C白色沉淀蓝色溶液黄色溶液无色溶液7、一种无色溶液能与氯化钡溶液反应,生成不溶
于稀硝酸的白色沉淀,则无色溶液( )
A、一定是稀硫酸 B、一定是硝酸银溶液
C、一定含有SO42- D、无法确定D8、检验某溶液是否呈酸性时,取少量溶液进行
如下实验,其中错误的做法是( )
A、滴入Na2CO3溶液 B、滴入紫色石蕊试液
C、加入锌粒 D、滴入NaOH溶液D有气泡产生紫色石蕊变红色有气泡产生无现象9、有一包白色粉末,可能含有KCl、CaCO3、K2CO3、Na2SO4、
无水CuSO4、CaCl2中的一种或几种,取该混合物做如下实验:
⑴加蒸馏水溶解后得到无色透明溶液;
⑵在该溶液中滴加BaCl2溶液,有白色沉淀生成;
⑶过滤后,在沉淀物里加入足量的稀HNO3,沉淀全部溶解并放
出无色气体;
⑷在滤液中加入硝酸银,生成不溶于稀硝酸的白色沉淀。
根据上述现象可知原混合物中一定有(用化学式表示)
,一定没有 ,可能有 。一定没有CaCO3(不溶)和CuSO4(溶液为蓝色),
CaCl2与K2CO3和Na2SO4不能同时存在(否则生成沉淀)。可能是BaCO3(不溶)或BaSO4(不溶)或
BaCO3(不溶)和BaSO4(不溶) ,白色沉淀是BaCO3(不溶)白色沉淀是AgCl(不溶),CaCO3、CuSO4、
Na2SO4、CaCl2Na2CO3KCl10、甲、乙两个相邻的化工厂,排放的污水虽经过处理
后,仍然各溶有以下8种离子(Ag+、Ba2+、Fe3+、Na+、
Cl-、SO42-、NO3-、OH-)中的各不相同的4种离子,若各
自单独排放污水将造成环境污染。如果将甲、乙两厂的
污水按适当比例充分混合,经再沉淀后,排放出的污水
转变为无色澄清的硝酸钠稀溶液,污染程度大为降低,
又经测定甲厂污水的PH值大于7。试推断:
⑴ 甲厂污水中含有的四种离子是 ,
⑵乙厂污水中含有的四种离子是 。OH-、Ag+、Fe3+、Cl-、SO42-、Ba2+、Na+、NO3-、
11.有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、
硫酸钠和硝酸钾中的某几种组成。为了鉴定其成分,实验如下:
(1)将少量粉末放入足量水中,搅拌、静置、过滤、得白色沉淀
和无色滤液。
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生。
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,
沉淀不溶解。
试根据以上现象推断该白色粉末中一定含有?? ????????????????????;
一定没有??????????????????????? ;可能含有???????????????。(填化学式)白色沉淀可能是AgCl、Mg(OH)2、BaCO3、BaSO4白色沉淀不是AgCl、BaCO3、BaSO4 ,是Mg(OH)2白色沉淀是AgCl,滤液中一定有Cl-,BaCl2和Mg(OH)2AgCl、Na2CO3、Na2SO4KNO3原混合物中BaCl2与Na2CO3、BaCl2与Na2SO4不能同时存在则原混合物中一定有BaCl2,一定没有Na2CO3和Na2SO4
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
