2024-2025学年北京一六一中高三(上)期中化学(PDF版,含答案)
文档属性
| 名称 | 2024-2025学年北京一六一中高三(上)期中化学(PDF版,含答案) |

|
|
| 格式 | |||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-07 22:09:55 | ||
图片预览




文档简介
2024北京一六一中高三(上)期中
化 学
班级 姓名 学号
考 1.本试卷共 5 页,满分 100 分,考试时长 90 分钟。
生 2.试题答案一律书写在答题纸上,在试卷上作答无效。
须 3.在答题纸上,选择题用 2B 铅笔作答,非选择题用黑色字迹签字笔作答。
知 4.考试结束后,将答题纸、试卷和草稿纸一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 S 32 Cl 35.5 Fe 56
Zn 65 Cu 64 I 127 Al 27 B 11 Ca 40 Mn 55
一、 选择题:本大题共 14 道小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项符合题
目的要求。把.正.确.答.案.涂.写.在.答.题.卡.上.相.应.的.位.置.。
1. 我国科学家提出了高强度人造蚕丝的制备方法,用表面活性剂 C12H25OSO3Na 和 Na2CO3 溶液使丝胶蛋
白水解,然后将浓缩的丝素蛋白挤入含 Zn2+和 Fe3+的溶液中凝固成纤维。
下列说法不.正.确.的是
A.含 Na+或 Zn2+的盐溶液均能使蛋白质变性
B.丝胶蛋白水解时酰胺基中 C-N 发生了断裂
C.C12H25OSO3Na 中既含有亲水基团又含有疏水基团
D. Na2CO3溶液显碱性的原因:
CO2― ― 3 + H2O HCO3 + OH
2. 下列化学用语或图示表达不.正.确.的是
A. HCHO分子的空间结构模型为
B. MgCl2的电子式:
C.乙烯分子中 π 键的形成过程:
D.邻羟基苯甲醛分子内形成的氢键:
3. 下列过程中没.有.发生酯化反应或酯的水解反应的是
A. 核苷酸聚合生成核酸 B. 氨基酸缩合生成多肽
C. 油脂在碱性溶液中反应制取肥皂 D. 纤维素和乙酸反应制取纤维素乙酸酯
4. 下列比较正确的是
A.热稳定性:NH3 > PH3 > HF B.键角:CH4 < NH3 < H2O
第1页/共8页
C.离子半径:S2- > Cl- > K+ D.酸性:HNO3 < H3PO4 < H2SiO3
5. 下列反应不.属.于.氧化还原反应的是
A.铜丝加热后,伸入无水乙醇中,先变黑,后重新变为红色
B.向 FeSO4溶液中加入 NaClO 溶液,产生红褐色沉淀
C.将 SO2通入到 Ba(NO3)2溶液中,生成白色沉淀
D.向硝酸银溶液中加入氨水至过量,产生沉淀又消失
6. 室温下,1 体积的水能溶解约 2 体积的 Cl2。用试管收集 Cl2后进行如图所示实验,下列对实验现象的分
析或预测正确的是
A.试管内液面上升,证明 Cl2与水发生了反应
B.取出试管中的溶液,加入少量 CaCO3粉末,溶液漂白能力减弱
C.取出试管中的溶液,光照一段时间后 光照 pH 下降,与反应 2HClO == 2HCl + O2↑有关
D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色
7. 我国科学家最新合成出一种聚醚酯(PM)新型材料,合成方法如下:
下列说法不.正.确.的是
A.M 分子中含有 2 个手性碳原子
B.M 在碱性条件下水解开环得到
C.PM 中含有酯基、醚键和羟基三种官能团
D.合成 1mol PM,理论上需要 n mol M 和 1mol 苯甲醇
8. 下列所给事实对应离子方程式书写不.正.确.的是
A.C 和浓 H2SO4反应:C + 2H2SO4(浓) =△== CO2↑+ 2SO2↑+ 2H2O
B. 用石灰乳吸收泄漏的氯气: 2Ca(OH)2 + 2Cl2 === CaCl2 + Ca(ClO)2 + 2H2O
C. Ca(OH)2溶液与少量的
―
NaHCO3溶液反应:HCO3 + Ca2+ + OH == CaCO3↓+ H2O
D. 钢铁发生吸氧腐蚀时铁做负极:Fe—3e— == Fe3+
9. NA为阿伏加德罗常数,下列说法正.确.的是
A.0.1 mol 氨基(—NH2)中含有 NA个质子
B.14 g 乙烯和丙烯的混合气体中所含碳氢键数为 2 NA
-
C.1.0 mol·L 1AlCl3溶液中,Cl-数目为 3 NA
D.22.4 L(标准状况)Cl2与足量 NaOH 溶液充分反应,电子转移数为 2 NA
10. 下列实验的对应操作中,不.合.理.的是
第2页/共8页
A.用 HCl 标准溶液 C.从提纯后的 NaCl D.配制一定物质的
B.稀释浓硫酸
滴定 NaOH 溶液 溶液获得 NaCl 晶体 量浓度的 KCl 溶液
11. 硫化氢的转化是资源利用和环境保护的重要研究课题。将 H2S 和空气的混合气体通入 FeCl3、FeCl2 和
CuCl2的混合溶液中回收 S,其转化如图所示。
下列说法不.正.确.的是
A.过程①生成了 HCl,说明酸性:H2S> HCl
B.过程②,每溶解 1mol CuS,转移 2mol e-
C.过程③,溶液的 pH 增大
D. 回收 S 的总反应为 2H 催化剂 2S + O2 ==== 2H2O + 2S↓
12. 新型 Li-Mg 双离子可充电电池是一种高效、低成本的储能电池,其装置示意图如下。当闭合 K2 时,该
电池的工作原理为 xMg + xLi2SO4 + 2Li1-xFePO4 = xMgSO4 + 2LiFePO4
下列关于该电池的说法正.确.的是
A.放电时,电子从 N 电极经导线流向 M 电极
B.充电时,外加直流电源的正极与 M 电极相连
C.放电时,正极的电极反应式:Li1-xFePO4 + xLi+ + xe- === LiFePO4
D.充电时,电路中每通过 1 mol e-,左室溶液增加 2 mol Li+
13. 化合物 K 与 L 反应可合成药物中间体 M,转化关系如下:
第3页/共8页
已知 L 能发生银镜反应,下列说法不.正.确.的是
A.K、M 分子中碳原子的杂化方式均有 sp3和 sp2
B.在水中的溶解度:K > M
C.L 为乙醛
D.生成物 M 与 H2O 的化学计量数之比为 1:1
14. 实验小组探究浓度对 FeSO4溶液与 AgNO3溶液反应的影响。实验如下:
试剂
沉淀物质的量之比
编 试剂 X 试剂 Y
实验 n(Ag2SO4)
号 c(AgNO )/mol·L-3
c(FeSO )/mol·L-14 n(Ag)
1
i 0.04 0.04 a
ii 0.1 0.1 0.15
iii 0.5 0.5 0.19
iv 1.0 1.0 0.26
已知:① K -5sp(Ag2SO4) = 1.2×10 。
② 取 i~iv 充分反应后的上层清液,滴加浓盐酸均产生白色沉淀;滴加 K3[Fe(CN)6]溶液均产生
蓝色沉淀。
下列说法不.正.确.的是
A.分析 i 中数据可知:a = 0
B.ii 中沉淀加适量浓氨水充分反应,取上层清液滴加 Ba(NO3)2溶液,产生白色沉淀
C.取 iii 中充分反应后的上层清液,滴加 K3[Fe(CN)6]溶液产生蓝色沉淀,可以作为 Fe2+ + Ag+ Ag +
Fe3+为可逆反应的证据
D.本实验中反应物浓度增大,对复分解反应的影响比对氧化还原反应的影响更大
二、非选择题:本大题共 5 小题,共 58 分。把.答.案.填.在.答.题.纸.中.相.应.的.横.线.上.。
15.(10 分)氧族元素 Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中 SeSO 2- 可看作是 SO 2-3 4 中的一个 O 原子被 Se 原子取代的产物)在某
些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
① 基态 Se 原子的价层电子排布式是______ 按照核外电子排布,可把元素周期表划分为 5 个区,Se
位于元素周期表 区
第4页/共8页
② SeSO 2-3 的空间结构是 ,基态 O 原子中处于最高能级的电子的运动状态共有___个。
③ 过程 ii 中 SeSO 2-3 一定断裂的化学键是 。
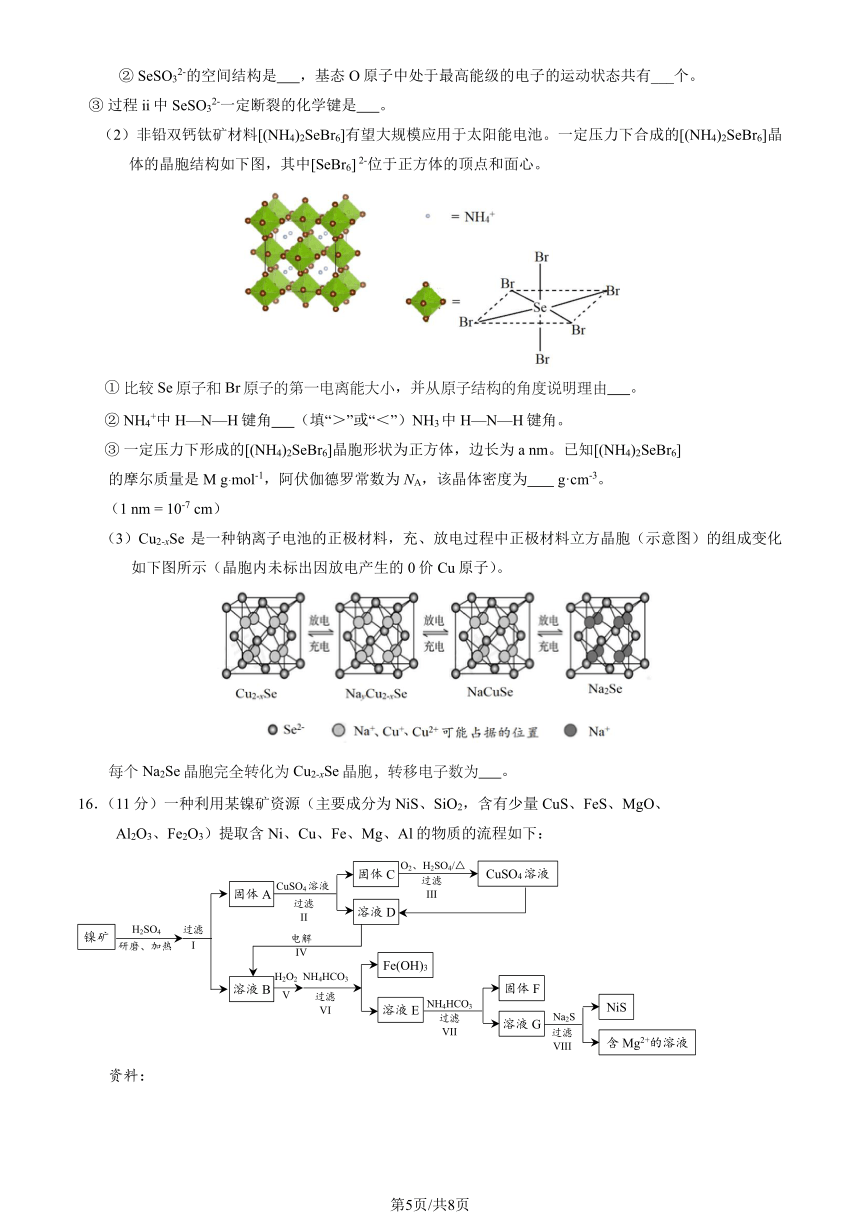
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶
体的晶胞结构如下图,其中[SeBr6] 2-位于正方体的顶点和面心。
① 比较 Se原子和 Br原子的第一电离能大小,并从原子结构的角度说明理由 。
② NH +4 中 H—N—H 键角 (填“>”或“<”)NH3中 H—N—H 键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为 a nm。已知[(NH4)2SeBr6]
的摩尔质量是 M g mol-1,阿伏伽德罗常数为 N ,该晶体密度为 g·cm-3· A 。
(1 nm = 10-7 cm)
(3)Cu2-xSe 是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化
如下图所示(晶胞内未标出因放电产生的 0 价 Cu 原子)。
每个 Na2Se晶胞完全转化为 Cu2-xSe晶胞,转移电子数为 。
16.(11 分)一种利用某镍矿资源(主要成分为 NiS、SiO2,含有少量 CuS、FeS、MgO、
Al2O3、Fe2O3)提取含 Ni、Cu、Fe、Mg、Al 的物质的流程如下:
O2、H2SO4/△
固体 C CuSO4溶液
CuSO4溶液
过滤
固体 A III
过滤
II 溶液 D
H2SO4 过滤
镍矿 电解
研磨、加热 I
IV
Fe(OH)3
H2O2 NH4HCO3
溶液 B 固体 F V 过滤
NH
溶液 E 4
HCO3
VI NiS
过滤 Na2S
溶液 G
VII 过滤
2+
VIII 含 Mg 的溶液
资料:
第5页/共8页
i.25°C 时,一些物质的 Ksp如下:
物质 CuS NiS FeS Al(OH)3 Fe(OH)3 Fe(OH)2
Ksp 6.3×10-36 2.0×10-26 6.3×10-18 4.6×10-33 4.0×10-38 8.0×10-16
ii.溶液中离子浓度≤10-5 mol·L 1时认为该离子沉淀完全。
(1)流程中能加快反应速率的措施有
(2)固体 A 中还有少量酸浸后剩余的 NiS,II 中反应的离子方程式为
-
(3)III 中,生成 1 mol CuSO4转移 8 mol e ,III 中反应的化学方程式为
III 过滤后得到的固体残渣中含有的物质是
(4)IV 可以除去溶液 D 中的 Cu2+,由此推测氧化性 Cu2+ Ni2+(填“>”或 “<”)。
(5)结合离子方程式解释 V 中加入 H2O2的作用:
(6)为了使 Fe3+沉淀完全,VI 中溶液 pH 的最小值所属范围为 (填字母)。
a.2~3 b.3~4 c.9~10 d.10~11
(7)VI 中,NH4HCO3不宜多加,结合化学用语解释原因
17.(12 分)化合物 K 有抗高血压活性,其合成路线如下。
已知:
(1)A 为芳香族化合物,A 的名称是______。
(2)B→D 的化学方程式是______。
(3)G 的结构简式是______。
(4)E 属于酯,E 的结构简式是______。
(5)K 中能与 NaOH 溶液反应的官能团有______。
a.碳碳双键 b.酯基 c.酰胺基
(6)D 也可由间硝基甲苯通过电解法制得,主要物质转化关系如下。
第6页/共8页
已知:电解效率 η 的定义: (n 生成P所用电子) (P)= 100%
(n 通过电极的电子)
① Ⅱ中,生成 Q 的离子方程式是______。
② 若电解产生的 Ce(OH)3+使间硝基甲苯通过两步氧化完全转化为 D,当电极
通过 1 mol e ,生成 a mol D 时,η(D)=______。
(7)以 D、F 和 CO(NH2)2为原料,“一锅法”合成 G 的转化过程如下。
M 的结构简式是______,M→N 的反应类型是______。
18.(13 分)KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分 MnO2)粉碎后,与 KOH 固体混合,通入空气充分焙烧,生成暗绿色熔融态
物质。
Ⅱ.冷却,将固体研细,用稀 KOH 溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入 CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得 KMnO4固体。
资料:K2MnO4 为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn 的
化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是________。
(2)Ⅰ中,生成 K2MnO4的化学方程式是________。
(3)Ⅱ中,浸取时用稀 KOH 溶液的原因是________。
(4)Ⅲ中,CO2和 K2MnO4在溶液中反应的化学方程式是________。
(5)将 K2MnO4溶液采用惰性电极隔膜法电解,也可制得 KMnO4。装置如下图:
① b 极是______极(填“阳”或“阴”),D 是________。
② 结合电极反应式简述生成 KMnO4的原理:________。
③ 传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,
其原因是________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 + H2SO4 == H2C2O4 + Na2SO4
5H + 2+ 2C2O4 + 2MnO4 + 6H == 2Mn + 10CO2↑+ 8H2O
摩尔质量:Na C O 1 12 2 4 134 g·mol KMnO4 158 g·mol
ⅰ.称取 a g 产品,配成 50 mL 溶液。
第7页/共8页
ⅱ.称取 b g Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到 75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液 V mL
(杂质不参与反应)。
产品中 KMnO4的质量分数的表达式为________。
.( 2― ― 2― 19 12 分)资料显示,酸性介质中,S 2+2O8 和 Mn 可反应转化为 MnO4 和 SO4 。某小组探究利用该反应
测定 Mn2+含量的适宜条件。
实验 序号 物质a 实验现象
0.002 mol/L
Ⅰ 无明显现象
MnSO4溶液
0.002 mol/L
Ⅱ 加热至沸腾,5 min后溶液变为紫色
MnSO4溶液
0.05 mol/L 加热至沸腾,生成大量棕黑色沉
Ⅲ
MnSO4溶液 淀,静置,上层溶液未变紫色
(1)根据实验Ⅱ的现象,氧化性:S O2― 2 8 ______ MnO
―
4 (填“>”或“<”)。
(2)实验Ⅱ中反应的离子方程式是______。
(3)实验Ⅰ的条件下 S 2― 2O8 能将 Mn2+氧化为 MnO
―
4 ,推测实验Ⅰ未出现紫色的原因:______。
(4)经检验,棕黑色沉淀为MnO2,针对实验Ⅲ中的现象,提出以下假设:
假设1:S2O
2― 的浓度较低,不足以将Mn2+8 氧化为MnO
―
4
假设2:溶液中存在还原剂Mn2+,将生成的MnO― 4 还原为MnO2
① 甲同学分析上述实验设计,认为假设1不成立,理由是______。
② 针对假设2,乙同学设计实验Ⅳ证实了推测合理。
请写出实验操作和现象:______。
③ 实验Ⅲ 中生成MnO2的离子方程式是______,
从化学反应速率的角度分析实验Ⅲ 未得到紫色溶液的原因:______。
(5)资料表明 Ag+可作为 Mn2+和 S O2― 2 8 反应转化为 MnO
―
4 的催化剂。丙同学设计实验Ⅲ的对比实验进行了
证实。向______中滴加 2 滴 0.1 mol/L AgNO3溶液,再加入 0.0005 mol (NH4)2S2O8固体,加热至沸腾,
观察到溶液变为紫色。
(6)根据上述实验,要利用(NH4) S 2+
―
2 2O8 将 Mn 转化为 MnO4 的反应来快速测定 Mn2+的含量,应控制的反
应适宜条件有:加热至沸腾、______。
第8页/共8页
化 学
班级 姓名 学号
考 1.本试卷共 5 页,满分 100 分,考试时长 90 分钟。
生 2.试题答案一律书写在答题纸上,在试卷上作答无效。
须 3.在答题纸上,选择题用 2B 铅笔作答,非选择题用黑色字迹签字笔作答。
知 4.考试结束后,将答题纸、试卷和草稿纸一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 S 32 Cl 35.5 Fe 56
Zn 65 Cu 64 I 127 Al 27 B 11 Ca 40 Mn 55
一、 选择题:本大题共 14 道小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项符合题
目的要求。把.正.确.答.案.涂.写.在.答.题.卡.上.相.应.的.位.置.。
1. 我国科学家提出了高强度人造蚕丝的制备方法,用表面活性剂 C12H25OSO3Na 和 Na2CO3 溶液使丝胶蛋
白水解,然后将浓缩的丝素蛋白挤入含 Zn2+和 Fe3+的溶液中凝固成纤维。
下列说法不.正.确.的是
A.含 Na+或 Zn2+的盐溶液均能使蛋白质变性
B.丝胶蛋白水解时酰胺基中 C-N 发生了断裂
C.C12H25OSO3Na 中既含有亲水基团又含有疏水基团
D. Na2CO3溶液显碱性的原因:
CO2― ― 3 + H2O HCO3 + OH
2. 下列化学用语或图示表达不.正.确.的是
A. HCHO分子的空间结构模型为
B. MgCl2的电子式:
C.乙烯分子中 π 键的形成过程:
D.邻羟基苯甲醛分子内形成的氢键:
3. 下列过程中没.有.发生酯化反应或酯的水解反应的是
A. 核苷酸聚合生成核酸 B. 氨基酸缩合生成多肽
C. 油脂在碱性溶液中反应制取肥皂 D. 纤维素和乙酸反应制取纤维素乙酸酯
4. 下列比较正确的是
A.热稳定性:NH3 > PH3 > HF B.键角:CH4 < NH3 < H2O
第1页/共8页
C.离子半径:S2- > Cl- > K+ D.酸性:HNO3 < H3PO4 < H2SiO3
5. 下列反应不.属.于.氧化还原反应的是
A.铜丝加热后,伸入无水乙醇中,先变黑,后重新变为红色
B.向 FeSO4溶液中加入 NaClO 溶液,产生红褐色沉淀
C.将 SO2通入到 Ba(NO3)2溶液中,生成白色沉淀
D.向硝酸银溶液中加入氨水至过量,产生沉淀又消失
6. 室温下,1 体积的水能溶解约 2 体积的 Cl2。用试管收集 Cl2后进行如图所示实验,下列对实验现象的分
析或预测正确的是
A.试管内液面上升,证明 Cl2与水发生了反应
B.取出试管中的溶液,加入少量 CaCO3粉末,溶液漂白能力减弱
C.取出试管中的溶液,光照一段时间后 光照 pH 下降,与反应 2HClO == 2HCl + O2↑有关
D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色
7. 我国科学家最新合成出一种聚醚酯(PM)新型材料,合成方法如下:
下列说法不.正.确.的是
A.M 分子中含有 2 个手性碳原子
B.M 在碱性条件下水解开环得到
C.PM 中含有酯基、醚键和羟基三种官能团
D.合成 1mol PM,理论上需要 n mol M 和 1mol 苯甲醇
8. 下列所给事实对应离子方程式书写不.正.确.的是
A.C 和浓 H2SO4反应:C + 2H2SO4(浓) =△== CO2↑+ 2SO2↑+ 2H2O
B. 用石灰乳吸收泄漏的氯气: 2Ca(OH)2 + 2Cl2 === CaCl2 + Ca(ClO)2 + 2H2O
C. Ca(OH)2溶液与少量的
―
NaHCO3溶液反应:HCO3 + Ca2+ + OH == CaCO3↓+ H2O
D. 钢铁发生吸氧腐蚀时铁做负极:Fe—3e— == Fe3+
9. NA为阿伏加德罗常数,下列说法正.确.的是
A.0.1 mol 氨基(—NH2)中含有 NA个质子
B.14 g 乙烯和丙烯的混合气体中所含碳氢键数为 2 NA
-
C.1.0 mol·L 1AlCl3溶液中,Cl-数目为 3 NA
D.22.4 L(标准状况)Cl2与足量 NaOH 溶液充分反应,电子转移数为 2 NA
10. 下列实验的对应操作中,不.合.理.的是
第2页/共8页
A.用 HCl 标准溶液 C.从提纯后的 NaCl D.配制一定物质的
B.稀释浓硫酸
滴定 NaOH 溶液 溶液获得 NaCl 晶体 量浓度的 KCl 溶液
11. 硫化氢的转化是资源利用和环境保护的重要研究课题。将 H2S 和空气的混合气体通入 FeCl3、FeCl2 和
CuCl2的混合溶液中回收 S,其转化如图所示。
下列说法不.正.确.的是
A.过程①生成了 HCl,说明酸性:H2S> HCl
B.过程②,每溶解 1mol CuS,转移 2mol e-
C.过程③,溶液的 pH 增大
D. 回收 S 的总反应为 2H 催化剂 2S + O2 ==== 2H2O + 2S↓
12. 新型 Li-Mg 双离子可充电电池是一种高效、低成本的储能电池,其装置示意图如下。当闭合 K2 时,该
电池的工作原理为 xMg + xLi2SO4 + 2Li1-xFePO4 = xMgSO4 + 2LiFePO4
下列关于该电池的说法正.确.的是
A.放电时,电子从 N 电极经导线流向 M 电极
B.充电时,外加直流电源的正极与 M 电极相连
C.放电时,正极的电极反应式:Li1-xFePO4 + xLi+ + xe- === LiFePO4
D.充电时,电路中每通过 1 mol e-,左室溶液增加 2 mol Li+
13. 化合物 K 与 L 反应可合成药物中间体 M,转化关系如下:
第3页/共8页
已知 L 能发生银镜反应,下列说法不.正.确.的是
A.K、M 分子中碳原子的杂化方式均有 sp3和 sp2
B.在水中的溶解度:K > M
C.L 为乙醛
D.生成物 M 与 H2O 的化学计量数之比为 1:1
14. 实验小组探究浓度对 FeSO4溶液与 AgNO3溶液反应的影响。实验如下:
试剂
沉淀物质的量之比
编 试剂 X 试剂 Y
实验 n(Ag2SO4)
号 c(AgNO )/mol·L-3
c(FeSO )/mol·L-14 n(Ag)
1
i 0.04 0.04 a
ii 0.1 0.1 0.15
iii 0.5 0.5 0.19
iv 1.0 1.0 0.26
已知:① K -5sp(Ag2SO4) = 1.2×10 。
② 取 i~iv 充分反应后的上层清液,滴加浓盐酸均产生白色沉淀;滴加 K3[Fe(CN)6]溶液均产生
蓝色沉淀。
下列说法不.正.确.的是
A.分析 i 中数据可知:a = 0
B.ii 中沉淀加适量浓氨水充分反应,取上层清液滴加 Ba(NO3)2溶液,产生白色沉淀
C.取 iii 中充分反应后的上层清液,滴加 K3[Fe(CN)6]溶液产生蓝色沉淀,可以作为 Fe2+ + Ag+ Ag +
Fe3+为可逆反应的证据
D.本实验中反应物浓度增大,对复分解反应的影响比对氧化还原反应的影响更大
二、非选择题:本大题共 5 小题,共 58 分。把.答.案.填.在.答.题.纸.中.相.应.的.横.线.上.。
15.(10 分)氧族元素 Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中 SeSO 2- 可看作是 SO 2-3 4 中的一个 O 原子被 Se 原子取代的产物)在某
些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
① 基态 Se 原子的价层电子排布式是______ 按照核外电子排布,可把元素周期表划分为 5 个区,Se
位于元素周期表 区
第4页/共8页
② SeSO 2-3 的空间结构是 ,基态 O 原子中处于最高能级的电子的运动状态共有___个。
③ 过程 ii 中 SeSO 2-3 一定断裂的化学键是 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶
体的晶胞结构如下图,其中[SeBr6] 2-位于正方体的顶点和面心。
① 比较 Se原子和 Br原子的第一电离能大小,并从原子结构的角度说明理由 。
② NH +4 中 H—N—H 键角 (填“>”或“<”)NH3中 H—N—H 键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为 a nm。已知[(NH4)2SeBr6]
的摩尔质量是 M g mol-1,阿伏伽德罗常数为 N ,该晶体密度为 g·cm-3· A 。
(1 nm = 10-7 cm)
(3)Cu2-xSe 是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化
如下图所示(晶胞内未标出因放电产生的 0 价 Cu 原子)。
每个 Na2Se晶胞完全转化为 Cu2-xSe晶胞,转移电子数为 。
16.(11 分)一种利用某镍矿资源(主要成分为 NiS、SiO2,含有少量 CuS、FeS、MgO、
Al2O3、Fe2O3)提取含 Ni、Cu、Fe、Mg、Al 的物质的流程如下:
O2、H2SO4/△
固体 C CuSO4溶液
CuSO4溶液
过滤
固体 A III
过滤
II 溶液 D
H2SO4 过滤
镍矿 电解
研磨、加热 I
IV
Fe(OH)3
H2O2 NH4HCO3
溶液 B 固体 F V 过滤
NH
溶液 E 4
HCO3
VI NiS
过滤 Na2S
溶液 G
VII 过滤
2+
VIII 含 Mg 的溶液
资料:
第5页/共8页
i.25°C 时,一些物质的 Ksp如下:
物质 CuS NiS FeS Al(OH)3 Fe(OH)3 Fe(OH)2
Ksp 6.3×10-36 2.0×10-26 6.3×10-18 4.6×10-33 4.0×10-38 8.0×10-16
ii.溶液中离子浓度≤10-5 mol·L 1时认为该离子沉淀完全。
(1)流程中能加快反应速率的措施有
(2)固体 A 中还有少量酸浸后剩余的 NiS,II 中反应的离子方程式为
-
(3)III 中,生成 1 mol CuSO4转移 8 mol e ,III 中反应的化学方程式为
III 过滤后得到的固体残渣中含有的物质是
(4)IV 可以除去溶液 D 中的 Cu2+,由此推测氧化性 Cu2+ Ni2+(填“>”或 “<”)。
(5)结合离子方程式解释 V 中加入 H2O2的作用:
(6)为了使 Fe3+沉淀完全,VI 中溶液 pH 的最小值所属范围为 (填字母)。
a.2~3 b.3~4 c.9~10 d.10~11
(7)VI 中,NH4HCO3不宜多加,结合化学用语解释原因
17.(12 分)化合物 K 有抗高血压活性,其合成路线如下。
已知:
(1)A 为芳香族化合物,A 的名称是______。
(2)B→D 的化学方程式是______。
(3)G 的结构简式是______。
(4)E 属于酯,E 的结构简式是______。
(5)K 中能与 NaOH 溶液反应的官能团有______。
a.碳碳双键 b.酯基 c.酰胺基
(6)D 也可由间硝基甲苯通过电解法制得,主要物质转化关系如下。
第6页/共8页
已知:电解效率 η 的定义: (n 生成P所用电子) (P)= 100%
(n 通过电极的电子)
① Ⅱ中,生成 Q 的离子方程式是______。
② 若电解产生的 Ce(OH)3+使间硝基甲苯通过两步氧化完全转化为 D,当电极
通过 1 mol e ,生成 a mol D 时,η(D)=______。
(7)以 D、F 和 CO(NH2)2为原料,“一锅法”合成 G 的转化过程如下。
M 的结构简式是______,M→N 的反应类型是______。
18.(13 分)KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分 MnO2)粉碎后,与 KOH 固体混合,通入空气充分焙烧,生成暗绿色熔融态
物质。
Ⅱ.冷却,将固体研细,用稀 KOH 溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入 CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得 KMnO4固体。
资料:K2MnO4 为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn 的
化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是________。
(2)Ⅰ中,生成 K2MnO4的化学方程式是________。
(3)Ⅱ中,浸取时用稀 KOH 溶液的原因是________。
(4)Ⅲ中,CO2和 K2MnO4在溶液中反应的化学方程式是________。
(5)将 K2MnO4溶液采用惰性电极隔膜法电解,也可制得 KMnO4。装置如下图:
① b 极是______极(填“阳”或“阴”),D 是________。
② 结合电极反应式简述生成 KMnO4的原理:________。
③ 传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,
其原因是________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 + H2SO4 == H2C2O4 + Na2SO4
5H + 2+ 2C2O4 + 2MnO4 + 6H == 2Mn + 10CO2↑+ 8H2O
摩尔质量:Na C O 1 12 2 4 134 g·mol KMnO4 158 g·mol
ⅰ.称取 a g 产品,配成 50 mL 溶液。
第7页/共8页
ⅱ.称取 b g Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到 75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液 V mL
(杂质不参与反应)。
产品中 KMnO4的质量分数的表达式为________。
.( 2― ― 2― 19 12 分)资料显示,酸性介质中,S 2+2O8 和 Mn 可反应转化为 MnO4 和 SO4 。某小组探究利用该反应
测定 Mn2+含量的适宜条件。
实验 序号 物质a 实验现象
0.002 mol/L
Ⅰ 无明显现象
MnSO4溶液
0.002 mol/L
Ⅱ 加热至沸腾,5 min后溶液变为紫色
MnSO4溶液
0.05 mol/L 加热至沸腾,生成大量棕黑色沉
Ⅲ
MnSO4溶液 淀,静置,上层溶液未变紫色
(1)根据实验Ⅱ的现象,氧化性:S O2― 2 8 ______ MnO
―
4 (填“>”或“<”)。
(2)实验Ⅱ中反应的离子方程式是______。
(3)实验Ⅰ的条件下 S 2― 2O8 能将 Mn2+氧化为 MnO
―
4 ,推测实验Ⅰ未出现紫色的原因:______。
(4)经检验,棕黑色沉淀为MnO2,针对实验Ⅲ中的现象,提出以下假设:
假设1:S2O
2― 的浓度较低,不足以将Mn2+8 氧化为MnO
―
4
假设2:溶液中存在还原剂Mn2+,将生成的MnO― 4 还原为MnO2
① 甲同学分析上述实验设计,认为假设1不成立,理由是______。
② 针对假设2,乙同学设计实验Ⅳ证实了推测合理。
请写出实验操作和现象:______。
③ 实验Ⅲ 中生成MnO2的离子方程式是______,
从化学反应速率的角度分析实验Ⅲ 未得到紫色溶液的原因:______。
(5)资料表明 Ag+可作为 Mn2+和 S O2― 2 8 反应转化为 MnO
―
4 的催化剂。丙同学设计实验Ⅲ的对比实验进行了
证实。向______中滴加 2 滴 0.1 mol/L AgNO3溶液,再加入 0.0005 mol (NH4)2S2O8固体,加热至沸腾,
观察到溶液变为紫色。
(6)根据上述实验,要利用(NH4) S 2+
―
2 2O8 将 Mn 转化为 MnO4 的反应来快速测定 Mn2+的含量,应控制的反
应适宜条件有:加热至沸腾、______。
第8页/共8页
同课章节目录
