湖南省衡阳市衡阳县2024-2025学年高二上学期11月期中考试化学试题(含答案)
文档属性
| 名称 | 湖南省衡阳市衡阳县2024-2025学年高二上学期11月期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 598.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-08 13:58:16 | ||
图片预览



文档简介
衡阳县2024-2025学年上学期高二期中考试
化 学
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32 Cl∶35.5
一、单选题(每题3分,共42分)
1.下列生产生活中的应用与盐类水解原理无关的是()
A.明矾净水 B.草木灰去油污
C.配制溶液时,加入一些铁粉 D.氯化铵除铁锈
2.已知热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol 1,下列说法错误的是()
A.H2的燃烧热为285.8 kJ·mol 1
B.能量图:
C.2H2(g)+O2(g)=2H2O(g) ΔH>-571.6 kJ·mol 1
D.1 mol H2和2 mol H2的燃烧热相同
3.在一密闭容器中发生反应,3min达到平衡状态,增加了0.6mol L 1,下列说法正确的是()
A.0~3min,
B.在2min末,
C.第4min时,和表示的反应速率的值相等
D.若相同时间内,,则这两段时间内反应速率相等
4.下列说法中,正确的是()
A.H2O(1)分解成H2(g)和O2(g)是熵增过程,该反应在室温下是自发反应
B.吸热反应一定不能自发进行
C.某条件下,反应2AB(g)=C(g)+3D(g) ΔH <0 一定能自发进行
D.合成氨反应N2(g)+3H2(g)=2NH3(g) ΔH <0 高温有利于自发进行
5.设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,1L pH=13的Ba(OH)2溶液中含有的OH 数目为0.1NA
B.100mL 2.0mol·L 1的盐酸与醋酸溶液中氢离子数均为0.2NA
C.密闭容器中,2mol SO2和1mol O2催化反应后分子总数为2NA
D.2.3g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
6.常温下,下列各组离子在相应条件下可能大量共存的是()
A.由水电离产生的的溶液中:、、、
B.能使甲基橙显橙色的溶液中:、、、
C.在的溶液中:、、、
D.澄清透明的无色溶液中:、、、
7.下列说法不正确的是()
A.pH相等的NaOH和Na2CO3溶液c(NaOH)>c(Na2CO3)
B.稀释0.1mol/L醋酸溶液,其电离程度增大,pH也增大
C.AlCl3溶液蒸干灼烧后得到的固体是Al2O3
D.分别用等体积的蒸馏水和稀硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤时的损失量
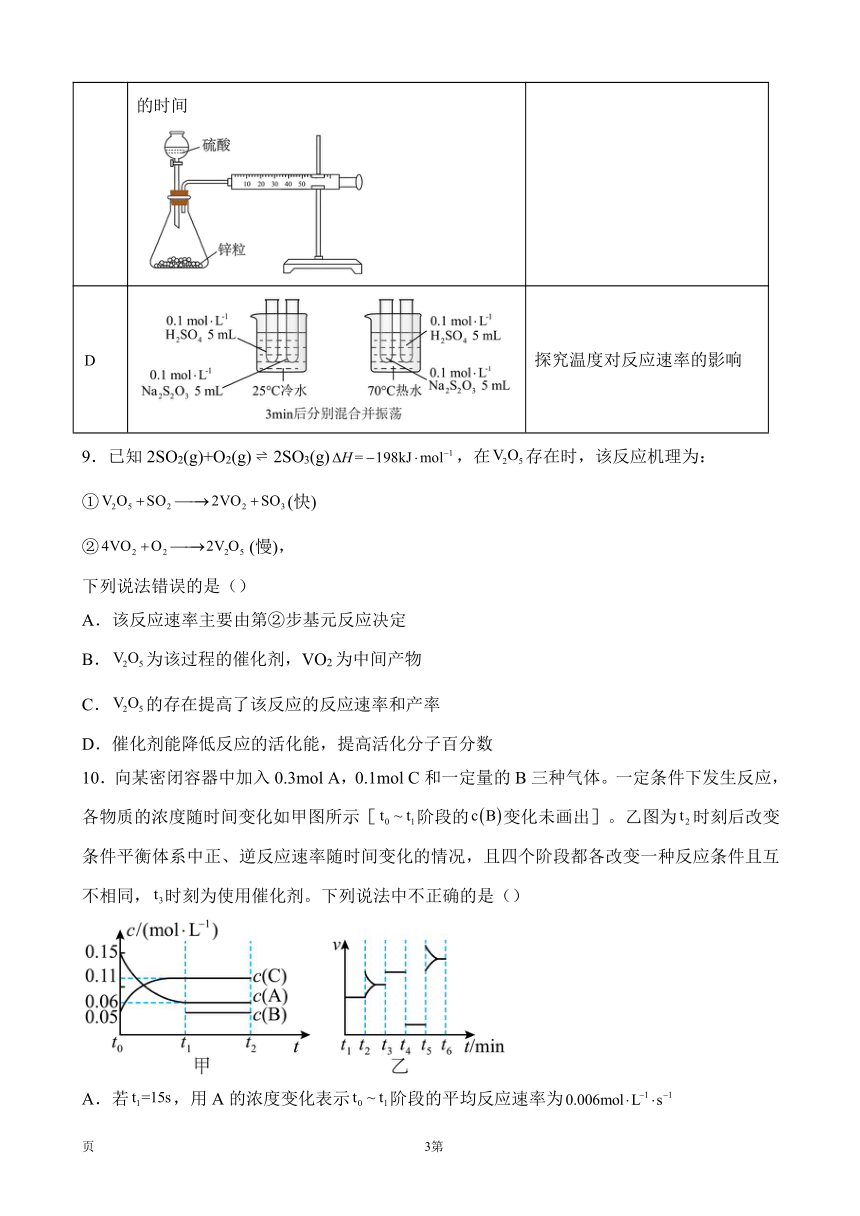
8.下列有关化学反应速率的实验探究方案设计合理的是()
选项 实验方案 实验目的
向不同体积等浓度的溶液中分别加入滴等 浓度的和溶液,观察气体产生的速率 比较不同催化剂的催化效果
两支试管,都加入的酸性溶液, 再同时向两支试管分别加入的 溶液和的溶液,观察高锰酸钾 溶液褪色所需时间 探究草酸浓度对反应速率影响
在锥形瓶内各盛有锌粒颗粒大小基本相同,然后通过分液漏斗分别加入和的硫酸。比较两者收集氢气所用的时间 探究硫酸浓度对应速率影响
探究温度对反应速率的影响
9.已知2SO2(g)+O2(g) 2SO3(g),在存在时,该反应机理为:
①(快)
②(慢),
下列说法错误的是()
A.该反应速率主要由第②步基元反应决定
B.为该过程的催化剂,VO2为中间产物
C.的存在提高了该反应的反应速率和产率
D.催化剂能降低反应的活化能,提高活化分子百分数
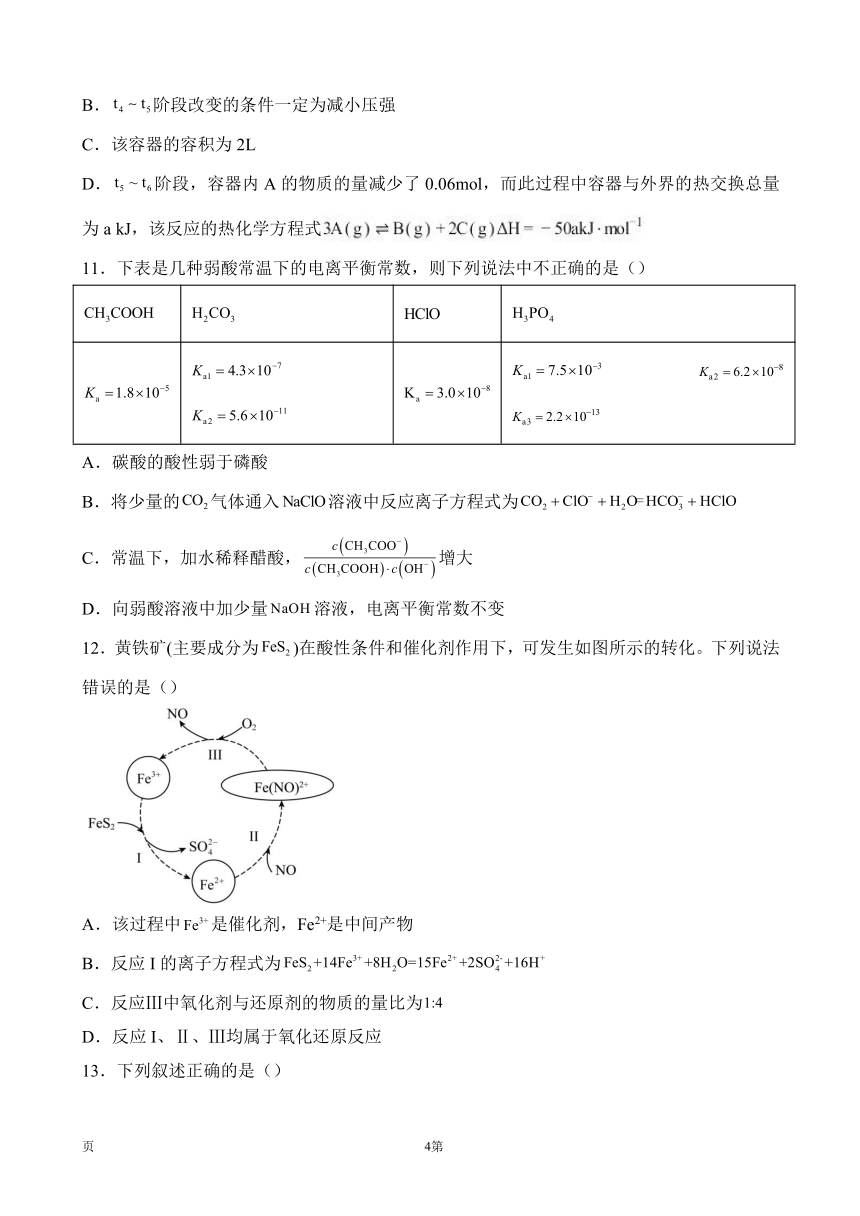
10.向某密闭容器中加入0.3mol A,0.1mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[阶段的变化未画出]。乙图为时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,时刻为使用催化剂。下列说法中不正确的是()
A.若,用A的浓度变化表示阶段的平均反应速率为
B.阶段改变的条件一定为减小压强
C.该容器的容积为2L
D.阶段,容器内A的物质的量减少了0.06mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式
11.下表是几种弱酸常温下的电离平衡常数,则下列说法中不正确的是()
A.碳酸的酸性弱于磷酸
B.将少量的气体通入溶液中反应离子方程式为
C.常温下,加水稀释醋酸,增大
D.向弱酸溶液中加少量溶液,电离平衡常数不变
12.黄铁矿(主要成分为)在酸性条件和催化剂作用下,可发生如图所示的转化。下列说法错误的是()
A.该过程中是催化剂,Fe2+是中间产物
B.反应I的离子方程式为
C.反应Ⅲ中氧化剂与还原剂的物质的量比为
D.反应I、Ⅱ、Ⅲ均属于氧化还原反应
13.下列叙述正确的是()
A.将溶液从20℃升温至30℃,溶液中增大
B.向盐酸中加入等浓度氨水至中性,
C.25℃时,的溶液比等浓度的溶液的导电能力弱
D.25℃时,一元酸HA与溶液等体积混合后溶液的pH为7,则
14.25℃时,某混合溶液中,、、和随pH变化的关系如图所示,为HCN的电离常数,下列说法错误的是()
A.N点时,
B.点过程中,水的电离程度逐渐增大
C.P点时,若溶液为HCN与NaCN的混合溶液,则此时
D.该溶液中,
二、填空题(4大题,共58分。)
15.现有下列物质:①熔融的 ②稀硫酸 ③液氯 ④冰醋酸 ⑤铜 ⑥ ⑦ ⑧液氨 ⑨ ⑩固体
请按要求回答下列问题。
(1)以上物质中属于弱电解质的是(填数字序号,下同),属于非电解质的是。
(2)可以证明醋酸是弱酸的事实是(填字母序号)。
a.醋酸和水能以任意比例混溶
b.在醋酸水溶液中还含有未电离的醋酸分子
c.醋酸与溶液反应放出气体
d.的醋酸水溶液能使紫色石蕊溶液变红色
e.等体积等的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(3)某温度时,某水溶液中的,,中和的关系如图所示:
Ⅰ.该温度下,若盐酸中,则由水电离产生的。
Ⅱ.该温度下,将的溶液与,的,溶液混合(忽略体积变化)。
①溶于水的电离方程式为。
②若所得混合溶液呈中性,且,,则。
16.除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:;已知还原性:Mg>Si。
(1)上述反应仍能发生的原因是。
(2)由下图,推测上述反应正向为(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时的浓度将(填“升高”、“降低”或“不变”)。
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,下列说法正确的是___________。
A.反应物不再转化为生成物
B.炉内与CaO·MgO的质量比保持不变
C.气体密度变大
D.单位时间内,
(4)若还原炉容积为,原料中煅白质量为9.6t,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率。
17.某化学小组欲定量探究含对溶液发生分解时化学反应速率的影响,该小组先取溶液利用如图装置进行实验,得到了如表数据:
0 2 4 6 8 10
0.0 9.9 17.2 22.4 26.5 29.9
说明:①表中是折合成标准状况下的体积:
②假设反应过程中溶液体积的变化忽略不计。
(1)检查该装置气密性的操作为。
(2)0~6min的平均反应速率:(保留两位有效数字),0~6min的平均反应速率6~10min的平均反应速率(填“>”“<”或“=”),原因是。
(3)对于的分解反应,也有一定的催化作用。为比较和对分解的催化效果,研究小组的同学设计了如图所示的实验,发现滴加溶液的试管产生的气泡史剧烈,研究小组得出了“的催化效果一定比更好”的结论,你认为利用该现象得出的该结论(填“合理”或“不合理”),原因是。某同学将溶液改为溶液进行实验,现象与上述实验一致,故研究小组得出了“催化效果更好”的结论,其理由是。
18.以、为原料合成涉及的主要反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)反应Ⅰ、Ⅱ的(代表化学平衡常数)随(温度的倒数)的变化如图所示。据图判断,升高温度时,反应的化学平衡常数将(填“增大”“减小”或“不变”)。
(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将
(填“正向”“逆向”或“不”)移动;若将反应体系体积压缩至原来一半,重新达到平衡时两反应所需时间填“>”“<”或“=”)。
(3)恒压条件下,将和按体积比混合,初始压强为,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内的选择性和产率随温度的变化如图。已知:的选择性
①在上述条件下合成甲醇的工业条件是。
A.210℃ B.230℃
C.催化剂CZT D.催化剂
②已知反应Ⅱ的速率方程可表示为,,其中、分别为正、逆反应的速率常数,与的关系如图所示,①、②、③、④四条斜线中,表示的是;230℃下,图中A、B、C、D点的纵坐标分别为、、、,达到平衡时,测得体系中,以物质的分压表示的反应Ⅰ的平衡常数。(已知:,)
化学参考答案
1.【答案】C
2.【答案】B
3.【答案】C
4.【答案】C
5.【答案】A
6.【答案】B
7.【答案】A
8.【答案】D
9.【答案】C
10.【答案】D
11.【答案】C
12.【答案】D
13.【答案】C
14.【答案】C
15.【答案】(1)④ ⑧⑨
(2)be
(3)2×10﹣12 1∶1
16.【答案】(1)1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动
(2)吸热 不变
(3)BC
(4)0.025
17.【答案】(1)关闭分液漏斗活塞,向外拉动注射器至一定位置,放开能够恢复到原来的位置,则证明气密性良好
(2) > 随着反应的进行,反应物浓度逐渐减小,化学反应速率降低
(3)不合理 阴离子种类不同 控制了阴离子浓度和种类一样,的浓度比小,出现反应更剧烈
18.【答案】(1)减小
(2)正向 =
(3)BD ④
1第
页
化 学
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 S∶32 Cl∶35.5
一、单选题(每题3分,共42分)
1.下列生产生活中的应用与盐类水解原理无关的是()
A.明矾净水 B.草木灰去油污
C.配制溶液时,加入一些铁粉 D.氯化铵除铁锈
2.已知热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol 1,下列说法错误的是()
A.H2的燃烧热为285.8 kJ·mol 1
B.能量图:
C.2H2(g)+O2(g)=2H2O(g) ΔH>-571.6 kJ·mol 1
D.1 mol H2和2 mol H2的燃烧热相同
3.在一密闭容器中发生反应,3min达到平衡状态,增加了0.6mol L 1,下列说法正确的是()
A.0~3min,
B.在2min末,
C.第4min时,和表示的反应速率的值相等
D.若相同时间内,,则这两段时间内反应速率相等
4.下列说法中,正确的是()
A.H2O(1)分解成H2(g)和O2(g)是熵增过程,该反应在室温下是自发反应
B.吸热反应一定不能自发进行
C.某条件下,反应2AB(g)=C(g)+3D(g) ΔH <0 一定能自发进行
D.合成氨反应N2(g)+3H2(g)=2NH3(g) ΔH <0 高温有利于自发进行
5.设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,1L pH=13的Ba(OH)2溶液中含有的OH 数目为0.1NA
B.100mL 2.0mol·L 1的盐酸与醋酸溶液中氢离子数均为0.2NA
C.密闭容器中,2mol SO2和1mol O2催化反应后分子总数为2NA
D.2.3g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
6.常温下,下列各组离子在相应条件下可能大量共存的是()
A.由水电离产生的的溶液中:、、、
B.能使甲基橙显橙色的溶液中:、、、
C.在的溶液中:、、、
D.澄清透明的无色溶液中:、、、
7.下列说法不正确的是()
A.pH相等的NaOH和Na2CO3溶液c(NaOH)>c(Na2CO3)
B.稀释0.1mol/L醋酸溶液,其电离程度增大,pH也增大
C.AlCl3溶液蒸干灼烧后得到的固体是Al2O3
D.分别用等体积的蒸馏水和稀硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤时的损失量
8.下列有关化学反应速率的实验探究方案设计合理的是()
选项 实验方案 实验目的
向不同体积等浓度的溶液中分别加入滴等 浓度的和溶液,观察气体产生的速率 比较不同催化剂的催化效果
两支试管,都加入的酸性溶液, 再同时向两支试管分别加入的 溶液和的溶液,观察高锰酸钾 溶液褪色所需时间 探究草酸浓度对反应速率影响
在锥形瓶内各盛有锌粒颗粒大小基本相同,然后通过分液漏斗分别加入和的硫酸。比较两者收集氢气所用的时间 探究硫酸浓度对应速率影响
探究温度对反应速率的影响
9.已知2SO2(g)+O2(g) 2SO3(g),在存在时,该反应机理为:
①(快)
②(慢),
下列说法错误的是()
A.该反应速率主要由第②步基元反应决定
B.为该过程的催化剂,VO2为中间产物
C.的存在提高了该反应的反应速率和产率
D.催化剂能降低反应的活化能,提高活化分子百分数
10.向某密闭容器中加入0.3mol A,0.1mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[阶段的变化未画出]。乙图为时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,时刻为使用催化剂。下列说法中不正确的是()
A.若,用A的浓度变化表示阶段的平均反应速率为
B.阶段改变的条件一定为减小压强
C.该容器的容积为2L
D.阶段,容器内A的物质的量减少了0.06mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式
11.下表是几种弱酸常温下的电离平衡常数,则下列说法中不正确的是()
A.碳酸的酸性弱于磷酸
B.将少量的气体通入溶液中反应离子方程式为
C.常温下,加水稀释醋酸,增大
D.向弱酸溶液中加少量溶液,电离平衡常数不变
12.黄铁矿(主要成分为)在酸性条件和催化剂作用下,可发生如图所示的转化。下列说法错误的是()
A.该过程中是催化剂,Fe2+是中间产物
B.反应I的离子方程式为
C.反应Ⅲ中氧化剂与还原剂的物质的量比为
D.反应I、Ⅱ、Ⅲ均属于氧化还原反应
13.下列叙述正确的是()
A.将溶液从20℃升温至30℃,溶液中增大
B.向盐酸中加入等浓度氨水至中性,
C.25℃时,的溶液比等浓度的溶液的导电能力弱
D.25℃时,一元酸HA与溶液等体积混合后溶液的pH为7,则
14.25℃时,某混合溶液中,、、和随pH变化的关系如图所示,为HCN的电离常数,下列说法错误的是()
A.N点时,
B.点过程中,水的电离程度逐渐增大
C.P点时,若溶液为HCN与NaCN的混合溶液,则此时
D.该溶液中,
二、填空题(4大题,共58分。)
15.现有下列物质:①熔融的 ②稀硫酸 ③液氯 ④冰醋酸 ⑤铜 ⑥ ⑦ ⑧液氨 ⑨ ⑩固体
请按要求回答下列问题。
(1)以上物质中属于弱电解质的是(填数字序号,下同),属于非电解质的是。
(2)可以证明醋酸是弱酸的事实是(填字母序号)。
a.醋酸和水能以任意比例混溶
b.在醋酸水溶液中还含有未电离的醋酸分子
c.醋酸与溶液反应放出气体
d.的醋酸水溶液能使紫色石蕊溶液变红色
e.等体积等的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(3)某温度时,某水溶液中的,,中和的关系如图所示:
Ⅰ.该温度下,若盐酸中,则由水电离产生的。
Ⅱ.该温度下,将的溶液与,的,溶液混合(忽略体积变化)。
①溶于水的电离方程式为。
②若所得混合溶液呈中性,且,,则。
16.除电解法,工业炼镁还可采用硅热法(Pidgeon法)。即以煅白(CaO·MgO)为原料与硅铁(含硅75%的硅铁合金)混合置于密闭还原炉,1200℃下发生反应:;已知还原性:Mg>Si。
(1)上述反应仍能发生的原因是。
(2)由下图,推测上述反应正向为(填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时的浓度将(填“升高”、“降低”或“不变”)。
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,下列说法正确的是___________。
A.反应物不再转化为生成物
B.炉内与CaO·MgO的质量比保持不变
C.气体密度变大
D.单位时间内,
(4)若还原炉容积为,原料中煅白质量为9.6t,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率。
17.某化学小组欲定量探究含对溶液发生分解时化学反应速率的影响,该小组先取溶液利用如图装置进行实验,得到了如表数据:
0 2 4 6 8 10
0.0 9.9 17.2 22.4 26.5 29.9
说明:①表中是折合成标准状况下的体积:
②假设反应过程中溶液体积的变化忽略不计。
(1)检查该装置气密性的操作为。
(2)0~6min的平均反应速率:(保留两位有效数字),0~6min的平均反应速率6~10min的平均反应速率(填“>”“<”或“=”),原因是。
(3)对于的分解反应,也有一定的催化作用。为比较和对分解的催化效果,研究小组的同学设计了如图所示的实验,发现滴加溶液的试管产生的气泡史剧烈,研究小组得出了“的催化效果一定比更好”的结论,你认为利用该现象得出的该结论(填“合理”或“不合理”),原因是。某同学将溶液改为溶液进行实验,现象与上述实验一致,故研究小组得出了“催化效果更好”的结论,其理由是。
18.以、为原料合成涉及的主要反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)反应Ⅰ、Ⅱ的(代表化学平衡常数)随(温度的倒数)的变化如图所示。据图判断,升高温度时,反应的化学平衡常数将(填“增大”“减小”或“不变”)。
(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将
(填“正向”“逆向”或“不”)移动;若将反应体系体积压缩至原来一半,重新达到平衡时两反应所需时间填“>”“<”或“=”)。
(3)恒压条件下,将和按体积比混合,初始压强为,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内的选择性和产率随温度的变化如图。已知:的选择性
①在上述条件下合成甲醇的工业条件是。
A.210℃ B.230℃
C.催化剂CZT D.催化剂
②已知反应Ⅱ的速率方程可表示为,,其中、分别为正、逆反应的速率常数,与的关系如图所示,①、②、③、④四条斜线中,表示的是;230℃下,图中A、B、C、D点的纵坐标分别为、、、,达到平衡时,测得体系中,以物质的分压表示的反应Ⅰ的平衡常数。(已知:,)
化学参考答案
1.【答案】C
2.【答案】B
3.【答案】C
4.【答案】C
5.【答案】A
6.【答案】B
7.【答案】A
8.【答案】D
9.【答案】C
10.【答案】D
11.【答案】C
12.【答案】D
13.【答案】C
14.【答案】C
15.【答案】(1)④ ⑧⑨
(2)be
(3)2×10﹣12 1∶1
16.【答案】(1)1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动
(2)吸热 不变
(3)BC
(4)0.025
17.【答案】(1)关闭分液漏斗活塞,向外拉动注射器至一定位置,放开能够恢复到原来的位置,则证明气密性良好
(2) > 随着反应的进行,反应物浓度逐渐减小,化学反应速率降低
(3)不合理 阴离子种类不同 控制了阴离子浓度和种类一样,的浓度比小,出现反应更剧烈
18.【答案】(1)减小
(2)正向 =
(3)BD ④
1第
页
同课章节目录
