2024-2025学年度北京北师大实验中学高一(上)期中化学(PDF版,无答案)
文档属性
| 名称 | 2024-2025学年度北京北师大实验中学高一(上)期中化学(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 726.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-08 14:00:35 | ||
图片预览




文档简介
北师大实验中学 2024-2025 学年度第一学期期中试卷
高一年级化学
班级 姓名 学号 成绩
1. 本试卷共 10页,共 26道大题;答题纸共 2页。
考 满分 100+20 分。考试时间 90分钟。
生 2. 在试卷和答题卡上准确填写班级、姓名、学号。
须 3. 试卷答案一律填写在答题卡上,在试卷上作答无效。
知 4. 在答题卡上,选择题须用 2B铅笔将选中项涂黑涂满,其他试题用黑
色字迹签字笔作答。
命题人:高一化学备课组 审题人:梁凯
可能用到的相对原子质量:H-1 O-16 C-12 N-14 Na-23 Cl-35.5 Fe-56 Cu-64
I 卷(共 100 分)
第一部分 选择题
(本部分共 20 小题,在每小题给出的四个选项中,只有一项最符合题意。每小题 2
分,共 40分)
1.下列物质不属于电解质的是
A.HCl B.CO2 C.BaSO4 D.Ca(OH)2
2.下列关于物质的分类的说法中,不.正.确.的是
A.CaO 属于氧化物 B.NaOH 属于碱
C.NaHCO3 属于酸 D.AgCl 属于盐
3.下列物质属于共价化合物的是
A.MgCl2 B.O2 C.H2O D.NH4Cl
4.下列物质只含有离子键的是
A.NaCl B.Na2O2 C.NaOH D.NaHCO3
5.下列物质的电子式书写正确的是
A. B.
C. D.
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第1页,共10页
6.下列化学用语或图示表达不.正.确.的是
A.用电子式表示 NaCl 的形成过程:
B.Al 的结构示意图:
C.HClO 的结构式:H—O—Cl
31
D.质量数为 31 的磷原子: 15 P
7.1960 年,威拉德 利比(美)发展了使用碳 - 14( C)同位素进行年代测定的方
法, C 是一种具有放射性的碳同位素。下列关于 C 的说法正确的是
A. C 与 C 互为同素异形体
B. C 与 C 的化学性质几乎完全相同
C. C 与 C 的中子数相同
D.碳元素的相对原子质量就是 C 的相对原子质量
8.下列物质在水溶液中的电离方程式书写正确的是
2
A.K2CO +3 === K2 + CO 3 B.Ba(OH)2 === Ba++OH-
C.HNO === H++NO -3 3 D.NaHSO4 === Na++HSO -4
9.水溶液中的下列反应可以用离子方程式:H+ + OH- === H2O 表示的是
A.Ba(OH)2 与 H2SO4 B.Cu(OH)2 与 HNO3
C.KOH 与 HCl D.NaOH 与 CH3COOH
10.下列离子方程式正确的是
A.钠与水反应:Na + 2H2O === Na+ + 2OH- + H2↑
B.CH3COOH 除水垢 CaCO3:CaCO + 2H+3 === Ca2+ + H2O + CO2↑
C.氧化铜与稀盐酸反应:O2-+2H+ === H2O
+ +
D.铁锈和稀盐酸反应:Fe2O3 + 6H === 2Fe3 + 3H2O
11.下列各组离子,在水溶液中能大量共存的是
2
A.H+、SO + 2+ -4 、HCO 3 B.K 、Ba 、OH
C.Mg2+、Cl 、OH- D.Ag+、Na+、Cl
12.下列操作不.符.合.实验安全或操作规范的是
A.金属钠不慎着火时,立即用沙土覆盖
B.实验结束后,将剩余药品倒入原试剂瓶中
C.容量瓶配制准确浓度的溶液,但不能作为反应容器使用
D.稀释浓硫酸,将浓硫酸沿器壁缓慢倒入水中并用玻璃棒不断搅拌
13.下列反应中属于非氧化还原反应的是
高温
A. CO+ CuO === Cu + CO2 B.Na2O2 + 2NO2 === 2NaNO3
C.H2SO4 + FeS === H2S↑+ FeSO4 D.3NO2 + H2O === 2HNO3 + NO
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第2页,共10页
14.下列关于金属 Na 的叙述中,说法正确的是 ( )
A.Na 在空气中燃烧,发出黄色火焰 B.Na 在空气中燃烧,产物是 Na2O
C.Na 是银白色金属,硬度大,熔点高 D.Na 能与水反应生成 O2
15.关于 Na2CO3 和 NaHCO3两种化合物的性质描述,下列说法不.正.确.的是
A.热稳定性:Na2CO3>NaHCO3
B.和酸反应放出 CO2 快慢:Na2CO3<NaHCO3
C.Na2CO3 和 NaHCO3 溶于均放热
D.向澄清石灰水中分别加入 Na2CO3 溶液和 NaHCO3溶液,均产生白色沉淀
16.分类是一种重要的研究方法,以下 SO2参与的反应中,不能用 SO2 为酸性氧化物解
释的是
A.SO2 + H2O === H2SO3
B.SO2 + CaO === CaSO3
C.SO2 + Cl2 +2H2O === H2SO4 + 2HCl
D.SO2 + 2NaOH === Na2SO3 + H2O
17.下列说法正确的是
A.11.2 L CO2的物质的量为 0.5 mol
B.同温同压下,等质量的 H2 和 O2的体积之比是 1∶16
C.28 g N2和 CO 混合气体的分子数一定为 NA
D.1 mol 的 Na2O2固体中含有离子数为 4NA
18.下列实验过程中产生的现象与如图所示坐标图形相符合的是
-
A.稀盐酸滴入 NaHCO3溶液中[横坐标是稀盐酸的体积,纵坐标为 c( HCO3 )]
B.NaOH 溶液滴入 Ba(HCO3)2溶液中(横坐标是 NaOH 溶液的体积,纵坐标为沉淀质量)
C.稀盐酸滴入 AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到 Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第3页,共10页
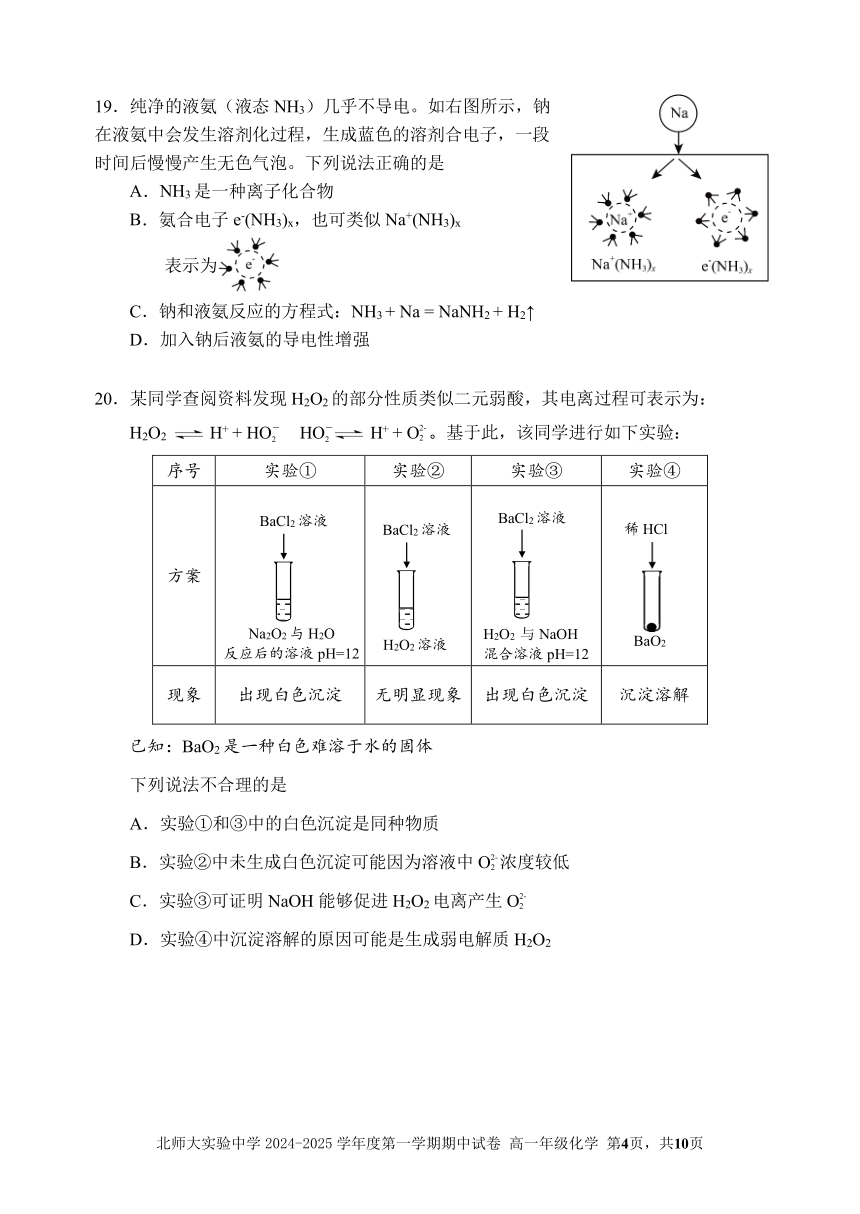
19.纯净的液氨(液态 NH3)几乎不导电。如右图所示,钠
在液氨中会发生溶剂化过程,生成蓝色的溶剂合电子,一段
时间后慢慢产生无色气泡。下列说法正确的是
A.NH3是一种离子化合物
B.氨合电子 e-(NH +3)x,也可类似 Na (NH3)x
表示为
C.钠和液氨反应的方程式:NH3 + Na = NaNH2 + H2↑
D.加入钠后液氨的导电性增强
20.某同学查阅资料发现 H2O2 的部分性质类似二元弱酸,其电离过程可表示为:
+ - - 2- H2O2 H + HO2 HO2 H
+ + O2 。基于此,该同学进行如下实验:
序号 实验① 实验② 实验③ 实验④
BaCl2 溶液 BaCl2 溶液
BaCl2 溶液 稀 HCl
方案
Na2O2 与 H2O H2O2 与 NaOH
H O 溶液 BaO2 2 2
反应后的溶液 pH=12 混合溶液 pH=12
现象 出现白色沉淀 无明显现象 出现白色沉淀 沉淀溶解
已知:BaO2是一种白色难溶于水的固体
下列说法不合理的是
A.实验①和③中的白色沉淀是同种物质
B.实验②中未生成白色沉淀可能因为溶液中 2- O2 浓度较低
2-
C.实验③可证明 NaOH 能够促进 H2O2 电离产生 O2
D.实验④中沉淀溶解的原因可能是生成弱电解质 H2O2
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第4页,共10页
第二部分 非选择题
21.用 NaCl 固体配制 100 mL 2.0 mol/L NaCl 溶液。
(1)通过计算,需用称量 NaCl 固体的质量为______g。
(2)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、______。
(3)配制溶液时,正确的实验操作顺序是____________。
a.将称好的 NaCl 固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使 NaCl 固
体全部溶解。
b.根据计算结果,称量 NaCl 固体。
c.计算需要 NaCl 固体的质量。
d.将烧杯中的溶液沿玻璃棒注入 100 mL 容量瓶,并用少量蒸馏水洗涤烧杯内壁和
玻璃棒 2~3 次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
e.将配制好的溶液倒入试剂瓶中,并贴好标签。
f.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线 1~2 cm 时,改用胶头滴管
滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(4)下列操作中,正确的是______(填字母)。
A. B. C.
溶解 转移 定容
(5)误差分析
配制过程中出现以下情况,分析对所配溶液浓度有何影响。
①容量瓶底部有少量水_________ (填“偏高”、“偏低”或“不影响”);
②没有洗涤烧杯和玻璃棒__________ (填“偏高”、“偏低”或“不影响”)。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第5页,共10页
22.钠及其化合物具有一系列重要的性质与用途。
I 钠单质
(1)钠的原子结构示意图是__________,在化学反应中容易________电子(填“得”
或“失”),化学性质活泼,在实验室通常保存在_____________中。
(2)钠可用于特种金属的冶炼。TiCl4是离子化合物,熔融 TiCl4 的电离方程式是___。
钠与熔融 TiCl4 反应得到 Ti 单质的化学方程式是____________。
II 钠的氧化物
(3)Na2O 是一种_____________氧化物(填“酸性”“碱性”或“两性”)。请写出常温
下 Na2O 与适当的氧.化.物.生成 Na2CO3 的化学方程式__________。
(4)Na2O2的电子式是____________,其中氧元素的化合价为______。Na2O2 可做太空
舱供氧剂,因为 Na2O2可与 CO2反应生成 O2,化学方程式是____________。
III 钠盐(以 NaF 为例)
右图将氟化钠的形成过程拆分成了
多个理想的分步过程。(g 表示气
态,s 表示固态)
信息:右图为玻恩-哈伯循环图,
可以用于计算化学过程中的能量变
化。其中“横线”代表体系中的物
质及状态,“→”代表转化过程。
(5)用电子式表示 NaF 的形成过程
。
(6)图中涉及共价键断裂的过程是 (填序号);描述了 Na 原子失电子转变为
Na+的过程是 (填序号)。
(7)下列说法正确的是 。
a.过程①只发生物理变化;
b.过程①②③吸收能量,过程④⑤放出能量
c.NaF(s)中不存在 Na+和 F-。
d.根据过程①②③④⑤的能量变化,可计算得出 1mol Na 与 F2反应放热多少。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第6页,共10页
23.现有含有少量 NaCl、Na2SO4、Na2CO3 等杂质的 NaNO3溶液,选择适当的试剂除去
杂质,得到纯净的 NaNO3固体,实验流程如下图所示。
(1)沉淀 A 的主要成分是 BaSO4 和 (填化学式)。
(2)①②③中均进行的分离操作是 。
(3)②中反应的离子方程式是 。
(4)过量 Na2CO3 溶液的作用是_____________________。
(5)①检验溶液 3 中是否含有 SO 2-4 离子的实验方案是_________________________。
②溶液 3 中肯定含有的杂质是 ,为了除去杂质,可向溶液 3 中加入 。
(6)溶液 3 经过处理可以得到 NaNO3 固体,获取 NaNO3固体的操作是 ,
过滤并洗涤结晶。(NaNO3溶解度随温度变化如图所示)
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第7页,共10页
24. 某研究小组为探究饱和 NaHCO3 溶液中是否还能溶解少量 NaHCO3 固体,设计并完
成了下列实验。
【查阅资料】
常温下: MgCO3微溶于水 Mg(HCO ) 易溶于水 3 2
在 pH<9.4 时溶液中的 Mg2+不形成 Mg(OH)2
【实验过程】
实验编号 实验操作 现象或结论
ⅰ 测饱和 NaHCO3溶液的 pH pH 为 8.3
向 20 mL 饱和 NaHCO3 溶 微小的气体 X 从溶液底部固体
ⅱ 液中再加入一定量NaHCO3 逸中缓慢逸出,最终固体全部
固体,静置 24 小时。 溶解,得到溶液 Y
【分析解释】
(1) ①NaHCO3的的俗称是_____________。
②NaHCO3 在水溶液中的电离方程式是_________________。
③NaHCO3 受热分解的化学方程式是___________________。
(2)取实验ⅱ反应后的气体 X,检验其成分。
①将气体 X 通入澄清石灰水,石灰水变浑浊,气体 X 是______(填化学式)
②气体 X 使澄清石灰水变浑浊的离子方程式是______________。
(3)取实验ⅱ反应后的溶液 Y,进行如下实验检验其成分:
实验 a.测得溶液 Y 的 pH 为 9.0。
实验 b.向溶液 Y 中滴加 MgCl2溶液,有白色沉淀生成。
实验 c.取少量 pH=9.0 的 Na2CO3溶液,加入 MgCl2溶液,有白色沉淀生成。
实验 d.取少量新制饱和 NaHCO3溶液,加入 MgCl2 溶液,无明显现象
实验 e. 向溶液 Y 中持续通入 CO2,一段时间后,溶液中析出少量白色固体。
①相同浓度的 Na2CO3 溶液和 NaHCO3溶液,_____溶液的碱性更强。
②实验 c 中反应的离子方程式是___________。
③综合上述实验,实验 b 中产生的白色沉淀是_____________。
④实验 c 和实验 d 的目的是________________________________。
⑤实验 e 中反应的化学方程式是___________。
【得出结论】
(4)通过上述实验证明饱和 NaHCO3溶液中还能溶解少量 NaHCO3固体,结合离子
方程式和必要的文字解释其原因:____________________________________。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第8页,共10页
II 卷(共 20 分)
25. 以下为一种以含铅废料(Pb、PbO、PbO2、Fe、Fe2O3及炭黑)制备纳米 PbO 和 PbSO4
的工艺流程。
已知:炭黑是一种碳单质,化学性质比较稳定;
PbSO4、PbCO3均为难溶于水的固体;
CH3COONa 易溶于水,电离方程式为 CH3COONa === Na+ + CH3COO-。
(1) PbO 具有碱性氧化物的性质,请写出过程 I 中 PbO 与稀硫酸反应的离子方程式
______。
(2) ①过程Ⅰ中,在 Fe2+催化下,Pb 和 PbO2 反应生成 PbSO4 的化学方程式是:
Pb + PbO2 + □________ —— □PbSO4 + □______
②过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2+
﹣
+PbO2+4H
++SO 24 === 2Fe
3++PbSO4+2H2O
ii:…
写出 ii 的离子方程式: .
(3) 过程 I 过滤除去的物质是______________。
(4) ①写出过程 II 主要反应的离子方程式___________________;
②结合复分解型离子反应的反应规律,说明(CH3COO)2Pb 可能具有怎样的性质__。
(5) 过程 II 过滤除去的物质是______________。
(6) 过程 III所得滤液中检出NH +4 ,请简述过程 III通入NH3的作用________________。
(7) ①PbCO3 生成纳米 PbSO4的离子方程式是_____________。
②PbCO3 生成纳米 PbO 的化学方程式是____________。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第9页,共10页
26.某小组同学探究 Mg、Cu 和 Fe2(SO4)3 溶液的反应。
已知:①Fe(OH)3为红褐色沉淀 ②Fe3+ + 3SCN- = Fe(SCN)3(红色)
(1)理论分析
依据金属活动性顺序,Cu 不能置换 Fe。Mg 和含 Fe3+溶液发生置换反应生成 Fe 的
离子方程式是 。
(2)进行实验
实验 操作 现象及产物
I 充分反应 48h 后,_________________。
100mL 0.1mol/L Fe2(SO4)3
溶液(pH≈1)和 1g 铜粉
产生大量无色气泡,反应剧烈,pH 逐渐增大,产
Ⅱ 生了大量红褐色沉淀。充分反应后,取出固体,固
100mL 0.1mol/L Fe2(SO4)3 体中检测到 Fe 单质
溶液(pH≈1)和 1g 镁粉
取 I 充分反应后的混合物
溶液变红,振荡后褪色,产生白色沉淀(经检验为
Ⅲ 过滤,取少量滤液,滴加
CuSCN)
KSCN 溶液
① 实验 I 中发生的反应为:2Fe3+ + Cu === 2Fe2+ + Cu2+。请补全实验现象:溶液逐
渐变为_______色,固体中_________(填“能”或“不能”)检测到 Fe 单质。
② 请结合离子方程式和必要的文字说明解释实验Ⅱ中现象“有大量气泡产生”“产
生了大量红褐色沉淀”__________________________。
(3)提出假设并验证
对实验Ⅲ中“滴加 KSCN 溶液,溶液变红”的原因作出如下假设:
假设 a:在含 SCN-的溶液中,Cu2+和 Fe2+反应生成 Fe3+和 CuSCN。
假设 b:在 pH 1 的溶液中,空气中的氧气可与 Fe2+反应生成 Fe3+。
假设 c:Cu 和 Fe3+反应慢,48h 后 Fe3+仍未完全反应。
①向 FeSO4 溶液中滴加 KSCN 溶液,溶液不显红色,继续滴加 CuSO4溶液,
______(填现象),证实假设 a 成立。反应的离子方程式为_________。
②设计实验方案证实假设 b 不是产生 Fe3+的主要原因:_______(填操作和现象)。
③甲同学认为,充分反应 48h 后,称量滤渣(已洗涤、干燥)的质量 m 可判断假设
c 是否成立。请说明 m 的大小与假设 c 是否成立的关系:__________________。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第10页,共10页
高一年级化学
班级 姓名 学号 成绩
1. 本试卷共 10页,共 26道大题;答题纸共 2页。
考 满分 100+20 分。考试时间 90分钟。
生 2. 在试卷和答题卡上准确填写班级、姓名、学号。
须 3. 试卷答案一律填写在答题卡上,在试卷上作答无效。
知 4. 在答题卡上,选择题须用 2B铅笔将选中项涂黑涂满,其他试题用黑
色字迹签字笔作答。
命题人:高一化学备课组 审题人:梁凯
可能用到的相对原子质量:H-1 O-16 C-12 N-14 Na-23 Cl-35.5 Fe-56 Cu-64
I 卷(共 100 分)
第一部分 选择题
(本部分共 20 小题,在每小题给出的四个选项中,只有一项最符合题意。每小题 2
分,共 40分)
1.下列物质不属于电解质的是
A.HCl B.CO2 C.BaSO4 D.Ca(OH)2
2.下列关于物质的分类的说法中,不.正.确.的是
A.CaO 属于氧化物 B.NaOH 属于碱
C.NaHCO3 属于酸 D.AgCl 属于盐
3.下列物质属于共价化合物的是
A.MgCl2 B.O2 C.H2O D.NH4Cl
4.下列物质只含有离子键的是
A.NaCl B.Na2O2 C.NaOH D.NaHCO3
5.下列物质的电子式书写正确的是
A. B.
C. D.
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第1页,共10页
6.下列化学用语或图示表达不.正.确.的是
A.用电子式表示 NaCl 的形成过程:
B.Al 的结构示意图:
C.HClO 的结构式:H—O—Cl
31
D.质量数为 31 的磷原子: 15 P
7.1960 年,威拉德 利比(美)发展了使用碳 - 14( C)同位素进行年代测定的方
法, C 是一种具有放射性的碳同位素。下列关于 C 的说法正确的是
A. C 与 C 互为同素异形体
B. C 与 C 的化学性质几乎完全相同
C. C 与 C 的中子数相同
D.碳元素的相对原子质量就是 C 的相对原子质量
8.下列物质在水溶液中的电离方程式书写正确的是
2
A.K2CO +3 === K2 + CO 3 B.Ba(OH)2 === Ba++OH-
C.HNO === H++NO -3 3 D.NaHSO4 === Na++HSO -4
9.水溶液中的下列反应可以用离子方程式:H+ + OH- === H2O 表示的是
A.Ba(OH)2 与 H2SO4 B.Cu(OH)2 与 HNO3
C.KOH 与 HCl D.NaOH 与 CH3COOH
10.下列离子方程式正确的是
A.钠与水反应:Na + 2H2O === Na+ + 2OH- + H2↑
B.CH3COOH 除水垢 CaCO3:CaCO + 2H+3 === Ca2+ + H2O + CO2↑
C.氧化铜与稀盐酸反应:O2-+2H+ === H2O
+ +
D.铁锈和稀盐酸反应:Fe2O3 + 6H === 2Fe3 + 3H2O
11.下列各组离子,在水溶液中能大量共存的是
2
A.H+、SO + 2+ -4 、HCO 3 B.K 、Ba 、OH
C.Mg2+、Cl 、OH- D.Ag+、Na+、Cl
12.下列操作不.符.合.实验安全或操作规范的是
A.金属钠不慎着火时,立即用沙土覆盖
B.实验结束后,将剩余药品倒入原试剂瓶中
C.容量瓶配制准确浓度的溶液,但不能作为反应容器使用
D.稀释浓硫酸,将浓硫酸沿器壁缓慢倒入水中并用玻璃棒不断搅拌
13.下列反应中属于非氧化还原反应的是
高温
A. CO+ CuO === Cu + CO2 B.Na2O2 + 2NO2 === 2NaNO3
C.H2SO4 + FeS === H2S↑+ FeSO4 D.3NO2 + H2O === 2HNO3 + NO
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第2页,共10页
14.下列关于金属 Na 的叙述中,说法正确的是 ( )
A.Na 在空气中燃烧,发出黄色火焰 B.Na 在空气中燃烧,产物是 Na2O
C.Na 是银白色金属,硬度大,熔点高 D.Na 能与水反应生成 O2
15.关于 Na2CO3 和 NaHCO3两种化合物的性质描述,下列说法不.正.确.的是
A.热稳定性:Na2CO3>NaHCO3
B.和酸反应放出 CO2 快慢:Na2CO3<NaHCO3
C.Na2CO3 和 NaHCO3 溶于均放热
D.向澄清石灰水中分别加入 Na2CO3 溶液和 NaHCO3溶液,均产生白色沉淀
16.分类是一种重要的研究方法,以下 SO2参与的反应中,不能用 SO2 为酸性氧化物解
释的是
A.SO2 + H2O === H2SO3
B.SO2 + CaO === CaSO3
C.SO2 + Cl2 +2H2O === H2SO4 + 2HCl
D.SO2 + 2NaOH === Na2SO3 + H2O
17.下列说法正确的是
A.11.2 L CO2的物质的量为 0.5 mol
B.同温同压下,等质量的 H2 和 O2的体积之比是 1∶16
C.28 g N2和 CO 混合气体的分子数一定为 NA
D.1 mol 的 Na2O2固体中含有离子数为 4NA
18.下列实验过程中产生的现象与如图所示坐标图形相符合的是
-
A.稀盐酸滴入 NaHCO3溶液中[横坐标是稀盐酸的体积,纵坐标为 c( HCO3 )]
B.NaOH 溶液滴入 Ba(HCO3)2溶液中(横坐标是 NaOH 溶液的体积,纵坐标为沉淀质量)
C.稀盐酸滴入 AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到 Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第3页,共10页
19.纯净的液氨(液态 NH3)几乎不导电。如右图所示,钠
在液氨中会发生溶剂化过程,生成蓝色的溶剂合电子,一段
时间后慢慢产生无色气泡。下列说法正确的是
A.NH3是一种离子化合物
B.氨合电子 e-(NH +3)x,也可类似 Na (NH3)x
表示为
C.钠和液氨反应的方程式:NH3 + Na = NaNH2 + H2↑
D.加入钠后液氨的导电性增强
20.某同学查阅资料发现 H2O2 的部分性质类似二元弱酸,其电离过程可表示为:
+ - - 2- H2O2 H + HO2 HO2 H
+ + O2 。基于此,该同学进行如下实验:
序号 实验① 实验② 实验③ 实验④
BaCl2 溶液 BaCl2 溶液
BaCl2 溶液 稀 HCl
方案
Na2O2 与 H2O H2O2 与 NaOH
H O 溶液 BaO2 2 2
反应后的溶液 pH=12 混合溶液 pH=12
现象 出现白色沉淀 无明显现象 出现白色沉淀 沉淀溶解
已知:BaO2是一种白色难溶于水的固体
下列说法不合理的是
A.实验①和③中的白色沉淀是同种物质
B.实验②中未生成白色沉淀可能因为溶液中 2- O2 浓度较低
2-
C.实验③可证明 NaOH 能够促进 H2O2 电离产生 O2
D.实验④中沉淀溶解的原因可能是生成弱电解质 H2O2
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第4页,共10页
第二部分 非选择题
21.用 NaCl 固体配制 100 mL 2.0 mol/L NaCl 溶液。
(1)通过计算,需用称量 NaCl 固体的质量为______g。
(2)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、______。
(3)配制溶液时,正确的实验操作顺序是____________。
a.将称好的 NaCl 固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使 NaCl 固
体全部溶解。
b.根据计算结果,称量 NaCl 固体。
c.计算需要 NaCl 固体的质量。
d.将烧杯中的溶液沿玻璃棒注入 100 mL 容量瓶,并用少量蒸馏水洗涤烧杯内壁和
玻璃棒 2~3 次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
e.将配制好的溶液倒入试剂瓶中,并贴好标签。
f.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线 1~2 cm 时,改用胶头滴管
滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(4)下列操作中,正确的是______(填字母)。
A. B. C.
溶解 转移 定容
(5)误差分析
配制过程中出现以下情况,分析对所配溶液浓度有何影响。
①容量瓶底部有少量水_________ (填“偏高”、“偏低”或“不影响”);
②没有洗涤烧杯和玻璃棒__________ (填“偏高”、“偏低”或“不影响”)。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第5页,共10页
22.钠及其化合物具有一系列重要的性质与用途。
I 钠单质
(1)钠的原子结构示意图是__________,在化学反应中容易________电子(填“得”
或“失”),化学性质活泼,在实验室通常保存在_____________中。
(2)钠可用于特种金属的冶炼。TiCl4是离子化合物,熔融 TiCl4 的电离方程式是___。
钠与熔融 TiCl4 反应得到 Ti 单质的化学方程式是____________。
II 钠的氧化物
(3)Na2O 是一种_____________氧化物(填“酸性”“碱性”或“两性”)。请写出常温
下 Na2O 与适当的氧.化.物.生成 Na2CO3 的化学方程式__________。
(4)Na2O2的电子式是____________,其中氧元素的化合价为______。Na2O2 可做太空
舱供氧剂,因为 Na2O2可与 CO2反应生成 O2,化学方程式是____________。
III 钠盐(以 NaF 为例)
右图将氟化钠的形成过程拆分成了
多个理想的分步过程。(g 表示气
态,s 表示固态)
信息:右图为玻恩-哈伯循环图,
可以用于计算化学过程中的能量变
化。其中“横线”代表体系中的物
质及状态,“→”代表转化过程。
(5)用电子式表示 NaF 的形成过程
。
(6)图中涉及共价键断裂的过程是 (填序号);描述了 Na 原子失电子转变为
Na+的过程是 (填序号)。
(7)下列说法正确的是 。
a.过程①只发生物理变化;
b.过程①②③吸收能量,过程④⑤放出能量
c.NaF(s)中不存在 Na+和 F-。
d.根据过程①②③④⑤的能量变化,可计算得出 1mol Na 与 F2反应放热多少。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第6页,共10页
23.现有含有少量 NaCl、Na2SO4、Na2CO3 等杂质的 NaNO3溶液,选择适当的试剂除去
杂质,得到纯净的 NaNO3固体,实验流程如下图所示。
(1)沉淀 A 的主要成分是 BaSO4 和 (填化学式)。
(2)①②③中均进行的分离操作是 。
(3)②中反应的离子方程式是 。
(4)过量 Na2CO3 溶液的作用是_____________________。
(5)①检验溶液 3 中是否含有 SO 2-4 离子的实验方案是_________________________。
②溶液 3 中肯定含有的杂质是 ,为了除去杂质,可向溶液 3 中加入 。
(6)溶液 3 经过处理可以得到 NaNO3 固体,获取 NaNO3固体的操作是 ,
过滤并洗涤结晶。(NaNO3溶解度随温度变化如图所示)
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第7页,共10页
24. 某研究小组为探究饱和 NaHCO3 溶液中是否还能溶解少量 NaHCO3 固体,设计并完
成了下列实验。
【查阅资料】
常温下: MgCO3微溶于水 Mg(HCO ) 易溶于水 3 2
在 pH<9.4 时溶液中的 Mg2+不形成 Mg(OH)2
【实验过程】
实验编号 实验操作 现象或结论
ⅰ 测饱和 NaHCO3溶液的 pH pH 为 8.3
向 20 mL 饱和 NaHCO3 溶 微小的气体 X 从溶液底部固体
ⅱ 液中再加入一定量NaHCO3 逸中缓慢逸出,最终固体全部
固体,静置 24 小时。 溶解,得到溶液 Y
【分析解释】
(1) ①NaHCO3的的俗称是_____________。
②NaHCO3 在水溶液中的电离方程式是_________________。
③NaHCO3 受热分解的化学方程式是___________________。
(2)取实验ⅱ反应后的气体 X,检验其成分。
①将气体 X 通入澄清石灰水,石灰水变浑浊,气体 X 是______(填化学式)
②气体 X 使澄清石灰水变浑浊的离子方程式是______________。
(3)取实验ⅱ反应后的溶液 Y,进行如下实验检验其成分:
实验 a.测得溶液 Y 的 pH 为 9.0。
实验 b.向溶液 Y 中滴加 MgCl2溶液,有白色沉淀生成。
实验 c.取少量 pH=9.0 的 Na2CO3溶液,加入 MgCl2溶液,有白色沉淀生成。
实验 d.取少量新制饱和 NaHCO3溶液,加入 MgCl2 溶液,无明显现象
实验 e. 向溶液 Y 中持续通入 CO2,一段时间后,溶液中析出少量白色固体。
①相同浓度的 Na2CO3 溶液和 NaHCO3溶液,_____溶液的碱性更强。
②实验 c 中反应的离子方程式是___________。
③综合上述实验,实验 b 中产生的白色沉淀是_____________。
④实验 c 和实验 d 的目的是________________________________。
⑤实验 e 中反应的化学方程式是___________。
【得出结论】
(4)通过上述实验证明饱和 NaHCO3溶液中还能溶解少量 NaHCO3固体,结合离子
方程式和必要的文字解释其原因:____________________________________。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第8页,共10页
II 卷(共 20 分)
25. 以下为一种以含铅废料(Pb、PbO、PbO2、Fe、Fe2O3及炭黑)制备纳米 PbO 和 PbSO4
的工艺流程。
已知:炭黑是一种碳单质,化学性质比较稳定;
PbSO4、PbCO3均为难溶于水的固体;
CH3COONa 易溶于水,电离方程式为 CH3COONa === Na+ + CH3COO-。
(1) PbO 具有碱性氧化物的性质,请写出过程 I 中 PbO 与稀硫酸反应的离子方程式
______。
(2) ①过程Ⅰ中,在 Fe2+催化下,Pb 和 PbO2 反应生成 PbSO4 的化学方程式是:
Pb + PbO2 + □________ —— □PbSO4 + □______
②过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2+
﹣
+PbO2+4H
++SO 24 === 2Fe
3++PbSO4+2H2O
ii:…
写出 ii 的离子方程式: .
(3) 过程 I 过滤除去的物质是______________。
(4) ①写出过程 II 主要反应的离子方程式___________________;
②结合复分解型离子反应的反应规律,说明(CH3COO)2Pb 可能具有怎样的性质__。
(5) 过程 II 过滤除去的物质是______________。
(6) 过程 III所得滤液中检出NH +4 ,请简述过程 III通入NH3的作用________________。
(7) ①PbCO3 生成纳米 PbSO4的离子方程式是_____________。
②PbCO3 生成纳米 PbO 的化学方程式是____________。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第9页,共10页
26.某小组同学探究 Mg、Cu 和 Fe2(SO4)3 溶液的反应。
已知:①Fe(OH)3为红褐色沉淀 ②Fe3+ + 3SCN- = Fe(SCN)3(红色)
(1)理论分析
依据金属活动性顺序,Cu 不能置换 Fe。Mg 和含 Fe3+溶液发生置换反应生成 Fe 的
离子方程式是 。
(2)进行实验
实验 操作 现象及产物
I 充分反应 48h 后,_________________。
100mL 0.1mol/L Fe2(SO4)3
溶液(pH≈1)和 1g 铜粉
产生大量无色气泡,反应剧烈,pH 逐渐增大,产
Ⅱ 生了大量红褐色沉淀。充分反应后,取出固体,固
100mL 0.1mol/L Fe2(SO4)3 体中检测到 Fe 单质
溶液(pH≈1)和 1g 镁粉
取 I 充分反应后的混合物
溶液变红,振荡后褪色,产生白色沉淀(经检验为
Ⅲ 过滤,取少量滤液,滴加
CuSCN)
KSCN 溶液
① 实验 I 中发生的反应为:2Fe3+ + Cu === 2Fe2+ + Cu2+。请补全实验现象:溶液逐
渐变为_______色,固体中_________(填“能”或“不能”)检测到 Fe 单质。
② 请结合离子方程式和必要的文字说明解释实验Ⅱ中现象“有大量气泡产生”“产
生了大量红褐色沉淀”__________________________。
(3)提出假设并验证
对实验Ⅲ中“滴加 KSCN 溶液,溶液变红”的原因作出如下假设:
假设 a:在含 SCN-的溶液中,Cu2+和 Fe2+反应生成 Fe3+和 CuSCN。
假设 b:在 pH 1 的溶液中,空气中的氧气可与 Fe2+反应生成 Fe3+。
假设 c:Cu 和 Fe3+反应慢,48h 后 Fe3+仍未完全反应。
①向 FeSO4 溶液中滴加 KSCN 溶液,溶液不显红色,继续滴加 CuSO4溶液,
______(填现象),证实假设 a 成立。反应的离子方程式为_________。
②设计实验方案证实假设 b 不是产生 Fe3+的主要原因:_______(填操作和现象)。
③甲同学认为,充分反应 48h 后,称量滤渣(已洗涤、干燥)的质量 m 可判断假设
c 是否成立。请说明 m 的大小与假设 c 是否成立的关系:__________________。
北师大实验中学 2024-2025 学年度第一学期期中试卷 高一年级化学 第10页,共10页
同课章节目录
