【特色专题专训】专题二 坐标曲线图题 2025年中考化学总复习(河南专版)(含解析)
文档属性
| 名称 | 【特色专题专训】专题二 坐标曲线图题 2025年中考化学总复习(河南专版)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 604.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-11 10:13:12 | ||
图片预览




文档简介
专题二 坐标曲线图题
题型分析 —— 河南中考特色题型分析
1.固体物质的溶解度及溶解度曲线是我省中考的高频考点,在以往每年的中考试题中都有涉及,常以选择题和填空题的形式进行考查,所占分值为1~3分;在填空题中常与物质的提纯、饱和溶液与不饱和溶液的相互转化、溶质质量分数的计算等结合在一起进行考查。
2.图像曲线具有形象直观、简明清晰、覆盖知识面广、综合性强等特点。解题时首先要仔细审题,看清题目的要求和要解决的问题,提炼题目中关键字眼;其次理解图像的横纵坐标、起点、拐点(反映了物质反应的先后顺序)、终点(反应何时终止)的含义;然后结合题目条件分析出每段图像对应的信息;再根据已知量对未知的应求量进行求解计算即可,同时要注意将数学、物理、生物与化学知识结合,应用多学科的思维来解决问题。
举例精讲 ——河南中考特色题型突破
类型1 饱和溶液与不饱和溶液的判断及转化
下图是A、B固体的溶解度曲线。
(1)40 ℃时,12 g A物质加入25 g水中充分溶解,形成的溶液质量为 ,该溶液属于 (选填“饱和”或“不饱和”)溶液。
(2)50 ℃时,A溶液中溶质与溶剂的质量比是3∶8,那么A溶液是 (选填“饱和”或“不饱和”)溶液。
(3)使A的饱和溶液转化为不饱和溶液的方法有 (填一种,下同),使B的饱和溶液转化为不饱和溶液的方法有 。
(4)在温度不变的条件下,使A的不饱和溶液转化为饱和溶液的方法有 。
[思维破冰] (1)40 ℃时A的溶解度为40 g,也就是说在该温度下100 g水中最多可以溶解40 g A物质,所以25 g水中最多可以溶解10 g A,因此将12 g A物质加入25 g水中充分溶解后,有2 g A无法溶解,故所得溶液质量为35 g,且该溶液属于饱和溶液。
(2)50 ℃时,A物质的溶解度为60 g,即100 g水中最多可以溶解60 g A物质,此时,溶质与溶剂质量比为60∶100=3∶5>3∶8,所以,溶质与溶剂的质量比是3∶8的溶液为不饱和溶液。
(3)饱和溶液转化为不饱和溶液的方法有根据不同物质的性质升高(或降低)温度、增加溶剂。
(4)温度不变的条件下,使不饱和溶液转化为饱和溶液的方法有增加溶质(或恒温蒸发溶剂)。
饱和溶液与不饱和溶液的转化
类型2 根据溶解度曲线的升降情况判断提纯方法
两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是 ( )
A.乙的饱和溶液由t2 ℃降温至t1 ℃,变为不饱和溶液
B.t1 ℃的甲、乙两物质的饱和溶液升温到t2 ℃,甲溶液的溶质质量分数大于乙溶液的溶质质量分数
C.t1 ℃时向质量分数为20%的甲溶液中加入溶质,可以得到质量分数为30%的甲溶液
D.甲中含有少量乙,一般用蒸发溶剂的方法提纯甲
[思维破冰] A.乙的溶解度随着温度的降低而减小,饱和溶液由t2 ℃降温至t1 ℃,仍然是饱和溶液,该选项说法不正确;B.t1 ℃时甲和乙的溶解度相等,甲、乙两物质的饱和溶液质量分数相等,升温到t2 ℃,都变成不饱和溶液,甲溶液的溶质质量分数等于乙溶液的溶质质量分数,该选项说法不正确;C.t1 ℃时甲的饱和溶液质量分数为33.3%,向质量分数为20%的甲溶液中加入溶质,可以得到质量分数为30%的甲溶液,该选项说法正确;D.甲的溶解度受温度变化影响较大,乙的溶解度受温度变化影响较小,甲中含有少量乙,一般用降温结晶的方法提纯甲,该选项说法不正确。
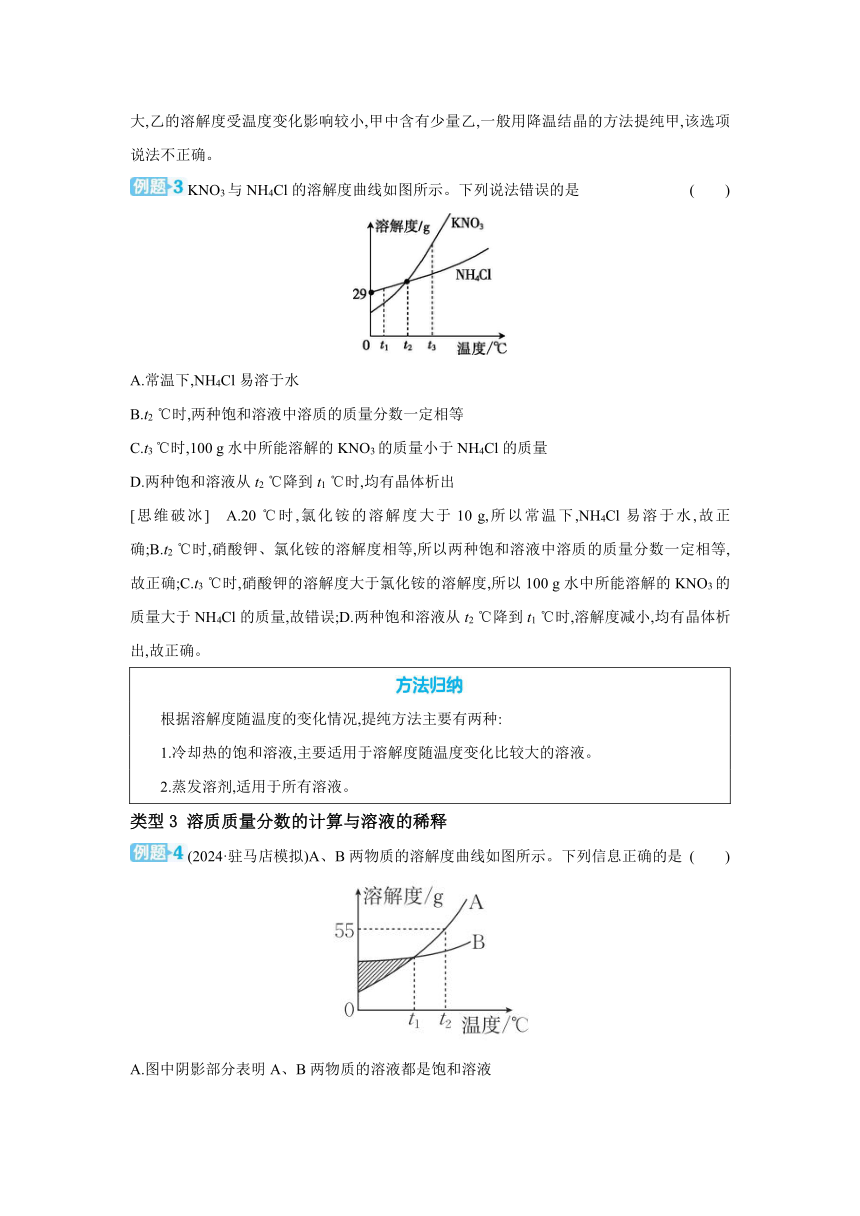
KNO3与NH4Cl的溶解度曲线如图所示。下列说法错误的是 ( )
A.常温下,NH4Cl易溶于水
B.t2 ℃时,两种饱和溶液中溶质的质量分数一定相等
C.t3 ℃时,100 g水中所能溶解的KNO3的质量小于NH4Cl的质量
D.两种饱和溶液从t2 ℃降到t1 ℃时,均有晶体析出
[思维破冰] A.20 ℃时,氯化铵的溶解度大于10 g,所以常温下,NH4Cl易溶于水,故正确;B.t2 ℃时,硝酸钾、氯化铵的溶解度相等,所以两种饱和溶液中溶质的质量分数一定相等,故正确;C.t3 ℃时,硝酸钾的溶解度大于氯化铵的溶解度,所以100 g水中所能溶解的KNO3的质量大于NH4Cl的质量,故错误;D.两种饱和溶液从t2 ℃降到t1 ℃时,溶解度减小,均有晶体析出,故正确。
根据溶解度随温度的变化情况,提纯方法主要有两种:
1.冷却热的饱和溶液,主要适用于溶解度随温度变化比较大的溶液。
2.蒸发溶剂,适用于所有溶液。
类型3 溶质质量分数的计算与溶液的稀释
(2024·驻马店模拟)A、B两物质的溶解度曲线如图所示。下列信息正确的是 ( )
A.图中阴影部分表明A、B两物质的溶液都是饱和溶液
B.t2℃时,A物质溶液的浓度大于B物质溶液的浓度
C.t1℃时,A、B两物质的饱和溶液中溶质的质量相等
D.t2℃时等质量的A、B两物质的饱和溶液降温到t1℃时析出溶质的质量:A>B
[思维破冰] A.图中阴影部分表明A是饱和溶液,B是不饱和溶液,故A不正确;B.t2℃时,不知道A、B两种物质的溶液是否达到饱和,不能判断A物质溶液的浓度与B物质溶液的浓度,故B不正确;C.t1℃时,A、B两物质的饱和溶液的质量未知,溶质质量不一定相等,故C不正确;D.t2℃时,A物质的溶解度大于B物质,A和B的溶解度都随温度的升高而增大,但B物质的溶解度受温度的影响较小,等质量的A、B两物质的饱和溶液中溶质的质量A>B,降温到t1℃时析出溶质的质量A>B,故D正确。
(2024·许昌模拟)硝酸钾、氯化钠的溶解度曲线如图所示。下列说法不正确的是 ( )
A.t ℃时,KNO3和NaCl的溶解度相等
B.50 ℃时,100 g NaCl饱和溶液中含有NaCl的质量为37 g
C.将t ℃时KNO3和NaCl的饱和溶液降温到10 ℃,均有晶体析出
D.将t ℃时等质量的KNO3和NaCl的饱和溶液升温到40 ℃,溶质质量分数:KNO3溶液=NaCl溶液
[思维破冰] A.t ℃时,KNO3与NaCl的溶解度曲线相交,此时二者的溶解度相等,不符合题意;B.50 ℃时,100 g NaCl饱和溶液中含有NaCl的质量为100 g××100%≈27 g,符合题意;C.KNO3和NaCl的溶解度均随温度的升高而增大,故将t ℃时的KNO3和NaCl的饱和溶液降温到10 ℃均有晶体析出,不符合题意;D.t ℃时,KNO3与NaCl的溶解度相等,等质量的KNO3和NaCl的饱和溶液溶质质量分数相等,KNO3和NaCl的溶解度均随温度的升高而增大,溶质、溶剂质量均不变,溶质质量分数不变,故升高温度,两者溶质质量分数仍相等,不符合题意。
溶液稀释问题的计算方法
溶质的质量分数=×100%
=×100%
溶液质量=密度×体积(m=ρV)
稀释问题:溶液稀释前后溶质的质量不变
w浓×m浓=w稀×m稀
类型4 质量曲线类
向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是 ( )
A.M点时,剩余固体是铜和氧化铜
B.M、N点时,溶液中的溶质均只有CuCl2
C.N、P点时,溶液的pH:N>P
D.混合物中铜的质量为(a-b) g
[思维破冰] A.向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,M点时,氧化铜未反应完全,则剩余固体是铜和氧化铜,故A正确。B.M、N点时,氧化铜和稀盐酸反应生成氯化铜和水,则溶液中的溶质均只有CuCl2,故B正确。C.N点时,氧化铜和稀盐酸反应完全,溶液显中性,溶液的pH等于7;P点时,稀盐酸过量,溶液显酸性,溶液的pH小于7,则N点时溶液的pH>P点时溶液的pH,故C正确。D.N点时,氧化铜和稀盐酸反应完全,则混合物中铜的质量为b g,故D不正确。
类型5 pH曲线类
向氢氧化钠溶液中不断滴入盐酸,得到的曲线如图所示。下列有关判断错误的是 ( )
A.a点时溶液中溶质有氢氧化钠和氯化钠
B.b点溶液中仅有1种溶质
C.c点溶液能使蓝色石蕊试纸变红
D.a、b、c三点的溶液中相等的量:Na+数目和水的质量
[思维破冰] A.a点时溶液呈碱性,说明氢氧化钠没有全部参加反应,有剩余,故溶液中含有氢氧化钠,氢氧化钠和盐酸能反应生成氯化钠,则溶液中含有氯化钠,故A正确;B.b点时溶液的pH=7,说明氢氧化钠和盐酸恰好完全反应,溶液中只含有生成的氯化钠,故B正确;C.c点时盐酸过量,溶液呈酸性,能使蓝色石蕊试纸变红,故C正确;D.该反应中生成水,故水的质量逐渐增加,故D错误。
题型专训
【基础作业】
1.(2024·濮阳三模)Na2CO3和 NaCl 的溶解度曲线如图所示。 下列说法不正确的是 ( )
A.t1 ℃时,Na2CO3和 NaCl 的溶解度相等
B.将t2 ℃的饱和NaCl溶液降温到t1 ℃,溶质质量分数变小
C.t2 ℃时,将30 g Na2CO3加入50 g水中充分溶解,得到70 g溶液
D.Na2CO3固体中含有少量 NaCl,可用蒸发结晶法提纯Na2CO3
2.(2024·洛阳二模)氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法正确的是 ( )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却热的饱和溶液的方法除去NaCl中的少量KNO3
C.将20 ℃的硝酸钾饱和溶液升温到60 ℃,溶液的溶质质量分数不变
D.40 ℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的质量为85 g
3.(2024·平顶山三模)下图是硝酸钾和氯化钾的溶解度曲线。下列说法不正确的是 ( )
A.t1 ℃时,硝酸钾和氯化钾的溶解度相等
B.硝酸钾中含有少量氯化钾可采用降温结晶的方法提纯硝酸钾
C.将t1 ℃的硝酸钾饱和溶液升温至 t2 ℃,溶质质量不变
D.t2 ℃时,硝酸钾饱和溶液中溶质与溶剂的质量比为11∶21
4.甲、乙两种固体的溶解度曲线如图所示。下列说法正确的是 ( )
A.甲的溶解度一定大于乙的溶解度
B.50 ℃时,甲、乙的饱和溶液分别降温至10 ℃,析出晶体的质量:甲>乙
C.20 ℃时,甲的饱和溶液中溶质和溶剂的质量比为1∶4
D.50 ℃时,等质量的甲、乙两物质的饱和溶液中,溶剂的质量大小关系:甲>乙
5.下图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是 ( )
A.使a、c的饱和溶液析出晶体都可以采用降温结晶的方法
B.t1 ℃时,a、c两种物质的溶液溶质质量分数一定相等
C.t2 ℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是a>b>c
D.在t2 ℃时,将30 g a物质加入50 g水中充分溶解,所得溶液质量为80 g
6.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是 ( )
A.t1 ℃时,甲、乙溶液的溶质质量分数相等
B.升高温度可将t1 ℃的乙的不饱和溶液变成饱和溶液
C.t2 ℃时,等质量甲、乙的饱和溶液中溶质质量:甲>乙
D.t2 ℃时,将30 g甲物质加入50 g水中充分溶解后,所得溶液质量为 80 g
7.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是 ( )
A.t1 ℃时,甲、乙的溶解度相等
B.丙的溶解度随温度的升高而增大
C.t2 ℃时,甲、丙溶液的溶质质量分数一定相等
D.将t3 ℃的等质量的甲、乙、丙三种物质的饱和溶液分别降温至t1 ℃,析出晶体最多的是乙
8.向过量的稀硫酸中加入一定质量的镁条,充分反应后绘制了下图所示的坐标曲线图,其中不正确的是 ( )
A. B.
C. D.
9.下列选项的叙述和所对应的图像正确的是 ( )
A. B.
C. D.
A.镁条在密闭容器中燃烧,容器里物质的总质量
B.电解水产生气体质量的关系
C.高温煅烧一定质量的石灰石
D.等体积、等质量分数的过氧化氢溶液制取氧气
10.(2024·洛阳三模)测定气体压强变化是进行实验监测的重要手段,如图甲,检查完气密性后向试管中加入少量氧化钙,试管中某数值y随时间变化的关系如图乙。下列说法错误的是 ( )
A.氧化钙与水反应放出热量
B.氢氧化钙的溶解度随着温度的升高而减小
C.y可以表示试管中溶液的质量
D.U形管内红墨水液面会出现左低右高的现象
11.(2024·南阳二模)向一定量稀盐酸中分别加入足量的水、锌粒、氢氧化钙溶液、硝酸银溶液,下列图示正确的是 ( )
A. B.
C. D.
12.下图是稀盐酸和氢氧化钠溶液反应过程中溶液pH变化规律的坐标曲线图。请认真观察,判断下列有关该实验事实的说法正确的是 ( )
A.用滴管滴加的溶液为氢氧化钠溶液
B.向A点时的溶液中滴加紫色石蕊溶液,溶液会变红
C.盐酸和氢氧化钠恰好完全反应时,对应的点为B点
D.曲线上C点对应的溶液中,溶质只有氯化钠
13.将稀盐酸逐渐加到盛有氧化铜的容器中,容器中溶液总质量随时间变化的关系正确的是 ( )
A. B.
C. D.
14.利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。如图1所示,某同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测得瓶内气压随时间的变化如图2所示。下列有关说法正确的是 ( )
A.对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸反应
B.对比分析c、d点可知,相同的气压时,碳酸钙粉末与稀盐酸反应速率更快
C.碳酸钙粉末产生的CO2质量更多
D.曲线②中b点表明反应已经结束
15.(2024·驻马店三模)下图为硫酸和氢氧化钠溶液反应时溶液pH变化情况。
(1)加入a mL甲溶液时,溶液中溶质的化学式为 。
(2)若将b mL甲溶液滴入与硫酸相同质量﹑相同质量分数的盐酸中,反应后所得溶液的pH (选填“>”“<”或“=”)7。
16.往硫酸和硫酸铜的混合溶液中,逐滴加入氢氧化钠溶液直至过量,根据实验事实绘制下图所示曲线。下列说法正确的是 ( )
A.a至b段有蓝色沉淀生成
B.c点所含的溶质种类最少
C.c至d段,溶液pH不断减小
D.d点时溶质种类为三种
17.下列图像与其描述不对应的是 ( )
A. B.
C. D.
A.高温煅烧一定质量的石灰石
B.用过量的红磷测定空气中氧气的含量
C.向一定量的锌粉中加入稀硫酸
D.向一定量的稀硫酸和硫酸镁混合溶液中滴入氢氧化钠溶液至过量
18.下列图像中有关量的变化趋势与对应叙述关系相符的是 ( )
A. B.
C. D.
A.向一定量的水中加入硝酸钾固体
B.向不饱和的氯化钠溶液中不断加入氯化钠固体
C.恒温条件下,将饱和氯化钠溶液蒸发适量水
D.温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙
19.小明将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化关系如图所示。下列分析不正确的是 ( )
A.AB段的化学反应是Al2O3+6HCl2AlCl3+3H2O
B.A 点盐酸浓度最低,C点盐酸浓度最大
C.CD段影响压强变化的主要因素是气体温度
D.E点处溶液中的溶质一定含有AlCl3,可能含有HCl
【素养作业】
20.(2024·南阳模拟)向一定量稀盐酸和氯化镁的混合溶液中逐滴加入一定溶质质量分数的氢氧化钡溶液至过量,得到某变化量X的变化关系如图所示。
(1)某变化量X可能是 (选填“溶液pH”或“沉淀质量”)。
(2)写出ab段发生反应的化学方程式: 。
(3)d点时,溶液中的溶质有哪些 。
21.下列四组实验均是向盛有不同物质的烧杯中逐滴加入X溶液至过量。生成沉淀或气体的质量与加入X溶液的质量关系如下,符合图像的一组是 ( )
组别 烧杯中的物质 X溶液
① CuSO4和Na2SO4的混合溶液 NaOH溶液
② 铜锌合金 稀硫酸
③ 稀硝酸和稀硫酸 BaCl2溶液
④ NaOH和Na2CO3的混合溶液 稀盐酸
A.① B.② C.③ D.④
22.向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图所示。下列分析正确的是 ( )
A.N点时的溶液一定呈红色
B.P点时的溶液能与纯碱发生反应
C.M→N过程中溶液的碱性逐渐增强
D.M→P过程中生成的硫酸钠不断增加
答案
例题1
(1)35 g 饱和
(2)不饱和
(3)升高温度(或增加溶剂) 降低温度(或增加溶剂)
(4)增加溶质(或恒温蒸发溶剂)
例题2 C
例题3 C
例题4 D
例题5 B
例题6 D
例题7 D
题型专训
1.D 【解析】A.由图可知,t1 ℃时,碳酸钠和氯化钠的溶解度曲线相交,则两者的溶解度相等,该选项说法正确;B.由于氯化钠的溶解度随温度降低而减小,饱和溶液的溶质质量分数=×100%,则溶质质量分数减小,该选项说法正确;C.t2 ℃时,碳酸钠的溶解度为40 g,则该温度下50 g水中最多可溶解碳酸钠的质量为40 g÷2=20 g,将30 gNa2CO3加入50 g水中充分溶解,得到溶液的质量为20 g+50 g=70 g,该选项说法正确;D.碳酸钠、氯化钠的溶解度均随温度的降低而减小,且碳酸钠的溶解度随温度影响比较大,故Na2CO3固体中含有少量NaCl,可用降温结晶法或冷却热饱和溶液法提纯 Na2CO3,该选项说法不正确。
2.C 【解析】A.在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也不能确定,故说法错误;B.NaCl的溶解度受温度影响较小,除去NaCl中少量的KNO3应该用蒸发结晶的方法,故说法错误;C.将20 ℃的硝酸钾饱和溶液升温到60 ℃,溶解度增大,溶质、溶剂质量都不变,所以溶液的溶质质量分数不变,故说法正确;D.40 ℃时,硝酸钾的溶解度是63.9 g,所以将35 g硝酸钾晶体放入50 g水中,充分搅拌后,只能溶解31.95 g的硝酸钾,所得溶液的质量为81.95 g,故说法错误。
3.D 【解析】A.t1 ℃时,硝酸钾和氯化钾的溶解度曲线相交,则t1 ℃时,硝酸钾和氯化钾的溶解度相等,说法正确,不符合题意;B.硝酸钾和氯化钾的溶解度均随温度的升高而增大,硝酸钾的溶解度受温度变化的影响较大,氯化钾的溶解度受温度变化的影响较小,则硝酸钾中含有少量氯化钾,可采用降温结晶的方法提纯硝酸钾,说法正确,不符合题意;C.将t1 ℃的硝酸钾饱和溶液升温至t2 ℃,硝酸钾的溶解度变大,变为t2 ℃的不饱和溶液,溶质质量不变,说法正确,不符合题意;D.t2 ℃时,硝酸钾的溶解度为110 g,则硝酸钾饱和溶液中溶质与溶剂的质量比为110 g∶100 g=11∶10,说法不正确,符合题意。
4.C 【解析】A.没有指定温度,甲的溶解度不一定大于乙的溶解度,故A错误;B.通过分析溶解度曲线可知,甲、乙两物质的溶解度都随温度的升高而增大,没有指定质量,50 ℃时,甲、乙的饱和溶液分别降温至10 ℃,甲析出晶体的质量不一定比乙的大,故B错误;C.20 ℃时,甲的溶解度为25 g,即100 g水中最多可以溶解25 g甲物质,所以甲的饱和溶液中溶质和溶剂的质量比为1∶4,故C正确;D.50 ℃时,甲物质的溶解度大于乙物质的溶解度,等质量的甲、乙两物质的饱和溶液中溶质甲物质的质量大于溶质乙物质的质量,则溶剂的质量大小关系为甲<乙,故D错误。
5.C 【解析】A.a物质的溶解度随温度的升高而增大,c物质的溶解度随温度的升高而减小,所以使a的饱和溶液析出晶体可以采用降温结晶的方法,但使c的饱和溶液析出晶体可以采用升温结晶的方法,故A错误;B.t1 ℃时,a、c两种物质的溶液状态不能确定,所以溶液的溶质质量分数不能确定,故B错误;C.t2 ℃时,a物质的溶解度最大,c物质的溶解度最小,所以a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是a>b>c,故C正确;D.在t2 ℃时,a物质的溶解度是50 g,所以将30 g a物质加入50 g水中充分溶解,只能溶解25 g的固体,所得溶液质量为75 g,故D错误。
6.C 【解析】A.t1 ℃时,甲、乙溶液的状态不能确定,无法比较二者的溶质质量分数,故A错误;B.乙的溶解度随温度的升高而增大,降温可将t1 ℃的乙的不饱和溶液变成饱和溶液,故B错误;C.t2 ℃时,甲的溶解度大于乙的溶解度,所以t2 ℃时,甲的饱和溶液的溶质质量分数大于乙的饱和溶液的溶质质量分数,则t2 ℃时,等质量甲、乙的饱和溶液中溶质质量大小关系为甲>乙,故C正确;D.t2 ℃时,甲物质的溶解度为30 g,则该温度下50 g水中最多能溶解15 g甲,故t2 ℃时,将30 g甲物质加入50 g水中充分溶解后所得溶液质量为65 g,故D错误。
7.A 【解析】A.由图可知,t1 ℃时,甲和乙的溶解度曲线相交,说明该温度下,甲、乙的溶解度相等,该选项说法正确;B.由图可知,丙的溶解度随温度的升高而减小,说法不正确;C.由图可知,t2 ℃时,甲和丙的溶解度相等,该温度下,甲、丙的饱和溶液的溶质质量分数相等,但是溶液状态未知,无法比较,该选项说法不正确;D.将t3 ℃的等质量的甲、乙、丙三种物质的饱和溶液分别降温至t1 ℃,降温后,丙的溶解度增大,变为不饱和溶液,无晶体析出,甲、乙的溶解度减小,有溶质析出,且甲的溶解度受温度影响比乙的大,故甲析出的晶体更多,即析出晶体最多的是甲,该选项说法不正确。
8.B 【解析】A.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,随着反应的进行,硫酸镁的质量逐渐增加,至完全反应不再发生改变,故选项图像正确;B.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,最终镁完全反应,质量减小至0,故选项图像错误;C.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,随着反应的进行,氢气的质量逐渐增加,至完全反应不再发生改变,故选项图像正确;D.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,随着反应的进行,稀硫酸中溶质的质量分数逐渐减小,最终稀硫酸有剩余,溶质质量分数不再发生改变,故选项图像正确。
9.B 【解析】A.根据质量守恒定律,镁条在密闭容器中(内含空气)燃烧,容器里物质的总质量不变,故选项图像错误;B.通电分解水,生成氢气和氧气的质量之比为1∶8,故选项图像正确;C.石灰石的主要成分碳酸钙高温分解生成氧化钙和二氧化碳,随着反应的进行,二氧化碳逸出,剩余固体的质量逐渐减小,至完全反应时不再发生改变,但不可能减小至0,故选项图像错误;D.等体积、等质量分数的过氧化氢溶液制取氧气,催化剂只能影响反应速率,不影响产生氧气的质量,有催化剂的反应速率快,完全反应所需时间短,故选项图像错误。
10.C
11.D 【解析】A.向一定量稀盐酸中加入足量的水,溶液的酸性逐渐减弱,溶液的pH逐渐变大,但溶液始终呈酸性,溶液的pH应始终小于7,选项错误;B.向一定量稀盐酸中加入足量的锌粒后,锌粒立即与稀盐酸反应生成氢气,氢气的质量立即逐渐增加,直至稀盐酸完全反应不再变化,选项错误;C.向一定量稀盐酸中加入足量的氢氧化钙溶液,溶液的质量增加,但溶液质量的起点不为0,选项错误;D.向一定量稀盐酸中加入足量的硝酸银溶液,硝酸银与稀盐酸反应生成氯化银沉淀和硝酸,氯化银沉淀的质量从零开始逐渐增加,直至稀盐酸完全反应,选项正确。
12.C 【解析】A.根据图中曲线的起点pH大于7,可知容器里的液体显碱性,是氢氧化钠溶液,则滴管中的液体是稀盐酸,错误;B.A点时溶液pH大于7,向A点时的溶液中滴加紫色石蕊溶液,溶液会变蓝,错误;C.酸碱恰好完全反应的点为B点,正确;D.曲线上C点的pH小于7,说明酸过量,此刻溶液中的溶质有NaCl和HCl,错误。
13.B 【解析】氧化铜和盐酸反应生成氯化铜和水,随着反应的进行,溶液质量增大,完全反应后继续加入稀盐酸,溶液质量增大,但是增大幅度减小,故选项B正确。
14.B 【解析】A.对比分析a、b点可知,曲线①单位时间内气压大,说明单位时间内产生的气体多,反应速率快,曲线①表示粉末状碳酸钙与稀盐酸反应,故选项说法错误;B.对比分析c、d点可知,相同的气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快,碳酸钙粉末与稀盐酸接触面积大,反应速率更快,故选项说法正确;C.最终曲线①②的气压相等,说明最终产生的CO2质量相等,故选项说法错误;D.曲线②中b点气压没达到最大值,反应没有结束,故选项说法错误。
15.(1)H2SO4、Na2SO4
(2)<
16.B 【解析】向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程中氢氧化钠先和硫酸反应,然后和硫酸铜反应。
A.a至b段,氢氧化钠与硫酸发生反应,没有蓝色沉淀生成,故说法错误;B.c点时硫酸铜恰好完全反应,此时对应溶液中的溶质只有硫酸钠,溶质种类最少,故说法正确;C.c至d段,氢氧化钠过量,溶液中氢氧化钠增多,碱性变强,pH变大,故说法错误;D.d点时氢氧化钠过量,此时对应溶液中的溶质有硫酸钠、氢氧化钠,溶质种类为两种,故说法错误。
17.B 【解析】A.高温煅烧石灰石生成固体氧化钙,固体质量减小,但不会减小到0,故A选项不符合题意; B.红磷过量,因此反应结束有剩余,质量不会减小到0,故B选项符合题意;C.锌与稀硫酸反应产生氢气,故C选项不符合题意;D.氢氧化钠先与稀硫酸反应,再与硫酸镁反应,故D选项不符合题意。
18.A 【解析】A.一定量的水中硝酸钾溶解的量有一定限度,故A选项符合题意;B.溶解氯化钠的过程中,溶剂的质量不会改变,故B选项不符合题意;C.温度不变,氯化钠的溶解度不变,饱和溶液蒸发水会析出固体,导致溶质质量减小,故C选项不符合题意;D.氧化钙与水反应放热,饱和氢氧化钙溶液的溶解度随温度的升高而减小,氢氧化钙析出,溶液质量减小,故D选项不符合题意。
19.B 【解析】A.因为铝的化学性质比较活泼,在空气中形成一层致密的氧化铝薄膜,将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,氧化铝先和稀盐酸反应,AB段的化学反应是Al2O3+3H2O,分析正确;B.A点时反应还没有开始,所以盐酸的浓度最大,C点时反应完全,盐酸浓度最低,分析错误;C.由于铝和盐酸的反应是放热反应,温度升高,完全反应以后,随着温度的下降,气压会降低,CD段影响压强变化的主要因素是气体温度,分析正确;D.E点反应结束,此点处溶液中的溶质一定含有AlCl3,可能含有HCl,分析正确。
20.(1)溶液pH
(2)2HCl+Ba(OH)2BaCl2+2H2O
(3)氯化钡、氢氧化钡[或BaCl2、Ba(OH)2]
【解析】(1)向一定量稀盐酸和氯化镁的混合溶液中逐滴加入一定溶质质量分数的氢氧化钡溶液至过量,氢氧化钡先与盐酸反应生成氯化钡和水,待盐酸反应完全,氯化镁和氢氧化钡反应生成氢氧化镁沉淀和氯化钡,所以加入氢氧化钡一段时间后,才会产生沉淀,随着反应的进行,沉淀的质量增大,至完全反应不再发生变化,故图示变化量X不能表示沉淀的质量。氢氧化钡先与盐酸反应生成氯化钡和水(ab段),随着反应的进行,盐酸被消耗,溶液的酸性减弱,pH逐渐增大,待盐酸恰好完全反应,溶液显中性,溶液的pH为7,继续滴加氢氧化钡,氯化镁和氢氧化钡反应生成氢氧化镁沉淀和氯化钡(bc段),此过程中溶液的pH保持不变,待氯化镁恰好反应完全(c点),继续滴加氢氧化钡溶液(c点以后),氢氧化钡过量,溶液的碱性增强,pH增大至大于7,图示变化量X可能是溶液pH。
(2)由(1)分析可知,ab段是氢氧化钡和盐酸反应生成氯化钡和水,化学方程式为2HCl+Ba(OH)2BaCl2+2H2O。
(3)由(1)分析可知,c点时氯化镁恰好完全反应,d点时氢氧化钡溶液过量,此时溶液中的溶质为生成的氯化钡和过量的氢氧化钡。
21.D 【解析】A.向硫酸铜和硫酸钠的混合溶液中逐滴加入氢氧化钠溶液,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,一开始就有沉淀生成,生成沉淀的质量逐渐增大,待完全反应后,不再变化,不符合题意;B.向铜锌合金中加入稀硫酸,锌和稀硫酸反应生成硫酸锌和氢气,一开始就有气体生成,生成气体的质量逐渐增大,待完全反应后,不再变化,不符合题意;C.向稀硝酸和稀硫酸的混合溶液中加入氯化钡溶液,氯化钡和硫酸反应生成硫酸钡沉淀和盐酸,硫酸钡沉淀难溶于酸,一开始就有沉淀生成,生成沉淀的质量逐渐增大,待完全反应后,不再变化,不符合题意;D.向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸,氢氧化钠先与稀盐酸反应生成氯化钠和水,待氢氧化钠完全反应后,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,故一开始无气体生成,后生成气体的质量逐渐增大,待完全反应后,不再变化,符合题意。
22.B 【解析】A.N点时,硫酸和氢氧化钠恰好完全反应,溶液此时呈中性,酚酞溶液在中性溶液中是无色的,错误。B.P点时,硫酸过量了,溶液中含有硫酸,硫酸和纯碱(碳酸钠)能发生反应产生硫酸钠、水和二氧化碳,正确。C.根据图像,M→N过程中溶液的碱性逐渐减弱,M点pH大于7,N点pH=7,错误。D.M→N过程中,硫酸和氢氧化钠反应产生硫酸钠和水,该过程中生成的硫酸钠不断增加;N点时,两者恰好完全反应,N→P过程中硫酸过量,没有硫酸钠产生,错误。
题型分析 —— 河南中考特色题型分析
1.固体物质的溶解度及溶解度曲线是我省中考的高频考点,在以往每年的中考试题中都有涉及,常以选择题和填空题的形式进行考查,所占分值为1~3分;在填空题中常与物质的提纯、饱和溶液与不饱和溶液的相互转化、溶质质量分数的计算等结合在一起进行考查。
2.图像曲线具有形象直观、简明清晰、覆盖知识面广、综合性强等特点。解题时首先要仔细审题,看清题目的要求和要解决的问题,提炼题目中关键字眼;其次理解图像的横纵坐标、起点、拐点(反映了物质反应的先后顺序)、终点(反应何时终止)的含义;然后结合题目条件分析出每段图像对应的信息;再根据已知量对未知的应求量进行求解计算即可,同时要注意将数学、物理、生物与化学知识结合,应用多学科的思维来解决问题。
举例精讲 ——河南中考特色题型突破
类型1 饱和溶液与不饱和溶液的判断及转化
下图是A、B固体的溶解度曲线。
(1)40 ℃时,12 g A物质加入25 g水中充分溶解,形成的溶液质量为 ,该溶液属于 (选填“饱和”或“不饱和”)溶液。
(2)50 ℃时,A溶液中溶质与溶剂的质量比是3∶8,那么A溶液是 (选填“饱和”或“不饱和”)溶液。
(3)使A的饱和溶液转化为不饱和溶液的方法有 (填一种,下同),使B的饱和溶液转化为不饱和溶液的方法有 。
(4)在温度不变的条件下,使A的不饱和溶液转化为饱和溶液的方法有 。
[思维破冰] (1)40 ℃时A的溶解度为40 g,也就是说在该温度下100 g水中最多可以溶解40 g A物质,所以25 g水中最多可以溶解10 g A,因此将12 g A物质加入25 g水中充分溶解后,有2 g A无法溶解,故所得溶液质量为35 g,且该溶液属于饱和溶液。
(2)50 ℃时,A物质的溶解度为60 g,即100 g水中最多可以溶解60 g A物质,此时,溶质与溶剂质量比为60∶100=3∶5>3∶8,所以,溶质与溶剂的质量比是3∶8的溶液为不饱和溶液。
(3)饱和溶液转化为不饱和溶液的方法有根据不同物质的性质升高(或降低)温度、增加溶剂。
(4)温度不变的条件下,使不饱和溶液转化为饱和溶液的方法有增加溶质(或恒温蒸发溶剂)。
饱和溶液与不饱和溶液的转化
类型2 根据溶解度曲线的升降情况判断提纯方法
两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是 ( )
A.乙的饱和溶液由t2 ℃降温至t1 ℃,变为不饱和溶液
B.t1 ℃的甲、乙两物质的饱和溶液升温到t2 ℃,甲溶液的溶质质量分数大于乙溶液的溶质质量分数
C.t1 ℃时向质量分数为20%的甲溶液中加入溶质,可以得到质量分数为30%的甲溶液
D.甲中含有少量乙,一般用蒸发溶剂的方法提纯甲
[思维破冰] A.乙的溶解度随着温度的降低而减小,饱和溶液由t2 ℃降温至t1 ℃,仍然是饱和溶液,该选项说法不正确;B.t1 ℃时甲和乙的溶解度相等,甲、乙两物质的饱和溶液质量分数相等,升温到t2 ℃,都变成不饱和溶液,甲溶液的溶质质量分数等于乙溶液的溶质质量分数,该选项说法不正确;C.t1 ℃时甲的饱和溶液质量分数为33.3%,向质量分数为20%的甲溶液中加入溶质,可以得到质量分数为30%的甲溶液,该选项说法正确;D.甲的溶解度受温度变化影响较大,乙的溶解度受温度变化影响较小,甲中含有少量乙,一般用降温结晶的方法提纯甲,该选项说法不正确。
KNO3与NH4Cl的溶解度曲线如图所示。下列说法错误的是 ( )
A.常温下,NH4Cl易溶于水
B.t2 ℃时,两种饱和溶液中溶质的质量分数一定相等
C.t3 ℃时,100 g水中所能溶解的KNO3的质量小于NH4Cl的质量
D.两种饱和溶液从t2 ℃降到t1 ℃时,均有晶体析出
[思维破冰] A.20 ℃时,氯化铵的溶解度大于10 g,所以常温下,NH4Cl易溶于水,故正确;B.t2 ℃时,硝酸钾、氯化铵的溶解度相等,所以两种饱和溶液中溶质的质量分数一定相等,故正确;C.t3 ℃时,硝酸钾的溶解度大于氯化铵的溶解度,所以100 g水中所能溶解的KNO3的质量大于NH4Cl的质量,故错误;D.两种饱和溶液从t2 ℃降到t1 ℃时,溶解度减小,均有晶体析出,故正确。
根据溶解度随温度的变化情况,提纯方法主要有两种:
1.冷却热的饱和溶液,主要适用于溶解度随温度变化比较大的溶液。
2.蒸发溶剂,适用于所有溶液。
类型3 溶质质量分数的计算与溶液的稀释
(2024·驻马店模拟)A、B两物质的溶解度曲线如图所示。下列信息正确的是 ( )
A.图中阴影部分表明A、B两物质的溶液都是饱和溶液
B.t2℃时,A物质溶液的浓度大于B物质溶液的浓度
C.t1℃时,A、B两物质的饱和溶液中溶质的质量相等
D.t2℃时等质量的A、B两物质的饱和溶液降温到t1℃时析出溶质的质量:A>B
[思维破冰] A.图中阴影部分表明A是饱和溶液,B是不饱和溶液,故A不正确;B.t2℃时,不知道A、B两种物质的溶液是否达到饱和,不能判断A物质溶液的浓度与B物质溶液的浓度,故B不正确;C.t1℃时,A、B两物质的饱和溶液的质量未知,溶质质量不一定相等,故C不正确;D.t2℃时,A物质的溶解度大于B物质,A和B的溶解度都随温度的升高而增大,但B物质的溶解度受温度的影响较小,等质量的A、B两物质的饱和溶液中溶质的质量A>B,降温到t1℃时析出溶质的质量A>B,故D正确。
(2024·许昌模拟)硝酸钾、氯化钠的溶解度曲线如图所示。下列说法不正确的是 ( )
A.t ℃时,KNO3和NaCl的溶解度相等
B.50 ℃时,100 g NaCl饱和溶液中含有NaCl的质量为37 g
C.将t ℃时KNO3和NaCl的饱和溶液降温到10 ℃,均有晶体析出
D.将t ℃时等质量的KNO3和NaCl的饱和溶液升温到40 ℃,溶质质量分数:KNO3溶液=NaCl溶液
[思维破冰] A.t ℃时,KNO3与NaCl的溶解度曲线相交,此时二者的溶解度相等,不符合题意;B.50 ℃时,100 g NaCl饱和溶液中含有NaCl的质量为100 g××100%≈27 g,符合题意;C.KNO3和NaCl的溶解度均随温度的升高而增大,故将t ℃时的KNO3和NaCl的饱和溶液降温到10 ℃均有晶体析出,不符合题意;D.t ℃时,KNO3与NaCl的溶解度相等,等质量的KNO3和NaCl的饱和溶液溶质质量分数相等,KNO3和NaCl的溶解度均随温度的升高而增大,溶质、溶剂质量均不变,溶质质量分数不变,故升高温度,两者溶质质量分数仍相等,不符合题意。
溶液稀释问题的计算方法
溶质的质量分数=×100%
=×100%
溶液质量=密度×体积(m=ρV)
稀释问题:溶液稀释前后溶质的质量不变
w浓×m浓=w稀×m稀
类型4 质量曲线类
向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是 ( )
A.M点时,剩余固体是铜和氧化铜
B.M、N点时,溶液中的溶质均只有CuCl2
C.N、P点时,溶液的pH:N>P
D.混合物中铜的质量为(a-b) g
[思维破冰] A.向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,M点时,氧化铜未反应完全,则剩余固体是铜和氧化铜,故A正确。B.M、N点时,氧化铜和稀盐酸反应生成氯化铜和水,则溶液中的溶质均只有CuCl2,故B正确。C.N点时,氧化铜和稀盐酸反应完全,溶液显中性,溶液的pH等于7;P点时,稀盐酸过量,溶液显酸性,溶液的pH小于7,则N点时溶液的pH>P点时溶液的pH,故C正确。D.N点时,氧化铜和稀盐酸反应完全,则混合物中铜的质量为b g,故D不正确。
类型5 pH曲线类
向氢氧化钠溶液中不断滴入盐酸,得到的曲线如图所示。下列有关判断错误的是 ( )
A.a点时溶液中溶质有氢氧化钠和氯化钠
B.b点溶液中仅有1种溶质
C.c点溶液能使蓝色石蕊试纸变红
D.a、b、c三点的溶液中相等的量:Na+数目和水的质量
[思维破冰] A.a点时溶液呈碱性,说明氢氧化钠没有全部参加反应,有剩余,故溶液中含有氢氧化钠,氢氧化钠和盐酸能反应生成氯化钠,则溶液中含有氯化钠,故A正确;B.b点时溶液的pH=7,说明氢氧化钠和盐酸恰好完全反应,溶液中只含有生成的氯化钠,故B正确;C.c点时盐酸过量,溶液呈酸性,能使蓝色石蕊试纸变红,故C正确;D.该反应中生成水,故水的质量逐渐增加,故D错误。
题型专训
【基础作业】
1.(2024·濮阳三模)Na2CO3和 NaCl 的溶解度曲线如图所示。 下列说法不正确的是 ( )
A.t1 ℃时,Na2CO3和 NaCl 的溶解度相等
B.将t2 ℃的饱和NaCl溶液降温到t1 ℃,溶质质量分数变小
C.t2 ℃时,将30 g Na2CO3加入50 g水中充分溶解,得到70 g溶液
D.Na2CO3固体中含有少量 NaCl,可用蒸发结晶法提纯Na2CO3
2.(2024·洛阳二模)氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法正确的是 ( )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却热的饱和溶液的方法除去NaCl中的少量KNO3
C.将20 ℃的硝酸钾饱和溶液升温到60 ℃,溶液的溶质质量分数不变
D.40 ℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的质量为85 g
3.(2024·平顶山三模)下图是硝酸钾和氯化钾的溶解度曲线。下列说法不正确的是 ( )
A.t1 ℃时,硝酸钾和氯化钾的溶解度相等
B.硝酸钾中含有少量氯化钾可采用降温结晶的方法提纯硝酸钾
C.将t1 ℃的硝酸钾饱和溶液升温至 t2 ℃,溶质质量不变
D.t2 ℃时,硝酸钾饱和溶液中溶质与溶剂的质量比为11∶21
4.甲、乙两种固体的溶解度曲线如图所示。下列说法正确的是 ( )
A.甲的溶解度一定大于乙的溶解度
B.50 ℃时,甲、乙的饱和溶液分别降温至10 ℃,析出晶体的质量:甲>乙
C.20 ℃时,甲的饱和溶液中溶质和溶剂的质量比为1∶4
D.50 ℃时,等质量的甲、乙两物质的饱和溶液中,溶剂的质量大小关系:甲>乙
5.下图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是 ( )
A.使a、c的饱和溶液析出晶体都可以采用降温结晶的方法
B.t1 ℃时,a、c两种物质的溶液溶质质量分数一定相等
C.t2 ℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是a>b>c
D.在t2 ℃时,将30 g a物质加入50 g水中充分溶解,所得溶液质量为80 g
6.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是 ( )
A.t1 ℃时,甲、乙溶液的溶质质量分数相等
B.升高温度可将t1 ℃的乙的不饱和溶液变成饱和溶液
C.t2 ℃时,等质量甲、乙的饱和溶液中溶质质量:甲>乙
D.t2 ℃时,将30 g甲物质加入50 g水中充分溶解后,所得溶液质量为 80 g
7.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法正确的是 ( )
A.t1 ℃时,甲、乙的溶解度相等
B.丙的溶解度随温度的升高而增大
C.t2 ℃时,甲、丙溶液的溶质质量分数一定相等
D.将t3 ℃的等质量的甲、乙、丙三种物质的饱和溶液分别降温至t1 ℃,析出晶体最多的是乙
8.向过量的稀硫酸中加入一定质量的镁条,充分反应后绘制了下图所示的坐标曲线图,其中不正确的是 ( )
A. B.
C. D.
9.下列选项的叙述和所对应的图像正确的是 ( )
A. B.
C. D.
A.镁条在密闭容器中燃烧,容器里物质的总质量
B.电解水产生气体质量的关系
C.高温煅烧一定质量的石灰石
D.等体积、等质量分数的过氧化氢溶液制取氧气
10.(2024·洛阳三模)测定气体压强变化是进行实验监测的重要手段,如图甲,检查完气密性后向试管中加入少量氧化钙,试管中某数值y随时间变化的关系如图乙。下列说法错误的是 ( )
A.氧化钙与水反应放出热量
B.氢氧化钙的溶解度随着温度的升高而减小
C.y可以表示试管中溶液的质量
D.U形管内红墨水液面会出现左低右高的现象
11.(2024·南阳二模)向一定量稀盐酸中分别加入足量的水、锌粒、氢氧化钙溶液、硝酸银溶液,下列图示正确的是 ( )
A. B.
C. D.
12.下图是稀盐酸和氢氧化钠溶液反应过程中溶液pH变化规律的坐标曲线图。请认真观察,判断下列有关该实验事实的说法正确的是 ( )
A.用滴管滴加的溶液为氢氧化钠溶液
B.向A点时的溶液中滴加紫色石蕊溶液,溶液会变红
C.盐酸和氢氧化钠恰好完全反应时,对应的点为B点
D.曲线上C点对应的溶液中,溶质只有氯化钠
13.将稀盐酸逐渐加到盛有氧化铜的容器中,容器中溶液总质量随时间变化的关系正确的是 ( )
A. B.
C. D.
14.利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。如图1所示,某同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测得瓶内气压随时间的变化如图2所示。下列有关说法正确的是 ( )
A.对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸反应
B.对比分析c、d点可知,相同的气压时,碳酸钙粉末与稀盐酸反应速率更快
C.碳酸钙粉末产生的CO2质量更多
D.曲线②中b点表明反应已经结束
15.(2024·驻马店三模)下图为硫酸和氢氧化钠溶液反应时溶液pH变化情况。
(1)加入a mL甲溶液时,溶液中溶质的化学式为 。
(2)若将b mL甲溶液滴入与硫酸相同质量﹑相同质量分数的盐酸中,反应后所得溶液的pH (选填“>”“<”或“=”)7。
16.往硫酸和硫酸铜的混合溶液中,逐滴加入氢氧化钠溶液直至过量,根据实验事实绘制下图所示曲线。下列说法正确的是 ( )
A.a至b段有蓝色沉淀生成
B.c点所含的溶质种类最少
C.c至d段,溶液pH不断减小
D.d点时溶质种类为三种
17.下列图像与其描述不对应的是 ( )
A. B.
C. D.
A.高温煅烧一定质量的石灰石
B.用过量的红磷测定空气中氧气的含量
C.向一定量的锌粉中加入稀硫酸
D.向一定量的稀硫酸和硫酸镁混合溶液中滴入氢氧化钠溶液至过量
18.下列图像中有关量的变化趋势与对应叙述关系相符的是 ( )
A. B.
C. D.
A.向一定量的水中加入硝酸钾固体
B.向不饱和的氯化钠溶液中不断加入氯化钠固体
C.恒温条件下,将饱和氯化钠溶液蒸发适量水
D.温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙
19.小明将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化关系如图所示。下列分析不正确的是 ( )
A.AB段的化学反应是Al2O3+6HCl2AlCl3+3H2O
B.A 点盐酸浓度最低,C点盐酸浓度最大
C.CD段影响压强变化的主要因素是气体温度
D.E点处溶液中的溶质一定含有AlCl3,可能含有HCl
【素养作业】
20.(2024·南阳模拟)向一定量稀盐酸和氯化镁的混合溶液中逐滴加入一定溶质质量分数的氢氧化钡溶液至过量,得到某变化量X的变化关系如图所示。
(1)某变化量X可能是 (选填“溶液pH”或“沉淀质量”)。
(2)写出ab段发生反应的化学方程式: 。
(3)d点时,溶液中的溶质有哪些 。
21.下列四组实验均是向盛有不同物质的烧杯中逐滴加入X溶液至过量。生成沉淀或气体的质量与加入X溶液的质量关系如下,符合图像的一组是 ( )
组别 烧杯中的物质 X溶液
① CuSO4和Na2SO4的混合溶液 NaOH溶液
② 铜锌合金 稀硫酸
③ 稀硝酸和稀硫酸 BaCl2溶液
④ NaOH和Na2CO3的混合溶液 稀盐酸
A.① B.② C.③ D.④
22.向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图所示。下列分析正确的是 ( )
A.N点时的溶液一定呈红色
B.P点时的溶液能与纯碱发生反应
C.M→N过程中溶液的碱性逐渐增强
D.M→P过程中生成的硫酸钠不断增加
答案
例题1
(1)35 g 饱和
(2)不饱和
(3)升高温度(或增加溶剂) 降低温度(或增加溶剂)
(4)增加溶质(或恒温蒸发溶剂)
例题2 C
例题3 C
例题4 D
例题5 B
例题6 D
例题7 D
题型专训
1.D 【解析】A.由图可知,t1 ℃时,碳酸钠和氯化钠的溶解度曲线相交,则两者的溶解度相等,该选项说法正确;B.由于氯化钠的溶解度随温度降低而减小,饱和溶液的溶质质量分数=×100%,则溶质质量分数减小,该选项说法正确;C.t2 ℃时,碳酸钠的溶解度为40 g,则该温度下50 g水中最多可溶解碳酸钠的质量为40 g÷2=20 g,将30 gNa2CO3加入50 g水中充分溶解,得到溶液的质量为20 g+50 g=70 g,该选项说法正确;D.碳酸钠、氯化钠的溶解度均随温度的降低而减小,且碳酸钠的溶解度随温度影响比较大,故Na2CO3固体中含有少量NaCl,可用降温结晶法或冷却热饱和溶液法提纯 Na2CO3,该选项说法不正确。
2.C 【解析】A.在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也不能确定,故说法错误;B.NaCl的溶解度受温度影响较小,除去NaCl中少量的KNO3应该用蒸发结晶的方法,故说法错误;C.将20 ℃的硝酸钾饱和溶液升温到60 ℃,溶解度增大,溶质、溶剂质量都不变,所以溶液的溶质质量分数不变,故说法正确;D.40 ℃时,硝酸钾的溶解度是63.9 g,所以将35 g硝酸钾晶体放入50 g水中,充分搅拌后,只能溶解31.95 g的硝酸钾,所得溶液的质量为81.95 g,故说法错误。
3.D 【解析】A.t1 ℃时,硝酸钾和氯化钾的溶解度曲线相交,则t1 ℃时,硝酸钾和氯化钾的溶解度相等,说法正确,不符合题意;B.硝酸钾和氯化钾的溶解度均随温度的升高而增大,硝酸钾的溶解度受温度变化的影响较大,氯化钾的溶解度受温度变化的影响较小,则硝酸钾中含有少量氯化钾,可采用降温结晶的方法提纯硝酸钾,说法正确,不符合题意;C.将t1 ℃的硝酸钾饱和溶液升温至t2 ℃,硝酸钾的溶解度变大,变为t2 ℃的不饱和溶液,溶质质量不变,说法正确,不符合题意;D.t2 ℃时,硝酸钾的溶解度为110 g,则硝酸钾饱和溶液中溶质与溶剂的质量比为110 g∶100 g=11∶10,说法不正确,符合题意。
4.C 【解析】A.没有指定温度,甲的溶解度不一定大于乙的溶解度,故A错误;B.通过分析溶解度曲线可知,甲、乙两物质的溶解度都随温度的升高而增大,没有指定质量,50 ℃时,甲、乙的饱和溶液分别降温至10 ℃,甲析出晶体的质量不一定比乙的大,故B错误;C.20 ℃时,甲的溶解度为25 g,即100 g水中最多可以溶解25 g甲物质,所以甲的饱和溶液中溶质和溶剂的质量比为1∶4,故C正确;D.50 ℃时,甲物质的溶解度大于乙物质的溶解度,等质量的甲、乙两物质的饱和溶液中溶质甲物质的质量大于溶质乙物质的质量,则溶剂的质量大小关系为甲<乙,故D错误。
5.C 【解析】A.a物质的溶解度随温度的升高而增大,c物质的溶解度随温度的升高而减小,所以使a的饱和溶液析出晶体可以采用降温结晶的方法,但使c的饱和溶液析出晶体可以采用升温结晶的方法,故A错误;B.t1 ℃时,a、c两种物质的溶液状态不能确定,所以溶液的溶质质量分数不能确定,故B错误;C.t2 ℃时,a物质的溶解度最大,c物质的溶解度最小,所以a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是a>b>c,故C正确;D.在t2 ℃时,a物质的溶解度是50 g,所以将30 g a物质加入50 g水中充分溶解,只能溶解25 g的固体,所得溶液质量为75 g,故D错误。
6.C 【解析】A.t1 ℃时,甲、乙溶液的状态不能确定,无法比较二者的溶质质量分数,故A错误;B.乙的溶解度随温度的升高而增大,降温可将t1 ℃的乙的不饱和溶液变成饱和溶液,故B错误;C.t2 ℃时,甲的溶解度大于乙的溶解度,所以t2 ℃时,甲的饱和溶液的溶质质量分数大于乙的饱和溶液的溶质质量分数,则t2 ℃时,等质量甲、乙的饱和溶液中溶质质量大小关系为甲>乙,故C正确;D.t2 ℃时,甲物质的溶解度为30 g,则该温度下50 g水中最多能溶解15 g甲,故t2 ℃时,将30 g甲物质加入50 g水中充分溶解后所得溶液质量为65 g,故D错误。
7.A 【解析】A.由图可知,t1 ℃时,甲和乙的溶解度曲线相交,说明该温度下,甲、乙的溶解度相等,该选项说法正确;B.由图可知,丙的溶解度随温度的升高而减小,说法不正确;C.由图可知,t2 ℃时,甲和丙的溶解度相等,该温度下,甲、丙的饱和溶液的溶质质量分数相等,但是溶液状态未知,无法比较,该选项说法不正确;D.将t3 ℃的等质量的甲、乙、丙三种物质的饱和溶液分别降温至t1 ℃,降温后,丙的溶解度增大,变为不饱和溶液,无晶体析出,甲、乙的溶解度减小,有溶质析出,且甲的溶解度受温度影响比乙的大,故甲析出的晶体更多,即析出晶体最多的是甲,该选项说法不正确。
8.B 【解析】A.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,随着反应的进行,硫酸镁的质量逐渐增加,至完全反应不再发生改变,故选项图像正确;B.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,最终镁完全反应,质量减小至0,故选项图像错误;C.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,随着反应的进行,氢气的质量逐渐增加,至完全反应不再发生改变,故选项图像正确;D.向过量的稀硫酸中加入一定质量的镁条,镁与稀硫酸反应生成硫酸镁和氢气,随着反应的进行,稀硫酸中溶质的质量分数逐渐减小,最终稀硫酸有剩余,溶质质量分数不再发生改变,故选项图像正确。
9.B 【解析】A.根据质量守恒定律,镁条在密闭容器中(内含空气)燃烧,容器里物质的总质量不变,故选项图像错误;B.通电分解水,生成氢气和氧气的质量之比为1∶8,故选项图像正确;C.石灰石的主要成分碳酸钙高温分解生成氧化钙和二氧化碳,随着反应的进行,二氧化碳逸出,剩余固体的质量逐渐减小,至完全反应时不再发生改变,但不可能减小至0,故选项图像错误;D.等体积、等质量分数的过氧化氢溶液制取氧气,催化剂只能影响反应速率,不影响产生氧气的质量,有催化剂的反应速率快,完全反应所需时间短,故选项图像错误。
10.C
11.D 【解析】A.向一定量稀盐酸中加入足量的水,溶液的酸性逐渐减弱,溶液的pH逐渐变大,但溶液始终呈酸性,溶液的pH应始终小于7,选项错误;B.向一定量稀盐酸中加入足量的锌粒后,锌粒立即与稀盐酸反应生成氢气,氢气的质量立即逐渐增加,直至稀盐酸完全反应不再变化,选项错误;C.向一定量稀盐酸中加入足量的氢氧化钙溶液,溶液的质量增加,但溶液质量的起点不为0,选项错误;D.向一定量稀盐酸中加入足量的硝酸银溶液,硝酸银与稀盐酸反应生成氯化银沉淀和硝酸,氯化银沉淀的质量从零开始逐渐增加,直至稀盐酸完全反应,选项正确。
12.C 【解析】A.根据图中曲线的起点pH大于7,可知容器里的液体显碱性,是氢氧化钠溶液,则滴管中的液体是稀盐酸,错误;B.A点时溶液pH大于7,向A点时的溶液中滴加紫色石蕊溶液,溶液会变蓝,错误;C.酸碱恰好完全反应的点为B点,正确;D.曲线上C点的pH小于7,说明酸过量,此刻溶液中的溶质有NaCl和HCl,错误。
13.B 【解析】氧化铜和盐酸反应生成氯化铜和水,随着反应的进行,溶液质量增大,完全反应后继续加入稀盐酸,溶液质量增大,但是增大幅度减小,故选项B正确。
14.B 【解析】A.对比分析a、b点可知,曲线①单位时间内气压大,说明单位时间内产生的气体多,反应速率快,曲线①表示粉末状碳酸钙与稀盐酸反应,故选项说法错误;B.对比分析c、d点可知,相同的气压时,c所需的时间短,说明单位时间内产生的气体多,反应速率快,碳酸钙粉末与稀盐酸接触面积大,反应速率更快,故选项说法正确;C.最终曲线①②的气压相等,说明最终产生的CO2质量相等,故选项说法错误;D.曲线②中b点气压没达到最大值,反应没有结束,故选项说法错误。
15.(1)H2SO4、Na2SO4
(2)<
16.B 【解析】向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程中氢氧化钠先和硫酸反应,然后和硫酸铜反应。
A.a至b段,氢氧化钠与硫酸发生反应,没有蓝色沉淀生成,故说法错误;B.c点时硫酸铜恰好完全反应,此时对应溶液中的溶质只有硫酸钠,溶质种类最少,故说法正确;C.c至d段,氢氧化钠过量,溶液中氢氧化钠增多,碱性变强,pH变大,故说法错误;D.d点时氢氧化钠过量,此时对应溶液中的溶质有硫酸钠、氢氧化钠,溶质种类为两种,故说法错误。
17.B 【解析】A.高温煅烧石灰石生成固体氧化钙,固体质量减小,但不会减小到0,故A选项不符合题意; B.红磷过量,因此反应结束有剩余,质量不会减小到0,故B选项符合题意;C.锌与稀硫酸反应产生氢气,故C选项不符合题意;D.氢氧化钠先与稀硫酸反应,再与硫酸镁反应,故D选项不符合题意。
18.A 【解析】A.一定量的水中硝酸钾溶解的量有一定限度,故A选项符合题意;B.溶解氯化钠的过程中,溶剂的质量不会改变,故B选项不符合题意;C.温度不变,氯化钠的溶解度不变,饱和溶液蒸发水会析出固体,导致溶质质量减小,故C选项不符合题意;D.氧化钙与水反应放热,饱和氢氧化钙溶液的溶解度随温度的升高而减小,氢氧化钙析出,溶液质量减小,故D选项不符合题意。
19.B 【解析】A.因为铝的化学性质比较活泼,在空气中形成一层致密的氧化铝薄膜,将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,氧化铝先和稀盐酸反应,AB段的化学反应是Al2O3+3H2O,分析正确;B.A点时反应还没有开始,所以盐酸的浓度最大,C点时反应完全,盐酸浓度最低,分析错误;C.由于铝和盐酸的反应是放热反应,温度升高,完全反应以后,随着温度的下降,气压会降低,CD段影响压强变化的主要因素是气体温度,分析正确;D.E点反应结束,此点处溶液中的溶质一定含有AlCl3,可能含有HCl,分析正确。
20.(1)溶液pH
(2)2HCl+Ba(OH)2BaCl2+2H2O
(3)氯化钡、氢氧化钡[或BaCl2、Ba(OH)2]
【解析】(1)向一定量稀盐酸和氯化镁的混合溶液中逐滴加入一定溶质质量分数的氢氧化钡溶液至过量,氢氧化钡先与盐酸反应生成氯化钡和水,待盐酸反应完全,氯化镁和氢氧化钡反应生成氢氧化镁沉淀和氯化钡,所以加入氢氧化钡一段时间后,才会产生沉淀,随着反应的进行,沉淀的质量增大,至完全反应不再发生变化,故图示变化量X不能表示沉淀的质量。氢氧化钡先与盐酸反应生成氯化钡和水(ab段),随着反应的进行,盐酸被消耗,溶液的酸性减弱,pH逐渐增大,待盐酸恰好完全反应,溶液显中性,溶液的pH为7,继续滴加氢氧化钡,氯化镁和氢氧化钡反应生成氢氧化镁沉淀和氯化钡(bc段),此过程中溶液的pH保持不变,待氯化镁恰好反应完全(c点),继续滴加氢氧化钡溶液(c点以后),氢氧化钡过量,溶液的碱性增强,pH增大至大于7,图示变化量X可能是溶液pH。
(2)由(1)分析可知,ab段是氢氧化钡和盐酸反应生成氯化钡和水,化学方程式为2HCl+Ba(OH)2BaCl2+2H2O。
(3)由(1)分析可知,c点时氯化镁恰好完全反应,d点时氢氧化钡溶液过量,此时溶液中的溶质为生成的氯化钡和过量的氢氧化钡。
21.D 【解析】A.向硫酸铜和硫酸钠的混合溶液中逐滴加入氢氧化钠溶液,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,一开始就有沉淀生成,生成沉淀的质量逐渐增大,待完全反应后,不再变化,不符合题意;B.向铜锌合金中加入稀硫酸,锌和稀硫酸反应生成硫酸锌和氢气,一开始就有气体生成,生成气体的质量逐渐增大,待完全反应后,不再变化,不符合题意;C.向稀硝酸和稀硫酸的混合溶液中加入氯化钡溶液,氯化钡和硫酸反应生成硫酸钡沉淀和盐酸,硫酸钡沉淀难溶于酸,一开始就有沉淀生成,生成沉淀的质量逐渐增大,待完全反应后,不再变化,不符合题意;D.向氢氧化钠和碳酸钠的混合溶液中加入稀盐酸,氢氧化钠先与稀盐酸反应生成氯化钠和水,待氢氧化钠完全反应后,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,故一开始无气体生成,后生成气体的质量逐渐增大,待完全反应后,不再变化,符合题意。
22.B 【解析】A.N点时,硫酸和氢氧化钠恰好完全反应,溶液此时呈中性,酚酞溶液在中性溶液中是无色的,错误。B.P点时,硫酸过量了,溶液中含有硫酸,硫酸和纯碱(碳酸钠)能发生反应产生硫酸钠、水和二氧化碳,正确。C.根据图像,M→N过程中溶液的碱性逐渐减弱,M点pH大于7,N点pH=7,错误。D.M→N过程中,硫酸和氢氧化钠反应产生硫酸钠和水,该过程中生成的硫酸钠不断增加;N点时,两者恰好完全反应,N→P过程中硫酸过量,没有硫酸钠产生,错误。
同课章节目录
