【特色专题专训】专题五 数字化微型实验探究 2025年中考化学总复习(河南专版)(含解析)
文档属性
| 名称 | 【特色专题专训】专题五 数字化微型实验探究 2025年中考化学总复习(河南专版)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 366.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-11 10:13:28 | ||
图片预览

文档简介
专题五 数字化微型实验探究
题型分析 —— 河南中考特色题型分析
微型实验探究试题是近年来中考考试的热点题型,该类试题主要以课本中的内容为基础,通过创新小实验,考查学生对实验现象的描述、化学方程式的书写等相关知识的运用。解决此类问题的关键是要看清楚实验中的仪器、试剂,结合学习过的内容进行分析,从而解决问题。
数字化实验探究,也是近几年来出现的热点题型,出现的背景也是创新实验,所不同的是通过传感器测出相关的实验数据,绘制成坐标曲线图。解决此类问题的关键是要看清楚横坐标和纵坐标表示的量以及数据所表示的含义。关注坐标图像的起点、拐点、变化趋势,利用控制变量法进行实验,再结合题干所给出的信息进行分析,从而得出结论。
举例精讲 ——河南中考特色题型突破
类型1 微型实验探究
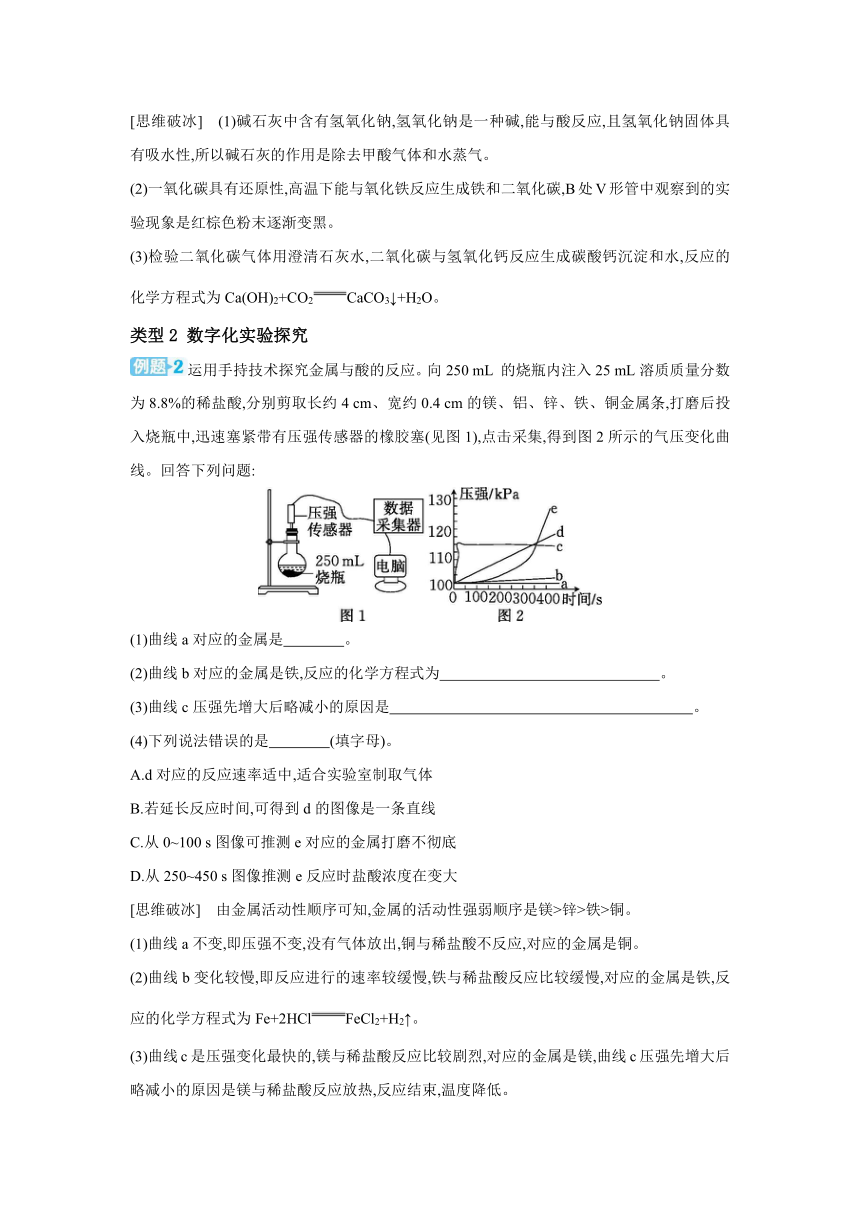
甲酸是一种具有挥发性的酸,在热的浓硫酸中分解生成CO和H2O。用V形管组装的微型实验装置制取CO,并用CO还原氧化铁以及检验气体生成物的实验如图所示。
(1)该实验中碱石灰的作用是什么
(2)写出B处V形管中观察到的实验现象。
(3)写出检验气体生成物的反应的化学方程式。
[思维破冰] (1)碱石灰中含有氢氧化钠,氢氧化钠是一种碱,能与酸反应,且氢氧化钠固体具有吸水性,所以碱石灰的作用是除去甲酸气体和水蒸气。
(2)一氧化碳具有还原性,高温下能与氧化铁反应生成铁和二氧化碳,B处V形管中观察到的实验现象是红棕色粉末逐渐变黑。
(3)检验二氧化碳气体用澄清石灰水,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为Ca(OH)2+CO2CaCO3↓+H2O。
类型2 数字化实验探究
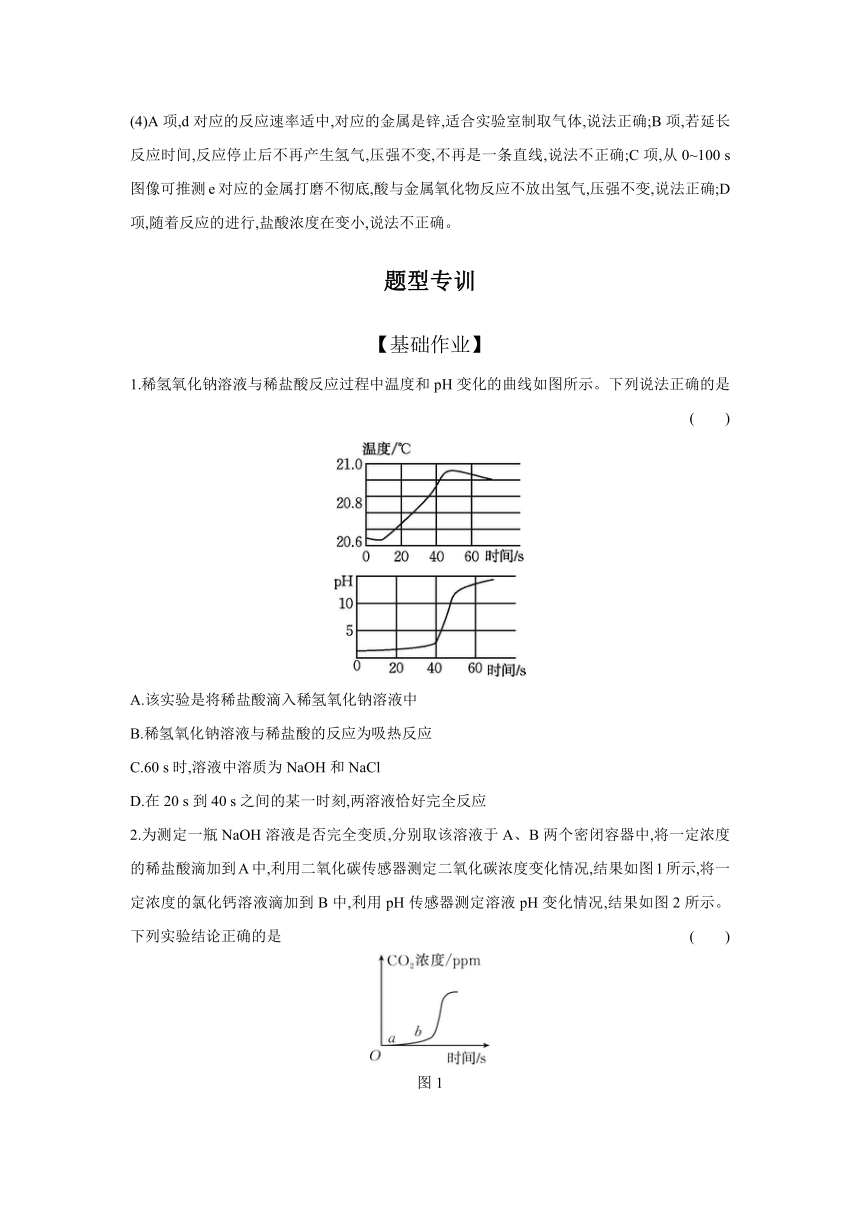
运用手持技术探究金属与酸的反应。向250 mL 的烧瓶内注入25 mL溶质质量分数为8.8%的稀盐酸,分别剪取长约4 cm、宽约0.4 cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡胶塞(见图1),点击采集,得到图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是 。
(2)曲线b对应的金属是铁,反应的化学方程式为 。
(3)曲线c压强先增大后略减小的原因是 。
(4)下列说法错误的是 (填字母)。
A.d对应的反应速率适中,适合实验室制取气体
B.若延长反应时间,可得到d的图像是一条直线
C.从0~100 s图像可推测e对应的金属打磨不彻底
D.从250~450 s图像推测e反应时盐酸浓度在变大
[思维破冰] 由金属活动性顺序可知,金属的活动性强弱顺序是镁>锌>铁>铜。
(1)曲线a不变,即压强不变,没有气体放出,铜与稀盐酸不反应,对应的金属是铜。
(2)曲线b变化较慢,即反应进行的速率较缓慢,铁与稀盐酸反应比较缓慢,对应的金属是铁,反应的化学方程式为Fe+2HClFeCl2+H2↑。
(3)曲线c是压强变化最快的,镁与稀盐酸反应比较剧烈,对应的金属是镁,曲线c压强先增大后略减小的原因是镁与稀盐酸反应放热,反应结束,温度降低。
(4)A项,d对应的反应速率适中,对应的金属是锌,适合实验室制取气体,说法正确;B项,若延长反应时间,反应停止后不再产生氢气,压强不变,不再是一条直线,说法不正确;C项,从0~100 s图像可推测e对应的金属打磨不彻底,酸与金属氧化物反应不放出氢气,压强不变,说法正确;D项,随着反应的进行,盐酸浓度在变小,说法不正确。
题型专训
【基础作业】
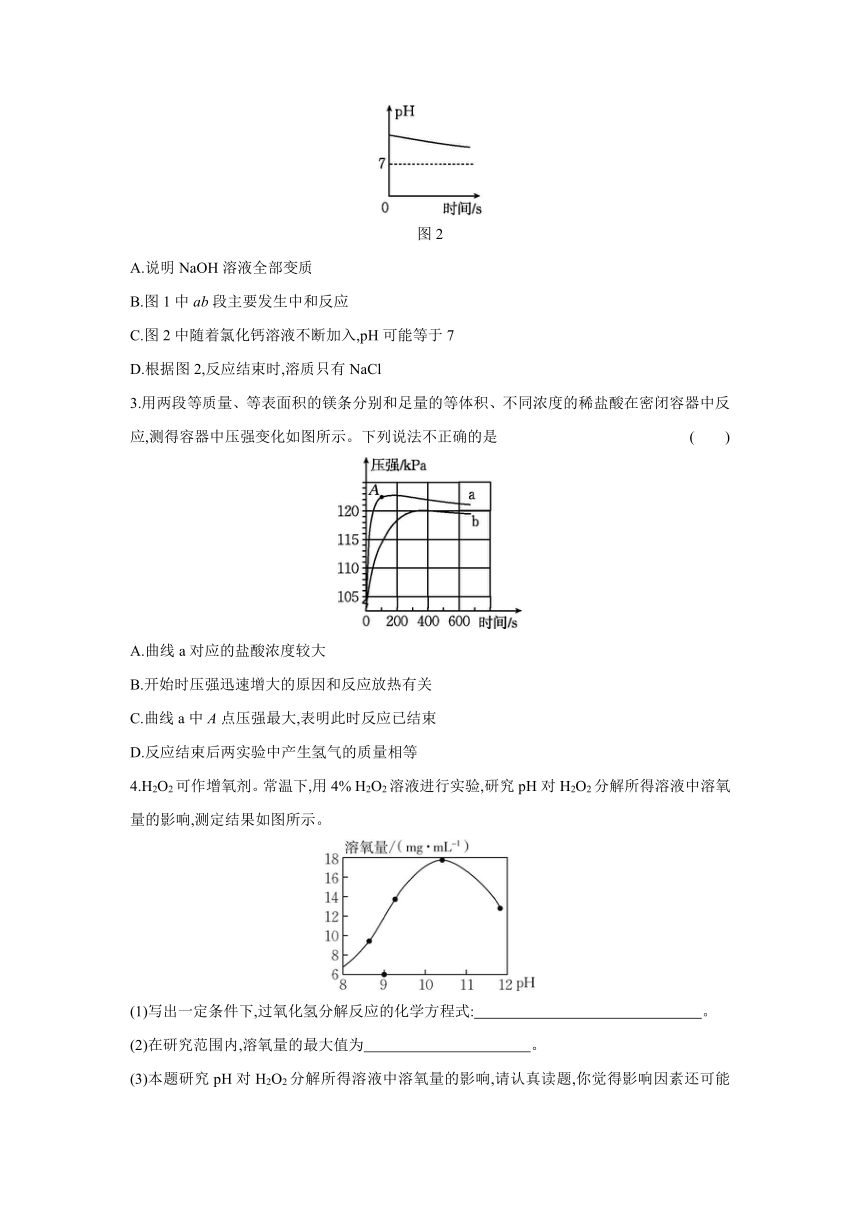
1.稀氢氧化钠溶液与稀盐酸反应过程中温度和pH变化的曲线如图所示。下列说法正确的是 ( )
A.该实验是将稀盐酸滴入稀氢氧化钠溶液中
B.稀氢氧化钠溶液与稀盐酸的反应为吸热反应
C.60 s时,溶液中溶质为NaOH和NaCl
D.在20 s到40 s之间的某一时刻,两溶液恰好完全反应
2.为测定一瓶NaOH溶液是否完全变质,分别取该溶液于A、B两个密闭容器中,将一定浓度的稀盐酸滴加到A中,利用二氧化碳传感器测定二氧化碳浓度变化情况,结果如图1所示,将一定浓度的氯化钙溶液滴加到B中,利用pH传感器测定溶液pH变化情况,结果如图2所示。下列实验结论正确的是 ( )
图1
图2
A.说明NaOH溶液全部变质
B.图1中ab段主要发生中和反应
C.图2中随着氯化钙溶液不断加入,pH可能等于7
D.根据图2,反应结束时,溶质只有NaCl
3.用两段等质量、等表面积的镁条分别和足量的等体积、不同浓度的稀盐酸在密闭容器中反应,测得容器中压强变化如图所示。下列说法不正确的是 ( )
A.曲线a对应的盐酸浓度较大
B.开始时压强迅速增大的原因和反应放热有关
C.曲线a中A点压强最大,表明此时反应已结束
D.反应结束后两实验中产生氢气的质量相等
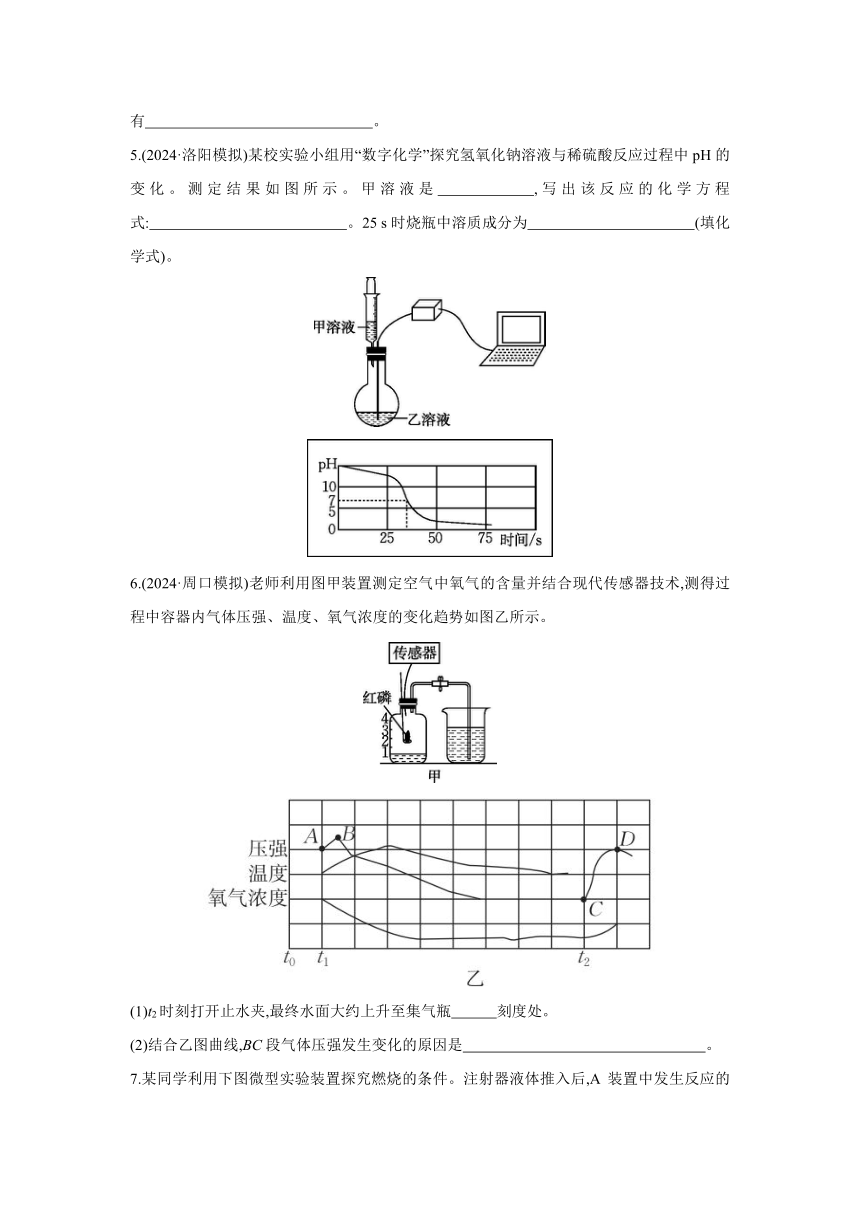
4.H2O2可作增氧剂。常温下,用4% H2O2溶液进行实验,研究pH对H2O2分解所得溶液中溶氧量的影响,测定结果如图所示。
(1)写出一定条件下,过氧化氢分解反应的化学方程式: 。
(2)在研究范围内,溶氧量的最大值为 。
(3)本题研究pH对H2O2分解所得溶液中溶氧量的影响,请认真读题,你觉得影响因素还可能有 。
5.(2024·洛阳模拟)某校实验小组用“数字化学”探究氢氧化钠溶液与稀硫酸反应过程中pH的变化。测定结果如图所示。甲溶液是 ,写出该反应的化学方程式: 。25 s时烧瓶中溶质成分为 (填化学式)。
6.(2024·周口模拟)老师利用图甲装置测定空气中氧气的含量并结合现代传感器技术,测得过程中容器内气体压强、温度、氧气浓度的变化趋势如图乙所示。
(1)t2时刻打开止水夹,最终水面大约上升至集气瓶 刻度处。
(2)结合乙图曲线,BC段气体压强发生变化的原因是 。
7.某同学利用下图微型实验装置探究燃烧的条件。注射器液体推入后,A 装置中发生反应的化学方程式为 ;然后加热 C 处红磷,C 处红磷燃烧而 B 处红磷不燃烧,说明燃烧的条件是 。
8.近年比较流行的“自热火锅”给人们生活带来了方便。“自热火锅”主要由料包和发热包(主要成分为生石灰、焙烧硅藻土、活性炭、铁粉、铝粉、碳酸钠等)组成,食用方法如图所示。发热包发热的原理是生石灰与水反应放热,生石灰的化学式为 ;焙烧硅藻土、活性炭都有 的结构,能起到吸附作用;“自热火锅”的内、外盒均由聚丙烯塑料材质制成,随意丢弃会带来 问题。
9.某化学兴趣小组同学利用pH传感器等数字化实验装置,对稀盐酸和氢氧化钙发生的中和反应(如图)进行如下探究。
(1)X为 (填化学式,下同)溶液。
(2)图3中A点对应溶液的溶质成分是 。
(3)该化学反应伴随的能量变化是 (选填“吸”或“放”)热。
10.电导率传感器可辅助探究复分解反应的实质,相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的氢氧化钡溶液平均分成两份置于两个烧杯中,插入电导传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的电导率变化如图所示。
(1)甲曲线对应的是哪个反应
(2)M点的出现,验证了哪些物质的哪些性质 (写出1条即可)
(3)请写出乙曲线对应的反应的化学方程式。
【素养作业】
11.探究钢铁锈蚀条件的实验装置如图所示,与教材实验相比的优点是将不同条件下的物质放在同一个装置中,增强了实验的对比性。通过实验,一周后观察到以下现象:钢丝棉1、2处均生锈,且钢丝棉1处生锈较严重,钢丝棉3、4处未观察到明显现象。由钢丝棉2、3处的现象可得出的结论是 ;对比钢丝棉1、2处的现象可知 ;该装置中使用刚冷却的凉开水的目的是 。
12.小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化如图所示。从图中所获信息正确的是 ( )
A.两个反应过程中都有热量放出
B.50 s时,溶液中的溶质只有AlCl3
C.0~100 s,只发生稀盐酸与氧化铝的反应
D.100~140 s,压强减小是因为温度降低
13.某化学兴趣小组利用pH传感器等数字化实验装置,测定盐酸逐滴加入碳酸钠溶液中溶液pH的变化情况,测定结果如图所示。
(1)滴加盐酸在0~8 s范围内,反应无气泡产生,且生成了两种盐。写出这两种盐的化学式: 。
(2)8 s之后,开始有气泡放出,写出反应的化学方程式: 。
(3)c点处的溶液中溶质有 (填字母)。
A.碳酸钠 B.氯化钠
C.盐酸 D.碳酸氢钠
答案
例题1
(1)除去甲酸气体和水蒸气
(2)红棕色粉末逐渐变黑
(3)Ca(OH)2+CO2CaCO3↓+H2O
例题2
(1)铜
(2)Fe+2HClFeCl2+H2↑
(3)镁与稀盐酸反应放热,反应结束,温度降低
(4)BD
题型专训
1.C 【解析】由图像中pH的变化是从小于7逐渐地增大到大于7可知,原溶液显酸性,然后不断地加入碱性溶液,即该实验是将稀氢氧化钠溶液滴入稀盐酸中;由稀氢氧化钠溶液与稀盐酸反应过程中温度变化图可知,随着反应的进行,溶液的温度逐渐升高,说明该反应是放热反应;60 s时,溶液的pH大于7,溶液显碱性,说明氢氧化钠过量,溶液中溶质为NaOH和NaCl;40 s时放出的热量还没有达到最高,且pH<7,还没有完全反应,稀盐酸有剩余。
2.B 【解析】结合以上分析可知,这瓶NaOH溶液部分变质;a点到b点曲线说明在部分变质的氢氧化钠溶液中,稀盐酸先与氢氧化钠反应,主要发生中和反应;随着氯化钙溶液的滴加,虽然Na2CO3和CaCl2发生反应生成氯化钠,溶液呈中性,但是还有部分氢氧化钠未变质,相当于氢氧化钠溶液会被稀释,pH逐渐减小,但溶液仍呈碱性,故pH不可能等于7;图2中滴加氯化钙溶液后,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,氢氧化钠不反应,因此反应结束时,溶质应为NaCl 和NaOH。
3.C 【解析】盐酸浓度越大,反应速率越快,相同时间内产生的气体多,压强大,完全反应需要的时间短,因此曲线a对应的盐酸浓度较大。开始时压强迅速增大的原因和反应放热有关,即温度升高,气体膨胀,压强增大。密闭容器内压强增大的原因主要有两个,一是反应放热,温度升高;二是反应有气体生成。在反应后期,反应速率减慢,如果容器散热速度大于反应放热的速度,即使反应还在缓慢进行,容器内的整体压强也可能是减小的,所以说,压强最大时并不能说明反应已经结束。镁质量相等,盐酸过量,反应结束后两实验中产生氢气质量相等。
4.(1)2H2O22H2O+O2↑
(2)18 mg·mL-1
(3)温度和过氧化氢溶液的浓度
【解析】(1)过氧化氢在一定条件下分解生成水和氧气。(2)由图像可知,在研究范围内,溶氧量的最大值为18 mg·mL-1。
(3)图示是pH对H2O2分解所得溶液中溶氧量的影响测定结果图,温度和过氧化氢的浓度可能对H2O2分解所得溶液中溶氧量有影响。
5.稀硫酸 H2SO4+2NaOHNa2SO4+2H2O Na2SO4、NaOH
【解析】由图像可知,开始时pH大于7,逐渐减小到7,然后小于7可知,原溶液显碱性,然后不断地加入酸性溶液,使pH减小,说明是把稀硫酸滴加到氢氧化钠溶液中。该实验是将甲溶液滴入乙溶液中,则甲溶液为稀硫酸;氢氧化钠和硫酸反应生成硫酸钠和水,化学方程式为H2SO4+2NaOHNa2SO4+2H2O;25 s时,溶液的pH>7,显碱性,说明氢氧化钠过量,此时溶质的成分是硫酸钠和氢氧化钠,化学式为Na2SO4、NaOH。
6.(1)1
(2)装置内氧气浓度减小
【解析】(1)红磷燃烧消耗了集气瓶内的氧气,使瓶内压强减小,因为氧气约占空气体积的,因此打开止水夹后,集气瓶内液面最终约上升至1刻度处;
(2)由题图乙可知,装置内氧气浓度不断减小,因此BC段压强不断减小。
7.2H2O22H2O+O2↑ 温度达到可燃物的着火点
8.CaO 疏松多孔 白色污染
9.(1)Ca(OH)2
(2)CaCl2、Ca(OH)2
(3)放
【解析】(1)通过图1看出是往烧杯中滴加X溶液,在图2中看出,横坐标是X溶液的质量,随着X溶液质量的增加,溶液的pH逐步增大,从酸性变成中性再到碱性,根据题中“对稀盐酸和氢氧化钙发生的中和反应(如图)进行如下探究”,可知X是氢氧化钙。
(2)从图3中看出在X溶液为30 g的时候,溶液温度达到了峰值,对比图2可以看出,在X溶液为30 g的时候,溶液恰好呈中性,可知在A点的时候,氢氧化钙已经过量,溶液的溶质成分是生成的CaCl2和过量的Ca(OH)2。
(3)在稀盐酸和氢氧化钙发生中和反应的过程中,溶液温度升高,反应结束后溶液温度下降,由此可知该化学反应伴随的能量变化是放热。
10.(1)Ba(OH)2 和H2SO4 的反应
(2)水不导电(或水几乎不导电,或硫酸钡不溶于水)
(3)Ba(OH)2+Na2SO4BaSO4↓+2NaOH
【解析】(1)从图中可以看到,甲曲线中,电导率能够减小到0,是因为氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,恰好完全反应时,宏观上几乎没有溶质的存在,微观上溶液中几乎没有离子存在,此时溶液的电导率接近0,因此甲对应的是氢氧化钡与稀硫酸的反应。
(2)由上述分析可知,甲曲线上的M点,电导率为0,溶液中几乎没有离子存在,可以验证水不导电、水几乎不导电、硫酸钡不溶于水等。
(3)乙曲线是氢氧化钡和硫酸钠反应生成硫酸钡沉淀和氢氧化钠,反应的化学方程式为Ba(OH)2+Na2SO4BaSO4↓+2NaOH。
11.钢铁生锈需与水接触 食盐水可以加快钢铁制品的锈蚀 除去水中溶解的氧气
【解析】由潮湿的钢丝棉2、干燥的钢丝棉3之间隔着干燥剂,可见钢丝棉3处没有水,其他条件相同,所以对比钢丝棉2、3处的现象可以得到钢铁生锈需与水接触;钢丝棉1浸湿在食盐水中,2处只是潮湿的钢丝棉,唯一不同的是食盐水,对比钢丝棉1、2处的现象可知,食盐水可以加快钢铁制品的锈蚀;该装置中使用刚冷却的凉开水的目的是除去水中溶解的氧气,水在煮沸的时候,水中溶解的氧气被释放出去。
12.D 【解析】未打磨的铝片和稀盐酸放入密闭容器中,首先发生的是盐酸与氧化铝的反应,这个反应没有热量放出,A选项说法错误;50 s时,盐酸未反应完,溶液中有溶质AlCl3和HCl,B选项说法错误;铝与盐酸的反应放热,同时放出氢气,压强增大,大约在100 s的时候反应停止,C选项说法错误;100~140 s,反应停止,压强减小是因为温度降低,D选项说法正确。
13.(1)NaCl、NaHCO3
(2)NaHCO3+HClNaCl+H2O+CO2↑
(3)BC
【解析】(1)滴加盐酸在0~8 s范围内,反应无气泡产生,且生成了两种盐,根据溶液中的物质推测,只能是钠盐,阴离子有氯离子和碳酸根转化成的碳酸氢根离子,所以这两种盐的化学式为NaCl、NaHCO3。
(2)8 s之后,开始有气泡放出,反应的化学方程式为NaHCO3+HClNaCl+H2O+CO2↑。
(3)c点处可以看出pH小于5,盐酸过量了,一定早已反应完全,所以此时溶液中的溶质有反应产物氯化钠和过量的盐酸。
题型分析 —— 河南中考特色题型分析
微型实验探究试题是近年来中考考试的热点题型,该类试题主要以课本中的内容为基础,通过创新小实验,考查学生对实验现象的描述、化学方程式的书写等相关知识的运用。解决此类问题的关键是要看清楚实验中的仪器、试剂,结合学习过的内容进行分析,从而解决问题。
数字化实验探究,也是近几年来出现的热点题型,出现的背景也是创新实验,所不同的是通过传感器测出相关的实验数据,绘制成坐标曲线图。解决此类问题的关键是要看清楚横坐标和纵坐标表示的量以及数据所表示的含义。关注坐标图像的起点、拐点、变化趋势,利用控制变量法进行实验,再结合题干所给出的信息进行分析,从而得出结论。
举例精讲 ——河南中考特色题型突破
类型1 微型实验探究
甲酸是一种具有挥发性的酸,在热的浓硫酸中分解生成CO和H2O。用V形管组装的微型实验装置制取CO,并用CO还原氧化铁以及检验气体生成物的实验如图所示。
(1)该实验中碱石灰的作用是什么
(2)写出B处V形管中观察到的实验现象。
(3)写出检验气体生成物的反应的化学方程式。
[思维破冰] (1)碱石灰中含有氢氧化钠,氢氧化钠是一种碱,能与酸反应,且氢氧化钠固体具有吸水性,所以碱石灰的作用是除去甲酸气体和水蒸气。
(2)一氧化碳具有还原性,高温下能与氧化铁反应生成铁和二氧化碳,B处V形管中观察到的实验现象是红棕色粉末逐渐变黑。
(3)检验二氧化碳气体用澄清石灰水,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为Ca(OH)2+CO2CaCO3↓+H2O。
类型2 数字化实验探究
运用手持技术探究金属与酸的反应。向250 mL 的烧瓶内注入25 mL溶质质量分数为8.8%的稀盐酸,分别剪取长约4 cm、宽约0.4 cm的镁、铝、锌、铁、铜金属条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡胶塞(见图1),点击采集,得到图2所示的气压变化曲线。回答下列问题:
(1)曲线a对应的金属是 。
(2)曲线b对应的金属是铁,反应的化学方程式为 。
(3)曲线c压强先增大后略减小的原因是 。
(4)下列说法错误的是 (填字母)。
A.d对应的反应速率适中,适合实验室制取气体
B.若延长反应时间,可得到d的图像是一条直线
C.从0~100 s图像可推测e对应的金属打磨不彻底
D.从250~450 s图像推测e反应时盐酸浓度在变大
[思维破冰] 由金属活动性顺序可知,金属的活动性强弱顺序是镁>锌>铁>铜。
(1)曲线a不变,即压强不变,没有气体放出,铜与稀盐酸不反应,对应的金属是铜。
(2)曲线b变化较慢,即反应进行的速率较缓慢,铁与稀盐酸反应比较缓慢,对应的金属是铁,反应的化学方程式为Fe+2HClFeCl2+H2↑。
(3)曲线c是压强变化最快的,镁与稀盐酸反应比较剧烈,对应的金属是镁,曲线c压强先增大后略减小的原因是镁与稀盐酸反应放热,反应结束,温度降低。
(4)A项,d对应的反应速率适中,对应的金属是锌,适合实验室制取气体,说法正确;B项,若延长反应时间,反应停止后不再产生氢气,压强不变,不再是一条直线,说法不正确;C项,从0~100 s图像可推测e对应的金属打磨不彻底,酸与金属氧化物反应不放出氢气,压强不变,说法正确;D项,随着反应的进行,盐酸浓度在变小,说法不正确。
题型专训
【基础作业】
1.稀氢氧化钠溶液与稀盐酸反应过程中温度和pH变化的曲线如图所示。下列说法正确的是 ( )
A.该实验是将稀盐酸滴入稀氢氧化钠溶液中
B.稀氢氧化钠溶液与稀盐酸的反应为吸热反应
C.60 s时,溶液中溶质为NaOH和NaCl
D.在20 s到40 s之间的某一时刻,两溶液恰好完全反应
2.为测定一瓶NaOH溶液是否完全变质,分别取该溶液于A、B两个密闭容器中,将一定浓度的稀盐酸滴加到A中,利用二氧化碳传感器测定二氧化碳浓度变化情况,结果如图1所示,将一定浓度的氯化钙溶液滴加到B中,利用pH传感器测定溶液pH变化情况,结果如图2所示。下列实验结论正确的是 ( )
图1
图2
A.说明NaOH溶液全部变质
B.图1中ab段主要发生中和反应
C.图2中随着氯化钙溶液不断加入,pH可能等于7
D.根据图2,反应结束时,溶质只有NaCl
3.用两段等质量、等表面积的镁条分别和足量的等体积、不同浓度的稀盐酸在密闭容器中反应,测得容器中压强变化如图所示。下列说法不正确的是 ( )
A.曲线a对应的盐酸浓度较大
B.开始时压强迅速增大的原因和反应放热有关
C.曲线a中A点压强最大,表明此时反应已结束
D.反应结束后两实验中产生氢气的质量相等
4.H2O2可作增氧剂。常温下,用4% H2O2溶液进行实验,研究pH对H2O2分解所得溶液中溶氧量的影响,测定结果如图所示。
(1)写出一定条件下,过氧化氢分解反应的化学方程式: 。
(2)在研究范围内,溶氧量的最大值为 。
(3)本题研究pH对H2O2分解所得溶液中溶氧量的影响,请认真读题,你觉得影响因素还可能有 。
5.(2024·洛阳模拟)某校实验小组用“数字化学”探究氢氧化钠溶液与稀硫酸反应过程中pH的变化。测定结果如图所示。甲溶液是 ,写出该反应的化学方程式: 。25 s时烧瓶中溶质成分为 (填化学式)。
6.(2024·周口模拟)老师利用图甲装置测定空气中氧气的含量并结合现代传感器技术,测得过程中容器内气体压强、温度、氧气浓度的变化趋势如图乙所示。
(1)t2时刻打开止水夹,最终水面大约上升至集气瓶 刻度处。
(2)结合乙图曲线,BC段气体压强发生变化的原因是 。
7.某同学利用下图微型实验装置探究燃烧的条件。注射器液体推入后,A 装置中发生反应的化学方程式为 ;然后加热 C 处红磷,C 处红磷燃烧而 B 处红磷不燃烧,说明燃烧的条件是 。
8.近年比较流行的“自热火锅”给人们生活带来了方便。“自热火锅”主要由料包和发热包(主要成分为生石灰、焙烧硅藻土、活性炭、铁粉、铝粉、碳酸钠等)组成,食用方法如图所示。发热包发热的原理是生石灰与水反应放热,生石灰的化学式为 ;焙烧硅藻土、活性炭都有 的结构,能起到吸附作用;“自热火锅”的内、外盒均由聚丙烯塑料材质制成,随意丢弃会带来 问题。
9.某化学兴趣小组同学利用pH传感器等数字化实验装置,对稀盐酸和氢氧化钙发生的中和反应(如图)进行如下探究。
(1)X为 (填化学式,下同)溶液。
(2)图3中A点对应溶液的溶质成分是 。
(3)该化学反应伴随的能量变化是 (选填“吸”或“放”)热。
10.电导率传感器可辅助探究复分解反应的实质,相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的氢氧化钡溶液平均分成两份置于两个烧杯中,插入电导传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,测得溶液的电导率变化如图所示。
(1)甲曲线对应的是哪个反应
(2)M点的出现,验证了哪些物质的哪些性质 (写出1条即可)
(3)请写出乙曲线对应的反应的化学方程式。
【素养作业】
11.探究钢铁锈蚀条件的实验装置如图所示,与教材实验相比的优点是将不同条件下的物质放在同一个装置中,增强了实验的对比性。通过实验,一周后观察到以下现象:钢丝棉1、2处均生锈,且钢丝棉1处生锈较严重,钢丝棉3、4处未观察到明显现象。由钢丝棉2、3处的现象可得出的结论是 ;对比钢丝棉1、2处的现象可知 ;该装置中使用刚冷却的凉开水的目的是 。
12.小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化如图所示。从图中所获信息正确的是 ( )
A.两个反应过程中都有热量放出
B.50 s时,溶液中的溶质只有AlCl3
C.0~100 s,只发生稀盐酸与氧化铝的反应
D.100~140 s,压强减小是因为温度降低
13.某化学兴趣小组利用pH传感器等数字化实验装置,测定盐酸逐滴加入碳酸钠溶液中溶液pH的变化情况,测定结果如图所示。
(1)滴加盐酸在0~8 s范围内,反应无气泡产生,且生成了两种盐。写出这两种盐的化学式: 。
(2)8 s之后,开始有气泡放出,写出反应的化学方程式: 。
(3)c点处的溶液中溶质有 (填字母)。
A.碳酸钠 B.氯化钠
C.盐酸 D.碳酸氢钠
答案
例题1
(1)除去甲酸气体和水蒸气
(2)红棕色粉末逐渐变黑
(3)Ca(OH)2+CO2CaCO3↓+H2O
例题2
(1)铜
(2)Fe+2HClFeCl2+H2↑
(3)镁与稀盐酸反应放热,反应结束,温度降低
(4)BD
题型专训
1.C 【解析】由图像中pH的变化是从小于7逐渐地增大到大于7可知,原溶液显酸性,然后不断地加入碱性溶液,即该实验是将稀氢氧化钠溶液滴入稀盐酸中;由稀氢氧化钠溶液与稀盐酸反应过程中温度变化图可知,随着反应的进行,溶液的温度逐渐升高,说明该反应是放热反应;60 s时,溶液的pH大于7,溶液显碱性,说明氢氧化钠过量,溶液中溶质为NaOH和NaCl;40 s时放出的热量还没有达到最高,且pH<7,还没有完全反应,稀盐酸有剩余。
2.B 【解析】结合以上分析可知,这瓶NaOH溶液部分变质;a点到b点曲线说明在部分变质的氢氧化钠溶液中,稀盐酸先与氢氧化钠反应,主要发生中和反应;随着氯化钙溶液的滴加,虽然Na2CO3和CaCl2发生反应生成氯化钠,溶液呈中性,但是还有部分氢氧化钠未变质,相当于氢氧化钠溶液会被稀释,pH逐渐减小,但溶液仍呈碱性,故pH不可能等于7;图2中滴加氯化钙溶液后,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,氢氧化钠不反应,因此反应结束时,溶质应为NaCl 和NaOH。
3.C 【解析】盐酸浓度越大,反应速率越快,相同时间内产生的气体多,压强大,完全反应需要的时间短,因此曲线a对应的盐酸浓度较大。开始时压强迅速增大的原因和反应放热有关,即温度升高,气体膨胀,压强增大。密闭容器内压强增大的原因主要有两个,一是反应放热,温度升高;二是反应有气体生成。在反应后期,反应速率减慢,如果容器散热速度大于反应放热的速度,即使反应还在缓慢进行,容器内的整体压强也可能是减小的,所以说,压强最大时并不能说明反应已经结束。镁质量相等,盐酸过量,反应结束后两实验中产生氢气质量相等。
4.(1)2H2O22H2O+O2↑
(2)18 mg·mL-1
(3)温度和过氧化氢溶液的浓度
【解析】(1)过氧化氢在一定条件下分解生成水和氧气。(2)由图像可知,在研究范围内,溶氧量的最大值为18 mg·mL-1。
(3)图示是pH对H2O2分解所得溶液中溶氧量的影响测定结果图,温度和过氧化氢的浓度可能对H2O2分解所得溶液中溶氧量有影响。
5.稀硫酸 H2SO4+2NaOHNa2SO4+2H2O Na2SO4、NaOH
【解析】由图像可知,开始时pH大于7,逐渐减小到7,然后小于7可知,原溶液显碱性,然后不断地加入酸性溶液,使pH减小,说明是把稀硫酸滴加到氢氧化钠溶液中。该实验是将甲溶液滴入乙溶液中,则甲溶液为稀硫酸;氢氧化钠和硫酸反应生成硫酸钠和水,化学方程式为H2SO4+2NaOHNa2SO4+2H2O;25 s时,溶液的pH>7,显碱性,说明氢氧化钠过量,此时溶质的成分是硫酸钠和氢氧化钠,化学式为Na2SO4、NaOH。
6.(1)1
(2)装置内氧气浓度减小
【解析】(1)红磷燃烧消耗了集气瓶内的氧气,使瓶内压强减小,因为氧气约占空气体积的,因此打开止水夹后,集气瓶内液面最终约上升至1刻度处;
(2)由题图乙可知,装置内氧气浓度不断减小,因此BC段压强不断减小。
7.2H2O22H2O+O2↑ 温度达到可燃物的着火点
8.CaO 疏松多孔 白色污染
9.(1)Ca(OH)2
(2)CaCl2、Ca(OH)2
(3)放
【解析】(1)通过图1看出是往烧杯中滴加X溶液,在图2中看出,横坐标是X溶液的质量,随着X溶液质量的增加,溶液的pH逐步增大,从酸性变成中性再到碱性,根据题中“对稀盐酸和氢氧化钙发生的中和反应(如图)进行如下探究”,可知X是氢氧化钙。
(2)从图3中看出在X溶液为30 g的时候,溶液温度达到了峰值,对比图2可以看出,在X溶液为30 g的时候,溶液恰好呈中性,可知在A点的时候,氢氧化钙已经过量,溶液的溶质成分是生成的CaCl2和过量的Ca(OH)2。
(3)在稀盐酸和氢氧化钙发生中和反应的过程中,溶液温度升高,反应结束后溶液温度下降,由此可知该化学反应伴随的能量变化是放热。
10.(1)Ba(OH)2 和H2SO4 的反应
(2)水不导电(或水几乎不导电,或硫酸钡不溶于水)
(3)Ba(OH)2+Na2SO4BaSO4↓+2NaOH
【解析】(1)从图中可以看到,甲曲线中,电导率能够减小到0,是因为氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,恰好完全反应时,宏观上几乎没有溶质的存在,微观上溶液中几乎没有离子存在,此时溶液的电导率接近0,因此甲对应的是氢氧化钡与稀硫酸的反应。
(2)由上述分析可知,甲曲线上的M点,电导率为0,溶液中几乎没有离子存在,可以验证水不导电、水几乎不导电、硫酸钡不溶于水等。
(3)乙曲线是氢氧化钡和硫酸钠反应生成硫酸钡沉淀和氢氧化钠,反应的化学方程式为Ba(OH)2+Na2SO4BaSO4↓+2NaOH。
11.钢铁生锈需与水接触 食盐水可以加快钢铁制品的锈蚀 除去水中溶解的氧气
【解析】由潮湿的钢丝棉2、干燥的钢丝棉3之间隔着干燥剂,可见钢丝棉3处没有水,其他条件相同,所以对比钢丝棉2、3处的现象可以得到钢铁生锈需与水接触;钢丝棉1浸湿在食盐水中,2处只是潮湿的钢丝棉,唯一不同的是食盐水,对比钢丝棉1、2处的现象可知,食盐水可以加快钢铁制品的锈蚀;该装置中使用刚冷却的凉开水的目的是除去水中溶解的氧气,水在煮沸的时候,水中溶解的氧气被释放出去。
12.D 【解析】未打磨的铝片和稀盐酸放入密闭容器中,首先发生的是盐酸与氧化铝的反应,这个反应没有热量放出,A选项说法错误;50 s时,盐酸未反应完,溶液中有溶质AlCl3和HCl,B选项说法错误;铝与盐酸的反应放热,同时放出氢气,压强增大,大约在100 s的时候反应停止,C选项说法错误;100~140 s,反应停止,压强减小是因为温度降低,D选项说法正确。
13.(1)NaCl、NaHCO3
(2)NaHCO3+HClNaCl+H2O+CO2↑
(3)BC
【解析】(1)滴加盐酸在0~8 s范围内,反应无气泡产生,且生成了两种盐,根据溶液中的物质推测,只能是钠盐,阴离子有氯离子和碳酸根转化成的碳酸氢根离子,所以这两种盐的化学式为NaCl、NaHCO3。
(2)8 s之后,开始有气泡放出,反应的化学方程式为NaHCO3+HClNaCl+H2O+CO2↑。
(3)c点处可以看出pH小于5,盐酸过量了,一定早已反应完全,所以此时溶液中的溶质有反应产物氯化钠和过量的盐酸。
同课章节目录
