3.1 课时1 铁的单质(23页) 课件 (共23张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 3.1 课时1 铁的单质(23页) 课件 (共23张PPT)2024-2025学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:00:22 | ||
图片预览








文档简介
(共23张PPT)
铁的单质
第三章 铁 金属材料
1.认识铁制品在生活中的应用,总结回顾铁单质的物理性质
2.探究燕麦中是否含有还原铁粉,思考单质铁被氧化为+2和+3价的条件
3.通过类比单质钠与水的反应预测铁与水蒸气的反应,并利用实验进行验证
人类使用铁的历史
公元前2 500年人类已发现和使用铁
约公元前2 000年人类发明了用铁矿石冶炼铁的方法
陨铁
我国目前发现最早的人工冶铁制品
甘肃灵台山出土的春秋初年秦国的铜柄铁剑
我国古代冶铁技术
战国时期最大的铁器——长方形铁炉
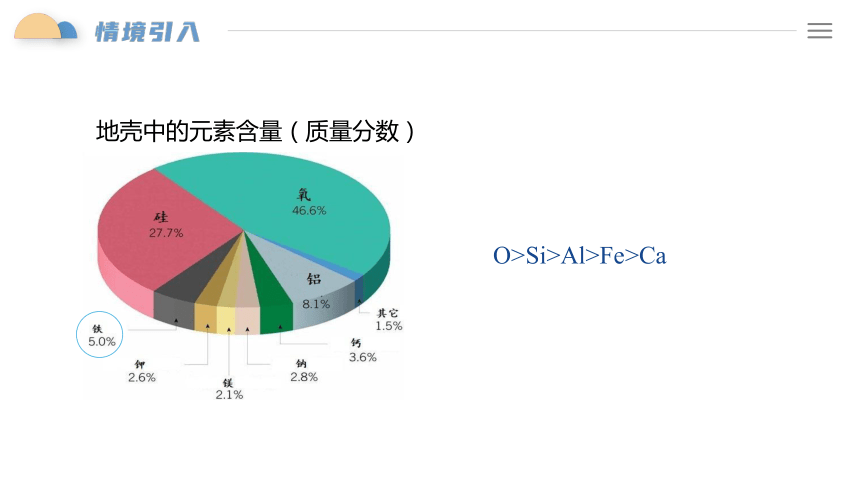
O>Si>Al>Fe>Ca
地壳中的元素含量(质量分数)
黄铁矿
(FeS2)
赤铁矿
(Fe2O3)
菱铁矿
(FeCO3)
磁铁矿
(Fe3O4)
常见的铁矿石
张掖丹霞地貌
请同学们根据下列铁制品的图片总结铁单质的物理性质。
延性、导电性
(但其导电性不如铜和铝)
展性、导热性
小结:铁的物理性质
通性:
特性:
银白色金属光泽、导电性、导热性、延展性
磁性
铁是人体内含量最多的必需微量元素
成人每天摄入铁的适宜量为15-20mg。
据最新数据显示,中国缺铁性贫血发生率高达20%。
铁摄入不足,就会引起贫血。
情境1:网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。这是不是不法商家添加的呢?
燕麦中的还原铁粉进入人体后能被胃吸收吗?(用离子方程式解释)
有什么作用?
Fe + 2H+ = Fe2+ +H2↑
燕麦中的还原铁粉有什么作用吗?
还原铁粉能吸收空气中的O2和H2O,防止食品氧化变质( Fe→ Fe2O3 )
补铁
我国现行标准《食品安全国家标准婴幼儿谷类辅助食品》
GB10769-2010规定,婴幼儿谷物类辅助食品中铁含量应在4-8mg/100g。
思考与讨论
2.观察上述化学反应方程式,铁的化合价变化有何异同?
Fe + 2HCl——2FeCl2 + H2↑
2Fe + 3Cl2 ——2FeCl3
点燃
Fe + CuSO4——FeSO4 + Cu
1.回顾已学知识,还有哪些物质可与铁反应呢?(写出化学方程式)
3Fe + 2O2——Fe3O4
点燃
4.概括铁单质氧化为+2价,+3价的条件分别是什么?
Fe → Fe 2+
弱氧化剂
Fe → Fe 3+
强氧化剂
3.思考上述化学中,为什么Fe被氧化成不同价态的产物?
情境2:在钢铁冶炼中,炽热的铁水必须注入干燥的模具。这是为什么呢?
【理论推测】
Fe与水高温条件下能反应,生成H2和Fe(OH)x
【类比思维】
活泼金属钠能与水发生反应,生成NaOH和H2
1
2
炽热的铁与水
冷的铁与水
是否反应
反应
不反应
反应物
Fe、H2O
Fe、H2O
反应条件
高温
低温
反应原理
?
【实验探究】铁与水高温条件下的反应
还原铁粉
吸满水的脱脂棉
肥皂液
实验现象 实验结论 实验原理
①听到“噗噗噗”爆鸣声
②固体仍为黑色
产物为H2
产物为Fe3O4
3Fe + 4H2O(g) Fe3O4 + 4H2
问:3 mol单质Fe完全转变为Fe3O4,失去_____ mol电子。
8
1.与非金属单质(氯气、氧气等)反应
2.与非氧化性酸(稀盐酸、稀硫酸等)反应
3.与某些盐溶液(CuSO4溶液等)反应
Fe与Cl2
Fe与稀盐酸
Fe与CuSO4溶液
一、铁的化学性质总结
铁的化学性质:还原性
铁与氯气反应
铁与硫酸铜溶液反应
Fe + Cu2+ Fe2+ + Cu
Fe + 2H+ Fe2+ + H2↑
2Fe + 3Cl2 2FeCl3
△
0
+3
0
+2
0
+2
铁与盐酸反应
Fe
+弱氧化剂
Fe
+强氧化剂
+O2或H2O(g)
Fe3O4
Fe
+2
FeCl2、FeSO4等
FeCl3等
还原剂
+
氧化剂
氧化还原反应产物
化学
性质
还原性
+3
4.与水的反应
2Na + 2H2O 2NaOH + H2
3Fe + 4H2O(g) Fe3O4 + 4H2
高温
Mg + 2H2O(热) Mg(OH)2 + H2
2Al + 6H2O(沸) 2Al(OH)3 + 3H2
一、铁的化学性质总结
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
H2O(g)
冷H2O
热H2O
小结:金属与水的反应
类别
化合价
单质
氧化物
盐
0
+2
+3
Fe3O4
Fe3+/Fe
+3
Fe2+/Fe
+2
强氧化剂
弱氧化剂
H2O/O2
1. 下列关于金属性质的叙述中,正确的是( )
A.金属钠与氧气反应时,产物与反应条件无关
B.镁条在空气中受热可以熔化,但不会燃烧
C.金属和非金属发生反应时,被氧化的一定是金属
D.铁丝无论在空气中还是纯氧中都不会燃烧
C
2.还原铁粉和水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )
A.该反应生成的固体是Fe(OH)3
B.湿棉花的主要作用是冷却试管,防止炸裂
C.肥皂液的主要作用是检验生成的是H2
D.铁粉和水蒸气反应后,可以立即用磁铁将剩余的铁粉分离出来
C
3.完成Fe与水蒸气的反应实验,装置如下图所示。
(1)B中反应的化学方程式是_____________________________;
(2)装置A受热的主要作用是__________; 酒精灯和酒精喷灯点燃的顺序_________;
(3)C中干燥管中碱石灰的作用是_________________________;
(4)在D处玻璃管点燃生成的气体前,必须对该气体进行 ,这一操作的目的是_______________________________。
持续提供水蒸气
先点酒精灯再点酒精喷灯
干燥氢气
验纯
防止点燃时,氢气因含有氧气而爆炸
3Fe + 4H2O(g)= = = Fe3O4 + 4H2
铁的单质
第三章 铁 金属材料
1.认识铁制品在生活中的应用,总结回顾铁单质的物理性质
2.探究燕麦中是否含有还原铁粉,思考单质铁被氧化为+2和+3价的条件
3.通过类比单质钠与水的反应预测铁与水蒸气的反应,并利用实验进行验证
人类使用铁的历史
公元前2 500年人类已发现和使用铁
约公元前2 000年人类发明了用铁矿石冶炼铁的方法
陨铁
我国目前发现最早的人工冶铁制品
甘肃灵台山出土的春秋初年秦国的铜柄铁剑
我国古代冶铁技术
战国时期最大的铁器——长方形铁炉
O>Si>Al>Fe>Ca
地壳中的元素含量(质量分数)
黄铁矿
(FeS2)
赤铁矿
(Fe2O3)
菱铁矿
(FeCO3)
磁铁矿
(Fe3O4)
常见的铁矿石
张掖丹霞地貌
请同学们根据下列铁制品的图片总结铁单质的物理性质。
延性、导电性
(但其导电性不如铜和铝)
展性、导热性
小结:铁的物理性质
通性:
特性:
银白色金属光泽、导电性、导热性、延展性
磁性
铁是人体内含量最多的必需微量元素
成人每天摄入铁的适宜量为15-20mg。
据最新数据显示,中国缺铁性贫血发生率高达20%。
铁摄入不足,就会引起贫血。
情境1:网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。这是不是不法商家添加的呢?
燕麦中的还原铁粉进入人体后能被胃吸收吗?(用离子方程式解释)
有什么作用?
Fe + 2H+ = Fe2+ +H2↑
燕麦中的还原铁粉有什么作用吗?
还原铁粉能吸收空气中的O2和H2O,防止食品氧化变质( Fe→ Fe2O3 )
补铁
我国现行标准《食品安全国家标准婴幼儿谷类辅助食品》
GB10769-2010规定,婴幼儿谷物类辅助食品中铁含量应在4-8mg/100g。
思考与讨论
2.观察上述化学反应方程式,铁的化合价变化有何异同?
Fe + 2HCl——2FeCl2 + H2↑
2Fe + 3Cl2 ——2FeCl3
点燃
Fe + CuSO4——FeSO4 + Cu
1.回顾已学知识,还有哪些物质可与铁反应呢?(写出化学方程式)
3Fe + 2O2——Fe3O4
点燃
4.概括铁单质氧化为+2价,+3价的条件分别是什么?
Fe → Fe 2+
弱氧化剂
Fe → Fe 3+
强氧化剂
3.思考上述化学中,为什么Fe被氧化成不同价态的产物?
情境2:在钢铁冶炼中,炽热的铁水必须注入干燥的模具。这是为什么呢?
【理论推测】
Fe与水高温条件下能反应,生成H2和Fe(OH)x
【类比思维】
活泼金属钠能与水发生反应,生成NaOH和H2
1
2
炽热的铁与水
冷的铁与水
是否反应
反应
不反应
反应物
Fe、H2O
Fe、H2O
反应条件
高温
低温
反应原理
?
【实验探究】铁与水高温条件下的反应
还原铁粉
吸满水的脱脂棉
肥皂液
实验现象 实验结论 实验原理
①听到“噗噗噗”爆鸣声
②固体仍为黑色
产物为H2
产物为Fe3O4
3Fe + 4H2O(g) Fe3O4 + 4H2
问:3 mol单质Fe完全转变为Fe3O4,失去_____ mol电子。
8
1.与非金属单质(氯气、氧气等)反应
2.与非氧化性酸(稀盐酸、稀硫酸等)反应
3.与某些盐溶液(CuSO4溶液等)反应
Fe与Cl2
Fe与稀盐酸
Fe与CuSO4溶液
一、铁的化学性质总结
铁的化学性质:还原性
铁与氯气反应
铁与硫酸铜溶液反应
Fe + Cu2+ Fe2+ + Cu
Fe + 2H+ Fe2+ + H2↑
2Fe + 3Cl2 2FeCl3
△
0
+3
0
+2
0
+2
铁与盐酸反应
Fe
+弱氧化剂
Fe
+强氧化剂
+O2或H2O(g)
Fe3O4
Fe
+2
FeCl2、FeSO4等
FeCl3等
还原剂
+
氧化剂
氧化还原反应产物
化学
性质
还原性
+3
4.与水的反应
2Na + 2H2O 2NaOH + H2
3Fe + 4H2O(g) Fe3O4 + 4H2
高温
Mg + 2H2O(热) Mg(OH)2 + H2
2Al + 6H2O(沸) 2Al(OH)3 + 3H2
一、铁的化学性质总结
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
H2O(g)
冷H2O
热H2O
小结:金属与水的反应
类别
化合价
单质
氧化物
盐
0
+2
+3
Fe3O4
Fe3+/Fe
+3
Fe2+/Fe
+2
强氧化剂
弱氧化剂
H2O/O2
1. 下列关于金属性质的叙述中,正确的是( )
A.金属钠与氧气反应时,产物与反应条件无关
B.镁条在空气中受热可以熔化,但不会燃烧
C.金属和非金属发生反应时,被氧化的一定是金属
D.铁丝无论在空气中还是纯氧中都不会燃烧
C
2.还原铁粉和水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )
A.该反应生成的固体是Fe(OH)3
B.湿棉花的主要作用是冷却试管,防止炸裂
C.肥皂液的主要作用是检验生成的是H2
D.铁粉和水蒸气反应后,可以立即用磁铁将剩余的铁粉分离出来
C
3.完成Fe与水蒸气的反应实验,装置如下图所示。
(1)B中反应的化学方程式是_____________________________;
(2)装置A受热的主要作用是__________; 酒精灯和酒精喷灯点燃的顺序_________;
(3)C中干燥管中碱石灰的作用是_________________________;
(4)在D处玻璃管点燃生成的气体前,必须对该气体进行 ,这一操作的目的是_______________________________。
持续提供水蒸气
先点酒精灯再点酒精喷灯
干燥氢气
验纯
防止点燃时,氢气因含有氧气而爆炸
3Fe + 4H2O(g)= = = Fe3O4 + 4H2
