3.2 课时3 物质的量在化学方程式计算中的应用 课件(共16张PPT) 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 3.2 课时3 物质的量在化学方程式计算中的应用 课件(共16张PPT) 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:19:58 | ||
图片预览





文档简介
(共16张PPT)
物质的量在化学方程式
计算中的应用
第三章 铁 金属材料
1.理解宏观到微观理解方程式计算中,其化学计量数代表的不同意义,明确在不同层次的运算中,都可以使用化学计量数
2.通过对物质的量在化学方程式中的应用,理解高中化学计算的基本概念,建立高中使用物质的量等概念进行方程式计算的基本模型
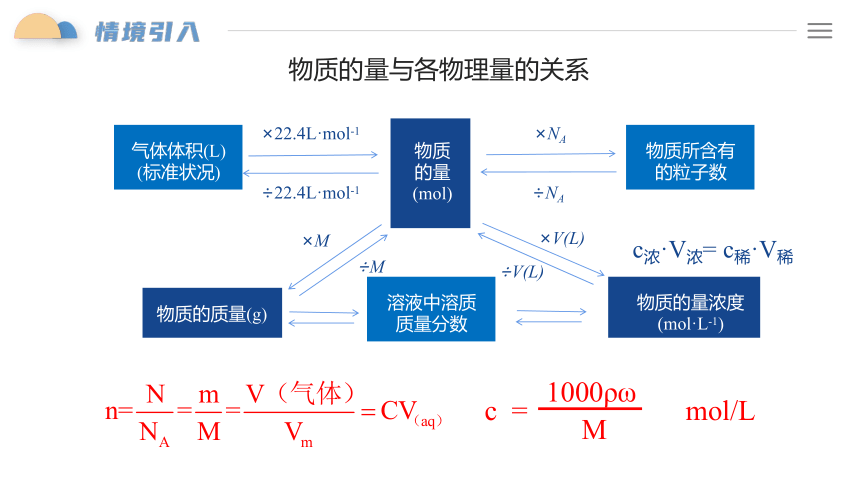
气体体积(L)
(标准状况)
物质的量
(mol)
物质所含有的粒子数
物质的质量(g)
物质的量浓度
(mol·L-1)
溶液中溶质质量分数
×22.4L·mol-1
÷22.4L·mol-1
×NA
÷NA
×M
÷M
×V(L)
÷V(L)
物质的量与各物理量的关系
c = mol/L
1000ρω
M
c浓·V浓= c稀·V稀
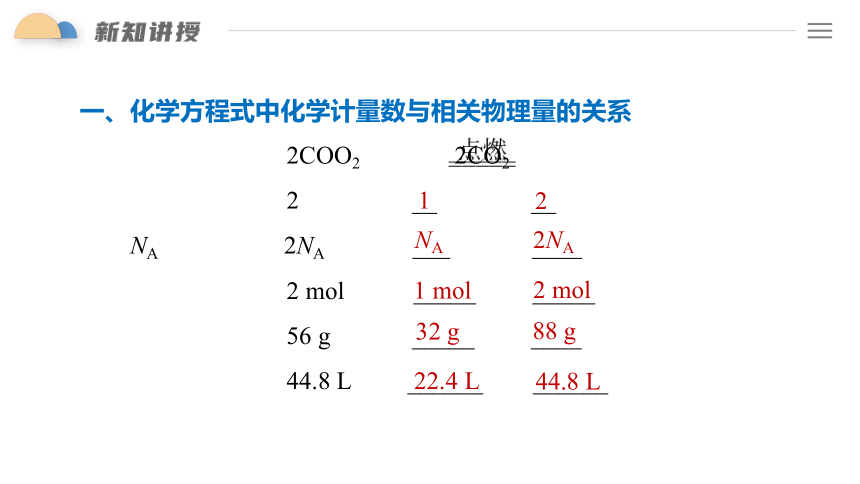
一、化学方程式中化学计量数与相关物理量的关系
2CO + O2 2CO2
化学计量数 2 __ __
扩大NA倍 2NA ___ ____
物质的量 2 mol _____ _____
质量 56 g _____ ____
标况下气体体积 44.8 L ______ ______
1
2
NA
2NA
1 mol
2 mol
32 g
88 g
22.4 L
44.8 L
结论:
(1)化学方程式中各物质的化学计量数之比等于其_________之比,等于其__________之比。
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其_____之比。
粒子数目
物质的量
体积
【例题】250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;
(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe)
Fe+H2SO4===FeSO4+H2↑
1 1
n(Fe) 0.50 mol
n(Fe)=0.50 mol
(2)设生成H2的物质的量为V(H2)
Fe+H2SO4===FeSO4+H2↑
1mol 22.4L
0.50 mol V(H2)
V(H2)=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2的体积在标准状况下为11.2L。
二、物质的量应用于化学方程式计算的基本步骤
练:5.4 g铝与足量NaOH溶液反应生成的氢气在标准状况的体积是多少?
解:
2Al+2NaOH+6H2O=== 2Na[Al(OH)4] +3H2↑
2 3
0.2 mol n(H2)
∴n(H2)=0.3 mol
∴V(H2)=n(H2)·Vm=0.3 mol×22.4 L·mol-1=6.72 L
答:生成标准状况下氢气的体积是6.72 L。
设生成标准状况下氢气的物质的量为n(H2)
1.关系式法
已知物和未知物之间建立联系
已知
一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集到9克水,则加入的铁粉质量为?
还原剂失电子总数=氧化剂得电子总数
用1 mol·L-1的Na2SO3溶液30 mL恰好将2×10-2 mol的 还原,已知氧化产物为 ,则元素X在还原产物中的化合价为 。
+4
氧化还原反应中得失电子总数相等,设元素X在还原产物中的化合价为x,
则有:1 mol·L-1×0.03 L×(6-4)=2×10-2 mol×(7-x),解得x=+4。
2.守恒法
根据化学反应中原子守恒、电荷守恒、电子守恒寻求关系
3.差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物的有关量成正比。差量法就是借助这种比例关系求解的方法。
把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 _。
28 g
解: Fe+CuSO4===FeSO4+Cu Δm
56 g 64 g 64 g-56 g=8 g
m(Fe) 4 g
练:为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将W1样品加热,其质量变为W2 g,则该样品的纯度(质量分数)是
4.方程组法
一般方程组法用于解决两种物质的混合物计算,一般读题时能找到两个已知量时,均可以利用二元一次方程组进行求算未知量。
练:把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。
消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol。
(2)该混合物中铝、铁的物质的量。
解: 设Al、Fe的物质的量分别为x、y。
2Al + 6HCl===2AlCl3+3H2↑
2 6
x 3x
Fe + 2HCl===FeCl2+H2↑
1 2
y 2y
解得:x=0.02 mol,y=0.01 mol。
即n(Al)=0.02 mol;n(Fe)=0.01 mol。
(1)有关化学方程式计算的等式关系
各物质的化学计量数之比=各物质的物质的量之比=各物质构成粒子的粒子数之比=相同条件下气体的体积之比。
(2)化学计算中常用方法
①守恒法(质量守恒、电荷守恒、电子守恒)
②差量法(质量差值法、体积差值法)
③关系式法(利用元素守恒建立关系式、利用方程式建立关系式、利用电子守恒建立关系式)
④方程组法(两个已知量求解混合物中两种物质的未知量)
1.完全溶解28.4g的碳酸铜和氢氧化铜的混合物,需要消耗1mol/L的盐酸500mL,若灼烧相同质量的上述混合物,得到氧化铜的质量为( )
A.40g B.30g C.20g D.16g
解析 根据题目计算出盐酸的物质的量为n(HCl)=1mol/L×0.5L=0.5mol,CuCO3和Cu(OH)2恰好与0.5mol HCl完全反应生成CuCl2、H2O和CO2气体,则n(CuCl2)=1/2n(HCl)=0.25mol,根据反应前后铜元素原子不变,则灼烧相同质量的上述混合物时,得到的CuO为0.25mol,m(CuO)=0.25mol×80g/mol=20g,因此选C。
C
物质的量在化学方程式
计算中的应用
第三章 铁 金属材料
1.理解宏观到微观理解方程式计算中,其化学计量数代表的不同意义,明确在不同层次的运算中,都可以使用化学计量数
2.通过对物质的量在化学方程式中的应用,理解高中化学计算的基本概念,建立高中使用物质的量等概念进行方程式计算的基本模型
气体体积(L)
(标准状况)
物质的量
(mol)
物质所含有的粒子数
物质的质量(g)
物质的量浓度
(mol·L-1)
溶液中溶质质量分数
×22.4L·mol-1
÷22.4L·mol-1
×NA
÷NA
×M
÷M
×V(L)
÷V(L)
物质的量与各物理量的关系
c = mol/L
1000ρω
M
c浓·V浓= c稀·V稀
一、化学方程式中化学计量数与相关物理量的关系
2CO + O2 2CO2
化学计量数 2 __ __
扩大NA倍 2NA ___ ____
物质的量 2 mol _____ _____
质量 56 g _____ ____
标况下气体体积 44.8 L ______ ______
1
2
NA
2NA
1 mol
2 mol
32 g
88 g
22.4 L
44.8 L
结论:
(1)化学方程式中各物质的化学计量数之比等于其_________之比,等于其__________之比。
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其_____之比。
粒子数目
物质的量
体积
【例题】250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;
(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe)
Fe+H2SO4===FeSO4+H2↑
1 1
n(Fe) 0.50 mol
n(Fe)=0.50 mol
(2)设生成H2的物质的量为V(H2)
Fe+H2SO4===FeSO4+H2↑
1mol 22.4L
0.50 mol V(H2)
V(H2)=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2的体积在标准状况下为11.2L。
二、物质的量应用于化学方程式计算的基本步骤
练:5.4 g铝与足量NaOH溶液反应生成的氢气在标准状况的体积是多少?
解:
2Al+2NaOH+6H2O=== 2Na[Al(OH)4] +3H2↑
2 3
0.2 mol n(H2)
∴n(H2)=0.3 mol
∴V(H2)=n(H2)·Vm=0.3 mol×22.4 L·mol-1=6.72 L
答:生成标准状况下氢气的体积是6.72 L。
设生成标准状况下氢气的物质的量为n(H2)
1.关系式法
已知物和未知物之间建立联系
已知
一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集到9克水,则加入的铁粉质量为?
还原剂失电子总数=氧化剂得电子总数
用1 mol·L-1的Na2SO3溶液30 mL恰好将2×10-2 mol的 还原,已知氧化产物为 ,则元素X在还原产物中的化合价为 。
+4
氧化还原反应中得失电子总数相等,设元素X在还原产物中的化合价为x,
则有:1 mol·L-1×0.03 L×(6-4)=2×10-2 mol×(7-x),解得x=+4。
2.守恒法
根据化学反应中原子守恒、电荷守恒、电子守恒寻求关系
3.差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物的有关量成正比。差量法就是借助这种比例关系求解的方法。
把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 _。
28 g
解: Fe+CuSO4===FeSO4+Cu Δm
56 g 64 g 64 g-56 g=8 g
m(Fe) 4 g
练:为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将W1样品加热,其质量变为W2 g,则该样品的纯度(质量分数)是
4.方程组法
一般方程组法用于解决两种物质的混合物计算,一般读题时能找到两个已知量时,均可以利用二元一次方程组进行求算未知量。
练:把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。
消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol。
(2)该混合物中铝、铁的物质的量。
解: 设Al、Fe的物质的量分别为x、y。
2Al + 6HCl===2AlCl3+3H2↑
2 6
x 3x
Fe + 2HCl===FeCl2+H2↑
1 2
y 2y
解得:x=0.02 mol,y=0.01 mol。
即n(Al)=0.02 mol;n(Fe)=0.01 mol。
(1)有关化学方程式计算的等式关系
各物质的化学计量数之比=各物质的物质的量之比=各物质构成粒子的粒子数之比=相同条件下气体的体积之比。
(2)化学计算中常用方法
①守恒法(质量守恒、电荷守恒、电子守恒)
②差量法(质量差值法、体积差值法)
③关系式法(利用元素守恒建立关系式、利用方程式建立关系式、利用电子守恒建立关系式)
④方程组法(两个已知量求解混合物中两种物质的未知量)
1.完全溶解28.4g的碳酸铜和氢氧化铜的混合物,需要消耗1mol/L的盐酸500mL,若灼烧相同质量的上述混合物,得到氧化铜的质量为( )
A.40g B.30g C.20g D.16g
解析 根据题目计算出盐酸的物质的量为n(HCl)=1mol/L×0.5L=0.5mol,CuCO3和Cu(OH)2恰好与0.5mol HCl完全反应生成CuCl2、H2O和CO2气体,则n(CuCl2)=1/2n(HCl)=0.25mol,根据反应前后铜元素原子不变,则灼烧相同质量的上述混合物时,得到的CuO为0.25mol,m(CuO)=0.25mol×80g/mol=20g,因此选C。
C
