3.1 课时2 铁的氧化物、氢氧化物 课件 (共29张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 3.1 课时2 铁的氧化物、氢氧化物 课件 (共29张PPT)2024-2025学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 20.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 00:00:00 | ||
图片预览






文档简介
(共29张PPT)
铁的氧化物、氢氧化物
第三章 铁 金属材料
1.能从物质类别、元素价态角度,依据复分解反应和氧化还原反应原,预测铁的氧化物、氢氧化物的化学性质,设计实验进行初步验证,并能分析、解释有关实验现象
2.通过学习铁的氧化物、氢氧化物,学会从物质类别和元素价态的视角认识具有变价元素物质间的转化关系,并建立认识模型,丰富研究物质的思路和方法
3.结合应用实例,将铁氧化物、氢氧化物性质的知识应用于解决生产、生活中简单的化学问题,强化性质决定用途的观念
朱门酒肉臭,路有冻死骨。
——杜甫
一、铁的氧化物
1.物理性质
化学式 FeO Fe2O3 Fe3O4
俗名 \
颜色状态
溶解性
黑色粉末
黑色晶体
红棕色粉末
磁性氧化铁
铁红
均不溶于水
铁的氧化物在生活中的应用:
FeO可做色素
Fe3O4可做磁性材料
Fe2O3常做油漆、涂料
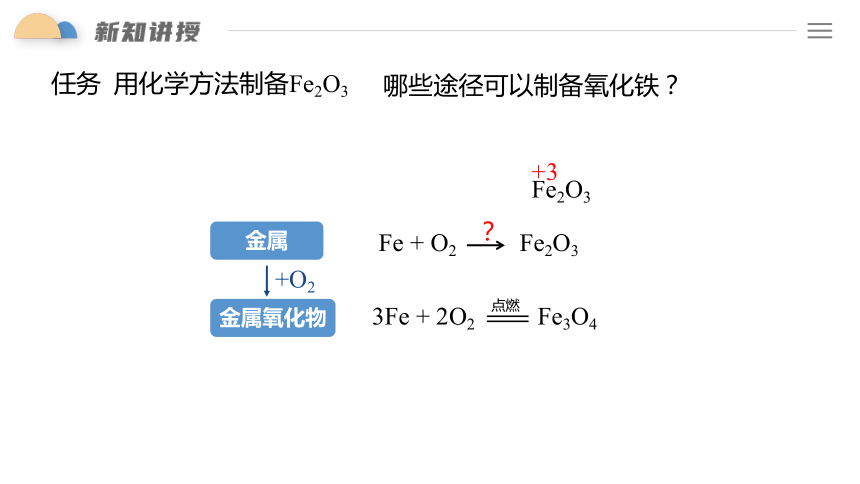
任务 用化学方法制备Fe2O3
哪些途径可以制备氧化铁?
Fe2O3
3Fe + 2O2 Fe3O4
点燃
Fe + O2 Fe2O3
?
+3
金属
金属氧化物
+O2
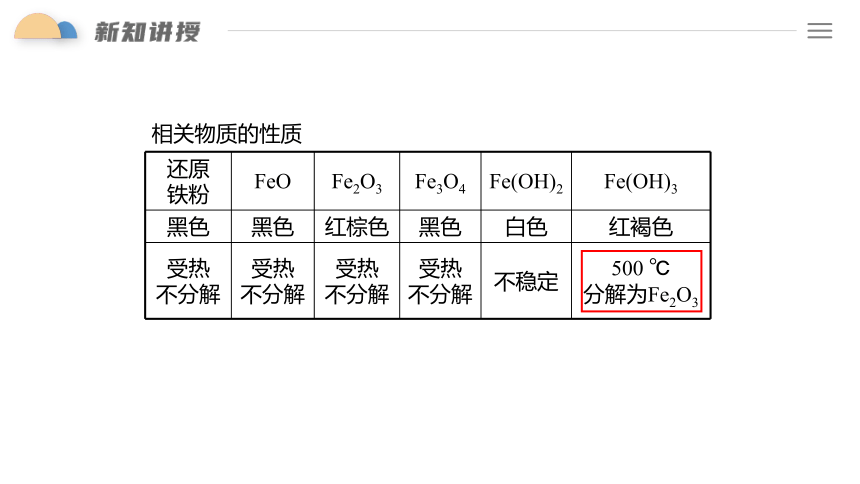
相关物质的性质
还原 铁粉 FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色 红棕色 黑色 白色 红褐色
受热 不分解 受热 不分解 受热 不分解 受热 不分解 不稳定 500 ℃
分解为Fe2O3
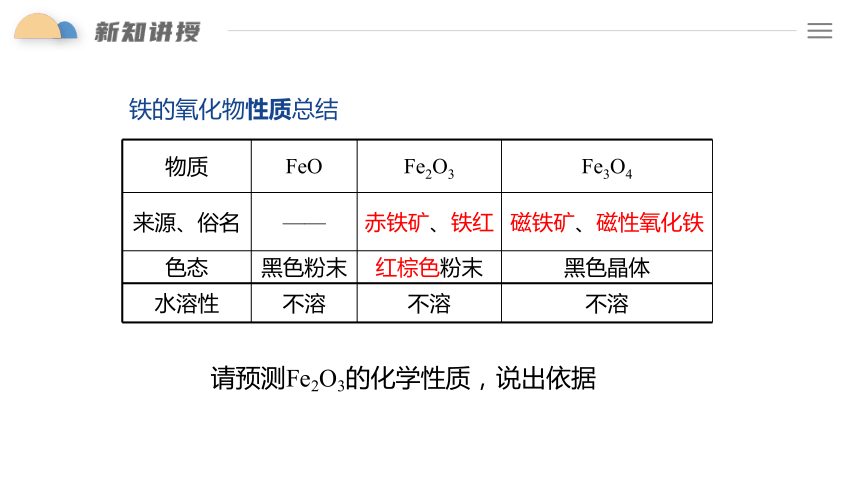
物质 FeO Fe2O3 Fe3O4
来源、俗名 —— 赤铁矿、铁红 磁铁矿、磁性氧化铁
色态 黑色粉末 红棕色粉末 黑色晶体
水溶性 不溶 不溶 不溶
铁的氧化物性质总结
请预测Fe2O3的化学性质,说出依据
方法导引
认识元素及其化合物性质的视角
物质类别和元素价态,是学习元素及其化合物性质的重要认识视角。
基于物质类别和元素价态,可以预测物质的性质。例如,对于Fe2O3,从物质类别来看,它属于金属氧化物,据此可以预测它可能与酸发生反应;从元素价态来看,Fe2O3中铁元素的化合价是+3价,为铁元素的高价态,据此可以预测它具有氧化性,可能与具有还原性的物质发生反应。
Fe2O3
+3
物质类别:
氧化性
Fe2O3 + 6H+ 2Fe3+ + 3H2O
2Fe(OH)3 Fe2O3 + 3H2O
△
Fe2O3 + 3CO 2Fe + 3CO2
高温
元素价态:
金属氧化物
FeO
+2
物质类别:
氧化性
FeO + 2H+ Fe2+ + H2O
FeO + CO Fe + CO2
高温
元素价态:
金属氧化物
还原性
6FeO + O2 2Fe3O4
△
Fe3O4
物质类别:
氧化性
元素价态:
特殊氧化物
Fe3O4 + 8H+ Fe2+ + 2Fe3+ + 4H2O
Fe3O4 + 4CO 3Fe + 4CO2
高温
两者颜色不同的原因是两者所含的铁的氧化物是不一样的,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是Fe2O3 ,青砖中含的是Fe3O4或FeO
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为Fe3O4或FeO,而制得青砖。
一、铁的氧化物
2.化学性质
分别写出以赤铁矿、磁铁矿为原料的高炉炼铁化学方程式。
Fe2O3 + 3CO === 2 Fe+3CO2
高温
Fe3O4 + 4CO === 3 Fe+4CO2
高温
写出工业上用稀盐酸除去铁表面的铁锈的离子方程式(提示:铁锈主要成分为氧化铁 )
FeO+2H+= Fe2++H2O
Fe2O3+6H+= 2Fe3++3H2O
名称 FeO Fe2O3 Fe3O4
俗称
类别
色态
化合价
水溶性
与酸 如:
与还原剂 如:
铁红
磁性氧化铁
特殊氧化物
黑色粉末
红棕色粉末
黑色晶体
+ 2
+ 3
+ 2、+ 3
难溶
难溶
难溶
Fe2O3 +6H+=2Fe3++3H2O
FexOy +yCO====xFe+yCO2
高温
FeO +2HCl =FeCl2 +H2O
Fe2O3 +6HCl =2FeCl3 +3H2O
Fe3O4 +8HCl=2FeCl3 + FeCl2 +4H2O
金属氧化物
金属氧化物
二、铁的氢氧化物
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3溶液中产生了红褐色沉淀;
FeSO4溶液生成的白色絮状沉淀迅速变成灰绿色,过一段时间后还会有红
褐色物质生成。
FeCl3溶液中的现象
FeSO4溶液中的现象
为什么FeSO4溶液在加入NaOH溶液时,会有那些现象变化呢?
这是因为白色的氢氧化亚铁被溶解在溶液中的氧气氧化成了红褐色的氢氧化铁,反应的化学式如下:
①FeSO4+2NaOH——Fe(OH)2↓+Na2S04
②4Fe(OH)2+O2+2H2O——4Fe(OH)3
名 称 氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
颜 色
溶解性
Fe(OH)2 + 2H+ =
Fe2+ +2H2O
Fe(OH)3 + 3H+
= Fe3+ + 3H2O
高温不稳定
2Fe(OH) 3
Fe2O3 +3H2O
还原性,不稳定,易氧化
4 Fe(OH)2 +O2 +2H2O
= 4Fe(OH)3
不溶于水 不溶于水
与H+反应
白色絮状
红褐色
稳定性
白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么,在实验室里,如何得到Fe(OH)2呢?
思路是如何防止Fe(OH)2被氧气氧化。
可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。这样就能使Fe(OH)2的在无氧环境下生成,不会氧化成Fe(OH)3。
思考与讨论
3.用煮沸过的蒸馏水配制溶液(除去O2) 。
1.在FeSO4溶液液面上加几滴煤油(加保护层,隔绝空气)
新制FeSO4溶液
煤油
NaOH溶液
除去试管和溶液中氧气,创造无氧环境
2.胶头滴管的末端伸入FeSO4溶液液面之下,不震荡。
在实验室里,如何得到Fe(OH)2?
思考与讨论
在实验室里,如何得到Fe(OH)2?
思考与讨论
改进实验装置,制造非氧环境。
铁及其化合物的“价—类”二维图
盐
单质
碱
氧化物
+2
0
+3
铁元素化合价
物质类别
Fe
Fe(OH)3
Fe(OH)2
Fe2+
Fe3+
Fe2O3
FeO
A
1.下列有关铁的化合物的说法不正确的是( )
A. FeO不稳定,在空气中加热生成Fe2O3
B. FeO、Fe2O3均为金属氧化物,均可与盐酸反应
C. Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D. Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
2.有关铁的氧化物的说法中,不正确的是( )
A. 赤铁矿主要成分是Fe2O3,Fe2O3俗称铁红,常用作红色油漆和涂料
B. 磁铁矿的主要成分是Fe3O4,打印机的墨粉中添加有Fe3O4
C. 烤蓝是一种古老的金属处理工艺,即在金属表面形成一层致密并且拥有一定厚度的氧化层,该氧化层的主要成分为Fe2O3
D. 高炉炼铁是用还原的方法把铁从铁矿石中提炼出来
C
3.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是 ( )
A. Fe(OH)3;Fe2O3
Fe(OH)2;Fe2O3
Fe(OH)2;Fe(OH)3、Fe3O4
Fe2O3;Fe(OH)3
B
4.下列化学方程式或离子方程式错误的是( )
A. 4Fe(OH)2+O2+2H2O===4Fe(OH)3
B. FeO+2H+===Fe3++H2O
C. 2Fe(OH)3===Fe2O3+3H2O
D. Fe3++3OH-===Fe(OH)3↓
B
5.有关铁的化合物的说法中,错误的是 ( )
A. Fe(OH)2是一种灰绿色沉淀,不稳定,在空
气中易被氧化转变为红褐色
B. 由图示操作可制取Fe(OH)2
C. Fe3O4、Fe(OH)3都可以由化合反应制得
D. Fe(OH)3胶体呈红褐色、透明,能发生丁
达尔效应
A
铁的氧化物、氢氧化物
第三章 铁 金属材料
1.能从物质类别、元素价态角度,依据复分解反应和氧化还原反应原,预测铁的氧化物、氢氧化物的化学性质,设计实验进行初步验证,并能分析、解释有关实验现象
2.通过学习铁的氧化物、氢氧化物,学会从物质类别和元素价态的视角认识具有变价元素物质间的转化关系,并建立认识模型,丰富研究物质的思路和方法
3.结合应用实例,将铁氧化物、氢氧化物性质的知识应用于解决生产、生活中简单的化学问题,强化性质决定用途的观念
朱门酒肉臭,路有冻死骨。
——杜甫
一、铁的氧化物
1.物理性质
化学式 FeO Fe2O3 Fe3O4
俗名 \
颜色状态
溶解性
黑色粉末
黑色晶体
红棕色粉末
磁性氧化铁
铁红
均不溶于水
铁的氧化物在生活中的应用:
FeO可做色素
Fe3O4可做磁性材料
Fe2O3常做油漆、涂料
任务 用化学方法制备Fe2O3
哪些途径可以制备氧化铁?
Fe2O3
3Fe + 2O2 Fe3O4
点燃
Fe + O2 Fe2O3
?
+3
金属
金属氧化物
+O2
相关物质的性质
还原 铁粉 FeO Fe2O3 Fe3O4 Fe(OH)2 Fe(OH)3
黑色 黑色 红棕色 黑色 白色 红褐色
受热 不分解 受热 不分解 受热 不分解 受热 不分解 不稳定 500 ℃
分解为Fe2O3
物质 FeO Fe2O3 Fe3O4
来源、俗名 —— 赤铁矿、铁红 磁铁矿、磁性氧化铁
色态 黑色粉末 红棕色粉末 黑色晶体
水溶性 不溶 不溶 不溶
铁的氧化物性质总结
请预测Fe2O3的化学性质,说出依据
方法导引
认识元素及其化合物性质的视角
物质类别和元素价态,是学习元素及其化合物性质的重要认识视角。
基于物质类别和元素价态,可以预测物质的性质。例如,对于Fe2O3,从物质类别来看,它属于金属氧化物,据此可以预测它可能与酸发生反应;从元素价态来看,Fe2O3中铁元素的化合价是+3价,为铁元素的高价态,据此可以预测它具有氧化性,可能与具有还原性的物质发生反应。
Fe2O3
+3
物质类别:
氧化性
Fe2O3 + 6H+ 2Fe3+ + 3H2O
2Fe(OH)3 Fe2O3 + 3H2O
△
Fe2O3 + 3CO 2Fe + 3CO2
高温
元素价态:
金属氧化物
FeO
+2
物质类别:
氧化性
FeO + 2H+ Fe2+ + H2O
FeO + CO Fe + CO2
高温
元素价态:
金属氧化物
还原性
6FeO + O2 2Fe3O4
△
Fe3O4
物质类别:
氧化性
元素价态:
特殊氧化物
Fe3O4 + 8H+ Fe2+ + 2Fe3+ + 4H2O
Fe3O4 + 4CO 3Fe + 4CO2
高温
两者颜色不同的原因是两者所含的铁的氧化物是不一样的,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是Fe2O3 ,青砖中含的是Fe3O4或FeO
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为Fe3O4或FeO,而制得青砖。
一、铁的氧化物
2.化学性质
分别写出以赤铁矿、磁铁矿为原料的高炉炼铁化学方程式。
Fe2O3 + 3CO === 2 Fe+3CO2
高温
Fe3O4 + 4CO === 3 Fe+4CO2
高温
写出工业上用稀盐酸除去铁表面的铁锈的离子方程式(提示:铁锈主要成分为氧化铁 )
FeO+2H+= Fe2++H2O
Fe2O3+6H+= 2Fe3++3H2O
名称 FeO Fe2O3 Fe3O4
俗称
类别
色态
化合价
水溶性
与酸 如:
与还原剂 如:
铁红
磁性氧化铁
特殊氧化物
黑色粉末
红棕色粉末
黑色晶体
+ 2
+ 3
+ 2、+ 3
难溶
难溶
难溶
Fe2O3 +6H+=2Fe3++3H2O
FexOy +yCO====xFe+yCO2
高温
FeO +2HCl =FeCl2 +H2O
Fe2O3 +6HCl =2FeCl3 +3H2O
Fe3O4 +8HCl=2FeCl3 + FeCl2 +4H2O
金属氧化物
金属氧化物
二、铁的氢氧化物
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3溶液中产生了红褐色沉淀;
FeSO4溶液生成的白色絮状沉淀迅速变成灰绿色,过一段时间后还会有红
褐色物质生成。
FeCl3溶液中的现象
FeSO4溶液中的现象
为什么FeSO4溶液在加入NaOH溶液时,会有那些现象变化呢?
这是因为白色的氢氧化亚铁被溶解在溶液中的氧气氧化成了红褐色的氢氧化铁,反应的化学式如下:
①FeSO4+2NaOH——Fe(OH)2↓+Na2S04
②4Fe(OH)2+O2+2H2O——4Fe(OH)3
名 称 氢氧化亚铁Fe(OH)2 氢氧化铁Fe(OH)3
颜 色
溶解性
Fe(OH)2 + 2H+ =
Fe2+ +2H2O
Fe(OH)3 + 3H+
= Fe3+ + 3H2O
高温不稳定
2Fe(OH) 3
Fe2O3 +3H2O
还原性,不稳定,易氧化
4 Fe(OH)2 +O2 +2H2O
= 4Fe(OH)3
不溶于水 不溶于水
与H+反应
白色絮状
红褐色
稳定性
白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么,在实验室里,如何得到Fe(OH)2呢?
思路是如何防止Fe(OH)2被氧气氧化。
可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。这样就能使Fe(OH)2的在无氧环境下生成,不会氧化成Fe(OH)3。
思考与讨论
3.用煮沸过的蒸馏水配制溶液(除去O2) 。
1.在FeSO4溶液液面上加几滴煤油(加保护层,隔绝空气)
新制FeSO4溶液
煤油
NaOH溶液
除去试管和溶液中氧气,创造无氧环境
2.胶头滴管的末端伸入FeSO4溶液液面之下,不震荡。
在实验室里,如何得到Fe(OH)2?
思考与讨论
在实验室里,如何得到Fe(OH)2?
思考与讨论
改进实验装置,制造非氧环境。
铁及其化合物的“价—类”二维图
盐
单质
碱
氧化物
+2
0
+3
铁元素化合价
物质类别
Fe
Fe(OH)3
Fe(OH)2
Fe2+
Fe3+
Fe2O3
FeO
A
1.下列有关铁的化合物的说法不正确的是( )
A. FeO不稳定,在空气中加热生成Fe2O3
B. FeO、Fe2O3均为金属氧化物,均可与盐酸反应
C. Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D. Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
2.有关铁的氧化物的说法中,不正确的是( )
A. 赤铁矿主要成分是Fe2O3,Fe2O3俗称铁红,常用作红色油漆和涂料
B. 磁铁矿的主要成分是Fe3O4,打印机的墨粉中添加有Fe3O4
C. 烤蓝是一种古老的金属处理工艺,即在金属表面形成一层致密并且拥有一定厚度的氧化层,该氧化层的主要成分为Fe2O3
D. 高炉炼铁是用还原的方法把铁从铁矿石中提炼出来
C
3.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是 ( )
A. Fe(OH)3;Fe2O3
Fe(OH)2;Fe2O3
Fe(OH)2;Fe(OH)3、Fe3O4
Fe2O3;Fe(OH)3
B
4.下列化学方程式或离子方程式错误的是( )
A. 4Fe(OH)2+O2+2H2O===4Fe(OH)3
B. FeO+2H+===Fe3++H2O
C. 2Fe(OH)3===Fe2O3+3H2O
D. Fe3++3OH-===Fe(OH)3↓
B
5.有关铁的化合物的说法中,错误的是 ( )
A. Fe(OH)2是一种灰绿色沉淀,不稳定,在空
气中易被氧化转变为红褐色
B. 由图示操作可制取Fe(OH)2
C. Fe3O4、Fe(OH)3都可以由化合反应制得
D. Fe(OH)3胶体呈红褐色、透明,能发生丁
达尔效应
A
