4.3 课时1 离子键 课件 (共21张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.3 课时1 离子键 课件 (共21张PPT)2024-2025学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
离子键
第四章 物质结构 元素周期律
1.理解离子键的概念,并能用电子式表示常见原子、离子、离子化合物等及物质的形成过程
2.能根据物质的构成微粒及相互作用,识别简单的离子化合物
3.理解化学反应的微观实质,认识化学学科的本质
1、构成物质的基本微粒有哪几种?分别举例说明。
⑴离子
⑵分子
⑶原子
氯化钠、氯化镁等
水、氯气、氧气等
金刚石、铜等
2、不同的物质含有不同的微粒,这些微粒是如何构成物质的?
一、化学键
1、定义:通常我们相邻的原子之间强烈的相互作用叫做化学键。
2 、类型
离子键:离子之间
共价键:原子之间
金属键:金属内
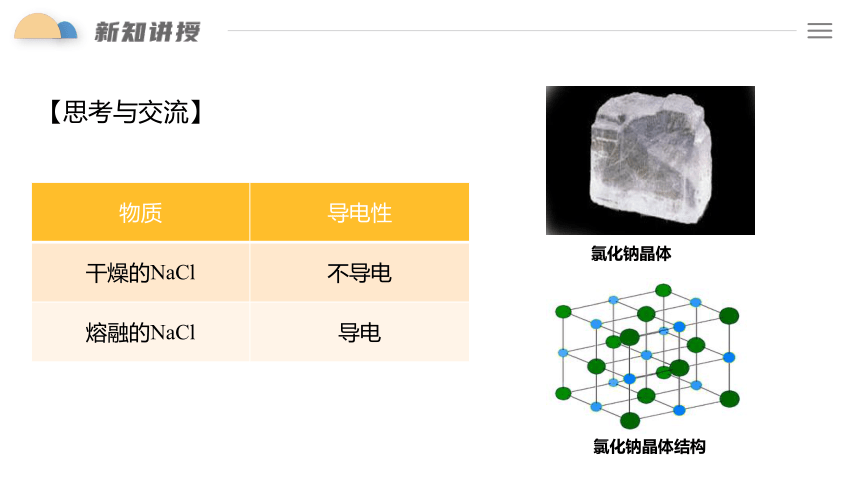
氯化钠晶体
氯化钠晶体结构
物质 导电性
干燥的NaCl 不导电
熔融的NaCl 导电
【思考与交流】
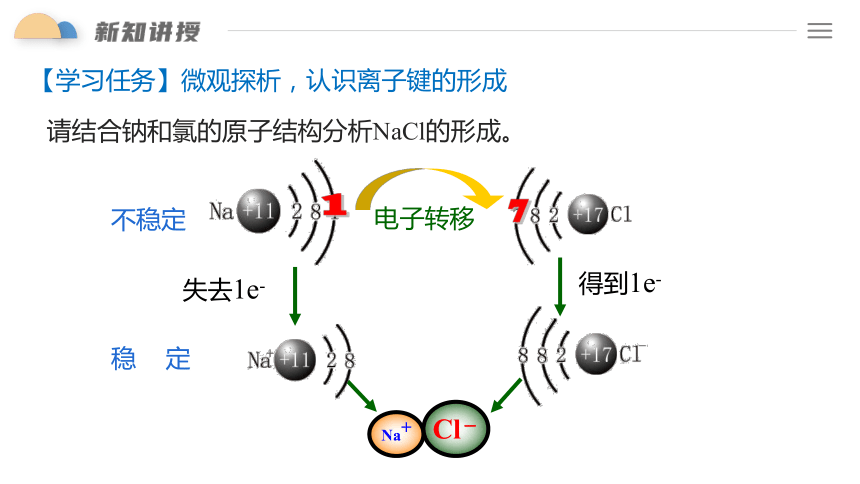
【学习任务】微观探析,认识离子键的形成
Na+
Cl-
电子转移
1
不稳定
稳 定
失去1e-
得到1e-
7
请结合钠和氯的原子结构分析NaCl的形成。
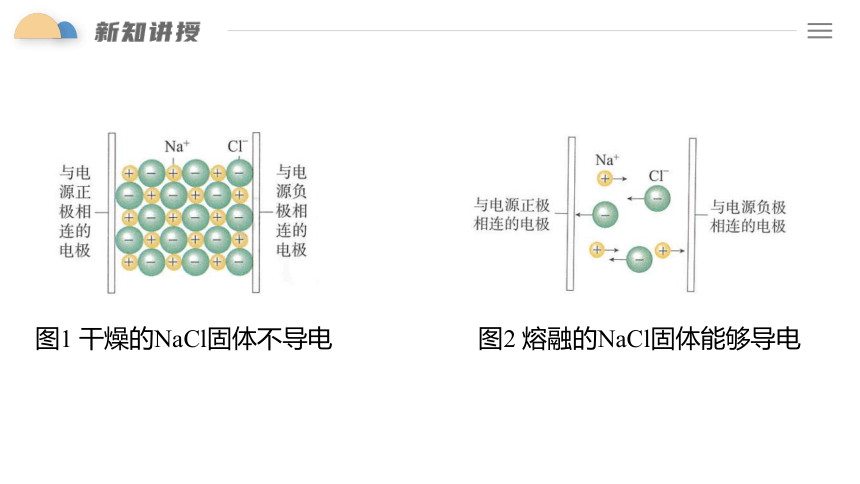
图1 干燥的NaCl固体不导电
图2 熔融的NaCl固体能够导电
【新概念】
带相反电荷离子之间的相互作用叫做离子键
(3)成键条件:
(1)成键粒子:
①活泼金属(IA、IIA)和活泼非金属 (VIA、VIIA)间
阴、阳离子
(2)离子键的实质:
静电作用
静电引力:阴离子、阳离子之间
静电斥力:原子核与原子核、电子与电子
②金属阳离子或NH4+ 和某些带电原子团之间
离子键
离子键
①活泼金属阳离子和活泼非金属阴离子形成的化合物
②活泼金属阳离子和酸根离子形成的盐
③铵根离子和酸根离子(或活泼非金属阴离子)形成的盐
NaCl MgCl2
Na2O MgO
Na2CO3 MgSO4
NH4Cl NH4NO3
常见哪些物质中含有离子键?
NaOH
[思考]非金属元素化合都不能形成离子键吗?举例说明
铵盐中就只有非金属元素,但它们是离子化合物。如NH4Cl、NH4NO3等。
[思考]金属和非金属化合都能形成离子键吗?举例说明。
AlCl3 等化合物中,铝原子与卤素原子之间所形成的并非离子键,均不是离子化合物。
特殊:AlCl3(共价键)
特殊:NH4+X-(离子键)
【学习任务】符号表征——用电子式表示物质的形成过程
电子式: 在元素符号周围用 “·” 或“×”来表示粒子最外层电子的式子
原子的电子式:
离子的电子式:
Na+
[ Cl ]-
··
··
:
:
Mg2+
[ O ]2-
··
··
:
:
【小结】离子的电子式表示方法:
(2) 阴离子的电子式:不但要画出最外层电子,且要用括号“[ ]”括起来,并在右上角标出离子所带电荷数(“n-”)。
(1) 简单阳离子(金属离子)的电子式直接用离子符号表示;
Na·
Cl ·
··
··
··
· Mg ·
·O·
··
··
·N·
··
·
·C ·
·
·
H·
(3)原子团的电子式
H
[H N H ]+
H
··
··
:
:
[ O H ]-
··
··
:
:
由离子键形成的物质的电子式如何表示?
由阴、阳离子的电子式组成,相同离子不能合并。
AB型
AB2型
A2B型
NaCl
Na2O
MgCl2
氮化钠
氢化钠
氧化钠
Na
Na
Na
N
: :
: :
3
-
+
+
+
Na
+
H
:
-
Na
O
2-
Na
写出下列微粒的电子式:
书写要点:
①左侧写原子的电子式
④右侧写化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
用电子式如何表示物质的形成过程?
请用电子式书写Na2O的形成过程。
用电子式表示氧化镁的形成过程
· O ·
··
··
[ O ]2-
··
··
:
:
· Mg ·
+
→
Mg2+
——由离子键构成的化合物
【新概念】
离子化合物
物质类别 常见代表物 性质特点
离子化合物 NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO 强碱、大多数盐及金属氧化物 熔融态能导电
熔沸点高、硬度大、难挥发
注意: ①离子键 离子化合物
②离子化合物不一定含金属元素
③含金属元素的化合物不一定是离子化合物
如:铵盐 NH4Cl
如:AlCl3
判断下列物质哪些是离子化合物?
是
是
是
不是
是
是
是
1. CaBr2
2. NaF
3. KBr
4. HCl
5. NH4Cl
6. NaOH
7. KNO3
8. Na2O
是
含有离子键的物质
强碱
活泼金属
氧化物
多数盐
离子键的三个“一定”和两个“不一定”
(1)三个“一定”
①离子化合物中一定含有离子键;
②含有离子键的化合物一定是离子化合物;
③离子化合物中一定含有阴离子和阳离子。
(2)两个“不一定”
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
离子键的特殊性:
(1)离子键在融化时一定被破坏,故离子化合物在融化时能够导电,这是判断离子化合物和共价化合物的方法。
(2)离子键是离子之间的静电作用,既有吸引也有排斥。
离子键
离子化合物
定义
成键要素
定义
常见类型
由离子键构成的化合物
强碱:如NaOH、KOH等
大多数盐:如NaCl、K2SO4等
活泼金属氧化物:如Na2O、CaO等
带相反电荷离子之间的相互作用
成键微粒
成键本质
成键元素
阳离子和阴离子
静电作用
一般是活泼金属和活泼非金属
形成
1.下列物质的电子式正确的是( )
D
2.下列化学用语表达方式错误的是( )
B
离子键
第四章 物质结构 元素周期律
1.理解离子键的概念,并能用电子式表示常见原子、离子、离子化合物等及物质的形成过程
2.能根据物质的构成微粒及相互作用,识别简单的离子化合物
3.理解化学反应的微观实质,认识化学学科的本质
1、构成物质的基本微粒有哪几种?分别举例说明。
⑴离子
⑵分子
⑶原子
氯化钠、氯化镁等
水、氯气、氧气等
金刚石、铜等
2、不同的物质含有不同的微粒,这些微粒是如何构成物质的?
一、化学键
1、定义:通常我们相邻的原子之间强烈的相互作用叫做化学键。
2 、类型
离子键:离子之间
共价键:原子之间
金属键:金属内
氯化钠晶体
氯化钠晶体结构
物质 导电性
干燥的NaCl 不导电
熔融的NaCl 导电
【思考与交流】
【学习任务】微观探析,认识离子键的形成
Na+
Cl-
电子转移
1
不稳定
稳 定
失去1e-
得到1e-
7
请结合钠和氯的原子结构分析NaCl的形成。
图1 干燥的NaCl固体不导电
图2 熔融的NaCl固体能够导电
【新概念】
带相反电荷离子之间的相互作用叫做离子键
(3)成键条件:
(1)成键粒子:
①活泼金属(IA、IIA)和活泼非金属 (VIA、VIIA)间
阴、阳离子
(2)离子键的实质:
静电作用
静电引力:阴离子、阳离子之间
静电斥力:原子核与原子核、电子与电子
②金属阳离子或NH4+ 和某些带电原子团之间
离子键
离子键
①活泼金属阳离子和活泼非金属阴离子形成的化合物
②活泼金属阳离子和酸根离子形成的盐
③铵根离子和酸根离子(或活泼非金属阴离子)形成的盐
NaCl MgCl2
Na2O MgO
Na2CO3 MgSO4
NH4Cl NH4NO3
常见哪些物质中含有离子键?
NaOH
[思考]非金属元素化合都不能形成离子键吗?举例说明
铵盐中就只有非金属元素,但它们是离子化合物。如NH4Cl、NH4NO3等。
[思考]金属和非金属化合都能形成离子键吗?举例说明。
AlCl3 等化合物中,铝原子与卤素原子之间所形成的并非离子键,均不是离子化合物。
特殊:AlCl3(共价键)
特殊:NH4+X-(离子键)
【学习任务】符号表征——用电子式表示物质的形成过程
电子式: 在元素符号周围用 “·” 或“×”来表示粒子最外层电子的式子
原子的电子式:
离子的电子式:
Na+
[ Cl ]-
··
··
:
:
Mg2+
[ O ]2-
··
··
:
:
【小结】离子的电子式表示方法:
(2) 阴离子的电子式:不但要画出最外层电子,且要用括号“[ ]”括起来,并在右上角标出离子所带电荷数(“n-”)。
(1) 简单阳离子(金属离子)的电子式直接用离子符号表示;
Na·
Cl ·
··
··
··
· Mg ·
·O·
··
··
·N·
··
·
·C ·
·
·
H·
(3)原子团的电子式
H
[H N H ]+
H
··
··
:
:
[ O H ]-
··
··
:
:
由离子键形成的物质的电子式如何表示?
由阴、阳离子的电子式组成,相同离子不能合并。
AB型
AB2型
A2B型
NaCl
Na2O
MgCl2
氮化钠
氢化钠
氧化钠
Na
Na
Na
N
: :
: :
3
-
+
+
+
Na
+
H
:
-
Na
O
2-
Na
写出下列微粒的电子式:
书写要点:
①左侧写原子的电子式
④右侧写化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
用电子式如何表示物质的形成过程?
请用电子式书写Na2O的形成过程。
用电子式表示氧化镁的形成过程
· O ·
··
··
[ O ]2-
··
··
:
:
· Mg ·
+
→
Mg2+
——由离子键构成的化合物
【新概念】
离子化合物
物质类别 常见代表物 性质特点
离子化合物 NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO 强碱、大多数盐及金属氧化物 熔融态能导电
熔沸点高、硬度大、难挥发
注意: ①离子键 离子化合物
②离子化合物不一定含金属元素
③含金属元素的化合物不一定是离子化合物
如:铵盐 NH4Cl
如:AlCl3
判断下列物质哪些是离子化合物?
是
是
是
不是
是
是
是
1. CaBr2
2. NaF
3. KBr
4. HCl
5. NH4Cl
6. NaOH
7. KNO3
8. Na2O
是
含有离子键的物质
强碱
活泼金属
氧化物
多数盐
离子键的三个“一定”和两个“不一定”
(1)三个“一定”
①离子化合物中一定含有离子键;
②含有离子键的化合物一定是离子化合物;
③离子化合物中一定含有阴离子和阳离子。
(2)两个“不一定”
①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
离子键的特殊性:
(1)离子键在融化时一定被破坏,故离子化合物在融化时能够导电,这是判断离子化合物和共价化合物的方法。
(2)离子键是离子之间的静电作用,既有吸引也有排斥。
离子键
离子化合物
定义
成键要素
定义
常见类型
由离子键构成的化合物
强碱:如NaOH、KOH等
大多数盐:如NaCl、K2SO4等
活泼金属氧化物:如Na2O、CaO等
带相反电荷离子之间的相互作用
成键微粒
成键本质
成键元素
阳离子和阴离子
静电作用
一般是活泼金属和活泼非金属
形成
1.下列物质的电子式正确的是( )
D
2.下列化学用语表达方式错误的是( )
B
