4.2 课时2 元素周期律的应用(共26张PPT) 课件 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.2 课时2 元素周期律的应用(共26张PPT) 课件 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:20:55 | ||
图片预览






文档简介
(共26张PPT)
元素周期律的应用
第四章 物质结构 元素周期律
1.能利用元素在元素周期表中的位置和原子结构分析、预测、比较元素及其化合物的性质
2.体会元素周期表(律)在学习元素及其化合物知识及学科研究中的重要作用
门捷列夫的预言
门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,为它们在周期表中留下空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,并命名为镓。
请画出碱金属元素的原子结构示意图
碱金属核外电子排布有何共同点?
联系之前学过的碱金属的化学性质,它们在化合物中表现的最高价态是多少?
最外层均为1个电子
NaOH、Na2CO3、Na2O、KCl、LiCl等化合物中,碱金属的化合价均为+1价。
碱金属元素的最外层电子数等于其在化合物中的最高正价等于主族序数
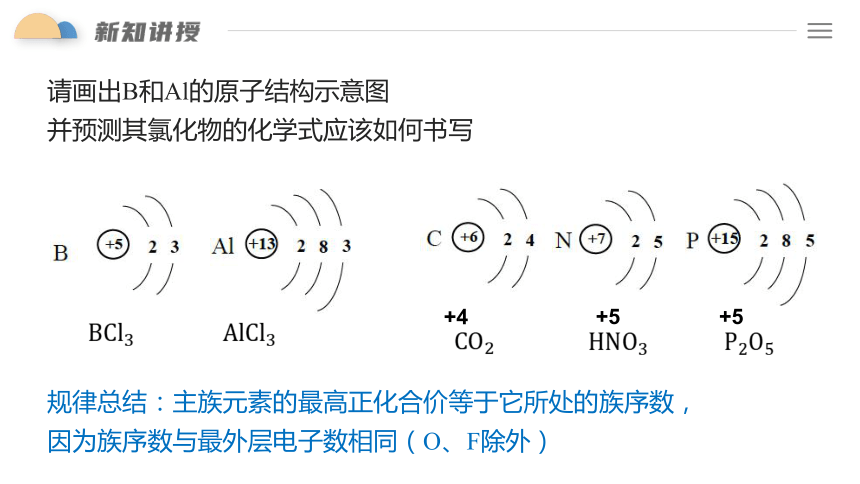
请画出B和Al的原子结构示意图
并预测其氯化物的化学式应该如何书写
+4
+5
规律总结:主族元素的最高正化合价等于它所处的族序数,因为族序数与最外层电子数相同(O、F除外)
+5
结论:非金属元素的最高正化合价,等于原子所能失去或偏移的最外层电子数;而它的最低负化合价,则等于使原子达到8电子稳定结构所需得到的电子数。即,最高正价与最低负价绝对值之和为8(H则为2)
-3
-3
请写出下列化合物中N和P的化合价
对比N和P的最高价可以发现什么规律?
同主族元素化合价特点
+1 +2 +3 +4 +5 +6 +7
最低负价: -4 -3 -2 -1
无正价
无正价
最低负价:-1
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
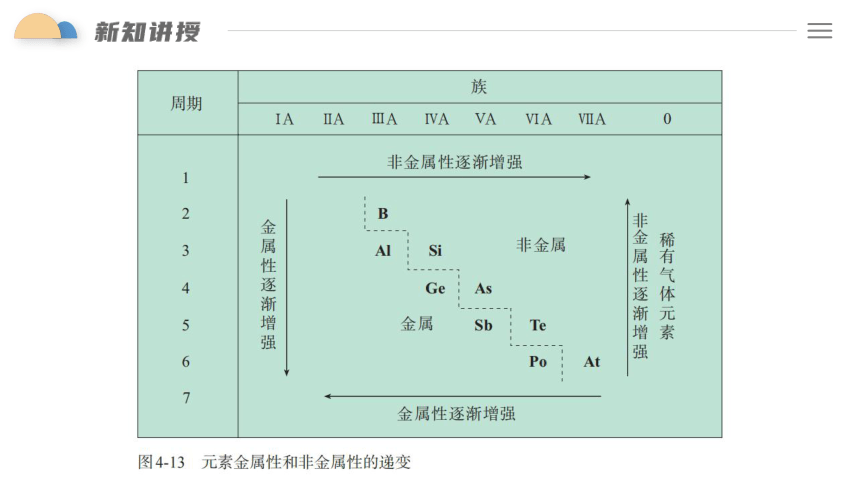
温故:同一周期,从左到右核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
知新:同一主族,从上到下,电子层数逐渐增多 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 。
增大
增强
减弱
增强
减弱
规律总结
1.根据元素周期表回答下列问题:
(1)金属性最强的元素是___,非金属性最强的元素是_____;
(2)第3周期中,原子半径最小的元素(稀有气体元素除外)是______,非金属性最强的元素是______;
Cs
F
Cl
Cl
(3)短周期主族元素中,最高价氧化物的水化物酸性最强的是 。碱性最强的是 。气态氢化物稳定性最强的是 。
NaOH
HClO4
HF
元素名称 硒 元素符号 Se
原子序数 34 金属还是 非金属?
原子结构示意图
最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应水化物
与硫酸比较酸性 与硫化氢比较稳定性
2.根据元素周期表和元素周期律,互相交流讨论,填写下表:
非金属
+6
-2
0,+4
H2Se
SeO3
H2SeO4
弱
弱
常见半导体材料:硅、锗、砷化镓
砷化镓
太阳能电池
硅基芯片
锗半导体
结论:半导体材料在金属与非金属交界处寻找
稻谷青
P
S
Cl
As
N
结论:通常农药中含有的元素集中在周期表的右上角
结论:可以在过渡元素中寻找催化剂或耐腐蚀、耐高温材料
预测新元素
寻找催化剂
寻找半导体
寻找农药
元素在
周期表中的位置
(位置)
原子核外
电子排布特点
(结构)
元素性质与应用
(性质)
最高正价
最低负价
化学性质
确定位置
推测结构
预测性质
1.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,W是大气中含量最高的元素,由此可知( )
A.Q的一种核素中14O的质子数和中子数相等
B.X的最高正化合价与最低负化合价的绝对值之差为6
C.Y是常见的半导体材料
D.Z的氧化物的水化物是强酸
C
Q W X
Y Z
2.下列事实,不能说明氯元素的非金属性比硫元素强的是( )
A.氯气与H2S能发生置换反应
B.HClO4酸性比H2SO4强
C.盐酸是强酸,氢硫酸是弱酸
D.受热时,氯化氢比硫化氢稳定
C
3.W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q为一元强碱,q、s的焰色均呈黄色。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径:W<X<Y<Z
B.Y的简单氢化物的稳定性比X的弱
C.元素非金属性:X<Y
D.由W、X、Y、Z四种元素只能组成一种化合物
C
4.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
A.对应简单离子半径:XB.对应简单气态氢化物的稳定性:YC.与Z元素同主族的元素最高价态均为+7
D.Y的氧化物能与X的最高价氧化物对应的水化物反应
C
5.现有下列短周期元素性质的数据,下列说法正确的是( )
A.⑧号元素为铝元素
B.②、③2种元素处于同一周期
C.上述8种元素中元素⑤的最高价氧化物对应的水化物的酸性最强
D.④元素的气态氢化物的稳定性比⑦元素的氢化物强
C
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径 (10-10 m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高或最 低化合价 -2 +2 +1 +5;-3 +7;-1 +1 +5;-3 +3
6.短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物是天然气的主要成分,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为23:16。可溶性化合物E和F分别含元素Y、X,在10 mL 1.0 mol·L-1E溶液中滴加1.0 mol·L-1F溶液,产生沉淀的物质的量与F溶液体积的关系如图所示。下列说法一定正确的是( )
A.原子半径:X>Y>R
B.最高价氧化物对应水化物的酸性:Z>Y>R
C.X和Y的单质组成的混合物不能完全溶于水
D.金属性:Y>X
A
7.某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为__________________,C中可观察到的现象是______________。
(2)B装置的作用是________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是____________,
由此得出碳、硅、氮三种元素非金属性的强弱顺序是____________。
CaCO3+2H+===Ca2++CO2↑+H2O
溶液变浑浊
除去二氧化碳中混有的硝酸蒸气
HNO3>H2CO3>H2SiO3
N>C>Si
7.某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:__________________________。
(5)C装置的作用是________________________。
(6)实验结论:氧化性___________,非金属性:___________。
Cl>Br
Cl2+2Br-===Br2+2Cl-
吸收尾气,防止氯气污染环境
Cl2>Br2
8.某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验。
Ⅰ.(1)将物质的量均为1 mol的钠、钾、镁、铝分别投入足量的0.1 mol·L-1的盐酸中,试预测实验结果:______与盐酸反应最剧烈,________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合,反应生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O的,继而可以验证Na的金属性强于N的,你认为此设计是否合理?并说明理由_______________________________________。
钾 铝
不合理,用碱性强弱来判断元素的金属性强弱时,一定要用元素的最高价氧化物对应的水化物的碱性强弱进行判断,NH3·H2O不是N元素的最高价氧化物对应的水化物
8.某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验。
Ⅱ.利用下图所示装置可以验证元素的非金属性的变化规律。
(3)仪器A的名称为________,仪器D的作用是____________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫的:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________。
(5)若要证明非金属性:C>Si,则A中应加入______,B中应加入Na2CO3,C中应加入_______溶液,观察到C中的现象为_______________________。
(3)分液漏斗 防止倒吸
(4)浓盐酸 KMnO4 Na2S S2-+Cl2===S↓+2Cl-
(5)硫酸 Na2SiO3 有白色胶状沉淀产生
元素周期律的应用
第四章 物质结构 元素周期律
1.能利用元素在元素周期表中的位置和原子结构分析、预测、比较元素及其化合物的性质
2.体会元素周期表(律)在学习元素及其化合物知识及学科研究中的重要作用
门捷列夫的预言
门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,为它们在周期表中留下空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,并命名为镓。
请画出碱金属元素的原子结构示意图
碱金属核外电子排布有何共同点?
联系之前学过的碱金属的化学性质,它们在化合物中表现的最高价态是多少?
最外层均为1个电子
NaOH、Na2CO3、Na2O、KCl、LiCl等化合物中,碱金属的化合价均为+1价。
碱金属元素的最外层电子数等于其在化合物中的最高正价等于主族序数
请画出B和Al的原子结构示意图
并预测其氯化物的化学式应该如何书写
+4
+5
规律总结:主族元素的最高正化合价等于它所处的族序数,因为族序数与最外层电子数相同(O、F除外)
+5
结论:非金属元素的最高正化合价,等于原子所能失去或偏移的最外层电子数;而它的最低负化合价,则等于使原子达到8电子稳定结构所需得到的电子数。即,最高正价与最低负价绝对值之和为8(H则为2)
-3
-3
请写出下列化合物中N和P的化合价
对比N和P的最高价可以发现什么规律?
同主族元素化合价特点
+1 +2 +3 +4 +5 +6 +7
最低负价: -4 -3 -2 -1
无正价
无正价
最低负价:-1
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
温故:同一周期,从左到右核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
知新:同一主族,从上到下,电子层数逐渐增多 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 。
增大
增强
减弱
增强
减弱
规律总结
1.根据元素周期表回答下列问题:
(1)金属性最强的元素是___,非金属性最强的元素是_____;
(2)第3周期中,原子半径最小的元素(稀有气体元素除外)是______,非金属性最强的元素是______;
Cs
F
Cl
Cl
(3)短周期主族元素中,最高价氧化物的水化物酸性最强的是 。碱性最强的是 。气态氢化物稳定性最强的是 。
NaOH
HClO4
HF
元素名称 硒 元素符号 Se
原子序数 34 金属还是 非金属?
原子结构示意图
最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应水化物
与硫酸比较酸性 与硫化氢比较稳定性
2.根据元素周期表和元素周期律,互相交流讨论,填写下表:
非金属
+6
-2
0,+4
H2Se
SeO3
H2SeO4
弱
弱
常见半导体材料:硅、锗、砷化镓
砷化镓
太阳能电池
硅基芯片
锗半导体
结论:半导体材料在金属与非金属交界处寻找
稻谷青
P
S
Cl
As
N
结论:通常农药中含有的元素集中在周期表的右上角
结论:可以在过渡元素中寻找催化剂或耐腐蚀、耐高温材料
预测新元素
寻找催化剂
寻找半导体
寻找农药
元素在
周期表中的位置
(位置)
原子核外
电子排布特点
(结构)
元素性质与应用
(性质)
最高正价
最低负价
化学性质
确定位置
推测结构
预测性质
1.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,W是大气中含量最高的元素,由此可知( )
A.Q的一种核素中14O的质子数和中子数相等
B.X的最高正化合价与最低负化合价的绝对值之差为6
C.Y是常见的半导体材料
D.Z的氧化物的水化物是强酸
C
Q W X
Y Z
2.下列事实,不能说明氯元素的非金属性比硫元素强的是( )
A.氯气与H2S能发生置换反应
B.HClO4酸性比H2SO4强
C.盐酸是强酸,氢硫酸是弱酸
D.受热时,氯化氢比硫化氢稳定
C
3.W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q为一元强碱,q、s的焰色均呈黄色。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径:W<X<Y<Z
B.Y的简单氢化物的稳定性比X的弱
C.元素非金属性:X<Y
D.由W、X、Y、Z四种元素只能组成一种化合物
C
4.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
A.对应简单离子半径:X
D.Y的氧化物能与X的最高价氧化物对应的水化物反应
C
5.现有下列短周期元素性质的数据,下列说法正确的是( )
A.⑧号元素为铝元素
B.②、③2种元素处于同一周期
C.上述8种元素中元素⑤的最高价氧化物对应的水化物的酸性最强
D.④元素的气态氢化物的稳定性比⑦元素的氢化物强
C
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径 (10-10 m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高或最 低化合价 -2 +2 +1 +5;-3 +7;-1 +1 +5;-3 +3
6.短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物是天然气的主要成分,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为23:16。可溶性化合物E和F分别含元素Y、X,在10 mL 1.0 mol·L-1E溶液中滴加1.0 mol·L-1F溶液,产生沉淀的物质的量与F溶液体积的关系如图所示。下列说法一定正确的是( )
A.原子半径:X>Y>R
B.最高价氧化物对应水化物的酸性:Z>Y>R
C.X和Y的单质组成的混合物不能完全溶于水
D.金属性:Y>X
A
7.某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为__________________,C中可观察到的现象是______________。
(2)B装置的作用是________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是____________,
由此得出碳、硅、氮三种元素非金属性的强弱顺序是____________。
CaCO3+2H+===Ca2++CO2↑+H2O
溶液变浑浊
除去二氧化碳中混有的硝酸蒸气
HNO3>H2CO3>H2SiO3
N>C>Si
7.某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:__________________________。
(5)C装置的作用是________________________。
(6)实验结论:氧化性___________,非金属性:___________。
Cl>Br
Cl2+2Br-===Br2+2Cl-
吸收尾气,防止氯气污染环境
Cl2>Br2
8.某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验。
Ⅰ.(1)将物质的量均为1 mol的钠、钾、镁、铝分别投入足量的0.1 mol·L-1的盐酸中,试预测实验结果:______与盐酸反应最剧烈,________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合,反应生成NH3·H2O,从而验证NaOH的碱性强于NH3·H2O的,继而可以验证Na的金属性强于N的,你认为此设计是否合理?并说明理由_______________________________________。
钾 铝
不合理,用碱性强弱来判断元素的金属性强弱时,一定要用元素的最高价氧化物对应的水化物的碱性强弱进行判断,NH3·H2O不是N元素的最高价氧化物对应的水化物
8.某中学化学兴趣小组同学为探究元素周期律,设计了如下一系列实验。
Ⅱ.利用下图所示装置可以验证元素的非金属性的变化规律。
(3)仪器A的名称为________,仪器D的作用是____________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫的:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________。
(5)若要证明非金属性:C>Si,则A中应加入______,B中应加入Na2CO3,C中应加入_______溶液,观察到C中的现象为_______________________。
(3)分液漏斗 防止倒吸
(4)浓盐酸 KMnO4 Na2S S2-+Cl2===S↓+2Cl-
(5)硫酸 Na2SiO3 有白色胶状沉淀产生
