4.2 课时1 元素周期律 课件 (共39张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.2 课时1 元素周期律 课件 (共39张PPT)2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:13:26 | ||
图片预览







文档简介
(共39张PPT)
元素周期律
第四章 物质结构 元素周期律
1.结合有关数据和实验事实认识原子核外电子排布、元素最高化合价和最低化合价、原子半径等随元素原子序数递增而呈周期性变化的规律
2.以第三周期元素为例,同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律,建构元素周期律
阅读 P107 表4--5 并 完成P108 思考与讨论
一、原子结构的周期性变化
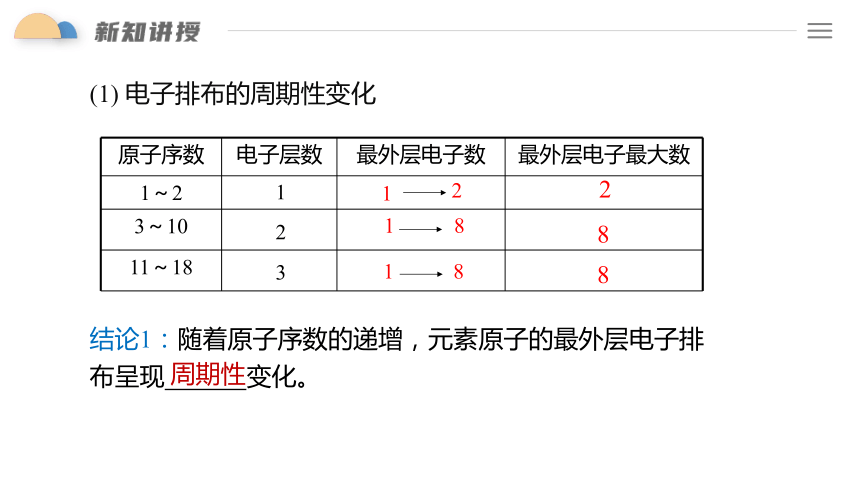
结论1:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。
原子序数 电子层数 最外层电子数 最外层电子最大数
1~2
3~10
11~18
1
2
3
1
2
1
8
1
8
8
8
2
周期性
(1) 电子排布的周期性变化
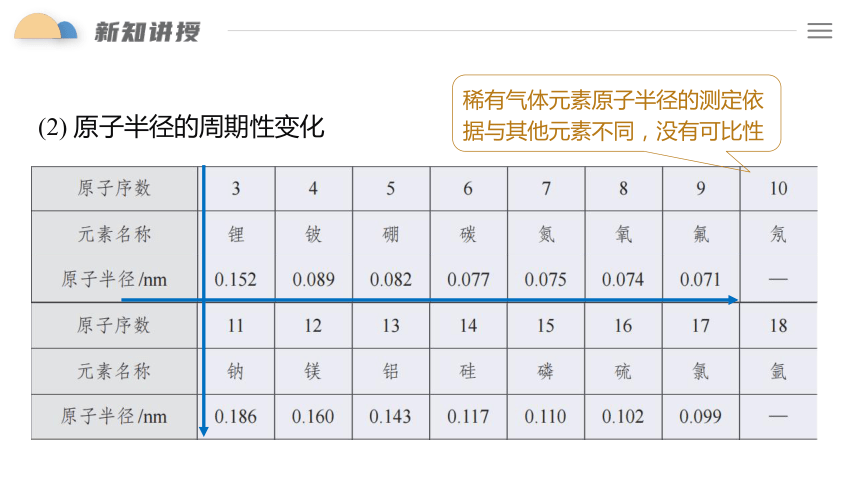
(2) 原子半径的周期性变化
稀有气体元素原子半径的测定依据与其他元素不同,没有可比性
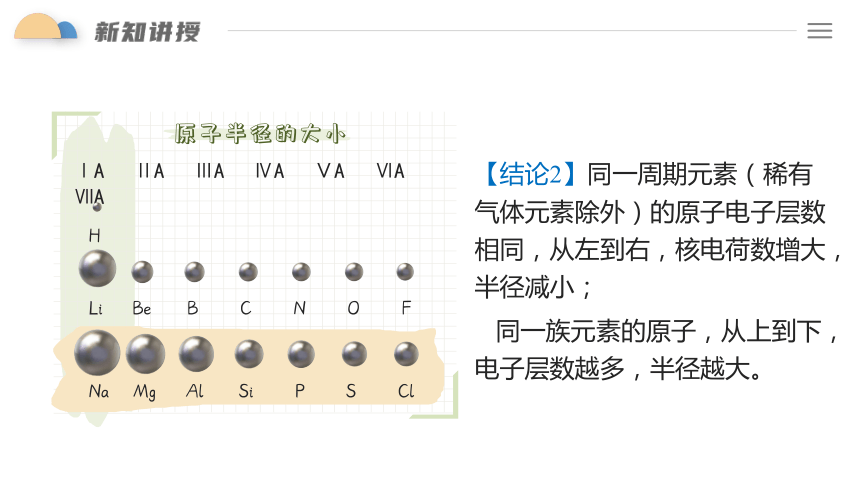
【结论2】同一周期元素(稀有气体元素除外)的原子电子层数相同,从左到右,核电荷数增大,半径减小;
同一族元素的原子,从上到下,电子层数越多,半径越大。
原子半径的大小
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
H
Li Be B C N O F
Na Mg Al Si P S Cl
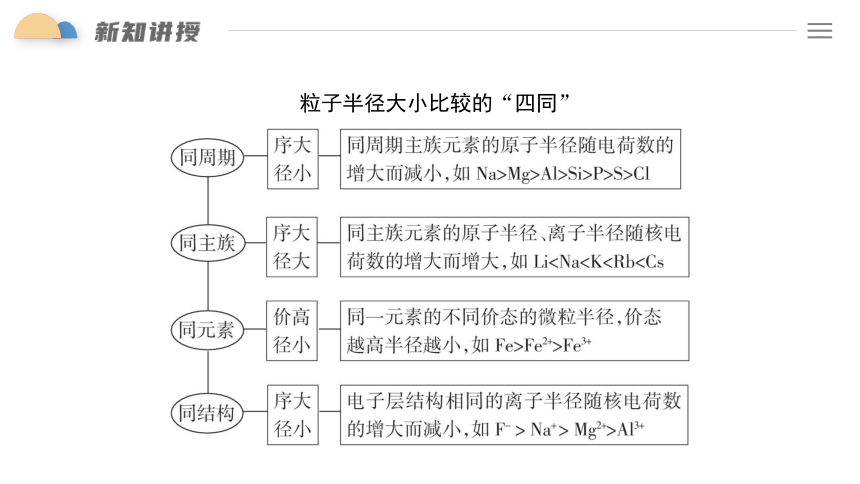
粒子半径大小比较的“四同”
粒子半径的大小比较的步骤 :
①先比电子层(一般层多半径大)
②电子层数相同时,再比原子序数(序大半径小)
③当电子层数和原子序数一样时(即同一种元素的不同微粒),再比电子数(电子数多半径大)
r(Li) r(Na) r(K);
r(Li+) r(Na+) r(K+)
r(Na) r(Mg) r(Al);
O2- F- Na+ Mg2+ Al3+
Cl Cl-
Na Na+
Fe2+ Fe3+
>
<
>
<
<
<
<
>
>
>
>
>
>
原子半径<相应的阴离子半径;原子 半径>相应的阳离子半径
“三看”
1.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C
B.原子的最外层电子数目:A>B>D>C
C.原子序数:d>c>b>a
D.离子半径:C2->D->B+>A2+
D
2.下列说法正确的是( )
A.原子序数越大,原子半径一定越大
B.电子层数多的原子半径一定比电子层数少的原子半径大
C.元素性质的周期性变化不是元素性质的简单重复
D.按C、N、O、F的顺序,元素的最高正化合价依次升高
C
二、元素性质的周期性变化
1-2号元素 H He
最高和最低 化合价 +1
0
3-10号元素 Li Be B C N O F Ne
最高和最低 化合价 +1 +2 +3 +4 +5 0
-4 -3 -2 -1
11-18号元素 Na Mg Al Si P S Cl Ar
最高和最低 化合价 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1
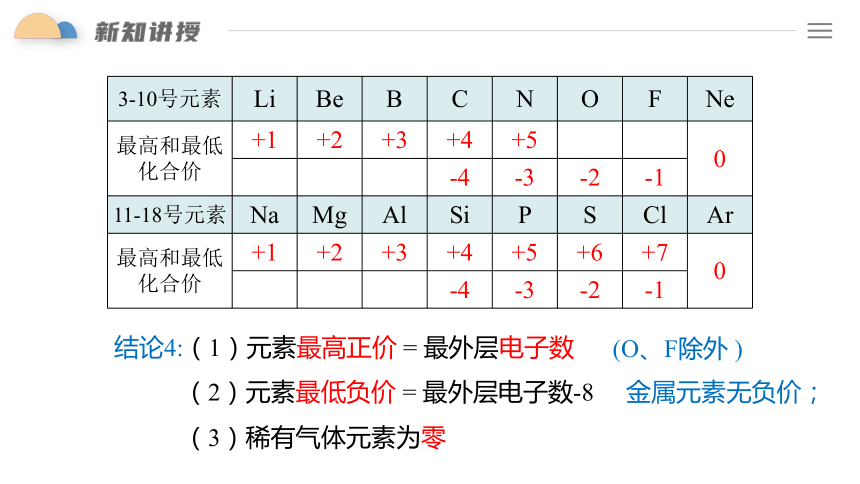
结论3:随核电荷数的递增,元素的主要化合价呈周期性变化。最高正价由+1到+7递增,最低负价由-4到-1递增。
(1)元素的主要化合价的周期性变化
结论4:(1)元素最高正价 = 最外层电子数
金属元素无负价;
3-10号元素 Li Be B C N O F Ne
最高和最低 化合价 +1 +2 +3 +4 +5 0
-4 -3 -2 -1
11-18号元素 Na Mg Al Si P S Cl Ar
最高和最低 化合价 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1
(O、F除外 )
(2)元素最低负价 = 最外层电子数-8
(3)稀有气体元素为零
延展提升
氢化物及其最高价含氧酸的关系
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物
实例
H2RO3或H4RO4
H3RO4或HRO3
H2RO4
HRO4
H2CO3或H4SiO4
H3PO4或HNO3
H2SO4
HClO4
3.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
金
属
性
(1)金属单质与水或酸反应置换出H2的难易
(2)金属最高价氧化物对应的水化物(最高价氢氧化物)的碱性强弱
判断元素金属性强弱的方法
判断元素非金属性强弱的方法
非
金
属
性
(1)非金属单质与H2化合的难易
(2)气态氢化物的稳定性
(3)最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
(3)相互之间的置换反应
(4)相互之间的置换反应
(2)第三周期元素性质的递变
思考:根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,半径减小
失电子能力减弱,得电子能力增强
金属性减弱,非金属性增强
甲同学:依据金属性活动顺序,预测金属性顺序为 Na>Mg>Al
乙同学:依据钠与水的剧烈反应,预测第三周期中Na金属性最强
性质预测
丙同学:依据最外层电子数多少预测,金属性顺序为Na>Mg>Al,最外层电子数越少越容易失去
丁同学:依据核电荷数多少预测,金属性顺序为Na>Mg>Al,核电荷数越多越难失去最外层电子
从左到右
核电荷数
增多
原子半径
减小
原子核
对最外
层电子
的引力
增强
失电子
能力减弱
金属性
减弱
相同
原子结构
核电
荷数
电子层数
最外层电子数
结构解释
你能设计实验验证金属性:Na>Mg>Al 吗?实验设计的依据是什么呢?
金属单质与水(或酸)反应置换出氢的难易程度
判断元素金属性强弱的依据
寻找证据
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
寻找证据
判断元素金属性强弱的依据
金属元素最高价氧化物对应的水化物——氢氧化物的碱性强弱。
如何设计实验证明NaOH、Mg(OH)2和Al(OH) 3三者碱性的强弱呢?
比较Mg(OH)2和Al(OH)3的碱性强弱
说明Al(OH)3是两性氢氧化物,表明金属铝已表现出一定的非金属性。
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH-=[Al(OH)4]-
比较Mg(OH)2和Al(OH)3的碱性强弱
得出结论
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
你能依据第三周期元素金属性的研究方法继续研究第三周期元素非金属性的递变规律吗?
判断元素非金属性强弱的依据
元素
非金属性
非金属单质与氢气反应生成气态氢化物的难易程度及氢化物的稳定性。
非金属元素的最高价氧化物对应的水化物——最高价含氧酸的酸性强弱。
寻找证据
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4)
Cl 高氯酸(HClO4)
强酸
酸性比硫酸的强
寻找证据
寻找证据
与氢气化合的难易:磷 < 硫 < 氯气;稳定性: H2S<HCl
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
得出结论
非金属性:Si<P<S<Cl
得出结论
对其它周期主族元素进行同样的研究,一般情况下也会得出同样的规律。
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
本质:元素原子的核外电子排布呈周期性变化。
总结归纳
元素周期律
含义:元素的性质随着原子序数的递增而呈周期性的变化。
原子
结构
最外层
电子数
电子
层数
核电荷数
元素位置
元素性质
原子序数
周期
族
化合价
原子半径
金属性/非金属性
判断依据
得失电子难易程度
1.有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
ⅥA
ⅦA
ⅤA
D
A
同主族非金属元素最高价氧化物对应的水化物酸性
2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
3.下列关于主族元素的说法错误的是( )
A.同主族元素随着原子序数的递增,元素的金属性增强
B.同主族元素随着原子序数的递增,元素单质的熔、沸点逐渐升高
C.同主族元素原子最外层电子数都相同
D.同主族元素随着原子序数的递增,元素(O、F除外)最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强
B
4.氯气的氧化性比硫的氧化性强,能证明这一结论的事实是( )
A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体
B.硫不溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2价,而氯被还原为-1 价
D.与同一种金属反应时,金属被硫氧化成低价态,但被氯气氧化成高价态
D
5.砹(At)原子序数为85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是( )
A.砹是有色固体
B.非金属性:At<I
C.HAt非常稳定
D.I2能从砹的可溶性盐溶液中置换出At2
C
6.下列关于卤素(用X表示)的叙述正确的是( )
A.其单质都能与水反应,通式为X2+H2O===HX+HXO
B.HX易溶于水,其水溶液都是强酸
C.其单质都有颜色,都有毒
D.最高价含氧酸的通式为HXO4
C
7.下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱
C.酸性H2CO3>H2SiO3,判断碳与硅的非金属活动性强弱
D.Br2与I2分别与足量的H2反应的难易,判断溴与碘的非金属活动性强弱
B
元素周期律
第四章 物质结构 元素周期律
1.结合有关数据和实验事实认识原子核外电子排布、元素最高化合价和最低化合价、原子半径等随元素原子序数递增而呈周期性变化的规律
2.以第三周期元素为例,同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律,建构元素周期律
阅读 P107 表4--5 并 完成P108 思考与讨论
一、原子结构的周期性变化
结论1:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。
原子序数 电子层数 最外层电子数 最外层电子最大数
1~2
3~10
11~18
1
2
3
1
2
1
8
1
8
8
8
2
周期性
(1) 电子排布的周期性变化
(2) 原子半径的周期性变化
稀有气体元素原子半径的测定依据与其他元素不同,没有可比性
【结论2】同一周期元素(稀有气体元素除外)的原子电子层数相同,从左到右,核电荷数增大,半径减小;
同一族元素的原子,从上到下,电子层数越多,半径越大。
原子半径的大小
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
H
Li Be B C N O F
Na Mg Al Si P S Cl
粒子半径大小比较的“四同”
粒子半径的大小比较的步骤 :
①先比电子层(一般层多半径大)
②电子层数相同时,再比原子序数(序大半径小)
③当电子层数和原子序数一样时(即同一种元素的不同微粒),再比电子数(电子数多半径大)
r(Li) r(Na) r(K);
r(Li+) r(Na+) r(K+)
r(Na) r(Mg) r(Al);
O2- F- Na+ Mg2+ Al3+
Cl Cl-
Na Na+
Fe2+ Fe3+
>
<
>
<
<
<
<
>
>
>
>
>
>
原子半径<相应的阴离子半径;原子 半径>相应的阳离子半径
“三看”
1.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C
B.原子的最外层电子数目:A>B>D>C
C.原子序数:d>c>b>a
D.离子半径:C2->D->B+>A2+
D
2.下列说法正确的是( )
A.原子序数越大,原子半径一定越大
B.电子层数多的原子半径一定比电子层数少的原子半径大
C.元素性质的周期性变化不是元素性质的简单重复
D.按C、N、O、F的顺序,元素的最高正化合价依次升高
C
二、元素性质的周期性变化
1-2号元素 H He
最高和最低 化合价 +1
0
3-10号元素 Li Be B C N O F Ne
最高和最低 化合价 +1 +2 +3 +4 +5 0
-4 -3 -2 -1
11-18号元素 Na Mg Al Si P S Cl Ar
最高和最低 化合价 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1
结论3:随核电荷数的递增,元素的主要化合价呈周期性变化。最高正价由+1到+7递增,最低负价由-4到-1递增。
(1)元素的主要化合价的周期性变化
结论4:(1)元素最高正价 = 最外层电子数
金属元素无负价;
3-10号元素 Li Be B C N O F Ne
最高和最低 化合价 +1 +2 +3 +4 +5 0
-4 -3 -2 -1
11-18号元素 Na Mg Al Si P S Cl Ar
最高和最低 化合价 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -1
(O、F除外 )
(2)元素最低负价 = 最外层电子数-8
(3)稀有气体元素为零
延展提升
氢化物及其最高价含氧酸的关系
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物
实例
H2RO3或H4RO4
H3RO4或HRO3
H2RO4
HRO4
H2CO3或H4SiO4
H3PO4或HNO3
H2SO4
HClO4
3.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
金
属
性
(1)金属单质与水或酸反应置换出H2的难易
(2)金属最高价氧化物对应的水化物(最高价氢氧化物)的碱性强弱
判断元素金属性强弱的方法
判断元素非金属性强弱的方法
非
金
属
性
(1)非金属单质与H2化合的难易
(2)气态氢化物的稳定性
(3)最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
(3)相互之间的置换反应
(4)相互之间的置换反应
(2)第三周期元素性质的递变
思考:根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,半径减小
失电子能力减弱,得电子能力增强
金属性减弱,非金属性增强
甲同学:依据金属性活动顺序,预测金属性顺序为 Na>Mg>Al
乙同学:依据钠与水的剧烈反应,预测第三周期中Na金属性最强
性质预测
丙同学:依据最外层电子数多少预测,金属性顺序为Na>Mg>Al,最外层电子数越少越容易失去
丁同学:依据核电荷数多少预测,金属性顺序为Na>Mg>Al,核电荷数越多越难失去最外层电子
从左到右
核电荷数
增多
原子半径
减小
原子核
对最外
层电子
的引力
增强
失电子
能力减弱
金属性
减弱
相同
原子结构
核电
荷数
电子层数
最外层电子数
结构解释
你能设计实验验证金属性:Na>Mg>Al 吗?实验设计的依据是什么呢?
金属单质与水(或酸)反应置换出氢的难易程度
判断元素金属性强弱的依据
寻找证据
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
寻找证据
判断元素金属性强弱的依据
金属元素最高价氧化物对应的水化物——氢氧化物的碱性强弱。
如何设计实验证明NaOH、Mg(OH)2和Al(OH) 3三者碱性的强弱呢?
比较Mg(OH)2和Al(OH)3的碱性强弱
说明Al(OH)3是两性氢氧化物,表明金属铝已表现出一定的非金属性。
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH-=[Al(OH)4]-
比较Mg(OH)2和Al(OH)3的碱性强弱
得出结论
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
你能依据第三周期元素金属性的研究方法继续研究第三周期元素非金属性的递变规律吗?
判断元素非金属性强弱的依据
元素
非金属性
非金属单质与氢气反应生成气态氢化物的难易程度及氢化物的稳定性。
非金属元素的最高价氧化物对应的水化物——最高价含氧酸的酸性强弱。
寻找证据
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4)
Cl 高氯酸(HClO4)
强酸
酸性比硫酸的强
寻找证据
寻找证据
与氢气化合的难易:磷 < 硫 < 氯气;稳定性: H2S<HCl
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
得出结论
非金属性:Si<P<S<Cl
得出结论
对其它周期主族元素进行同样的研究,一般情况下也会得出同样的规律。
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
本质:元素原子的核外电子排布呈周期性变化。
总结归纳
元素周期律
含义:元素的性质随着原子序数的递增而呈周期性的变化。
原子
结构
最外层
电子数
电子
层数
核电荷数
元素位置
元素性质
原子序数
周期
族
化合价
原子半径
金属性/非金属性
判断依据
得失电子难易程度
1.有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
ⅥA
ⅦA
ⅤA
D
A
同主族非金属元素最高价氧化物对应的水化物酸性
2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
3.下列关于主族元素的说法错误的是( )
A.同主族元素随着原子序数的递增,元素的金属性增强
B.同主族元素随着原子序数的递增,元素单质的熔、沸点逐渐升高
C.同主族元素原子最外层电子数都相同
D.同主族元素随着原子序数的递增,元素(O、F除外)最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强
B
4.氯气的氧化性比硫的氧化性强,能证明这一结论的事实是( )
A.通常情况下硫为浅黄色固体,而氯气为黄绿色气体
B.硫不溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2价,而氯被还原为-1 价
D.与同一种金属反应时,金属被硫氧化成低价态,但被氯气氧化成高价态
D
5.砹(At)原子序数为85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是( )
A.砹是有色固体
B.非金属性:At<I
C.HAt非常稳定
D.I2能从砹的可溶性盐溶液中置换出At2
C
6.下列关于卤素(用X表示)的叙述正确的是( )
A.其单质都能与水反应,通式为X2+H2O===HX+HXO
B.HX易溶于水,其水溶液都是强酸
C.其单质都有颜色,都有毒
D.最高价含氧酸的通式为HXO4
C
7.下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱
B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱
C.酸性H2CO3>H2SiO3,判断碳与硅的非金属活动性强弱
D.Br2与I2分别与足量的H2反应的难易,判断溴与碘的非金属活动性强弱
B
