2.1 课时2 一种重要的混合物——胶体 课件 (共21张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.1 课时2 一种重要的混合物——胶体 课件 (共21张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 29.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:14:53 | ||
图片预览







文档简介
(共21张PPT)
一种重要的混合物
——胶体
第2章 元素与物质世界
1.能从宏观和微观的角度认识分散系及其分类,熟知溶液、浊液、胶体三种分散系的本质区别。
2.知道胶体是一种重要的分散系,了解胶体的特点、性质及其应用,会分离提纯胶体,会鉴别胶体和溶液。
联想 · 质疑
联想 · 质疑
这类现象是如何产生的呢?
一、分散系
(2)组成
分散质
分散剂
(1)定义:由一种(或几种)物质(分散质)分散到另一种物质(分散剂)里形成的混合物。
CuSO4溶液
蒸馏水
+
CuSO4晶体
分散质
分散剂
分散系
分散系中被分散的物质
分散系中容纳分散质的物质
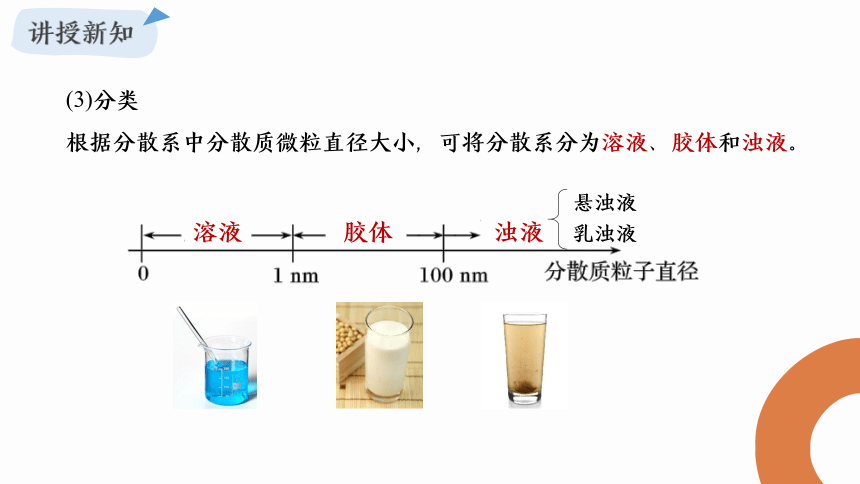
(3)分类
根据分散系中分散质微粒直径大小,可将分散系分为溶液、胶体和浊液。
溶液
胶体
浊液
悬浊液
乳浊液
二、胶体
(1)定义:分散质的微粒直径介于1~100 nm的分散系。
(2)分类:依据分散剂状态分为气溶胶、液溶胶、固溶胶。
比如云、雾、烟的分散剂是空气,分散质微粒是微小的液滴或固体颗粒,属于气溶胶。
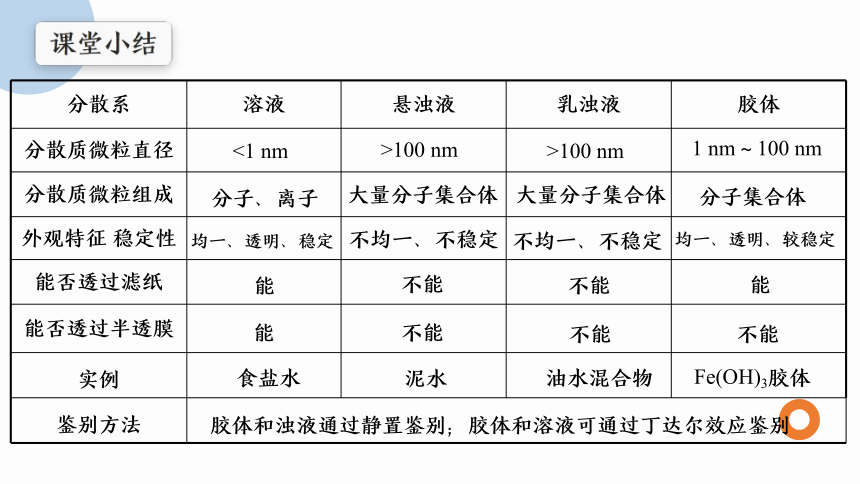
分散系 溶液 悬浊液 乳浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸
能否透过半透膜
实例
鉴别方法 <1 nm
>100 nm
>100 nm
1 nm~100 nm
分子、离子
大量分子集合体
大量分子集合体
分子集合体
均一、透明、稳定
不均一、不稳定
不均一、不稳定
均一、透明、较稳定
能
不能
不能
能
能
不能
不能
不能
食盐水
Fe(OH)3胶体
泥水
油水混合物
胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别
蛋白质分子与淀粉分子的大小都在几十纳米左右,则淀粉溶液、豆浆、牛奶都是胶体吗?
是,分散质粒子的直径介于1~100 nm时形成的分散系称为胶体。
思考与讨论
三.胶体的性质
(1)丁达尔现象或丁达尔效应
光散射
光束通过胶体时出现光亮的
“通路”的现象称为“丁达尔效应”
原因:胶粒直径大小与可见光的波长(400~700 nm)相近,胶粒对光有散射作用;而溶液分散质的粒子太小,散射及其微弱。
(2)渗析
①概念
胶体的分散质微粒不能透过半透膜,而小分子、离子能够透过半透膜,因此可以利用半透膜分离胶体中的杂质分子或离子。这种提纯、精制胶体的方法称为渗析。
②操作
如图除去Fe(OH)3胶体中的FeCl3,将混合物盛于半透膜制作的渗析袋中,置于流动(或频繁更换)的蒸馏水里一段时间即可。
如何证明Fe(OH)3胶体没有透过半透膜?
用可见光源照射烧杯中的液体,从侧面不能看到光亮的通路。
(3)电泳
①定义:在通电的情况下,胶体粒子发生定向移动的现象。
②原因:
③应用:
胶体的分散质具有巨大的比表面积,能吸附带有某种电荷的离子,从而形成带电微粒。
工业上用于电泳电镀、电泳除尘等。
通电前
通电后
﹣
﹢
氢氧化铁胶体的电泳现象
胶粒带正电的胶体:金属氧化物、金属氢氧化物
胶粒带负电的胶体:非金属氧化物、金属硫化物、硅酸胶体、土壤胶体
胶粒不带电的胶体:淀粉溶液、蛋白质溶液
特殊的AgI胶粒,随着AgNO3和KI相对量不同而带正电或者负电。若AgNO3过量,则AgI胶粒吸附Ag+带正电;若KI过量,则AgI胶粒吸附I-带负电。
胶体中胶粒带电性总结
胶粒
拓 展 · 视 野
电泳电镀就是利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上。
随着汽车工业的发展,先进的汽车涂装特别是轿车涂装技术和设备在我国得以快速应用。目前在我国安装的涂装设备的水平已经有了很大进步,今后随着水性漆及粉末涂料等环保涂料的使用,我国的涂装技术水平将整体达到世界先进水平。
电泳工艺分为阳极电泳和阴极电泳。若涂料粒子带负电,工件为阳极,涂料粒子在电场力作用下在工件沉积成膜称为阳极电泳;反之,若涂料粒子带正电,工件为阴极,涂料粒子在工件上沉积成膜称为阴极电泳。
阳极电泳的特点是:原料价格便宜(一般比阴极电泳便宜50%);设备较简单,投资少(一般比阴极电泳便宜30%);技术要求较低;涂层耐蚀性能较阴极电泳差(约为阴极电泳寿命之1/4)。
阴极电泳涂层耐蚀性高的原因是:工件是阴极,不发生阳极溶解,工件表面及磷化膜不破坏;电泳涂料(一般为含氮树脂)对金属有保护作用,且所用漆价高质优。
电 泳
(4)聚沉
①定义:在一定条件下胶体的分散质微粒聚集成较大的微粒,在重力作用下沉淀析出的现象。
氢氧化铁胶体的聚沉
加入Na2SO4溶液
②原因:
③应用:
加入酸、碱或盐等物质
加热
搅拌
豆腐的制作,黄河三角洲的形成等
中和胶体微粒的电荷,使之聚集沉淀
加速胶粒碰撞,减弱胶粒的吸附能力使之沉淀
性质 丁达尔效应
渗析
电泳
聚沉
主要应用
内 容
胶粒对可见光的散射而产生的,是一种物理现象
胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜
胶粒在外加电场作用下做定向移动
胶体粒子聚集成较大的颗粒形成沉淀
胶体的提纯、血液透析
鉴别胶体与溶液
静电除尘、电泳电镀等
明矾净水、制豆腐等
三、Fe(OH)3胶体的制备
如图所示,向沸水中逐滴加入1~2 mL饱和FeCl3溶液,继续煮沸至液体呈透明的红褐色,停止加热
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
注意:本实验用蒸馏水,不能用自来水,自来水含HCl能等使胶体聚沉;不能过度加热,也不能搅拌,以免Fe(OH)3胶体发生聚沉。
(1)如何检验制备的红褐色液体为Fe(OH)3胶体?
用一束可见光线照射,从侧面观察,若出现一道光亮的通路,则证明成功制得胶体。
(2)含1 mol Fe(OH)3胶粒的胶体中,Fe(OH)3分子个数为NA吗?
不是,Fe(OH)3胶粒为Fe(OH)3分子集合体,1 mol Fe(OH)3胶粒中Fe(OH)3分子个数大于NA。
思考与讨论
牛奶是常见的胶体,牛奶中的微粒可以与酸中的物质反应,也就是聚沉,使牛奶中的蛋白质沉淀而凝结成块,不利于消化吸收。
你能解释喝完牛奶不能吃酸性食物原因。
1. 溶液、浊液、胶体的本质区别是( )
A.透明程度 B.分散质颗粒大小
C.稳定性 D.丁达尔现象
2. 下列关于胶体的叙述正确的是( )
A.胶体和溶液的本质区别是胶体可以产生丁达尔现象
B.0.1 mol FeCl3溶于水中形成胶体后含有胶体粒子的数目为0.1NA
C.明矾净水与胶体的性质有关
D.可以用滤纸分离提纯胶体和溶液
B
C
3.下列说法不正确的是 ( )
A.分散质颗粒直径为纳米级(1-100nm)的分散系是胶体
B.胶体可通过过滤的方法从溶液中分离出来
C.氢氧化铁胶体可以稳定存在的原因是胶粒带正电荷
D.胶体粒子很小,可以透过滤纸
B
4. 不能用胶体的知识解释的现象是( )
A.豆浆中加入石膏做豆腐
B.一支钢笔使用不同牌号的墨水易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.在海水与河水交界处,易形成三角洲
C
一种重要的混合物
——胶体
第2章 元素与物质世界
1.能从宏观和微观的角度认识分散系及其分类,熟知溶液、浊液、胶体三种分散系的本质区别。
2.知道胶体是一种重要的分散系,了解胶体的特点、性质及其应用,会分离提纯胶体,会鉴别胶体和溶液。
联想 · 质疑
联想 · 质疑
这类现象是如何产生的呢?
一、分散系
(2)组成
分散质
分散剂
(1)定义:由一种(或几种)物质(分散质)分散到另一种物质(分散剂)里形成的混合物。
CuSO4溶液
蒸馏水
+
CuSO4晶体
分散质
分散剂
分散系
分散系中被分散的物质
分散系中容纳分散质的物质
(3)分类
根据分散系中分散质微粒直径大小,可将分散系分为溶液、胶体和浊液。
溶液
胶体
浊液
悬浊液
乳浊液
二、胶体
(1)定义:分散质的微粒直径介于1~100 nm的分散系。
(2)分类:依据分散剂状态分为气溶胶、液溶胶、固溶胶。
比如云、雾、烟的分散剂是空气,分散质微粒是微小的液滴或固体颗粒,属于气溶胶。
分散系 溶液 悬浊液 乳浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸
能否透过半透膜
实例
鉴别方法 <1 nm
>100 nm
>100 nm
1 nm~100 nm
分子、离子
大量分子集合体
大量分子集合体
分子集合体
均一、透明、稳定
不均一、不稳定
不均一、不稳定
均一、透明、较稳定
能
不能
不能
能
能
不能
不能
不能
食盐水
Fe(OH)3胶体
泥水
油水混合物
胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别
蛋白质分子与淀粉分子的大小都在几十纳米左右,则淀粉溶液、豆浆、牛奶都是胶体吗?
是,分散质粒子的直径介于1~100 nm时形成的分散系称为胶体。
思考与讨论
三.胶体的性质
(1)丁达尔现象或丁达尔效应
光散射
光束通过胶体时出现光亮的
“通路”的现象称为“丁达尔效应”
原因:胶粒直径大小与可见光的波长(400~700 nm)相近,胶粒对光有散射作用;而溶液分散质的粒子太小,散射及其微弱。
(2)渗析
①概念
胶体的分散质微粒不能透过半透膜,而小分子、离子能够透过半透膜,因此可以利用半透膜分离胶体中的杂质分子或离子。这种提纯、精制胶体的方法称为渗析。
②操作
如图除去Fe(OH)3胶体中的FeCl3,将混合物盛于半透膜制作的渗析袋中,置于流动(或频繁更换)的蒸馏水里一段时间即可。
如何证明Fe(OH)3胶体没有透过半透膜?
用可见光源照射烧杯中的液体,从侧面不能看到光亮的通路。
(3)电泳
①定义:在通电的情况下,胶体粒子发生定向移动的现象。
②原因:
③应用:
胶体的分散质具有巨大的比表面积,能吸附带有某种电荷的离子,从而形成带电微粒。
工业上用于电泳电镀、电泳除尘等。
通电前
通电后
﹣
﹢
氢氧化铁胶体的电泳现象
胶粒带正电的胶体:金属氧化物、金属氢氧化物
胶粒带负电的胶体:非金属氧化物、金属硫化物、硅酸胶体、土壤胶体
胶粒不带电的胶体:淀粉溶液、蛋白质溶液
特殊的AgI胶粒,随着AgNO3和KI相对量不同而带正电或者负电。若AgNO3过量,则AgI胶粒吸附Ag+带正电;若KI过量,则AgI胶粒吸附I-带负电。
胶体中胶粒带电性总结
胶粒
拓 展 · 视 野
电泳电镀就是利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上。
随着汽车工业的发展,先进的汽车涂装特别是轿车涂装技术和设备在我国得以快速应用。目前在我国安装的涂装设备的水平已经有了很大进步,今后随着水性漆及粉末涂料等环保涂料的使用,我国的涂装技术水平将整体达到世界先进水平。
电泳工艺分为阳极电泳和阴极电泳。若涂料粒子带负电,工件为阳极,涂料粒子在电场力作用下在工件沉积成膜称为阳极电泳;反之,若涂料粒子带正电,工件为阴极,涂料粒子在工件上沉积成膜称为阴极电泳。
阳极电泳的特点是:原料价格便宜(一般比阴极电泳便宜50%);设备较简单,投资少(一般比阴极电泳便宜30%);技术要求较低;涂层耐蚀性能较阴极电泳差(约为阴极电泳寿命之1/4)。
阴极电泳涂层耐蚀性高的原因是:工件是阴极,不发生阳极溶解,工件表面及磷化膜不破坏;电泳涂料(一般为含氮树脂)对金属有保护作用,且所用漆价高质优。
电 泳
(4)聚沉
①定义:在一定条件下胶体的分散质微粒聚集成较大的微粒,在重力作用下沉淀析出的现象。
氢氧化铁胶体的聚沉
加入Na2SO4溶液
②原因:
③应用:
加入酸、碱或盐等物质
加热
搅拌
豆腐的制作,黄河三角洲的形成等
中和胶体微粒的电荷,使之聚集沉淀
加速胶粒碰撞,减弱胶粒的吸附能力使之沉淀
性质 丁达尔效应
渗析
电泳
聚沉
主要应用
内 容
胶粒对可见光的散射而产生的,是一种物理现象
胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜
胶粒在外加电场作用下做定向移动
胶体粒子聚集成较大的颗粒形成沉淀
胶体的提纯、血液透析
鉴别胶体与溶液
静电除尘、电泳电镀等
明矾净水、制豆腐等
三、Fe(OH)3胶体的制备
如图所示,向沸水中逐滴加入1~2 mL饱和FeCl3溶液,继续煮沸至液体呈透明的红褐色,停止加热
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
注意:本实验用蒸馏水,不能用自来水,自来水含HCl能等使胶体聚沉;不能过度加热,也不能搅拌,以免Fe(OH)3胶体发生聚沉。
(1)如何检验制备的红褐色液体为Fe(OH)3胶体?
用一束可见光线照射,从侧面观察,若出现一道光亮的通路,则证明成功制得胶体。
(2)含1 mol Fe(OH)3胶粒的胶体中,Fe(OH)3分子个数为NA吗?
不是,Fe(OH)3胶粒为Fe(OH)3分子集合体,1 mol Fe(OH)3胶粒中Fe(OH)3分子个数大于NA。
思考与讨论
牛奶是常见的胶体,牛奶中的微粒可以与酸中的物质反应,也就是聚沉,使牛奶中的蛋白质沉淀而凝结成块,不利于消化吸收。
你能解释喝完牛奶不能吃酸性食物原因。
1. 溶液、浊液、胶体的本质区别是( )
A.透明程度 B.分散质颗粒大小
C.稳定性 D.丁达尔现象
2. 下列关于胶体的叙述正确的是( )
A.胶体和溶液的本质区别是胶体可以产生丁达尔现象
B.0.1 mol FeCl3溶于水中形成胶体后含有胶体粒子的数目为0.1NA
C.明矾净水与胶体的性质有关
D.可以用滤纸分离提纯胶体和溶液
B
C
3.下列说法不正确的是 ( )
A.分散质颗粒直径为纳米级(1-100nm)的分散系是胶体
B.胶体可通过过滤的方法从溶液中分离出来
C.氢氧化铁胶体可以稳定存在的原因是胶粒带正电荷
D.胶体粒子很小,可以透过滤纸
B
4. 不能用胶体的知识解释的现象是( )
A.豆浆中加入石膏做豆腐
B.一支钢笔使用不同牌号的墨水易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.在海水与河水交界处,易形成三角洲
C
