2.1 课时1 元素与物质的关系 物质分类 课件(共30张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.1 课时1 元素与物质的关系 物质分类 课件(共30张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 34.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:17:30 | ||
图片预览










文档简介
(共30张PPT)
元素与物质的关系
物质分类
第2章 元素与物质世界
4.感受分类法在科研和学习中的重要作用。
1.知道元素是物质的组成成分,元素以游离态和化合态两种形态存在
2.通过设计实验及实验验证理解物质类别与物质性质之间的关系并能预测陌生物质的性质
3.了解单质、氧化物、酸、碱、盐之间的相互转化关系
联想 · 质疑
联想 · 质疑
面对丰富多彩的物质世界,你是否想过,这些物质之间有什么内在联系?我们可以采用分类认识和研究物质。那么,怎样分类才能更有效地帮助我们认识和研究物质呢?
交流 · 研讨
交流 · 研讨
钠、镁、铁、氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯气、氢气、氧气、氯化亚铁、三氧化二铁、碳酸钠、碳单质、硫酸、氯化铁
请从元素组成的角度对这些物质进行分类。
物质
元素
组成
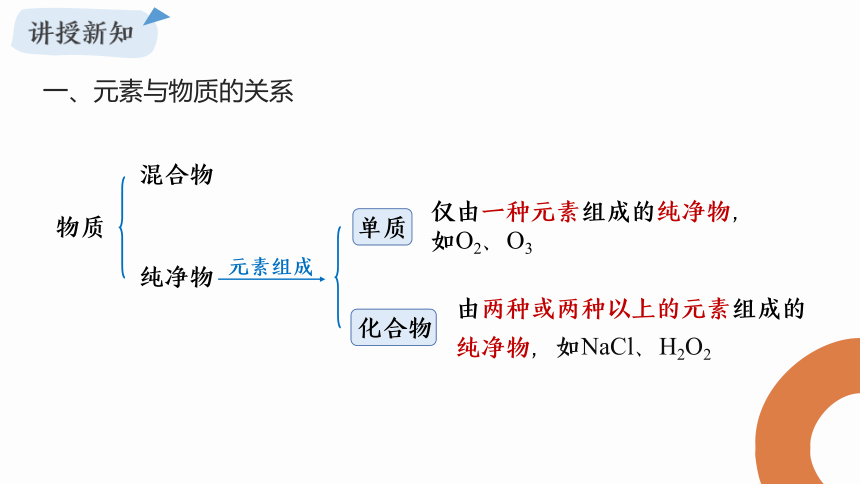
一、元素与物质的关系
仅由一种元素组成的纯净物,如O2、O3
由两种或两种以上的元素组成的纯净物,如NaCl、H2O2
物质
混合物
纯净物
单质
化合物
元素组成
物质
混合物
纯净物
单质
化合物
元素组成
一、元素与物质的关系
氧化物
酸
碱
盐
非金属单质
金属单质
钠、镁、铁、氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯气、氢气、氧气、氯化亚铁、三氧化二铁、碳酸钠、碳单质、硫酸、氯化铁
交流 · 研讨
交流 · 研讨
有些元素在不同化合物中可能呈现不同的化合价。
铁
三氧化二铁
氯化亚铁
钠
氯化钠 碳酸钠
氢氧化钠
碳单质
一氧化碳
碳酸钠
从上述物质中找出含有相同元素的物质,观察含有同一种元素的不同物质,你有什么发现?
二氧化碳
氯化铁
交流 · 研讨
交流 · 研讨
碳及其化合物的“价—类”二维图可以清楚地看出碳及其化合物的所属类别和其中所含碳元素的化合价,请用化学式补充完整。。
CH4
CO2
CO
H2CO3
1.下列元素在自然界中仅以化合态存在的是( )
①Na ②Cl ③H ④O ⑤N ⑥C
2.某学生发现实验室中的一瓶无色气体,他想知道是何种气体。经实验测定此瓶气体中只含有C、O两种元素。通常情况下这瓶气体不可能是( )
C.①②③ D.①②③④⑤
A.一种化合物 B.单质和化合物的混合物
C.两种化合物 D.两种单质
D
C
A.①②⑤ B.①②
二、物质分类与物质性质
1.物质的分类
酸性氧化物:
与碱反应只生成盐和水的氧化物。
多数酸性氧化物能溶于水,与水化合生成酸。
CO2+Ca(OH)2 === CaCO3↓+H2O
碱性氧化物:
与酸反应只生成盐和水的氧化物。
部分碱性氧化物能溶于水,与水化合生成碱。
Na2O+2HCl === 2NaCl+H2O
(1)物质的性质也是对物质进行分类常用的依据。根据以下反应及物质的性质,对所涉及的氧化物进行分类。
①CO2+2NaOH===Na2CO3+H2O,②CaO+2HCl===CaCl2+H2O,
③Mn2O7+2KOH===2KMnO4+H2O,
④CO、NO既不能与酸反应,也不能与碱反应。
将上述反应中的氧化物填入下列空格:酸性氧化物: ;碱性氧化物: ;金属氧化物: ;非金属氧化物:______
______________。
CO2、Mn2O7
CaO
CaO、Mn2O7
CO2、
CO、NO、H2O
拓展:CO、NO属于不成盐氧化物。
(2)正误判断
①Na2CO3含有氧元素,所以属于氧化物
②Na2O、MgO、CO均属于碱性氧化物
③SO2、CO2、BaO、SO3均属于酸性氧化物
④酸性氧化物都是非金属氧化物,碱性氧化物都是金属氧化物
⑤不能与酸反应的氧化物一定能与碱反应
(2)根据物质的组成和性质对物质进行分类
物质
纯净物
单质
化合物
氧化物
混合物
酸
碱
盐
溶液(如NaCl溶液等)
胶体[如Fe(OH)3胶体等](下一课时学习)
浊液
悬浊液(如泥水混合物等)
乳浊液(如油水混合物等)
金属单质(如Fe等)
非金属单质(如C等)
酸
按是否含氧
含氧酸(如HClO4等)
无氧酸(如HCl、H2S等)
按解离出
的H+数
一元酸(如HCl等)
二元酸(如H2SO4等)
多元酸(如H3PO4等)
按挥发性
难挥发性酸(如H3PO4、H2SO4等)
挥发性酸(如浓盐酸、浓硝酸等)
按溶解性
可溶性酸(如HNO3、H2SO4等)难溶性酸(如H2SiO3等)
碱
按溶解性
可溶性碱(如NaOH、NH3·H2O等)
难溶性碱[如Mg(OH)2、Fe(OH)3等]
按解离出
的OH-数
一元碱(如NaOH等)
二元碱[如Ba(OH)2等]
多元碱[如Fe(OH)3等]
盐
按组成
正盐(如K2SO4、CaCO3等)
酸式盐(如KHSO4、NaHCO3等)
碱式盐[如Cu2(OH)2CO3等]
按酸根
含氧酸盐(如Na2SO4、AgNO3等)
无氧酸盐(NaCl、MgCl2等)
按溶解性
可溶性盐(如KNO3、NH4Cl等)微溶性盐(如CaSO4等)
难溶性盐(如CaCO3、BaSO4等)
(3)其他分类方法
根据在水溶液中或熔融状态下能否导电
化合物
电解质
非电解质
根据在反应中所含元素化合价的改变情况
物质
氧化剂
还原剂
根据被分散物质的颗粒大小
分散系
溶液
浊液
胶体
物质分类是怎样帮助我们认识和研究物质的呢?
分组讨论交流(Fe、C)、(HCl、NaOH)、(Na2CO3、CuSO4)、(CO2、Fe2O3)等初中所学物质的化学性质(括号内为一组),通过书写化学方程式表示,并说明其中涉及的反应类型。
Fe
与O2反应:3Fe+2O2===Fe3O4
点燃
与盐反应:Fe+CuSO4==Cu+FeSO4
与酸反应:Fe+2HCl==FeCl2+H2↑
分组讨论交流(Fe、C)、(HCl、NaOH)、(Na2CO3、CuSO4)、(CO2、Fe2O3)等初中所学物质的化学性质(括号内为一组),通过书写化学方程式表示,并说明其中涉及的反应类型。
金属+氧气→金属氧化物
金属+酸→盐+氢气
金属+盐→新盐+新金属
金属通性
预测其他金属性质(如Na)
HCl
与金属反应:2HCl+Fe=FeCl2+H2↑
与碱反应:HCl+NaOH=NaCl+H2O
与盐反应:2HCl+CaCO3=CaCl2+H2O+CO2↑
与碱性氧化物反应:6HCl+Fe2O3=2FeCl3+3H2O
与O2反应:C+O2(充足)===CO2
点燃
非金属+氧气→非金属氧化物
酸+金属→盐+氢气
酸+碱→盐+水
酸+盐→新盐+新酸
酸+碱性氧化物→盐+水
预测其他酸的性质
预测其他非金属性质
酸的通性
NaOH
与酸反应:NaOH+HCl==NaCl+H2O
与酸性氧化物反应:2NaOH+CO2==Na2CO3+H2O
与盐反应:2NaOH+MgCl2=2NaCl+Mg(OH)2↓
碱的通性
碱+酸→盐+水
碱+盐→新盐+新碱
碱+酸性氧化物→盐+水
预测其他碱的性质
Na2CO3
CuSO4
与酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑
与金属反应:Fe+CuSO4==FeSO4+Cu
与碱反应:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH
与其他盐反应:Na2CO3+CaCl2==2CaCO3↓ +2NaCl
盐的通性
盐+碱→新盐+新碱
盐+酸→新盐+新酸
盐+金属→新盐+新金属
盐+盐→新盐+新盐
预测其他盐的性质
CO2
Fe2O3
CaO
与碱反应:CO2+2NaOH==Na2CO3+H2O
与水反应:CO2+H2O==H2CO3
与酸反应:Fe2O3+6HCl==2FeCl3+3H2O
与水反应:CaO+H2O==Ca(OH)2
酸碱氧化物间的反应:CaO+CO2==CaCO3
酸性氧化物
碱性氧化物
酸性氧化物+碱→盐+水
酸性氧化物+水→酸
碱性氧化物+酸→盐+水
碱性氧化物+水→碱
酸性氧化物+碱性氧化物→盐
预测其他酸性氧化物的性质
预测其他碱性氧化物的性质
根据物质类别预测陌生物质的性质
判断陌生物质所属物质类别
根据该类别物质的一般性质及反应规律预测该物质的性质
选择可能与该物质发生反应的类别代表物
实验验证
获得结论
同类物质往往具有相似的性质,SO2和CO2同为酸性氧化物,试根据酸性氧化物具有的通性(或CO2的性质),回答下列问题:
(1)请写出SO2与生石灰反应的化学方程式: 。
(2)SO2的实验室制法与CO2的实验室制法具有许多相似之处,请写出H2SO4和Na2SO3反应制取SO2的化学方程式:________________________
_____________。
SO2+CaO===CaSO3
H2SO4+Na2SO3===Na2SO4
+SO2↑+H2O
元素与物质的关系
物质分类
第2章 元素与物质世界
4.感受分类法在科研和学习中的重要作用。
1.知道元素是物质的组成成分,元素以游离态和化合态两种形态存在
2.通过设计实验及实验验证理解物质类别与物质性质之间的关系并能预测陌生物质的性质
3.了解单质、氧化物、酸、碱、盐之间的相互转化关系
联想 · 质疑
联想 · 质疑
面对丰富多彩的物质世界,你是否想过,这些物质之间有什么内在联系?我们可以采用分类认识和研究物质。那么,怎样分类才能更有效地帮助我们认识和研究物质呢?
交流 · 研讨
交流 · 研讨
钠、镁、铁、氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯气、氢气、氧气、氯化亚铁、三氧化二铁、碳酸钠、碳单质、硫酸、氯化铁
请从元素组成的角度对这些物质进行分类。
物质
元素
组成
一、元素与物质的关系
仅由一种元素组成的纯净物,如O2、O3
由两种或两种以上的元素组成的纯净物,如NaCl、H2O2
物质
混合物
纯净物
单质
化合物
元素组成
物质
混合物
纯净物
单质
化合物
元素组成
一、元素与物质的关系
氧化物
酸
碱
盐
非金属单质
金属单质
钠、镁、铁、氧化镁、氯化钠、氢氧化钠、一氧化碳、二氧化碳、氯气、氢气、氧气、氯化亚铁、三氧化二铁、碳酸钠、碳单质、硫酸、氯化铁
交流 · 研讨
交流 · 研讨
有些元素在不同化合物中可能呈现不同的化合价。
铁
三氧化二铁
氯化亚铁
钠
氯化钠 碳酸钠
氢氧化钠
碳单质
一氧化碳
碳酸钠
从上述物质中找出含有相同元素的物质,观察含有同一种元素的不同物质,你有什么发现?
二氧化碳
氯化铁
交流 · 研讨
交流 · 研讨
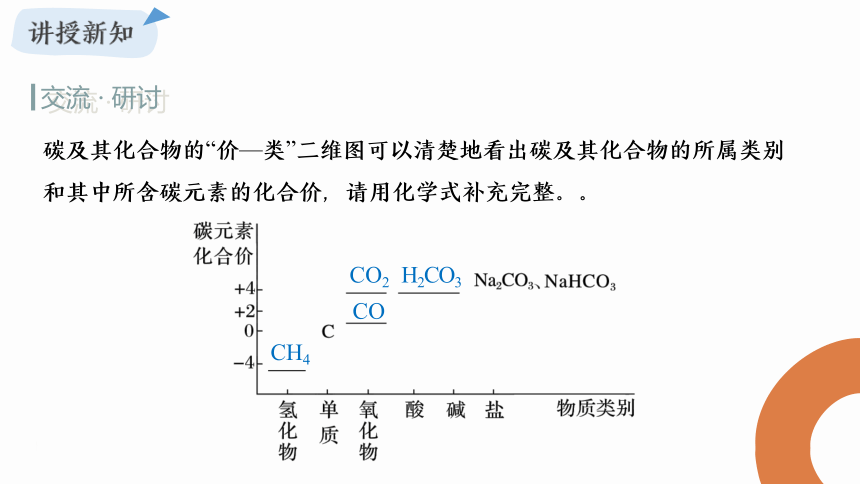
碳及其化合物的“价—类”二维图可以清楚地看出碳及其化合物的所属类别和其中所含碳元素的化合价,请用化学式补充完整。。
CH4
CO2
CO
H2CO3
1.下列元素在自然界中仅以化合态存在的是( )
①Na ②Cl ③H ④O ⑤N ⑥C
2.某学生发现实验室中的一瓶无色气体,他想知道是何种气体。经实验测定此瓶气体中只含有C、O两种元素。通常情况下这瓶气体不可能是( )
C.①②③ D.①②③④⑤
A.一种化合物 B.单质和化合物的混合物
C.两种化合物 D.两种单质
D
C
A.①②⑤ B.①②
二、物质分类与物质性质
1.物质的分类
酸性氧化物:
与碱反应只生成盐和水的氧化物。
多数酸性氧化物能溶于水,与水化合生成酸。
CO2+Ca(OH)2 === CaCO3↓+H2O
碱性氧化物:
与酸反应只生成盐和水的氧化物。
部分碱性氧化物能溶于水,与水化合生成碱。
Na2O+2HCl === 2NaCl+H2O
(1)物质的性质也是对物质进行分类常用的依据。根据以下反应及物质的性质,对所涉及的氧化物进行分类。
①CO2+2NaOH===Na2CO3+H2O,②CaO+2HCl===CaCl2+H2O,
③Mn2O7+2KOH===2KMnO4+H2O,
④CO、NO既不能与酸反应,也不能与碱反应。
将上述反应中的氧化物填入下列空格:酸性氧化物: ;碱性氧化物: ;金属氧化物: ;非金属氧化物:______
______________。
CO2、Mn2O7
CaO
CaO、Mn2O7
CO2、
CO、NO、H2O
拓展:CO、NO属于不成盐氧化物。
(2)正误判断
①Na2CO3含有氧元素,所以属于氧化物
②Na2O、MgO、CO均属于碱性氧化物
③SO2、CO2、BaO、SO3均属于酸性氧化物
④酸性氧化物都是非金属氧化物,碱性氧化物都是金属氧化物
⑤不能与酸反应的氧化物一定能与碱反应
(2)根据物质的组成和性质对物质进行分类
物质
纯净物
单质
化合物
氧化物
混合物
酸
碱
盐
溶液(如NaCl溶液等)
胶体[如Fe(OH)3胶体等](下一课时学习)
浊液
悬浊液(如泥水混合物等)
乳浊液(如油水混合物等)
金属单质(如Fe等)
非金属单质(如C等)
酸
按是否含氧
含氧酸(如HClO4等)
无氧酸(如HCl、H2S等)
按解离出
的H+数
一元酸(如HCl等)
二元酸(如H2SO4等)
多元酸(如H3PO4等)
按挥发性
难挥发性酸(如H3PO4、H2SO4等)
挥发性酸(如浓盐酸、浓硝酸等)
按溶解性
可溶性酸(如HNO3、H2SO4等)难溶性酸(如H2SiO3等)
碱
按溶解性
可溶性碱(如NaOH、NH3·H2O等)
难溶性碱[如Mg(OH)2、Fe(OH)3等]
按解离出
的OH-数
一元碱(如NaOH等)
二元碱[如Ba(OH)2等]
多元碱[如Fe(OH)3等]
盐
按组成
正盐(如K2SO4、CaCO3等)
酸式盐(如KHSO4、NaHCO3等)
碱式盐[如Cu2(OH)2CO3等]
按酸根
含氧酸盐(如Na2SO4、AgNO3等)
无氧酸盐(NaCl、MgCl2等)
按溶解性
可溶性盐(如KNO3、NH4Cl等)微溶性盐(如CaSO4等)
难溶性盐(如CaCO3、BaSO4等)
(3)其他分类方法
根据在水溶液中或熔融状态下能否导电
化合物
电解质
非电解质
根据在反应中所含元素化合价的改变情况
物质
氧化剂
还原剂
根据被分散物质的颗粒大小
分散系
溶液
浊液
胶体
物质分类是怎样帮助我们认识和研究物质的呢?
分组讨论交流(Fe、C)、(HCl、NaOH)、(Na2CO3、CuSO4)、(CO2、Fe2O3)等初中所学物质的化学性质(括号内为一组),通过书写化学方程式表示,并说明其中涉及的反应类型。
Fe
与O2反应:3Fe+2O2===Fe3O4
点燃
与盐反应:Fe+CuSO4==Cu+FeSO4
与酸反应:Fe+2HCl==FeCl2+H2↑
分组讨论交流(Fe、C)、(HCl、NaOH)、(Na2CO3、CuSO4)、(CO2、Fe2O3)等初中所学物质的化学性质(括号内为一组),通过书写化学方程式表示,并说明其中涉及的反应类型。
金属+氧气→金属氧化物
金属+酸→盐+氢气
金属+盐→新盐+新金属
金属通性
预测其他金属性质(如Na)
HCl
与金属反应:2HCl+Fe=FeCl2+H2↑
与碱反应:HCl+NaOH=NaCl+H2O
与盐反应:2HCl+CaCO3=CaCl2+H2O+CO2↑
与碱性氧化物反应:6HCl+Fe2O3=2FeCl3+3H2O
与O2反应:C+O2(充足)===CO2
点燃
非金属+氧气→非金属氧化物
酸+金属→盐+氢气
酸+碱→盐+水
酸+盐→新盐+新酸
酸+碱性氧化物→盐+水
预测其他酸的性质
预测其他非金属性质
酸的通性
NaOH
与酸反应:NaOH+HCl==NaCl+H2O
与酸性氧化物反应:2NaOH+CO2==Na2CO3+H2O
与盐反应:2NaOH+MgCl2=2NaCl+Mg(OH)2↓
碱的通性
碱+酸→盐+水
碱+盐→新盐+新碱
碱+酸性氧化物→盐+水
预测其他碱的性质
Na2CO3
CuSO4
与酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑
与金属反应:Fe+CuSO4==FeSO4+Cu
与碱反应:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH
与其他盐反应:Na2CO3+CaCl2==2CaCO3↓ +2NaCl
盐的通性
盐+碱→新盐+新碱
盐+酸→新盐+新酸
盐+金属→新盐+新金属
盐+盐→新盐+新盐
预测其他盐的性质
CO2
Fe2O3
CaO
与碱反应:CO2+2NaOH==Na2CO3+H2O
与水反应:CO2+H2O==H2CO3
与酸反应:Fe2O3+6HCl==2FeCl3+3H2O
与水反应:CaO+H2O==Ca(OH)2
酸碱氧化物间的反应:CaO+CO2==CaCO3
酸性氧化物
碱性氧化物
酸性氧化物+碱→盐+水
酸性氧化物+水→酸
碱性氧化物+酸→盐+水
碱性氧化物+水→碱
酸性氧化物+碱性氧化物→盐
预测其他酸性氧化物的性质
预测其他碱性氧化物的性质
根据物质类别预测陌生物质的性质
判断陌生物质所属物质类别
根据该类别物质的一般性质及反应规律预测该物质的性质
选择可能与该物质发生反应的类别代表物
实验验证
获得结论
同类物质往往具有相似的性质,SO2和CO2同为酸性氧化物,试根据酸性氧化物具有的通性(或CO2的性质),回答下列问题:
(1)请写出SO2与生石灰反应的化学方程式: 。
(2)SO2的实验室制法与CO2的实验室制法具有许多相似之处,请写出H2SO4和Na2SO3反应制取SO2的化学方程式:________________________
_____________。
SO2+CaO===CaSO3
H2SO4+Na2SO3===Na2SO4
+SO2↑+H2O
