2.2 课时3 离子反应的应用 课件 (共22张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2 课时3 离子反应的应用 课件 (共22张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 26.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:18:51 | ||
图片预览








文档简介
(共22张PPT)
离子反应的应用
第2章 元素与物质世界
1.掌握常见离子的检验方法。
2.掌握粗盐的提纯方法,学会利用离子反应进行物质的除杂与提纯。
离子反应广泛应用于化学研究、工业生产、医疗诊断、食品检验、环境保护等方面。
利用离子反应可以检验某种(或某些)离子是否存在。
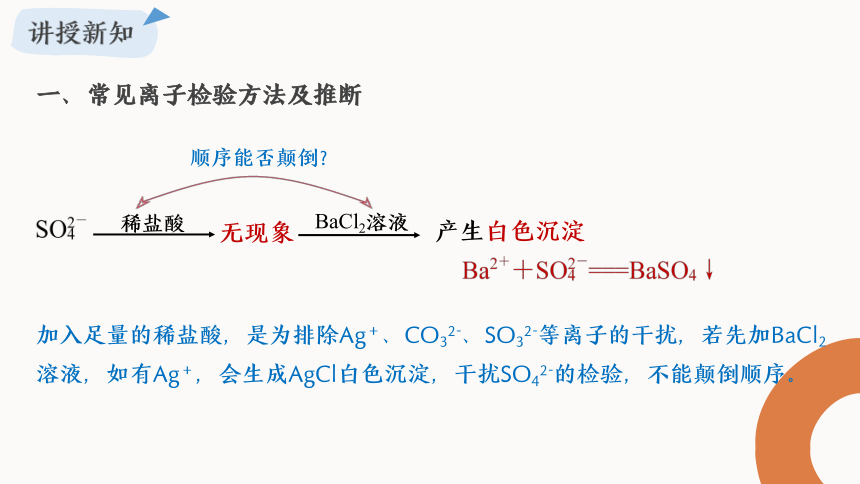
一、常见离子检验方法
Cl-
AgNO3溶液
稀硝酸
沉淀不溶解
Cl-+Ag+===AgCl↓
加入稀HNO3的目的是什么?
产生白色沉淀
排除CO32-等离子的干扰
产生白色沉淀
稀盐酸
无现象
BaCl2溶液
顺序能否颠倒?
一、常见离子检验方法及推断
加入足量的稀盐酸,是为排除Ag+、CO32-、SO32-等离子的干扰,若先加BaCl2溶液,如有Ag+,会生成AgCl白色沉淀,干扰SO42-的检验,不能颠倒顺序。
CaCl2溶液
产生白色沉淀
稀盐酸
沉淀溶解,产生无色无味气体,气体能使澄清石灰水变浑浊
CaCO3+2H+===Ca2++CO2↑+H2O
一、常见离子检验方法及推断
一、常见离子检验方法及推断
根据离子反应所表现出的某“唯一性”的特征性质及现象可以用于该离子的检验。
离子 试剂 现象
Cl- AgNO3溶液+稀HNO3 产生白色沉淀(AgCl)
SO42- 稀盐酸+BaCl2溶液 产生白色沉淀
Fe3+ NaOH溶液 产生红褐色沉淀
NH4+ 浓NaOH溶液+ 湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝(NH3)
CO32- 稀盐酸+石灰水 石灰水变浑浊
注意:排除其他离子干扰。
离子检验的答题模板
(1)取样:(若为固体样品)取某固体样品少许,溶于水配成溶液,取溶液少许于试管中。(若为液体样品)取某样品溶液少许于试管中。
(2)操作:加入××溶液(或物质)。
(3)现象:看到有××色气体生成(或××色沉淀产生)等。
(4)结论:证明有(或无)××离子存在。
1.判断正误
(1)检测溶液中的Cl-时,可先加盐酸,再加AgNO3溶液
(3)溶液中加入Na2CO3溶液产生白色沉淀,再加稀盐酸,沉淀消失,一定存在Ba2+
(4)向溶液中加入酚酞溶液,若溶液变红色,则溶液中含有OH-
(2)某溶液加入BaCl2溶液产生白色沉淀,说明溶液中一定含有SO42-
回答下列问题:
(1)试分析原溶液中一定含有的离子是 , 一定不含有的离子是 ;可能含有的离子是 。
(2)实验③说明原溶液中含有 。
Mg2+、Cl-
Na+
Cl-
2.有一瓶溶液只含Cl-、、、Na+、Mg2+、Cu2+六种离子中的某几种。通过实验:①原溶液中加足量NaOH溶液只产生白色沉淀;②原溶液中加BaCl2溶液不产生沉淀;③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
二、离子的推断方法
离子推断要坚持“四项基本原则”。
肯定性原则
互斥性原则
进出性原则
守恒性原则
据现象推断肯定存在或肯定不存在的离子
如溶液中含有Ba2+,则不存在大量的、
要注意所加试剂引入什么离子,是否造成干扰
阳离子和阴离 子同时存在溶液中且正、负
电荷总量相等
三、物质的除杂与分离——食盐的精制
【目的】
从粗食盐水中除去Ca2+、Mg2+、SO42-
活动 · 探究
活动 · 探究
Na2CO3
溶液
NaOH
溶液
BaCl2
溶液
实验操作流程
粗食盐水
除去Mg2+
除去
除去Ca2+、过量的Ba2+
过量的BaCl2溶液
过量的NaOH溶液
过滤
适量的稀盐酸
除去过量的OH-、
除去BaSO4、Mg(OH)2、CaCO3沉淀
过量的Na2CO3溶液
Mg2++2OH-===Mg(OH)2↓
沿玻璃棒向漏斗中加蒸馏水至刚好没过沉淀,待水自然流出后,再重复操作2~3次;取最后一次洗涤液少许于试管中,加入AgNO3溶液,若不产生白色沉淀,则沉淀已洗涤干净。
按实验操作流程图,如何洗涤得到的BaSO4沉淀?如何检验BaSO4沉淀是否洗涤干净?
沉淀洗涤(或洗净)的答题模板
(1)沉淀洗涤的答题模板
注洗涤液
标准
重复
沿玻璃棒向漏斗中注入洗涤液
使洗涤液完全浸没沉淀或晶体
待洗涤液流尽后,重复操作2~3次
沉淀洗涤(或洗净)的答题模板
(2)沉淀是否洗净的答题模板
取样
加试剂
现象
结论
取少量最后一次洗涤液于试管中
加入××试剂(必要时加热,如检验
不产生××沉淀、溶液不变××色或不产生××气体
说明沉淀已经洗涤干净
物质的分离和提纯的“三必须”和“四原则”
(1)三必须
①除杂试剂必须稍过量。
②过量试剂必须除尽,且容易除去。
③除杂途径选最佳,有多种杂质时除杂顺序必须合理。
(2)四原则
不增、不减、易分离、易复原
1.某同学设计了如下实验方案,以除去NaCl固体中的Na2SO4杂质。
可供选择的试剂:Ba(NO3)2溶液、Na2CO3溶液、BaCl2溶液、盐酸。
回答下列问题:
(1)操作①和②均需要使用玻璃棒,其作用分别为 。
搅拌、引流
(2)试剂a是 ,沉淀B是______。
BaCl2溶液
BaCO3
(3)加入试剂a发生反应的化学方程式为 ,加入试剂c发生反应的离子方程式为 。
Na2SO4+BaCl2===BaSO4↓+2NaCl
(4)若要测定原混合物中Na2SO4的质量分数,除了要准确称量混合物的质量,至少还需获得的数据是 。
沉淀A的质量
2.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是
A.①④②⑤③ B.④①②⑤③ C.⑤④①②③ D.⑤②④①③
D
粗食盐水
除去
除去Mg2+
除去Ca2+、过量的Ba2+
过量的BaCl2溶液
过量的NaOH溶液
过滤
适量的稀盐酸
除去过量的OH-、
除去BaSO4、Mg(OH)2、CaCO3沉淀
过量的Na2CO3溶液
根据电解质电离和离子反应的知识,归纳总结分析溶液体系的基本思路
离子反应的应用
第2章 元素与物质世界
1.掌握常见离子的检验方法。
2.掌握粗盐的提纯方法,学会利用离子反应进行物质的除杂与提纯。
离子反应广泛应用于化学研究、工业生产、医疗诊断、食品检验、环境保护等方面。
利用离子反应可以检验某种(或某些)离子是否存在。
一、常见离子检验方法
Cl-
AgNO3溶液
稀硝酸
沉淀不溶解
Cl-+Ag+===AgCl↓
加入稀HNO3的目的是什么?
产生白色沉淀
排除CO32-等离子的干扰
产生白色沉淀
稀盐酸
无现象
BaCl2溶液
顺序能否颠倒?
一、常见离子检验方法及推断
加入足量的稀盐酸,是为排除Ag+、CO32-、SO32-等离子的干扰,若先加BaCl2溶液,如有Ag+,会生成AgCl白色沉淀,干扰SO42-的检验,不能颠倒顺序。
CaCl2溶液
产生白色沉淀
稀盐酸
沉淀溶解,产生无色无味气体,气体能使澄清石灰水变浑浊
CaCO3+2H+===Ca2++CO2↑+H2O
一、常见离子检验方法及推断
一、常见离子检验方法及推断
根据离子反应所表现出的某“唯一性”的特征性质及现象可以用于该离子的检验。
离子 试剂 现象
Cl- AgNO3溶液+稀HNO3 产生白色沉淀(AgCl)
SO42- 稀盐酸+BaCl2溶液 产生白色沉淀
Fe3+ NaOH溶液 产生红褐色沉淀
NH4+ 浓NaOH溶液+ 湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝(NH3)
CO32- 稀盐酸+石灰水 石灰水变浑浊
注意:排除其他离子干扰。
离子检验的答题模板
(1)取样:(若为固体样品)取某固体样品少许,溶于水配成溶液,取溶液少许于试管中。(若为液体样品)取某样品溶液少许于试管中。
(2)操作:加入××溶液(或物质)。
(3)现象:看到有××色气体生成(或××色沉淀产生)等。
(4)结论:证明有(或无)××离子存在。
1.判断正误
(1)检测溶液中的Cl-时,可先加盐酸,再加AgNO3溶液
(3)溶液中加入Na2CO3溶液产生白色沉淀,再加稀盐酸,沉淀消失,一定存在Ba2+
(4)向溶液中加入酚酞溶液,若溶液变红色,则溶液中含有OH-
(2)某溶液加入BaCl2溶液产生白色沉淀,说明溶液中一定含有SO42-
回答下列问题:
(1)试分析原溶液中一定含有的离子是 , 一定不含有的离子是 ;可能含有的离子是 。
(2)实验③说明原溶液中含有 。
Mg2+、Cl-
Na+
Cl-
2.有一瓶溶液只含Cl-、、、Na+、Mg2+、Cu2+六种离子中的某几种。通过实验:①原溶液中加足量NaOH溶液只产生白色沉淀;②原溶液中加BaCl2溶液不产生沉淀;③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
二、离子的推断方法
离子推断要坚持“四项基本原则”。
肯定性原则
互斥性原则
进出性原则
守恒性原则
据现象推断肯定存在或肯定不存在的离子
如溶液中含有Ba2+,则不存在大量的、
要注意所加试剂引入什么离子,是否造成干扰
阳离子和阴离 子同时存在溶液中且正、负
电荷总量相等
三、物质的除杂与分离——食盐的精制
【目的】
从粗食盐水中除去Ca2+、Mg2+、SO42-
活动 · 探究
活动 · 探究
Na2CO3
溶液
NaOH
溶液
BaCl2
溶液
实验操作流程
粗食盐水
除去Mg2+
除去
除去Ca2+、过量的Ba2+
过量的BaCl2溶液
过量的NaOH溶液
过滤
适量的稀盐酸
除去过量的OH-、
除去BaSO4、Mg(OH)2、CaCO3沉淀
过量的Na2CO3溶液
Mg2++2OH-===Mg(OH)2↓
沿玻璃棒向漏斗中加蒸馏水至刚好没过沉淀,待水自然流出后,再重复操作2~3次;取最后一次洗涤液少许于试管中,加入AgNO3溶液,若不产生白色沉淀,则沉淀已洗涤干净。
按实验操作流程图,如何洗涤得到的BaSO4沉淀?如何检验BaSO4沉淀是否洗涤干净?
沉淀洗涤(或洗净)的答题模板
(1)沉淀洗涤的答题模板
注洗涤液
标准
重复
沿玻璃棒向漏斗中注入洗涤液
使洗涤液完全浸没沉淀或晶体
待洗涤液流尽后,重复操作2~3次
沉淀洗涤(或洗净)的答题模板
(2)沉淀是否洗净的答题模板
取样
加试剂
现象
结论
取少量最后一次洗涤液于试管中
加入××试剂(必要时加热,如检验
不产生××沉淀、溶液不变××色或不产生××气体
说明沉淀已经洗涤干净
物质的分离和提纯的“三必须”和“四原则”
(1)三必须
①除杂试剂必须稍过量。
②过量试剂必须除尽,且容易除去。
③除杂途径选最佳,有多种杂质时除杂顺序必须合理。
(2)四原则
不增、不减、易分离、易复原
1.某同学设计了如下实验方案,以除去NaCl固体中的Na2SO4杂质。
可供选择的试剂:Ba(NO3)2溶液、Na2CO3溶液、BaCl2溶液、盐酸。
回答下列问题:
(1)操作①和②均需要使用玻璃棒,其作用分别为 。
搅拌、引流
(2)试剂a是 ,沉淀B是______。
BaCl2溶液
BaCO3
(3)加入试剂a发生反应的化学方程式为 ,加入试剂c发生反应的离子方程式为 。
Na2SO4+BaCl2===BaSO4↓+2NaCl
(4)若要测定原混合物中Na2SO4的质量分数,除了要准确称量混合物的质量,至少还需获得的数据是 。
沉淀A的质量
2.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是
A.①④②⑤③ B.④①②⑤③ C.⑤④①②③ D.⑤②④①③
D
粗食盐水
除去
除去Mg2+
除去Ca2+、过量的Ba2+
过量的BaCl2溶液
过量的NaOH溶液
过滤
适量的稀盐酸
除去过量的OH-、
除去BaSO4、Mg(OH)2、CaCO3沉淀
过量的Na2CO3溶液
根据电解质电离和离子反应的知识,归纳总结分析溶液体系的基本思路
