2.3 课时2 氧化剂和还原剂 课件 (共18张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3 课时2 氧化剂和还原剂 课件 (共18张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:25:49 | ||
图片预览




文档简介
(共18张PPT)
氧化剂和还原剂
第2章 元素与物质世界
3.知道氧化还原反应的基本规律及相关应用。
1.掌握氧化剂、还原剂、氧化性、还原性等基本概念,了解常见的氧化剂和还原剂。
2.会从化合价的角度分析物质的氧化性和还原性,会比较物质氧化性或还原性的强弱。
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
交流 · 研讨
交流 · 研讨
(1)2Cu + O2 === 2CuO
(2)CuO + H2 === Cu + H2O
(3)Fe2O3+3CO ==== 2Fe+3CO2
高温
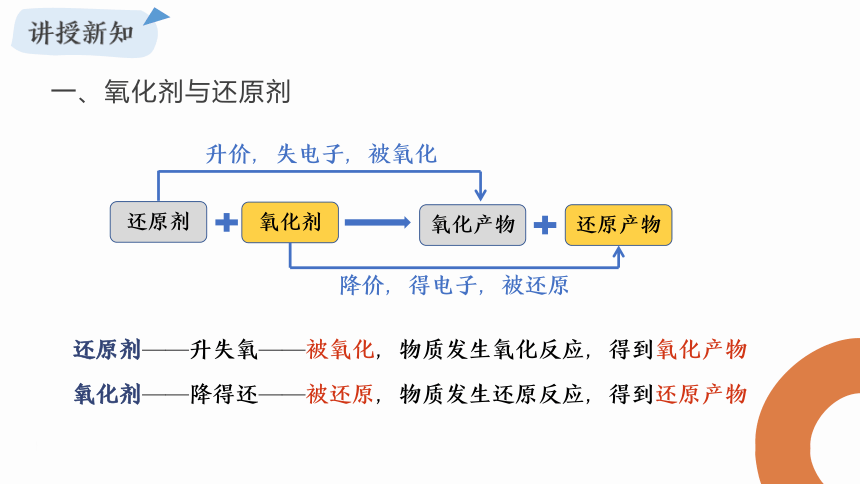
一、氧化剂与还原剂
氧化剂
还原剂
还原产物
氧化产物
升价,失电子,被氧化
降价,得电子,被还原
还原剂——升失氧——被氧化,物质发生氧化反应,得到氧化产物
氧化剂——降得还——被还原,物质发生还原反应,得到还原产物
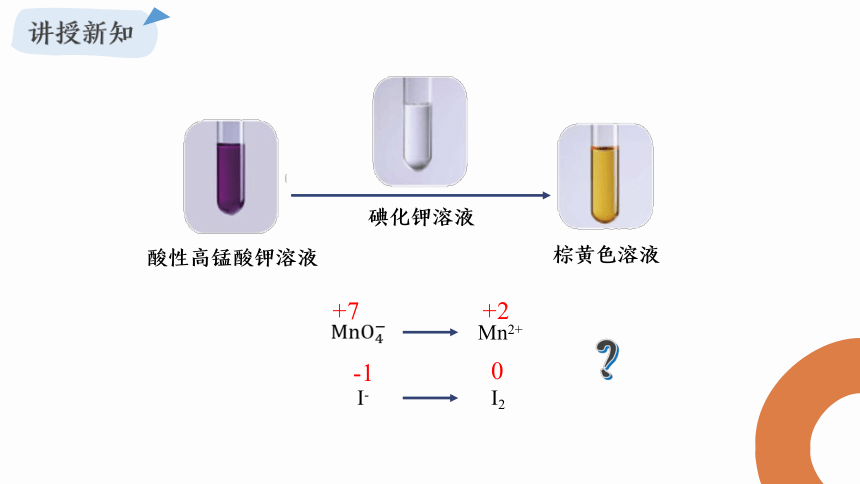
Mn2+
I-
I2
+7
+2
-1
0
?
酸性高锰酸钾溶液
碘化钾溶液
棕黄色溶液
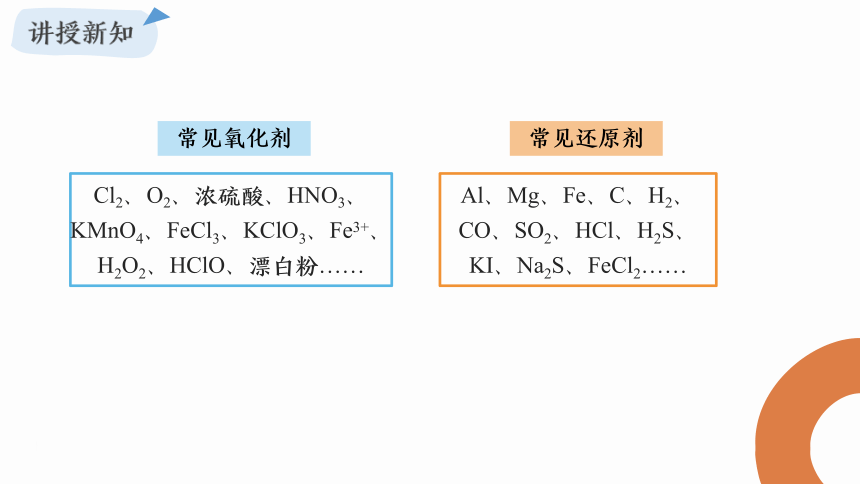
Cl2、O2、浓硫酸、HNO3、KMnO4、FeCl3、KClO3、Fe3+、H2O2、HClO、漂白粉……
Al、Mg、Fe、C、H2、CO、SO2、HCl、H2S、KI、Na2S、FeCl2……
常见氧化剂
常见还原剂
请快速指出下列反应的氧化剂和还原剂,氧化产物和还原产物。
① H2SO3+I2+H2O=2HI+H2SO4
② H2O2+2H++2Fe2+===2Fe3++2H2O
③ Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
④ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑤ 2H2S+SO2===3S↓+2H2O
二、氧化性和还原性
点燃
氧化剂
还原剂
还原产物
氧化产物
2Mg + CO2 2MgO + C
+4
0
0
+2
低价 高价
高价 低价
问题:中间价态具有氧化性还是还原性呢?
氧化性、还原性和元素化合价之间的关系
只具有还原性
既具有还原性
又具有氧化性
只具有氧化性
最低价
中间价
最高价
从氧化性、还原性的角度认识和研究物质的性质
三、物质的氧化性、还原性强弱比较
失电子能力越强
氧化性越强
得电子能力越强
还原性越强
金属单质的还原性
还原性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K+ .. Mg2+ Al3+ Zn2+ Fe2+ .. H+ Cu2+ Fe3+ Ag+..
氧化性逐渐增强
金属单质的还原性越强;
对应金属阳离子的氧化性越弱
1.根据 金属活动性顺序表比较物质的氧化性与还原性
“前强后弱”
还原性 氧化性 氧化性 还原性
较弱
较强
氧化性:
氧化剂 >氧化产物
还原性:
还原剂 >还原产物
② 根据化学方程式判断还原性强弱
Fe + CuSO4 ==== FeSO4 + Cu
增强
减弱
③根据元素的化合价:
同一种元素,一般价态越高,其氧化性越强;价态越低,其还原性越强
④从反应难易程度(温度、浓度、酸碱性)和反应的剧烈程度判断:
一般反应中,反应条件要求越低,反应越剧烈,对应反应物的氧化性或还原性越强。
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+ 5Cl2↑+8H2O,
氧化性:KMnO4>MnO2。
△
例外氧化性:HClO4氧化还原反应的规律
1.守恒规律
应用:有关氧化还原反应的计算与化学方程式的配平。
2.强弱规律
在同一个氧化还原反应中,氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
应用:比较物质间氧化性或还原性的强弱。
3.先后规律
(1)同一氧化剂与多种还原剂混合,还原性强的先被氧化。
(2)同一还原剂与多种氧化剂混合,氧化性强的先被还原。
应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
4.价态规律
(1)归中规律。
①同种元素不同价态之间发生氧化还原反应,元素的化合价“只向中间靠拢不出现交叉”。例如:
②同种元素相邻价态间不发生化学反应。
应用:判断同种元素不同价态的物质间发生氧化还原反应的可能性。
(2)歧化规律。
同种元素的中间价态变为高价态和低价态,即中间价态→高价态+低价态。如
反应物
得失电子
化合价变化
性质
反应类型
产物
氧化剂
得电子
降低
氧化性
还原反应(被还原)
还原产物
还原剂
失电子
升高
还原性
氧化反应(被氧化)
氧化产物
常温下,发生下列反应:
①16H++10Cl-+ ===2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是?
MnO4->Cl2>Br2>Fe3+
氧化剂和还原剂
第2章 元素与物质世界
3.知道氧化还原反应的基本规律及相关应用。
1.掌握氧化剂、还原剂、氧化性、还原性等基本概念,了解常见的氧化剂和还原剂。
2.会从化合价的角度分析物质的氧化性和还原性,会比较物质氧化性或还原性的强弱。
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
交流 · 研讨
交流 · 研讨
(1)2Cu + O2 === 2CuO
(2)CuO + H2 === Cu + H2O
(3)Fe2O3+3CO ==== 2Fe+3CO2
高温
一、氧化剂与还原剂
氧化剂
还原剂
还原产物
氧化产物
升价,失电子,被氧化
降价,得电子,被还原
还原剂——升失氧——被氧化,物质发生氧化反应,得到氧化产物
氧化剂——降得还——被还原,物质发生还原反应,得到还原产物
Mn2+
I-
I2
+7
+2
-1
0
?
酸性高锰酸钾溶液
碘化钾溶液
棕黄色溶液
Cl2、O2、浓硫酸、HNO3、KMnO4、FeCl3、KClO3、Fe3+、H2O2、HClO、漂白粉……
Al、Mg、Fe、C、H2、CO、SO2、HCl、H2S、KI、Na2S、FeCl2……
常见氧化剂
常见还原剂
请快速指出下列反应的氧化剂和还原剂,氧化产物和还原产物。
① H2SO3+I2+H2O=2HI+H2SO4
② H2O2+2H++2Fe2+===2Fe3++2H2O
③ Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
④ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑤ 2H2S+SO2===3S↓+2H2O
二、氧化性和还原性
点燃
氧化剂
还原剂
还原产物
氧化产物
2Mg + CO2 2MgO + C
+4
0
0
+2
低价 高价
高价 低价
问题:中间价态具有氧化性还是还原性呢?
氧化性、还原性和元素化合价之间的关系
只具有还原性
既具有还原性
又具有氧化性
只具有氧化性
最低价
中间价
最高价
从氧化性、还原性的角度认识和研究物质的性质
三、物质的氧化性、还原性强弱比较
失电子能力越强
氧化性越强
得电子能力越强
还原性越强
金属单质的还原性
还原性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K+ .. Mg2+ Al3+ Zn2+ Fe2+ .. H+ Cu2+ Fe3+ Ag+..
氧化性逐渐增强
金属单质的还原性越强;
对应金属阳离子的氧化性越弱
1.根据 金属活动性顺序表比较物质的氧化性与还原性
“前强后弱”
还原性 氧化性 氧化性 还原性
较弱
较强
氧化性:
氧化剂 >氧化产物
还原性:
还原剂 >还原产物
② 根据化学方程式判断还原性强弱
Fe + CuSO4 ==== FeSO4 + Cu
增强
减弱
③根据元素的化合价:
同一种元素,一般价态越高,其氧化性越强;价态越低,其还原性越强
④从反应难易程度(温度、浓度、酸碱性)和反应的剧烈程度判断:
一般反应中,反应条件要求越低,反应越剧烈,对应反应物的氧化性或还原性越强。
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+ 5Cl2↑+8H2O,
氧化性:KMnO4>MnO2。
△
例外氧化性:HClO4
1.守恒规律
应用:有关氧化还原反应的计算与化学方程式的配平。
2.强弱规律
在同一个氧化还原反应中,氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
应用:比较物质间氧化性或还原性的强弱。
3.先后规律
(1)同一氧化剂与多种还原剂混合,还原性强的先被氧化。
(2)同一还原剂与多种氧化剂混合,氧化性强的先被还原。
应用:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
4.价态规律
(1)归中规律。
①同种元素不同价态之间发生氧化还原反应,元素的化合价“只向中间靠拢不出现交叉”。例如:
②同种元素相邻价态间不发生化学反应。
应用:判断同种元素不同价态的物质间发生氧化还原反应的可能性。
(2)歧化规律。
同种元素的中间价态变为高价态和低价态,即中间价态→高价态+低价态。如
反应物
得失电子
化合价变化
性质
反应类型
产物
氧化剂
得电子
降低
氧化性
还原反应(被还原)
还原产物
还原剂
失电子
升高
还原性
氧化反应(被氧化)
氧化产物
常温下,发生下列反应:
①16H++10Cl-+ ===2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是?
MnO4->Cl2>Br2>Fe3+
