3.1 课时1 亚铁盐和铁盐 课件(共20张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.1 课时1 亚铁盐和铁盐 课件(共20张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:27:45 | ||
图片预览






文档简介
(共20张PPT)
亚铁盐和铁盐
第3章 物质的性质与转化
1.能说出铁在自然界中的存在形态及在日常生活中的应用;
2.通过实验探究,能够说出亚铁盐和铁盐的化学性质,并会书写相关方程式。
联想 · 质疑
联想 · 质疑
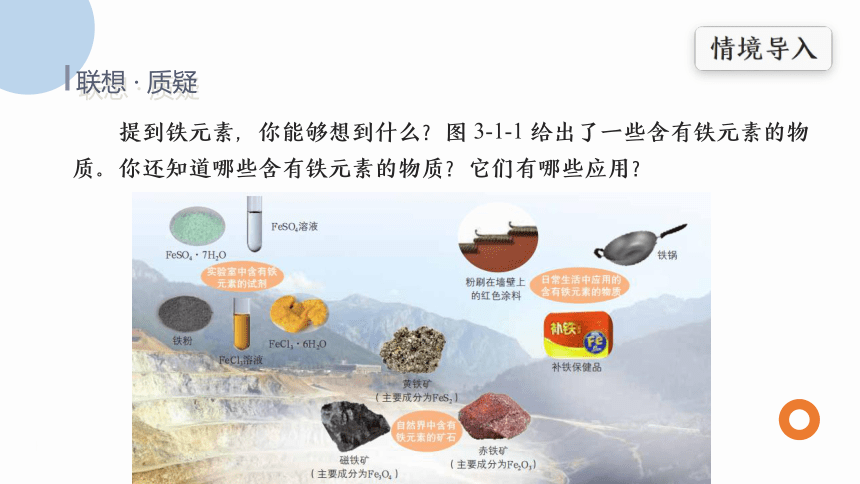
提到铁元素,你能够想到什么?图 3-1-1 给出了一些含有铁元素的物质。你还知道哪些含有铁元素的物质?它们有哪些应用?
单质
氧化物
化合物
碱
盐
混合物
纯净物
含铁元素
的物质
Fe
亚铁盐(如FeSO4)、铁盐(如FeCl3)
FeO、Fe2O3、Fe3O4
Fe(OH)2、Fe(OH)3
赤铁矿、菱铁矿、黄铁矿
一、铁元素的存在
二、亚铁盐和铁盐
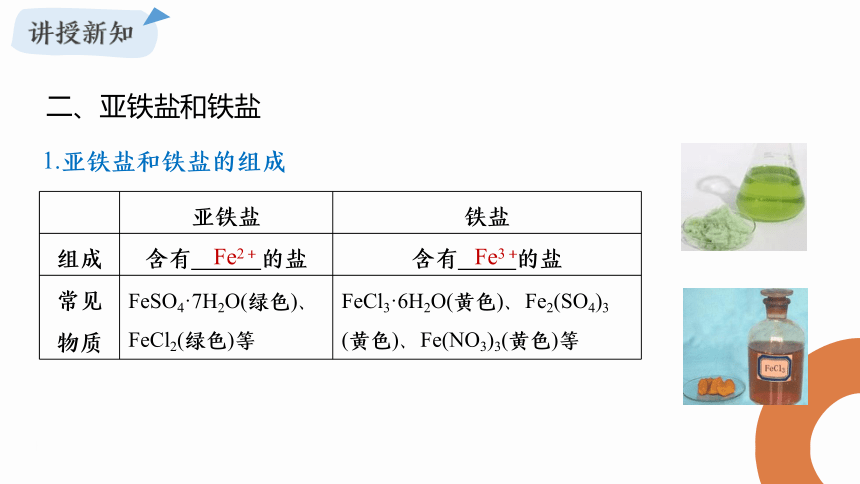
亚铁盐 铁盐
组成 含有 的盐 含有 的盐
常见 物质 FeSO4·7H2O(绿色)、FeCl2(绿色)等 FeCl3·6H2O(黄色)、Fe2(SO4)3 (黄色)、Fe(NO3)3(黄色)等
Fe3+
Fe2+
1.亚铁盐和铁盐的组成
活动 · 探究
活动 · 探究
亚铁盐和铁盐的性质
实验目的
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐和铁盐的性质。
实验用品
FeSO4 溶液,FeCl3 溶液,NaOH 溶液,酸性 KMnO4溶液,氯水,KSCN(硫氰酸钾)溶液,KI 溶液,淀粉溶液,铁粉,锌片,铜片;
试管,胶头滴管,镊子,药匙。
思考:如何预测物质性质和选取试剂。
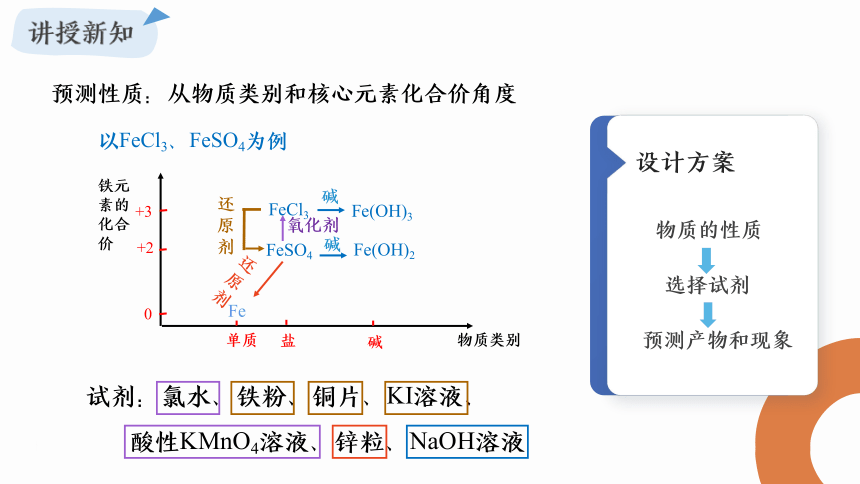
预测性质:从物质类别和核心元素化合价角度
以FeCl3、FeSO4为例
铁元素的化合价
物质类别
+3
+2
0
盐
碱
碱
Fe
单质
还原剂
FeSO4
FeCl3
Fe(OH)3
碱
Fe(OH)2
试剂:氯水、铁粉、铜片、KI溶液、
酸性KMnO4溶液、锌粒、NaOH溶液
氧化剂
还原剂
物质的性质
选择试剂
预测产物和现象
设计方案
思考:什么样的实验现象可以作为证据支持你所预测的亚铁盐和铁盐的性质?
记录总结铁盐和亚铁盐的性质。
实验操作 实验现象 结论及有关离子方程式
验证FeCl3能与碱反应 产生 沉淀 Fe3+和碱反应生成Fe(OH)3,离子方程式_________________________
验证FeCl3能与KSCN溶液反应 加入KSCN溶液, 溶液变为_____ Fe3+的特征反应,离子方程式:
____________________
红褐色
Fe3++3OH- ===Fe(OH)3↓
铁盐:从物质类别角度
红色
Fe3++3SCN-===Fe(SCN)3
铁盐:从化合价角度
实验操作 实验现象 结论及有关离子方程式
验证FeCl3 具有氧化性, 可作氧化剂 向足量铁粉中加入FeCl3溶液振荡,溶液由________变 。 Fe3+具有较强的______,离子方程式:
____________________
与铜丝接触的溶液变为_____ Fe3+具有较强的______,离子方程式:______________________
无色溶液变为_____ Fe3+具有较强的_______,离子方程式:__________________________
黄色
浅绿色
氧化性
2Fe3++Fe===3Fe2+
蓝色
氧化性
Cu+2Fe3+===Cu2++2Fe2+
蓝色
氧化性
2Fe3++2I- ===2Fe2++I2
亚铁盐:从物质类别角度
实验操作 实验现象 结论及有关离子方程式
验证FeCl3能与碱反应 Fe2+和碱反应生成Fe(OH)2,离子方程式:________________________
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
白色沉淀
灰绿色沉淀
红褐色沉淀
【拓展】:制取氢氧化亚铁的改进
【分析】Fe(OH)2会被O2氧化,因此制取Fe(OH)2的关键是防止O2的干扰,做到:
隔绝氧气、除去氧气
【具体措施】
1.使用新配制的FeSO4溶液和NaOH溶液
3.把NaOH溶液或配制溶液用的蒸馏水加热煮沸除去溶解氧
4.滴入溶液时将胶头滴管伸入液面以下,不要全部挤出
2.向FeSO4溶液中加入光亮的细铁丝或铁粉
5.用苯、植物油等物质进行液封,避免生成的Fe(OH)2与O2接触
亚铁盐:从化合价角度
实验操作 实验现象 结论及有关离子方程式
验证FeSO4 具有还原性,可作还原剂 加入KSCN溶液,溶液 ,滴加氯水后溶液呈 色 Fe2+具有 ,离子方程式:______________________
__________________________
溶液由______色变为____色 Fe2+具有______,被 _____成Fe3+,离子方程式:
_________________________________________
验证FeSO4具有氧化性,可作氧化剂 溶液由______色变为____色 Fe2+具有_______,离子方程式:_____________________
无现象
红
还原性
2Fe2++Cl2===2Fe3++2Cl-、
紫红
黄
还原性
氧化
浅绿
无
氧化性
Zn+Fe2+===Fe+Zn2+
Fe3++3SCN-===Fe(SCN)3
5Fe2++MnO4-+8H+===5Fe3+
+Mn2++4H2O
Fe3+
Fe2+
与碱的反应
氧化性
Fe
与碱的反应
氧化性
还原性
2Fe3++Fe === 3Fe2+
2Fe3+ +Cu === 2Fe2++Cu2+
2Fe3+ +2I-===I2+2Fe2+
常用于工业腐蚀线路板
实验室保存FeSO4溶液,加入铁粉防止Fe2+被氧化
Fe3++3OH-=Fe(OH)3↓
2Fe2++Cl2 === 2Fe3+ +2Cl-
Fe2++Zn === Fe+Zn2+
Fe2++2OH-=Fe(OH)2↓
2Fe2++H2O2+2H+=2Fe3++2H20
和酸性KMnO4溶液
1.实验室配制FeCl2溶液时,为什么要加入少量铁屑?
深度思考:用离子方程式来解释
目的是防止Fe2+被氧化成Fe3+。加入的铁屑可将溶液中Fe3+转化成Fe2+,离子方程式为2Fe3++Fe===3Fe2+。
2.如何除去FeCl2溶液中混有的少量Cu2+?
加入过量铁粉后过滤,除去剩余的Fe和生成的铜,离子方程式为Fe+Cu2+===Cu+Fe2+。
3.如何通过实验证明铁锈中含有Fe3+?
向试管中加入少量铁锈,加入稀盐酸使其溶解,再滴入几滴KSCN溶液,若溶液变成红色,则说明铁锈中含有Fe3+。
Fe3++3SCN-===Fe(SCN)3
4.FeCl2溶液中混有少量FeCl3时,如何除去杂质?
5.FeCl3溶液中混有FeCl2时,如何除去杂质?
向溶液中加入足量的氯水,使FeCl2转化为FeCl3。
6.若用过量的锌和FeCl3溶液反应,产物是FeCl2吗?为什么?
产物不是FeCl2。因为锌比铁活泼,所以过量的锌会和FeCl2反应生成Fe,锌的表面会变黑。
向溶液中加入足量的铁粉,使FeCl3和Fe充分反应生成FeCl2,然后过滤除去多余的Fe。
7.向某溶液中滴加氯水后再滴入几滴KSCN溶液,溶液变成红色,能否说明溶液中含有Fe2+?
不能;若溶液中含有Fe3+而不含Fe2+,会发生相同的现象。
8.用NaOH溶液能否检验某溶液中是否存在Fe3+或Fe2+?
能;若溶液中含有Fe3+,滴加NaOH溶液会生成红褐色沉淀;若溶液中含有Fe2+,滴加NaOH溶液后先生成白色沉淀,然后迅速变成灰绿色,最后变成红褐色。
Fe3+的检验方法
Fe2+的检验方法
同时含有Fe2+、Fe3+的检验方法
主要成分 杂质 除杂方法
FeCl3(aq) FeCl2(aq) 加入氯水或H2O2
FeCl2(aq) FeCl3(aq) 加过量铁粉后过滤
FeCl2(aq) CuCl2(aq) 加过量铁粉后过滤
含Fe2+、Fe3+的除杂问题
亚铁盐和铁盐
第3章 物质的性质与转化
1.能说出铁在自然界中的存在形态及在日常生活中的应用;
2.通过实验探究,能够说出亚铁盐和铁盐的化学性质,并会书写相关方程式。
联想 · 质疑
联想 · 质疑
提到铁元素,你能够想到什么?图 3-1-1 给出了一些含有铁元素的物质。你还知道哪些含有铁元素的物质?它们有哪些应用?
单质
氧化物
化合物
碱
盐
混合物
纯净物
含铁元素
的物质
Fe
亚铁盐(如FeSO4)、铁盐(如FeCl3)
FeO、Fe2O3、Fe3O4
Fe(OH)2、Fe(OH)3
赤铁矿、菱铁矿、黄铁矿
一、铁元素的存在
二、亚铁盐和铁盐
亚铁盐 铁盐
组成 含有 的盐 含有 的盐
常见 物质 FeSO4·7H2O(绿色)、FeCl2(绿色)等 FeCl3·6H2O(黄色)、Fe2(SO4)3 (黄色)、Fe(NO3)3(黄色)等
Fe3+
Fe2+
1.亚铁盐和铁盐的组成
活动 · 探究
活动 · 探究
亚铁盐和铁盐的性质
实验目的
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐和铁盐的性质。
实验用品
FeSO4 溶液,FeCl3 溶液,NaOH 溶液,酸性 KMnO4溶液,氯水,KSCN(硫氰酸钾)溶液,KI 溶液,淀粉溶液,铁粉,锌片,铜片;
试管,胶头滴管,镊子,药匙。
思考:如何预测物质性质和选取试剂。
预测性质:从物质类别和核心元素化合价角度
以FeCl3、FeSO4为例
铁元素的化合价
物质类别
+3
+2
0
盐
碱
碱
Fe
单质
还原剂
FeSO4
FeCl3
Fe(OH)3
碱
Fe(OH)2
试剂:氯水、铁粉、铜片、KI溶液、
酸性KMnO4溶液、锌粒、NaOH溶液
氧化剂
还原剂
物质的性质
选择试剂
预测产物和现象
设计方案
思考:什么样的实验现象可以作为证据支持你所预测的亚铁盐和铁盐的性质?
记录总结铁盐和亚铁盐的性质。
实验操作 实验现象 结论及有关离子方程式
验证FeCl3能与碱反应 产生 沉淀 Fe3+和碱反应生成Fe(OH)3,离子方程式_________________________
验证FeCl3能与KSCN溶液反应 加入KSCN溶液, 溶液变为_____ Fe3+的特征反应,离子方程式:
____________________
红褐色
Fe3++3OH- ===Fe(OH)3↓
铁盐:从物质类别角度
红色
Fe3++3SCN-===Fe(SCN)3
铁盐:从化合价角度
实验操作 实验现象 结论及有关离子方程式
验证FeCl3 具有氧化性, 可作氧化剂 向足量铁粉中加入FeCl3溶液振荡,溶液由________变 。 Fe3+具有较强的______,离子方程式:
____________________
与铜丝接触的溶液变为_____ Fe3+具有较强的______,离子方程式:______________________
无色溶液变为_____ Fe3+具有较强的_______,离子方程式:__________________________
黄色
浅绿色
氧化性
2Fe3++Fe===3Fe2+
蓝色
氧化性
Cu+2Fe3+===Cu2++2Fe2+
蓝色
氧化性
2Fe3++2I- ===2Fe2++I2
亚铁盐:从物质类别角度
实验操作 实验现象 结论及有关离子方程式
验证FeCl3能与碱反应 Fe2+和碱反应生成Fe(OH)2,离子方程式:________________________
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
白色沉淀
灰绿色沉淀
红褐色沉淀
【拓展】:制取氢氧化亚铁的改进
【分析】Fe(OH)2会被O2氧化,因此制取Fe(OH)2的关键是防止O2的干扰,做到:
隔绝氧气、除去氧气
【具体措施】
1.使用新配制的FeSO4溶液和NaOH溶液
3.把NaOH溶液或配制溶液用的蒸馏水加热煮沸除去溶解氧
4.滴入溶液时将胶头滴管伸入液面以下,不要全部挤出
2.向FeSO4溶液中加入光亮的细铁丝或铁粉
5.用苯、植物油等物质进行液封,避免生成的Fe(OH)2与O2接触
亚铁盐:从化合价角度
实验操作 实验现象 结论及有关离子方程式
验证FeSO4 具有还原性,可作还原剂 加入KSCN溶液,溶液 ,滴加氯水后溶液呈 色 Fe2+具有 ,离子方程式:______________________
__________________________
溶液由______色变为____色 Fe2+具有______,被 _____成Fe3+,离子方程式:
_________________________________________
验证FeSO4具有氧化性,可作氧化剂 溶液由______色变为____色 Fe2+具有_______,离子方程式:_____________________
无现象
红
还原性
2Fe2++Cl2===2Fe3++2Cl-、
紫红
黄
还原性
氧化
浅绿
无
氧化性
Zn+Fe2+===Fe+Zn2+
Fe3++3SCN-===Fe(SCN)3
5Fe2++MnO4-+8H+===5Fe3+
+Mn2++4H2O
Fe3+
Fe2+
与碱的反应
氧化性
Fe
与碱的反应
氧化性
还原性
2Fe3++Fe === 3Fe2+
2Fe3+ +Cu === 2Fe2++Cu2+
2Fe3+ +2I-===I2+2Fe2+
常用于工业腐蚀线路板
实验室保存FeSO4溶液,加入铁粉防止Fe2+被氧化
Fe3++3OH-=Fe(OH)3↓
2Fe2++Cl2 === 2Fe3+ +2Cl-
Fe2++Zn === Fe+Zn2+
Fe2++2OH-=Fe(OH)2↓
2Fe2++H2O2+2H+=2Fe3++2H20
和酸性KMnO4溶液
1.实验室配制FeCl2溶液时,为什么要加入少量铁屑?
深度思考:用离子方程式来解释
目的是防止Fe2+被氧化成Fe3+。加入的铁屑可将溶液中Fe3+转化成Fe2+,离子方程式为2Fe3++Fe===3Fe2+。
2.如何除去FeCl2溶液中混有的少量Cu2+?
加入过量铁粉后过滤,除去剩余的Fe和生成的铜,离子方程式为Fe+Cu2+===Cu+Fe2+。
3.如何通过实验证明铁锈中含有Fe3+?
向试管中加入少量铁锈,加入稀盐酸使其溶解,再滴入几滴KSCN溶液,若溶液变成红色,则说明铁锈中含有Fe3+。
Fe3++3SCN-===Fe(SCN)3
4.FeCl2溶液中混有少量FeCl3时,如何除去杂质?
5.FeCl3溶液中混有FeCl2时,如何除去杂质?
向溶液中加入足量的氯水,使FeCl2转化为FeCl3。
6.若用过量的锌和FeCl3溶液反应,产物是FeCl2吗?为什么?
产物不是FeCl2。因为锌比铁活泼,所以过量的锌会和FeCl2反应生成Fe,锌的表面会变黑。
向溶液中加入足量的铁粉,使FeCl3和Fe充分反应生成FeCl2,然后过滤除去多余的Fe。
7.向某溶液中滴加氯水后再滴入几滴KSCN溶液,溶液变成红色,能否说明溶液中含有Fe2+?
不能;若溶液中含有Fe3+而不含Fe2+,会发生相同的现象。
8.用NaOH溶液能否检验某溶液中是否存在Fe3+或Fe2+?
能;若溶液中含有Fe3+,滴加NaOH溶液会生成红褐色沉淀;若溶液中含有Fe2+,滴加NaOH溶液后先生成白色沉淀,然后迅速变成灰绿色,最后变成红褐色。
Fe3+的检验方法
Fe2+的检验方法
同时含有Fe2+、Fe3+的检验方法
主要成分 杂质 除杂方法
FeCl3(aq) FeCl2(aq) 加入氯水或H2O2
FeCl2(aq) FeCl3(aq) 加过量铁粉后过滤
FeCl2(aq) CuCl2(aq) 加过量铁粉后过滤
含Fe2+、Fe3+的除杂问题
