2.3 课时3 氧化还原反应的应用 课件 (共19张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3 课时3 氧化还原反应的应用 课件 (共19张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:29:03 | ||
图片预览





文档简介
(共19张PPT)
氧化还原反应的应用
第2章 元素与物质世界
1.以H2O2为例,学会根据元素化合价预测并设计实验探究物质的氧化性或还原性。
2.了解氧化还原反应在物质转化和能量转化中的应用,能从元素价态变化的视角说明物质的转化路径,学会氯气的实验室制法。
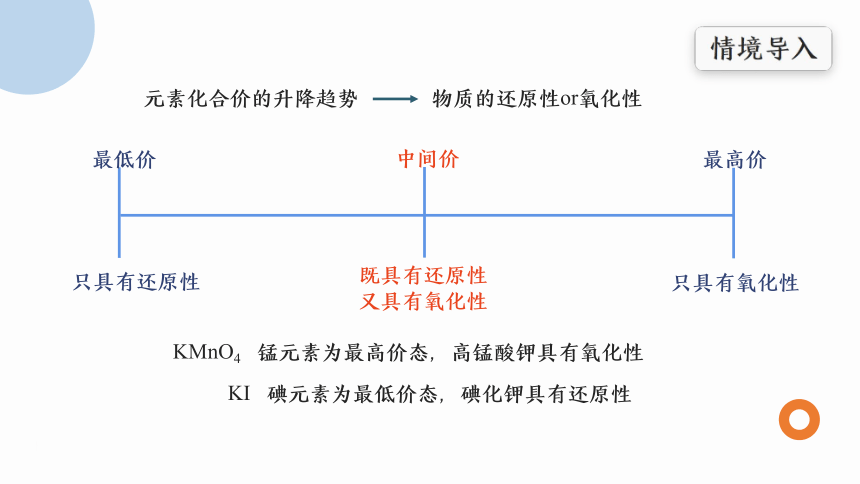
元素化合价的升降趋势
物质的还原性or氧化性
最低价
中间价
最高价
只具有还原性
既具有还原性
又具有氧化性
只具有氧化性
KMnO4 锰元素为最高价态,高锰酸钾具有氧化性
KI 碘元素为最低价态,碘化钾具有还原性
活动 · 探究
活动 · 探究
探究物质的氧化性或还原性
过氧化氢(H2O2)中氢元素的化合价为 +1 价,氧元素的化合价为 -1 价。过氧化氢是否具有氧化性或还原性呢?请你设计实验验证自己的预测。
实验用品
5% H2O2 溶液,酸性 KMnO4 溶液,KI 溶液,淀粉溶液;
试管,胶头滴管。
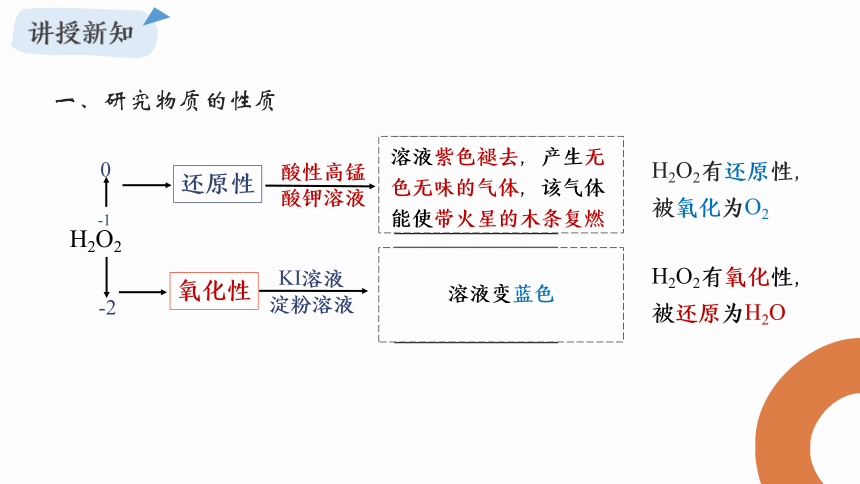
H2O2
-1
0
-2
还原性
氧化性
酸性高锰
酸钾溶液
KI溶液
淀粉溶液
溶液紫色褪去,产生无色无味的气体,该气体能使带火星的木条复燃
溶液变蓝色
H2O2有还原性,
被氧化为O2
H2O2有氧化性,
被还原为H2O
一、研究物质的性质
证明过氧化氢具有氧化性或还原性的依据是什么?
证明H2O2具有氧化性的依据是能将具有强还原性的KI氧化为使淀粉溶液变蓝的I2;
证明H2O2具有还原性的依据是能使具有强氧化性的酸性KMnO4溶液紫色褪去。
思考与讨论
影响物质氧化性或还原性的因素
(1)物质氧化性或还原性的强弱由物质得失电子的能力决定。
(2)环境条件也会影响物质氧化性或还原性的强弱。如酸性越强,KMnO4的氧化性越强。
思考:金属在自然界主要以游离态还是化合态形式存在?
Au 单质
Ag 单质
黄铜矿CuFeS2
赤铁矿Fe2O3
铝土矿Al(OH)3
如何得到金属单质?
二、实现物质转化
(1)冶炼金属
①金属冶炼的本质
金属阳离子得电子被还原生成金属单质
Mn++ne-===M
②金属冶炼方法
热还原法:
以C、CO等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质。
Fe2O3+3CO ==== 2Fe + 3CO2
高温
(高炉炼铁)
金属置换法:
以活泼金属为还原剂,将目标金属从其盐溶液中还原出来。
CuSO4+Fe===FeSO4+Cu
②金属冶炼方法
电解法:
热分解法:
利用外加电源提供电子,使金属元素的化合价降低,从而获得金属单质。
2Al2O3 (熔融) ==== 4Al + 3O2 ↑
电解
冰晶石
在加热条件下,物质自身发生氧化还原反应,将金属还原出来。
2HgO ==== 2Hg + O2 ↑
加热
金属的冶炼方法
金属活泼性与冶炼方法的关系如下:
特别提醒 ①冶炼Mg时只能电解熔融MgCl2不能电解MgO,原因是MgO的熔点高,熔化时消耗更多能量,增加生产成本。
②冶炼Al时只能电解熔融Al2O3不能电解熔融AlCl3,原因是AlCl3在熔融态时不导电。
下表中金属在工业上的冶炼方法错误的是
Al和Na是活泼的金属,冶炼方法分别是电解熔融的Al2O3和NaCl。
选项 A B C D
金属 Ca、Mg Sn、Pb Al、Na Hg、Ag
冶炼方法 电解法 热还原法 热还原法 热分解法
C
迁移 · 应用
迁移 · 应用
瑞典化学家舍勒(C.W.Scheele)是最早发现氯气的人。他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气。
0
+4 -1
+2
化合价升高,氧化反应
化合价降低,还原反应
氧化剂
还原剂
MnO2+ 4HCl(浓) ==== MnCl2 + Cl2 ↑ + 2H2O
三、实验室制取氯气
①制备原理
MnO2+ 4HCl(浓) ==== MnCl2 + Cl2 ↑ + 2H2O
思考:含有146 g HCl的浓盐酸与足量的MnO2反应,能生成71 g Cl2吗?
不能。一是随着反应的进行,盐酸浓度变小,Cl-的还原性减弱,MnO2不能再氧化HCl,此反应不再进行;二是浓盐酸具有挥发性。
②仪器装置
分液漏斗
圆底烧瓶
NaOH溶液
除去Cl2中少量的HCl气体
干燥氯气(或除去Cl2中的水蒸气)
向上排空气法
思考与讨论
如何检验收集到的氯气已集满?
a.将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸变蓝,则证明已集满。
b.将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸先变红后褪色,则证明已集满。
实验室用氢氧化钠溶液吸收尾气的原理是什么,氯气表现什么性质?
反应的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O,氯气既
表现氧化性又表现还原性。
思考与讨论
为防止Cl2污染,能否用澄清石灰水处理过量的Cl2
吸收Cl2时不宜用澄清石灰水代替NaOH溶液,因为Ca(OH)2微溶于水,溶解的量少,不能保证Cl2全部被吸收。
在实验室中也可以利用高锰酸钾与浓盐酸在常温下反应制取氯气,请预测反应产物,写出该反应的化学方程式。
16HCl(浓)+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O。
三、获得能量
煤的燃烧
天然气的燃烧
火力发电厂
燃料电池电车
镁条燃烧
氧化还原反应的应用
第2章 元素与物质世界
1.以H2O2为例,学会根据元素化合价预测并设计实验探究物质的氧化性或还原性。
2.了解氧化还原反应在物质转化和能量转化中的应用,能从元素价态变化的视角说明物质的转化路径,学会氯气的实验室制法。
元素化合价的升降趋势
物质的还原性or氧化性
最低价
中间价
最高价
只具有还原性
既具有还原性
又具有氧化性
只具有氧化性
KMnO4 锰元素为最高价态,高锰酸钾具有氧化性
KI 碘元素为最低价态,碘化钾具有还原性
活动 · 探究
活动 · 探究
探究物质的氧化性或还原性
过氧化氢(H2O2)中氢元素的化合价为 +1 价,氧元素的化合价为 -1 价。过氧化氢是否具有氧化性或还原性呢?请你设计实验验证自己的预测。
实验用品
5% H2O2 溶液,酸性 KMnO4 溶液,KI 溶液,淀粉溶液;
试管,胶头滴管。
H2O2
-1
0
-2
还原性
氧化性
酸性高锰
酸钾溶液
KI溶液
淀粉溶液
溶液紫色褪去,产生无色无味的气体,该气体能使带火星的木条复燃
溶液变蓝色
H2O2有还原性,
被氧化为O2
H2O2有氧化性,
被还原为H2O
一、研究物质的性质
证明过氧化氢具有氧化性或还原性的依据是什么?
证明H2O2具有氧化性的依据是能将具有强还原性的KI氧化为使淀粉溶液变蓝的I2;
证明H2O2具有还原性的依据是能使具有强氧化性的酸性KMnO4溶液紫色褪去。
思考与讨论
影响物质氧化性或还原性的因素
(1)物质氧化性或还原性的强弱由物质得失电子的能力决定。
(2)环境条件也会影响物质氧化性或还原性的强弱。如酸性越强,KMnO4的氧化性越强。
思考:金属在自然界主要以游离态还是化合态形式存在?
Au 单质
Ag 单质
黄铜矿CuFeS2
赤铁矿Fe2O3
铝土矿Al(OH)3
如何得到金属单质?
二、实现物质转化
(1)冶炼金属
①金属冶炼的本质
金属阳离子得电子被还原生成金属单质
Mn++ne-===M
②金属冶炼方法
热还原法:
以C、CO等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质。
Fe2O3+3CO ==== 2Fe + 3CO2
高温
(高炉炼铁)
金属置换法:
以活泼金属为还原剂,将目标金属从其盐溶液中还原出来。
CuSO4+Fe===FeSO4+Cu
②金属冶炼方法
电解法:
热分解法:
利用外加电源提供电子,使金属元素的化合价降低,从而获得金属单质。
2Al2O3 (熔融) ==== 4Al + 3O2 ↑
电解
冰晶石
在加热条件下,物质自身发生氧化还原反应,将金属还原出来。
2HgO ==== 2Hg + O2 ↑
加热
金属的冶炼方法
金属活泼性与冶炼方法的关系如下:
特别提醒 ①冶炼Mg时只能电解熔融MgCl2不能电解MgO,原因是MgO的熔点高,熔化时消耗更多能量,增加生产成本。
②冶炼Al时只能电解熔融Al2O3不能电解熔融AlCl3,原因是AlCl3在熔融态时不导电。
下表中金属在工业上的冶炼方法错误的是
Al和Na是活泼的金属,冶炼方法分别是电解熔融的Al2O3和NaCl。
选项 A B C D
金属 Ca、Mg Sn、Pb Al、Na Hg、Ag
冶炼方法 电解法 热还原法 热还原法 热分解法
C
迁移 · 应用
迁移 · 应用
瑞典化学家舍勒(C.W.Scheele)是最早发现氯气的人。他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气。
0
+4 -1
+2
化合价升高,氧化反应
化合价降低,还原反应
氧化剂
还原剂
MnO2+ 4HCl(浓) ==== MnCl2 + Cl2 ↑ + 2H2O
三、实验室制取氯气
①制备原理
MnO2+ 4HCl(浓) ==== MnCl2 + Cl2 ↑ + 2H2O
思考:含有146 g HCl的浓盐酸与足量的MnO2反应,能生成71 g Cl2吗?
不能。一是随着反应的进行,盐酸浓度变小,Cl-的还原性减弱,MnO2不能再氧化HCl,此反应不再进行;二是浓盐酸具有挥发性。
②仪器装置
分液漏斗
圆底烧瓶
NaOH溶液
除去Cl2中少量的HCl气体
干燥氯气(或除去Cl2中的水蒸气)
向上排空气法
思考与讨论
如何检验收集到的氯气已集满?
a.将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸变蓝,则证明已集满。
b.将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸先变红后褪色,则证明已集满。
实验室用氢氧化钠溶液吸收尾气的原理是什么,氯气表现什么性质?
反应的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O,氯气既
表现氧化性又表现还原性。
思考与讨论
为防止Cl2污染,能否用澄清石灰水处理过量的Cl2
吸收Cl2时不宜用澄清石灰水代替NaOH溶液,因为Ca(OH)2微溶于水,溶解的量少,不能保证Cl2全部被吸收。
在实验室中也可以利用高锰酸钾与浓盐酸在常温下反应制取氯气,请预测反应产物,写出该反应的化学方程式。
16HCl(浓)+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O。
三、获得能量
煤的燃烧
天然气的燃烧
火力发电厂
燃料电池电车
镁条燃烧
