3.3 课时1 自然界中的氮循环 氮的固定 课件(共18张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.3 课时1 自然界中的氮循环 氮的固定 课件(共18张PPT) 2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 15:33:00 | ||
图片预览




文档简介
(共18张PPT)
自然界中的氮循环
氮的固定
第3章 物质的性质与转化
1.了解自然界中氮循环的基本过程,认识氮的固定。
2.熟知氮气的主要性质。
3.通过实验探究了解一氧化氮和二氧化氮的主要性质。
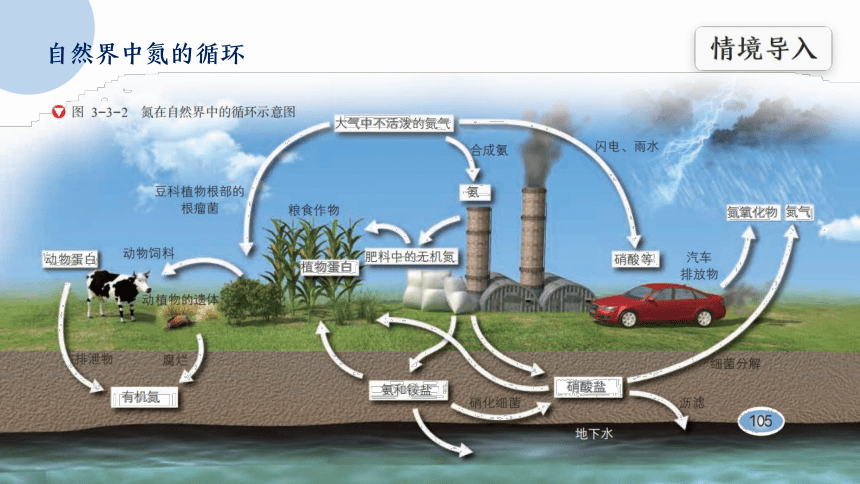
自然界中氮的循环
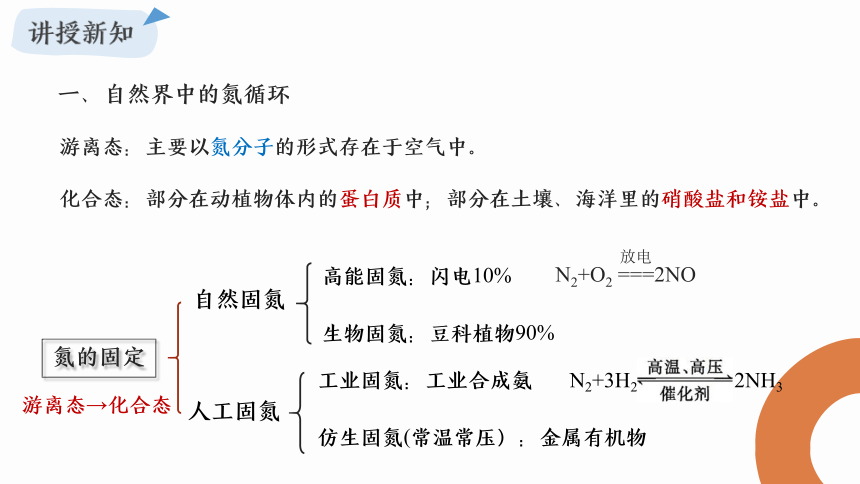
一、自然界中的氮循环
游离态:主要以氮分子的形式存在于空气中。
化合态:部分在动植物体内的蛋白质中;部分在土壤、海洋里的硝酸盐和铵盐中。
氮的固定
人工固氮
自然固氮
游离态→化合态
工业固氮:工业合成氨
仿生固氮(常温常压):金属有机物
N2+3H2 2NH3
高能固氮:闪电10%
生物固氮:豆科植物90%
N2+O2 ===2NO
放电
酸
单质
盐
氧化物
+2
0
+4
氮元素化合价
物质类别
-3
氢化物
+5
碱
NO2
N2
NO
NH3
HNO3
NH3·H2O
氮及其化合物的“价—类”二维图
氮元素常见化合价:
-3价,0价,+2价,+4价,+5价
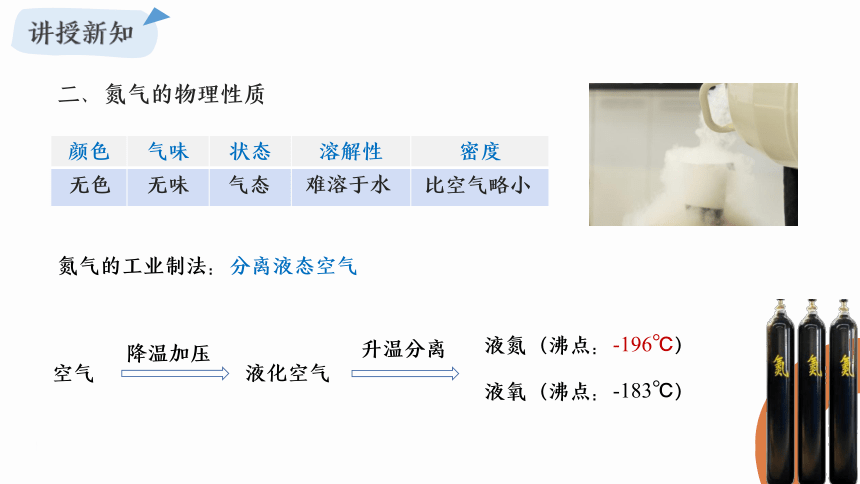
二、氮气的物理性质
颜色 气味 状态 溶解性 密度
无色
无味
气态
难溶于水
比空气略小
氮气的工业制法:分离液态空气
空气
降温加压
液化空气
升温分离
液氧(沸点:-183℃)
液氮(沸点:-196℃)
三、氮气的化学性质
氮原子的最外电子层有5个电子,既不容易得到3个电子,也不容易失去5个电子。因此,氮原子一般通过共用电子对与其他原子相互结合构成物质。常温下,氮气的化学性质稳定。
氮元素常见化合价:
-3价,0价,+2价,+4价,+5价
三、氮气的化学性质
N2+O2 ===2NO
放电
①氮气的还原性:
气体颜色由无色变为红棕色
NO
NO2
2NO+O2==2NO2
②氮气的氧化性:
N2+3H2 2NH3
3Mg+N2===Mg3N2
点燃
四、氮的氧化物
化合价 +1 +2 +3 +4 +5
对应 氧化物 N2O NO N2O3 NO2 N2O4 N2O5
2NO2 N2O4
酸酐
观察 · 思考
观察 · 思考
试管内气体减少,液面上升,红棕色气体变为无色,得到无色溶液。
3NO2+H2O===2HNO3+NO
思考:在该实验中,氧化剂和还原剂反应的物质的量的比值是?
NO2转化为HNO3,化合价升高,体现还原性。NO2转化为NO,化合价降低,体现氧化性。该实验中,氧化剂和还原剂的物质的量的比值是1:2
五、一氧化氮和二氧化氮
NO
NO2
NO NO2
物理性质 色味态
毒性
溶解性
密度
化学性质 还原性
氧化性
无色、无味、气体 红棕色、刺激性气味、气体
难溶于水 易溶于水,与水反应
有毒 有毒
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
略大于空气 大于空气
6NO+4NH3 ==== 5N2+6H2O
催化剂
气体由无色变为红棕色
气体由红棕色逐渐变为无色,水位上升到2/3处
工业制硝酸
知识网络构建:尾气处理
Cl2:
SO2:
NH3:
NO2
NO
NaOH
NaOH
稀硫酸、水
NaOH
通O2、NaOH
4NO+3O2+4NaOH=4NaNO3+2H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO、NO2
NO+NO2+2NaOH=2NaNO2+H2O
NO、NO2应用与危害
中毒(结合血红蛋白,造成人体缺氧)
传递神经信息
扩张血管
对抗微生物入侵
提高免疫力
提升记忆力
NO
NO2
使织物褪色
腐蚀金属和非金属材料
火箭燃料中的氧化剂
写出“雷雨发庄稼”的有关化学方程式。
O2
放电
O2
N2
NO
NO2
HNO3
H2O
盐
N2+O2 ===2NO
放电
2NO+O2==2NO2
3NO2 + H2O = 2HNO3 + NO
典型计算:含氮氧化物和氧气的混合气体与水反应后气体成分的规律
若试管中装10molNO2,则通入多少摩尔O2可以使NO2充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①+②×2得:4NO2+O2+2H2O === 4HNO3,即当NO2和O2的体积比为4︰1时水可以充满试管,需通入2.5 moL O2。
若试管中装10molNO,则通入多少摩尔O2可以使NO充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①×3+②×2得:4NO+3O2+2H2O === 4HNO3,即当NO和O2的体积比为4︰3时水可以充满试管,需通入7.5 moL O2。
典型计算:含氮氧化物和氧气的混合气体与水反应后气体成分的规律
4NO+3O2+2H2O === 4HNO3
当体积比V(NO):V(O2)
4:3
=4:3
>4:3
当NO、O2混合气体与水反应时
O2过量,剩余气体是O2
恰好完全反应
NO过量,剩余气体是NO
当NO2、O2混合气体与水反应时
4NO2+O2+2H2O === 4HNO3
当体积比V(NO2):V(O2)
4:1
=4:1
>4:1
(过量NO2与H2O反应生成NO)
O2过量,剩余气体是O2
恰好完全反应
NO2过量,剩余气体是NO
3NO2+H2O==2HNO3 + NO
4NO+3O2+2H2O==4HNO3
将20mL充满NO2和NO的混合气体的试管倒立于盛水的水槽中,充分反应后,剩余气体10mL。
(1)原混合气体的中NO和NO2的体积。
(2)向上述剩余气体中通入一定体积的氧气,最终剩余5ml气体。求通入氧气的体积。
3V
VNO2= 15mL VNO = 5mL
10mL
①若剩余O2,则10mLNO完全反应,需要消耗7.5mLO2。则通入O2共12.5mL。
②若剩余NO,则同入的O2完全被(10-5)mLNO消耗,共通入3.75mL。
10mL
15mL
V
2V
△
自然界中的氮循环
氮的循环
氮的固定
氮气
氮的氧化物
自然固氮
人工固氮
高能固氮
生物固氮
合成氨
合成氨反应
一氧化氮
二氧化氮
无色无味气体,难溶于水
红棕色、刺激性气味气体,易溶于水
自然界中含氮的物质
N2+O2===2NO
放电
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
自然界中的氮循环
氮的固定
第3章 物质的性质与转化
1.了解自然界中氮循环的基本过程,认识氮的固定。
2.熟知氮气的主要性质。
3.通过实验探究了解一氧化氮和二氧化氮的主要性质。
自然界中氮的循环
一、自然界中的氮循环
游离态:主要以氮分子的形式存在于空气中。
化合态:部分在动植物体内的蛋白质中;部分在土壤、海洋里的硝酸盐和铵盐中。
氮的固定
人工固氮
自然固氮
游离态→化合态
工业固氮:工业合成氨
仿生固氮(常温常压):金属有机物
N2+3H2 2NH3
高能固氮:闪电10%
生物固氮:豆科植物90%
N2+O2 ===2NO
放电
酸
单质
盐
氧化物
+2
0
+4
氮元素化合价
物质类别
-3
氢化物
+5
碱
NO2
N2
NO
NH3
HNO3
NH3·H2O
氮及其化合物的“价—类”二维图
氮元素常见化合价:
-3价,0价,+2价,+4价,+5价
二、氮气的物理性质
颜色 气味 状态 溶解性 密度
无色
无味
气态
难溶于水
比空气略小
氮气的工业制法:分离液态空气
空气
降温加压
液化空气
升温分离
液氧(沸点:-183℃)
液氮(沸点:-196℃)
三、氮气的化学性质
氮原子的最外电子层有5个电子,既不容易得到3个电子,也不容易失去5个电子。因此,氮原子一般通过共用电子对与其他原子相互结合构成物质。常温下,氮气的化学性质稳定。
氮元素常见化合价:
-3价,0价,+2价,+4价,+5价
三、氮气的化学性质
N2+O2 ===2NO
放电
①氮气的还原性:
气体颜色由无色变为红棕色
NO
NO2
2NO+O2==2NO2
②氮气的氧化性:
N2+3H2 2NH3
3Mg+N2===Mg3N2
点燃
四、氮的氧化物
化合价 +1 +2 +3 +4 +5
对应 氧化物 N2O NO N2O3 NO2 N2O4 N2O5
2NO2 N2O4
酸酐
观察 · 思考
观察 · 思考
试管内气体减少,液面上升,红棕色气体变为无色,得到无色溶液。
3NO2+H2O===2HNO3+NO
思考:在该实验中,氧化剂和还原剂反应的物质的量的比值是?
NO2转化为HNO3,化合价升高,体现还原性。NO2转化为NO,化合价降低,体现氧化性。该实验中,氧化剂和还原剂的物质的量的比值是1:2
五、一氧化氮和二氧化氮
NO
NO2
NO NO2
物理性质 色味态
毒性
溶解性
密度
化学性质 还原性
氧化性
无色、无味、气体 红棕色、刺激性气味、气体
难溶于水 易溶于水,与水反应
有毒 有毒
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
略大于空气 大于空气
6NO+4NH3 ==== 5N2+6H2O
催化剂
气体由无色变为红棕色
气体由红棕色逐渐变为无色,水位上升到2/3处
工业制硝酸
知识网络构建:尾气处理
Cl2:
SO2:
NH3:
NO2
NO
NaOH
NaOH
稀硫酸、水
NaOH
通O2、NaOH
4NO+3O2+4NaOH=4NaNO3+2H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO、NO2
NO+NO2+2NaOH=2NaNO2+H2O
NO、NO2应用与危害
中毒(结合血红蛋白,造成人体缺氧)
传递神经信息
扩张血管
对抗微生物入侵
提高免疫力
提升记忆力
NO
NO2
使织物褪色
腐蚀金属和非金属材料
火箭燃料中的氧化剂
写出“雷雨发庄稼”的有关化学方程式。
O2
放电
O2
N2
NO
NO2
HNO3
H2O
盐
N2+O2 ===2NO
放电
2NO+O2==2NO2
3NO2 + H2O = 2HNO3 + NO
典型计算:含氮氧化物和氧气的混合气体与水反应后气体成分的规律
若试管中装10molNO2,则通入多少摩尔O2可以使NO2充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①+②×2得:4NO2+O2+2H2O === 4HNO3,即当NO2和O2的体积比为4︰1时水可以充满试管,需通入2.5 moL O2。
若试管中装10molNO,则通入多少摩尔O2可以使NO充分被水吸收
已知2NO+O2 === 2NO2 ① 3NO2+H2O === 2HNO3+NO ②
由方程式①×3+②×2得:4NO+3O2+2H2O === 4HNO3,即当NO和O2的体积比为4︰3时水可以充满试管,需通入7.5 moL O2。
典型计算:含氮氧化物和氧气的混合气体与水反应后气体成分的规律
4NO+3O2+2H2O === 4HNO3
当体积比V(NO):V(O2)
4:3
=4:3
>4:3
当NO、O2混合气体与水反应时
O2过量,剩余气体是O2
恰好完全反应
NO过量,剩余气体是NO
当NO2、O2混合气体与水反应时
4NO2+O2+2H2O === 4HNO3
当体积比V(NO2):V(O2)
4:1
=4:1
>4:1
(过量NO2与H2O反应生成NO)
O2过量,剩余气体是O2
恰好完全反应
NO2过量,剩余气体是NO
3NO2+H2O==2HNO3 + NO
4NO+3O2+2H2O==4HNO3
将20mL充满NO2和NO的混合气体的试管倒立于盛水的水槽中,充分反应后,剩余气体10mL。
(1)原混合气体的中NO和NO2的体积。
(2)向上述剩余气体中通入一定体积的氧气,最终剩余5ml气体。求通入氧气的体积。
3V
VNO2= 15mL VNO = 5mL
10mL
①若剩余O2,则10mLNO完全反应,需要消耗7.5mLO2。则通入O2共12.5mL。
②若剩余NO,则同入的O2完全被(10-5)mLNO消耗,共通入3.75mL。
10mL
15mL
V
2V
△
自然界中的氮循环
氮的循环
氮的固定
氮气
氮的氧化物
自然固氮
人工固氮
高能固氮
生物固氮
合成氨
合成氨反应
一氧化氮
二氧化氮
无色无味气体,难溶于水
红棕色、刺激性气味气体,易溶于水
自然界中含氮的物质
N2+O2===2NO
放电
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
