2.2 课时2 离子反应 课件 (共19张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2 课时2 离子反应 课件 (共19张PPT)2024-2025学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-09 19:12:13 | ||
图片预览





文档简介
(共19张PPT)
第2章 元素与物质世界
离子反应
1.通过实验事实认识离子反应,并掌握离子反应发生的条件。
2.掌握离子方程式的书写方法及正误判断。
温故知新
完成下列物质在水溶液中的电离方程式。
(1) HF (2)H2SO (3)H3PO4
(4) NH3·H2O (5)Al(OH)3 (6)Mg(OH)2
(7)NaHCO3 (8) KAl(SO4)2 (9)AgCl
(10)NaHSO4 (11)H2S (12)HClO4
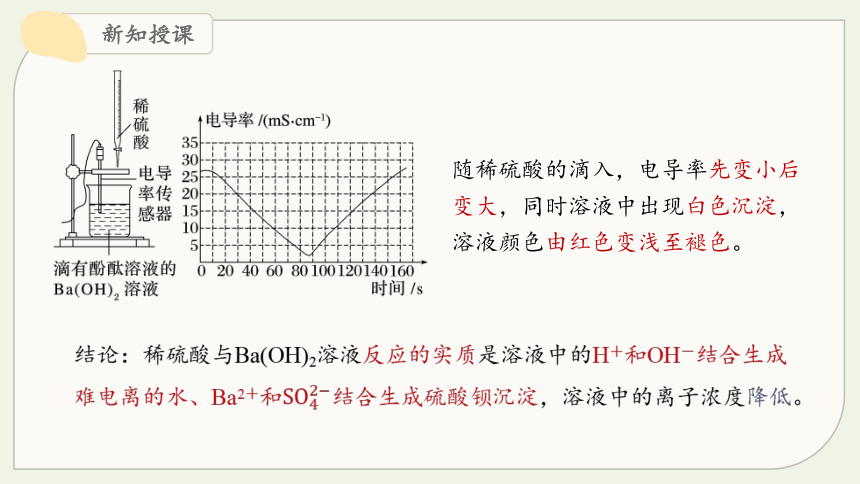
观察 · 思考
探究电解质在水溶液中反应的实质
随稀硫酸的滴入,电导率先变小后变大,同时溶液中出现白色沉淀,溶液颜色由红色变浅至褪色。
结论:稀硫酸与Ba(OH)2溶液反应的实质是溶液中的H+和OH-结合生成难电离的水、Ba2+和结合生成硫酸钡沉淀,溶液中的离子浓度降低。
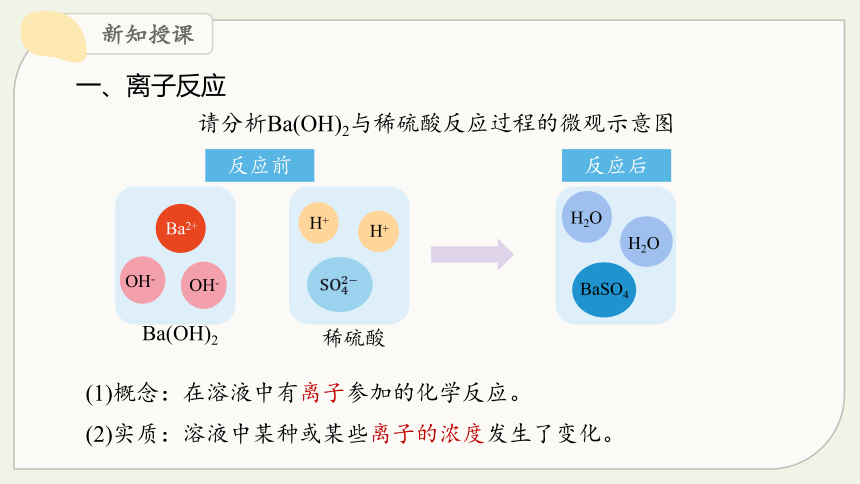
一、离子反应
(1)概念:在溶液中有离子参加的化学反应。
(2)实质:溶液中某种或某些离子的浓度发生了变化。
请分析Ba(OH)2与稀硫酸反应过程的微观示意图
反应前
反应后
Ba(OH)2
稀硫酸
Ba2+
OH-
OH-
H+
H+
BaSO4
H2O
H2O
①生成难溶物
(3)离子反应发生的条件
单质:Cu、Ag、Fe、Si等 氧化物:Al2O3、SiO2、CuO、MnO2等
酸:H2SiO3(硅酸)
碱:除了强碱 NaOH、KOH、Ba(OH)2 、Ca(OH)2 ;弱碱(NH3 H2O)外其余的碱基本都难溶。
盐:
盐酸盐(Cl-):AgCl(白色沉淀),其余基本都可溶于水
硫酸盐(SO42-):BaSO4(白色沉淀),其余基本都可溶于水
硝酸盐(NO3-):全部可以溶于水
弱酸盐:除阳离子为Na+、K+、NH4+的弱酸盐可以溶于水外,其余的基本都不溶于水。
②生成气体
③生成难电离的物质
(3)离子反应发生的条件
弱酸:CH3COOH、H2CO3、H2S、H2SO3
弱碱:NH3.H2O
水
三条件中,只要具备其中之一即可。
1.判断正误
(1)溶液中有离子参加或生成的化学反应都属于离子反应
(2)只要有H2O生成的反应就是离子反应
(3)发生离子反应时溶液中的离子浓度一定会减小
(4)电解质在溶液中发生了离子反应,则溶液的导电性一定减弱
(5)电解质在溶液中发生离子反应一定要生成沉淀、水或气体
A.M→N段溶液中的离子数目减少
B.N点Ca2+完全转化为CaCO3
C.N→P段溶液中的阴离子、阳离子数目均增加
D.N→P段反应的化学方程式为CaCO3+CO2===Ca(HCO3)2
D
2.CO2通入澄清石灰水中,溶液的导电能力与通入CO2的质量关系如图所示(假设反应过程中溶液的体积不变)。下列叙述不正确的是
联想 · 质疑
将KCl溶液与AgNO3溶液混合,分析KCl溶液与AgNO3溶液反应的实质,如何表示该反应的实质呢?
Ag+与Cl-反应生成了AgCl沉淀,用Ag++Cl-===AgCl↓表示离子反应的实质,即离子反应方程式。
Cl-
Ag+
AgCl
Cl-
Cl-
K+
K+
Ag+
K+
用实际参加反应的离子符号来表示反应的式子
二、离子方程式
Ba2+ + SO42- = BaSO4↓
【思考】氢气还原氧化铜,能否用离子方程式表示?
只能用化学方程式表示: H2 + CuO = Cu + H2O
(1)“写”正确写出反应的化学方程式。
例: 以Na2SO4溶液跟BaCl2溶液反应为例
Na2SO4 + BaCl2 = BaSO4 ↓ + 2NaCl
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2Na+ + 2Cl-
(2)“拆” 把易溶于水且易电离的物质(强酸、强碱、和大部分可溶性盐)拆写成离子形式;难溶的物质、气体和水等仍用化学式表示。
性质思维
分类思维
为什么可以发生反应?
物质类别(酸、碱、盐……)
性质(通性、特性)
HCl、H2SO4、HNO3、HBr、HI、HClO4
可溶性盐
KOH、NaOH、Ba(OH)2、Ca(OH)2
可 拆
六大强酸:
四大强碱:
难溶性盐:
不可拆
弱酸:
弱碱:
H2CO3、H2SO3、CH3COOH等
NH3·H2O、Mg(OH)2、Fe(OH)3等
CaCO3、BaSO4、AgCl等
氧化物:
CaO、H2O、CuO等
单质:
Na、Cl2、C、O2等
微溶物的处理:
1.溶液状态时(例如澄清石灰水),拆
2.浊液或固态时(例如石灰乳),不拆
3.出现在生成物中,不拆
(3)“删” 删去方程式两边不参加反应的离子,并将方程式化简
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2Na+ + 2Cl-
(4)“查”检查离子方程两边各元素的原子个数和电荷是否相等
SO42- + Ba2+ = BaSO4 ↓
变化思维
守恒思维
书写下列各组物质之间发生反应的离子方程式。
(1)NaOH溶液与稀硫酸: 。
(2)KOH溶液与稀盐酸: 。
(3)BaCl2溶液与Na2SO4溶液: 。
(4)Ba(NO3)2溶液与Na2SO4溶液: 。
(5)碳酸钙与稀盐酸: 。
OH-+H+===H2O
OH-+H+===H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Ba2++===BaSO4↓
Ba2++===BaSO4↓
(1)你认为离子方程式与化学方程式有哪些区别和联系?
联系:离子方程式和化学方程式都可以用来表示化学反应。
区别:离子方程式所表示的不仅仅是一个反应,而是一类反应,并且揭示了这类反应的实质;而化学方程式仅能表示某一个化学反应。
(2)你能再补充一个与OH-+H+===H2O对应的化学反应吗?
NaOH+HNO3===NaNO3+H2O、
【思考与讨论】
离子方程式的意义
离子方程式和化学方程式都可以用来表示化学反应,但离子方程式所表示的不仅仅是一个反应,而是一类反应,并且揭示了这类反应的实质。
H++OH- === H2O
表示一类反应
强酸
强碱
生成H2O
Ba(OH)2+2HNO3===Ba(NO3)2+2H2O
2NaOH+H2SO4 === Na2SO4↓+2H2O
不是,如NaHSO4溶液和NaOH溶液混合反应的离子方程式为H++OH-===H2O,但两者的反应不是酸碱中和反应
H++OH-===H2O仅表示酸碱中和反应吗?请从下列试剂中选择物质,证明你的观点:_______________________________________________
_____________________________________________________。
a.稀H2SO4 b.Cu(OH)2
c.NaHSO4溶液 d.NaOH溶液
e.Ba(OH)2溶液
第2章 元素与物质世界
离子反应
1.通过实验事实认识离子反应,并掌握离子反应发生的条件。
2.掌握离子方程式的书写方法及正误判断。
温故知新
完成下列物质在水溶液中的电离方程式。
(1) HF (2)H2SO (3)H3PO4
(4) NH3·H2O (5)Al(OH)3 (6)Mg(OH)2
(7)NaHCO3 (8) KAl(SO4)2 (9)AgCl
(10)NaHSO4 (11)H2S (12)HClO4
观察 · 思考
探究电解质在水溶液中反应的实质
随稀硫酸的滴入,电导率先变小后变大,同时溶液中出现白色沉淀,溶液颜色由红色变浅至褪色。
结论:稀硫酸与Ba(OH)2溶液反应的实质是溶液中的H+和OH-结合生成难电离的水、Ba2+和结合生成硫酸钡沉淀,溶液中的离子浓度降低。
一、离子反应
(1)概念:在溶液中有离子参加的化学反应。
(2)实质:溶液中某种或某些离子的浓度发生了变化。
请分析Ba(OH)2与稀硫酸反应过程的微观示意图
反应前
反应后
Ba(OH)2
稀硫酸
Ba2+
OH-
OH-
H+
H+
BaSO4
H2O
H2O
①生成难溶物
(3)离子反应发生的条件
单质:Cu、Ag、Fe、Si等 氧化物:Al2O3、SiO2、CuO、MnO2等
酸:H2SiO3(硅酸)
碱:除了强碱 NaOH、KOH、Ba(OH)2 、Ca(OH)2 ;弱碱(NH3 H2O)外其余的碱基本都难溶。
盐:
盐酸盐(Cl-):AgCl(白色沉淀),其余基本都可溶于水
硫酸盐(SO42-):BaSO4(白色沉淀),其余基本都可溶于水
硝酸盐(NO3-):全部可以溶于水
弱酸盐:除阳离子为Na+、K+、NH4+的弱酸盐可以溶于水外,其余的基本都不溶于水。
②生成气体
③生成难电离的物质
(3)离子反应发生的条件
弱酸:CH3COOH、H2CO3、H2S、H2SO3
弱碱:NH3.H2O
水
三条件中,只要具备其中之一即可。
1.判断正误
(1)溶液中有离子参加或生成的化学反应都属于离子反应
(2)只要有H2O生成的反应就是离子反应
(3)发生离子反应时溶液中的离子浓度一定会减小
(4)电解质在溶液中发生了离子反应,则溶液的导电性一定减弱
(5)电解质在溶液中发生离子反应一定要生成沉淀、水或气体
A.M→N段溶液中的离子数目减少
B.N点Ca2+完全转化为CaCO3
C.N→P段溶液中的阴离子、阳离子数目均增加
D.N→P段反应的化学方程式为CaCO3+CO2===Ca(HCO3)2
D
2.CO2通入澄清石灰水中,溶液的导电能力与通入CO2的质量关系如图所示(假设反应过程中溶液的体积不变)。下列叙述不正确的是
联想 · 质疑
将KCl溶液与AgNO3溶液混合,分析KCl溶液与AgNO3溶液反应的实质,如何表示该反应的实质呢?
Ag+与Cl-反应生成了AgCl沉淀,用Ag++Cl-===AgCl↓表示离子反应的实质,即离子反应方程式。
Cl-
Ag+
AgCl
Cl-
Cl-
K+
K+
Ag+
K+
用实际参加反应的离子符号来表示反应的式子
二、离子方程式
Ba2+ + SO42- = BaSO4↓
【思考】氢气还原氧化铜,能否用离子方程式表示?
只能用化学方程式表示: H2 + CuO = Cu + H2O
(1)“写”正确写出反应的化学方程式。
例: 以Na2SO4溶液跟BaCl2溶液反应为例
Na2SO4 + BaCl2 = BaSO4 ↓ + 2NaCl
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2Na+ + 2Cl-
(2)“拆” 把易溶于水且易电离的物质(强酸、强碱、和大部分可溶性盐)拆写成离子形式;难溶的物质、气体和水等仍用化学式表示。
性质思维
分类思维
为什么可以发生反应?
物质类别(酸、碱、盐……)
性质(通性、特性)
HCl、H2SO4、HNO3、HBr、HI、HClO4
可溶性盐
KOH、NaOH、Ba(OH)2、Ca(OH)2
可 拆
六大强酸:
四大强碱:
难溶性盐:
不可拆
弱酸:
弱碱:
H2CO3、H2SO3、CH3COOH等
NH3·H2O、Mg(OH)2、Fe(OH)3等
CaCO3、BaSO4、AgCl等
氧化物:
CaO、H2O、CuO等
单质:
Na、Cl2、C、O2等
微溶物的处理:
1.溶液状态时(例如澄清石灰水),拆
2.浊液或固态时(例如石灰乳),不拆
3.出现在生成物中,不拆
(3)“删” 删去方程式两边不参加反应的离子,并将方程式化简
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2Na+ + 2Cl-
(4)“查”检查离子方程两边各元素的原子个数和电荷是否相等
SO42- + Ba2+ = BaSO4 ↓
变化思维
守恒思维
书写下列各组物质之间发生反应的离子方程式。
(1)NaOH溶液与稀硫酸: 。
(2)KOH溶液与稀盐酸: 。
(3)BaCl2溶液与Na2SO4溶液: 。
(4)Ba(NO3)2溶液与Na2SO4溶液: 。
(5)碳酸钙与稀盐酸: 。
OH-+H+===H2O
OH-+H+===H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Ba2++===BaSO4↓
Ba2++===BaSO4↓
(1)你认为离子方程式与化学方程式有哪些区别和联系?
联系:离子方程式和化学方程式都可以用来表示化学反应。
区别:离子方程式所表示的不仅仅是一个反应,而是一类反应,并且揭示了这类反应的实质;而化学方程式仅能表示某一个化学反应。
(2)你能再补充一个与OH-+H+===H2O对应的化学反应吗?
NaOH+HNO3===NaNO3+H2O、
【思考与讨论】
离子方程式的意义
离子方程式和化学方程式都可以用来表示化学反应,但离子方程式所表示的不仅仅是一个反应,而是一类反应,并且揭示了这类反应的实质。
H++OH- === H2O
表示一类反应
强酸
强碱
生成H2O
Ba(OH)2+2HNO3===Ba(NO3)2+2H2O
2NaOH+H2SO4 === Na2SO4↓+2H2O
不是,如NaHSO4溶液和NaOH溶液混合反应的离子方程式为H++OH-===H2O,但两者的反应不是酸碱中和反应
H++OH-===H2O仅表示酸碱中和反应吗?请从下列试剂中选择物质,证明你的观点:_______________________________________________
_____________________________________________________。
a.稀H2SO4 b.Cu(OH)2
c.NaHSO4溶液 d.NaOH溶液
e.Ba(OH)2溶液
