沉淀溶解平衡 专项练 2025年高考化学一轮复习备考
文档属性
| 名称 | 沉淀溶解平衡 专项练 2025年高考化学一轮复习备考 |

|
|
| 格式 | docx | ||
| 文件大小 | 838.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-11 16:08:17 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
沉淀溶解平衡 专项练
2025年高考化学一轮复习备考
一、单选题(共15题)
1.下列关于沉淀溶解平衡的说法正确的是
A.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
B.沉淀溶解平衡是可逆的
C.在平衡状态时
D.达到沉淀溶解平衡的溶液不一定是饱和溶液
2.石灰水是实验室中常用的一种化学试剂,其在室温下的溶度积Ksp[Ca(OH)2]=4.7×10-6,在不同温度下的溶解度变化如图所示。下列有关饱和澄清石灰水的说法错误的是
A. B.加入少量粉末,溶液变浑浊
C.在空气中敞口久置只析出 D.水浴加热,溶液变浑浊
3.已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10 mol2·L-2,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液为AgCl饱和溶液
D.将固体AgCl加入到KI溶液中,固体由白色变为黄色,AgCl完全转化为AgI,AgCl的溶解度小于AgI的溶解度
4.室温下,将溶液和溶液等体积充分混合,一段时间后过滤,得滤液a和沉淀b。取等量的滤液a于两支试管中,分别滴加相同体积、浓度均为的溶液和溶液,前者出现浑浊,后者溶液仍澄清。下列说法正确的是
A.从实验现象可以得出该温度下:
B.溶液中存在:
C.滤液a中一定存在:
D.滴加溶液后,所得清液中一定存在:
5.一定温度下,饱和溶液中存在,c(Sr2+)和的关系如图所示。下列说法错误的是
A.c点溶液的溶质只有
B.d点为该温度下的过饱和溶液
C.降低温度,曲线沿角平分线向左下方的e点方向移动
D.向b点的溶液中加入固体,溶液由b点向c点方向移动
6.硫化镉是一种难溶于水的黄色颜料,在水溶液中存在如下溶解平衡:,其沉淀溶解平衡曲线如图所示。下列说法错误的是
A.图中温度
B.图中各点对应的的关系为:
C.向m点的溶液中加入少量固体,溶液组成由m沿线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿线向p方向移动
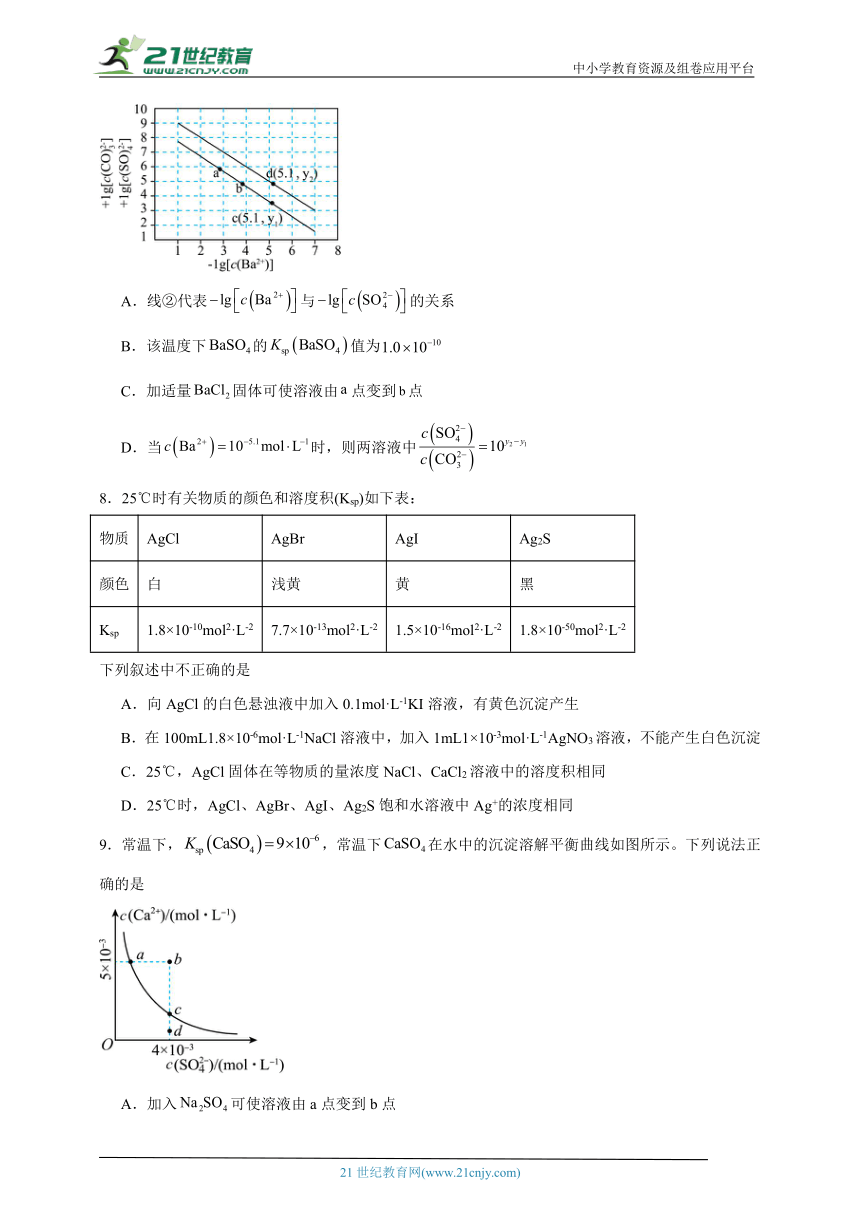
7.已知相同温度下,。某温度下,饱和溶液中、与的关系如图所示。下列说法正确的是
A.线②代表与的关系
B.该温度下的值为
C.加适量固体可使溶液由点变到点
D.当时,则两溶液中
8.25℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 AgCl AgBr AgI Ag2S
颜色 白 浅黄 黄 黑
Ksp 1.8×10-10mol2·L-2 7.7×10-13mol2·L-2 1.5×10-16mol2·L-2 1.8×10-50mol2·L-2
下列叙述中不正确的是
A.向AgCl的白色悬浊液中加入0.1mol·L-1KI溶液,有黄色沉淀产生
B.在100mL1.8×10-6mol·L-1NaCl溶液中,加入1mL1×10-3mol·L-1AgNO3溶液,不能产生白色沉淀
C.25℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D.25℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
9.常温下,,常温下在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.加入可使溶液由a点变到b点
B.b点将有沉淀生成,平衡后溶液中一定等于
C.a点对应的等于c点对应的
D.d点溶液通过蒸发可以变到c点
10.化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:,下列说法正确的是
A.相同温度时,MnS的比CuS的小
B.该反应达到平衡时
C.设该反应的平衡常数为K,则
D.向平衡体系中加入少量固体后,减小,增大
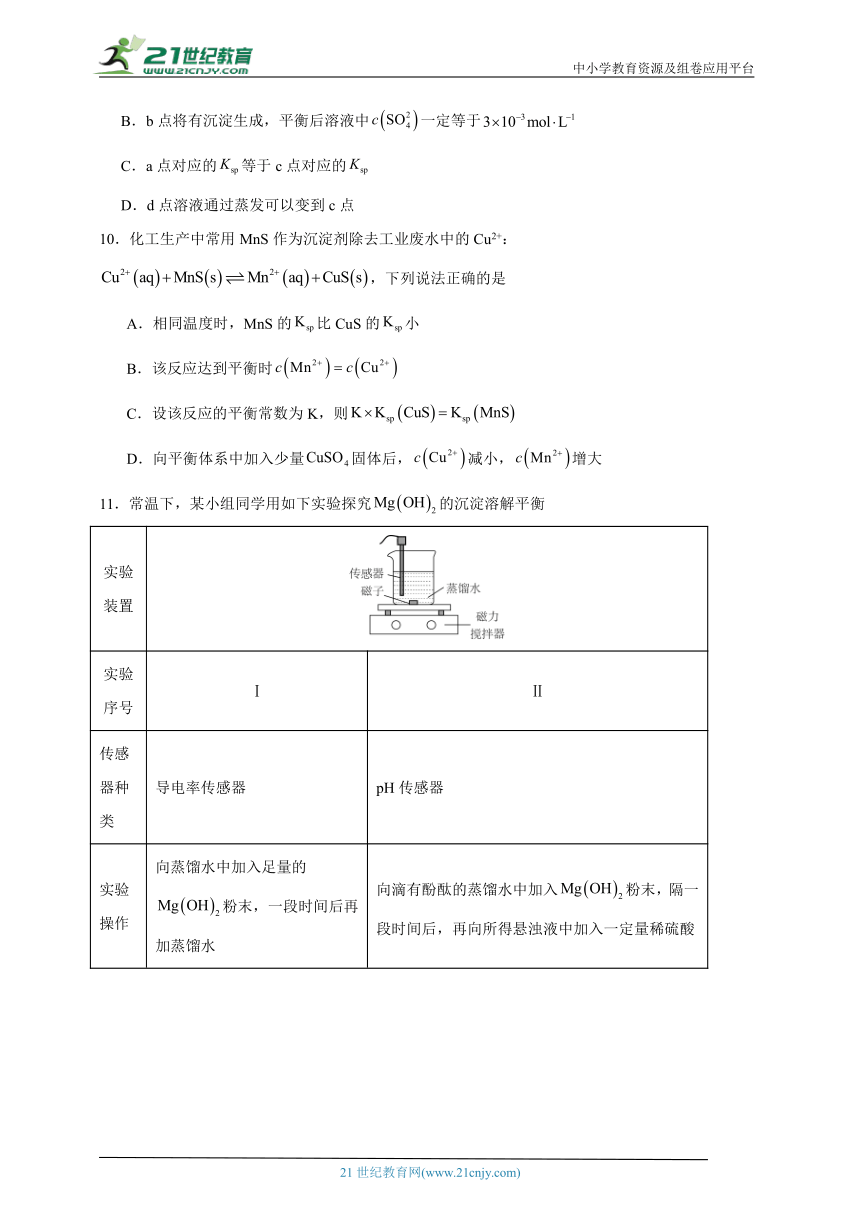
11.常温下,某小组同学用如下实验探究的沉淀溶解平衡
实验装置
实验序号 Ⅰ Ⅱ
传感器种类 导电率传感器 pH传感器
实验操作 向蒸馏水中加入足量的粉末,一段时间后再加蒸馏水 向滴有酚酞的蒸馏水中加入粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸
实验数据
已知:酚酞的变色范围:pH<8.2无色;8.2≤pH≤10.0粉红色;pH>10红色
下列说法不正确的是
A.图1中a点导电率不为0的原因是:
B.图1中d点小于
C.实验Ⅱ中,溶液颜色先变红,后变为无色,最后溶液呈粉红色
D.实验Ⅱ中:加入的物质的量小于加入硫酸的物质的量
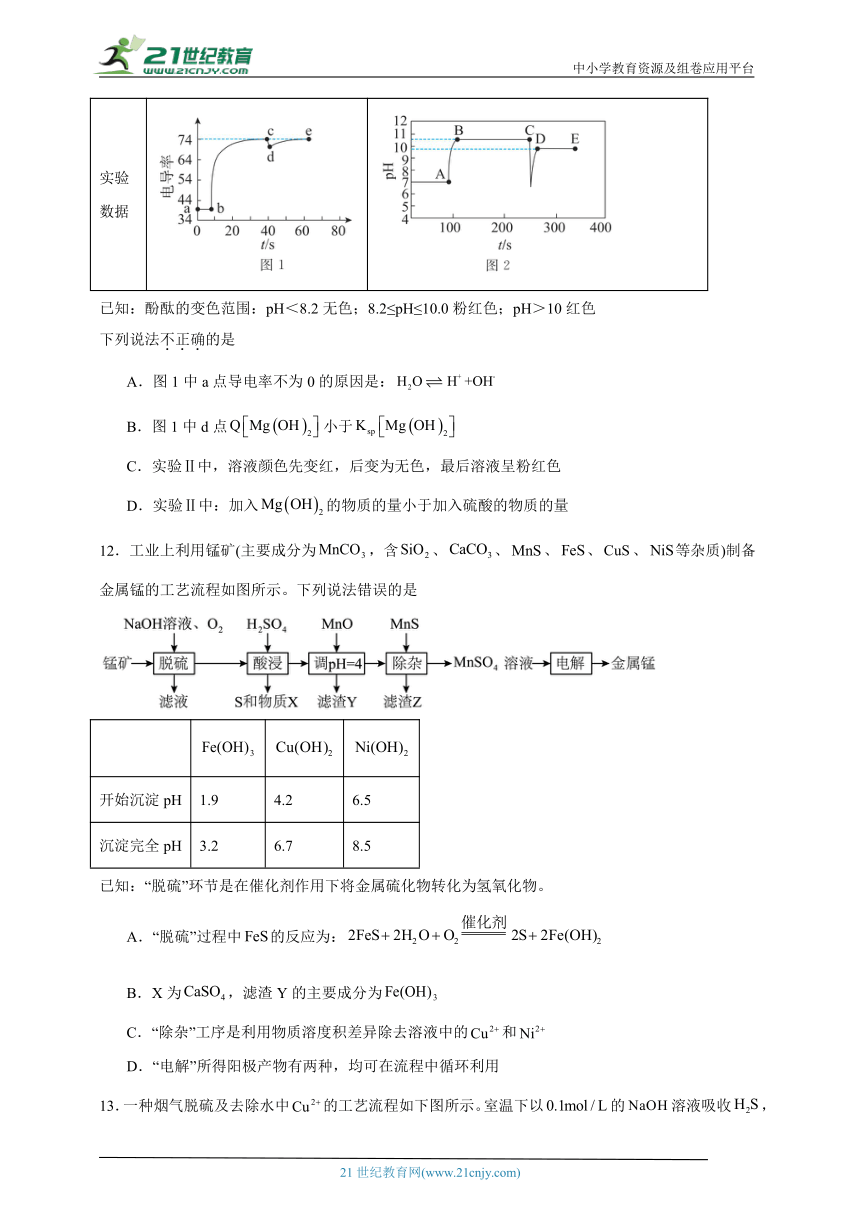
12.工业上利用锰矿(主要成分为,含、、、、、等杂质)制备金属锰的工艺流程如图所示。下列说法错误的是
开始沉淀pH 1.9 4.2 6.5
沉淀完全pH 3.2 6.7 8.5
已知:“脱硫”环节是在催化剂作用下将金属硫化物转化为氢氧化物。
A.“脱硫”过程中的反应为:
B.X为,滤渣Y的主要成分为
C.“除杂”工序是利用物质溶度积差异除去溶液中的和
D.“电解”所得阳极产物有两种,均可在流程中循环利用
13.一种烟气脱硫及去除水中的工艺流程如下图所示。室温下以的溶液吸收,通入所引起的溶液体积变化和水的挥发可忽略,溶液中含硫物种的浓度。室温下,已知,的电离常数分别为、。下列说法正确的是
A.溶液显碱性的原因:,
B.吸收所得的溶液中:
C.恰好转化为的溶液中:
D.“除铜”得到的上层清液中:
14.实验室利用钴渣[含Co(OH)3、Fe(OH)3等]制备Co3O4的工艺流程如图所示:
已知:,
下列说法正确的是
A.“溶解还原”过程中消耗的Na2SO3与生成Co2+的物质的量之比为1∶2
B.“纯化处理”时需将溶液调至强碱性,确保将铁元素完全除去
C.“沉钴”时,不用Na2C2O4溶液是为了防止溶液碱性太强而生成Co(OH)2沉淀
D.在空气中煅烧时,每生成1 mol Co3O4转移2 mol e-
15.已知(白色固体)和(黑色固体)均难溶于水,实验室通常用溶液作指示剂,利用标准溶液测定待测液的浓度。时,的沉淀溶解平衡曲线如图所示[图中,表示或]。
下列说法错误的是
A.溶液中:
B.曲线①表示的是
C.点所示的体系中,可以通过产生沉淀移动到点和点
D.滴定时,若产生黑色沉淀立即读数,导致测得的溶液浓度偏小
二、非选择题(共2题)
16.25℃时,用沉淀、两种金属离子(),所需最低浓度的对数值与的关系如图所示,请回答:
(1)25℃时 。
(2)25℃时向50mL的、浓度均为0.01mol/L的混合溶液中逐滴加入溶液,当溶液加到150mL时开始生成SnS沉淀,则此时溶液中浓度为 mol/L。
17.沉淀的生成及转化在实际生产中有重要作用。部分难溶电解质的溶度积见下表(均为数据,单位省略)。
约为 约为 约为 约为
利用作为沉淀剂除去某工业废水中的部分流程如图所示。
(1)结合化学用语,从平衡移动角度解释可用除去的原因: 。
(2)可使(1)中平衡发生移动所需的最小浓度 。
(3)处理含浓度为的该废水至合格(浓度小于)最少所需的质量是 mg。
(4)已知,。现将浓度为溶液与溶液等体积混合,则生成沉淀所需溶液的最小浓度为 。
参考答案:
1.B
A.沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,如AgCl溶于盐酸,Ag+和Cl-浓度不相等,A错误;
B.沉淀溶解平衡为可逆反应,改变条件时溶解平衡发生移动,B正确;
C.平衡为动态平衡,则在平衡状态时,C错误;
D.达到沉淀溶解平衡的溶液,溶质不能再溶解,则一定是饱和溶液,D错误;
2.C
A.饱和澄清石灰水中有溶解平衡,则,A正确;
B.加入少量粉末,增大,平衡逆向移动,生成,溶液变浑浊,B正确;
C.饱和澄清石灰水在空气中敞口久置,与空气中的CO2反应生成CaCO3沉淀,因此在空气中敞口久置析出和CaCO3,C错误;
D.由溶解度变化图像可知,的溶解度随温度的升高而减小,则加热饱和澄清石灰水,溶液变浑浊,D正确;
3.C
A.向饱和AgCl水溶液中加入盐酸,溶解度减小,但Ksp不变,Ksp只受温度影响,故A错误;
B.两种溶液混合,因为各溶液的浓度未知,所以c(Ag+)不一定等于c(Cl-),故B错误;
C.温度一定,当溶液中c(Ag+)·c(Cl-)=Ksp时,说明此溶液为AgCl饱和溶液,故C正确;
D.沉淀转化时是溶解度较小的沉淀转化为溶解度更小的沉淀,AgCl的溶解度大于AgI的溶解度,故D错误;
4.C
A.滤液a是氯化银饱和溶液,从实验现象可以得出硫化银比硫酸银更难溶,Ksp(Ag2SO4)>Ksp(Ag2S),故A项错误;
B.Na2S溶液中存在电荷守恒:c(Na+)+c(H+)=2c(S2 )+c(HS )+c(OH ),物料守恒:c(Na+)=2c(S2 )+2c(HS )+2c(H2S),两式联立,可得质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),故B项错误;
C.滤液a为氯化银的饱和溶液,所以过滤后所得滤液中一定存在:,故C项正确;
D.过滤后所得清液是AgCl饱和溶液,所以,而滴加硫酸钠溶液并未产生沉淀,说明5.A
A.c点在溶度积曲线上,c(Sr2+)>,而饱和溶液中,(Sr2+)=,所以该溶液中的溶质除含外,还有其它锶的化合物,A错误;
B.d点时,(Sr2+)=,但都大于饱和溶液中的浓度(b点),所以该溶液为该温度下的过饱和溶液,B正确;
C.降低温度,的溶解平衡逆向移动,虽然(Sr2+)=但都比b点时小,所以曲线沿角平分线向左下方的e点方向移动,C正确;
D.向b点的溶液中加入固体,增大溶液中的c(Sr2+),使的溶解平衡逆向移动,达平衡时,c(Sr2+)>,所以溶液由b点向c点方向移动,D正确;
6.B
A.根据题干信息CdS(s)Cd2+(aq)+S2-(aq)可知CdS在水中溶解过程是一个吸热过程,升高温度平衡正向移动,故Ksp=c(Cd2+) c(S2-)增大,从图中可知T1<T2,A正确;
B.图象中m、n、p点均为在温度T1下所测离子浓度,故Ksp(m)=Ksp(n)=Ksp(p),B错误;
C.m点达到沉淀溶解平衡,加入少量Na2S固体,平衡逆向移动,c(S2-)增大,c(Cd2+)减小,溶液组成由m沿mpn线向p方向移动,C正确;
D.平衡CdS(s) Cd2++S2-正向吸热,温度降低时,q点对应饱和溶液溶解度下降,说明溶液中c(S2-)和c(Cd2+)同时减小,q点的饱和溶液的组成由q沿qp线向p方向移动,D正确;
7.B
A.由分析可知,线②代表与的关系,A项错误;
B.当溶液中时,,则,因此,B项正确;
C.向饱和溶液中加入适量固体后,溶液中增大,根据温度不变则不变可知,溶液中将减小,因此溶液对应图像上的点将由a点沿线②向左上方移动,C项错误;
D.由图可知,当溶液中时,两溶液中,D项错误;
8.D
A.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀,溶度积大小AgI<AgBr<AgCl,所以在AgCl悬浊液中加入KI溶液,会有AgI生成,即有黄色沉淀产生,故A正确;
B.加入1mL 1×10-3mol/LAgNO3溶液,c(Cl-)可认为保持不变,即c(Cl-)=1.8×10-6mol/L,而AgNO3溶液相当于稀释100倍,故c(Ag+)=1×10-5mol/L,c(Cl-) c(Ag+)=1.8×10-11<Ksp(AgCl),故没有沉淀生成,故B正确;
C.溶度积只与温度有关,所以25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同,故C正确;
D.由表中数据可知溶度积最大的是AgCl,其溶解度也最大,所以AgCl饱和溶液中c(Ag+)最大,故D错误;
9.C
A.从a点到b点,c(Ca2+)不变,增大,加入,增大硫酸根离子浓度,使CaSO4的溶解平衡逆向移动,c(Ca2+)降低,故A不选;
B.b点溶液中c(Ca2+)>,有沉淀生成,b点溶液中c(Ca2+)≠,所以平衡后溶液中不等于,故B不选;
C.只和温度有关,所以a点对应的等于c点对应的,故C选;
D.d点溶液蒸发,c(Ca2+)和同时增大,不能变到c点,故D不选;
10.C
A.难溶物发生转化时,通常生成物的溶度积比反应物小,所以相同温度时,MnS的比CuS的大,A不正确;
B.该反应达到平衡时>1,则,B不正确;
C.设该反应的平衡常数为K,K=,则,C正确;
D.向平衡体系中加入少量固体后,溶液中增大,平衡正向移动,则增大,D不正确;
11.D
A.H2O是弱电解质,能发生微弱的电离,电离方程式为H2O H++OH-,因此a点电导率不等于0,选项A正确;
B.cd段再加入少量蒸馏水,Mg2+和OH-浓度减小,使得d点小于,选项B正确;
C.由图像可知,AB段pH不断增大,氢氧化镁不断溶解,BC段pH不变,存在平衡,此时溶液pH>10,因此实验②中溶液变红,CD段加入稀硫酸,消耗氢氧化镁,pH减小,稀硫酸消耗完,氢氧化镁继续溶解,pH增大,最终溶液的pH值范围为9D.a点时加入的Mg(OH)2使溶液pH变化到了b点,c点时加入硫酸与氢氧化镁反应,使得溶液的pH变化到了d点,若Mg(OH)2与硫酸恰好完全反应生成硫酸镁,溶液会因Mg2+水解而呈酸性,但d点溶液的pH约为10,显碱性,说明加入的稀硫酸的物质的量小于Mg(OH)2,选项D不正确;
12.A
A.“脱硫”过程中FeS被氧气氧化在碱性条件下生成硫单质与氢氧化铁, ,A错误;
B.脱硫过程二氧化硅与氢氧化钠溶液发生反应转化为硅酸钠,硅酸钠与硫酸反应会生成硅酸,滤渣X中还含有硫酸钙;酸浸时铁转化为硫酸铁,过滤后,在滤液中加MnO调节pH值使铁转化为,B正确;
C.难溶沉淀会向更难溶沉淀转化,“除杂”过程中加入MnS的目的是为了使Ni2+与Cu2+转化为NiS和CuS,利用了物质溶度积差异,C正确;
D.惰性电极“电解”MnSO4,会产生氧气和硫酸,这些所得阳极产物均可循环利用,D正确;
13.B
A.S2-的水解分步进行,以第一步水解为主,离子方程式为:,故A错误;
B.室温下以0.1mol·L-1NaOH溶液吸收H2S,吸收所得,即,此时加入的NaOH的物质的量等于H2S的物质的量,溶质全为NaHS, Ka2=1.1×10-12,HS-的水解平衡常数Kh==1.1×10-7,即HS-的水解程度大于电离程度,,故B正确;
C.NaOH恰好转化为Na2S的溶液中存在守恒,电荷守恒,综合得,故C错误;
D.“除铜”得到的上层清液中若,即,此时还有沉淀生成,不符合题意,故D错误;
14.C
A.溶解还原过程中三价铁离子和三价钴离子均被亚硫酸钠还原为+2价,2Co(OH)3+4H++═2Co2+++5H2O、2Fe(OH)3+4H++═2Fe 2+++5H2O,所以消耗的Na2SO3与生成Co2+的物质的量之比大于1∶2,A错误;
B.“纯化处理”时若将溶液调至强碱性,铁元素完全除去同时钴元素生成Co(OH)2沉淀降低产品的产率,B错误;
C.由于Na2C2O4溶液呈碱性,且碱性强于溶液,故“沉钴”时,若用溶液代替溶液,则可能由于溶液碱性太强而生成Co(OH)2沉淀引入杂质,C正确;
D.空气中煅烧发生反应为,每生成1 mol Co3O4转移4mol e-,D错误;
15.C
A.在Na2S溶液中存在物料守恒,A正确;
B.根据分析可知,曲线②表示的是FeS,曲线①表示的是ZnS,B正确;
C.c点所示的体系中,产生沉淀硫离子浓度也会减小,不会移动到a点和b点,C错误;
D.滴定时,若产生黑色沉淀立即读数,Na2S标准溶液偏小,导致测得的ZnSO4溶液浓度偏小,D正确;
故选C。
16.(1)10-35
(2)2.5×10-13
(1)由图可知,1gc(S2-)=-25时lgc(Cu2+)=-10,Ksp(CuS)=c(S2-) c(Cu2+)=10-25×10-10=10-35,故答案为:10-35;
(2)由图可知,Ksp(SnS)=c(S2-) c(Sn2+)=1×10-25=10-25,向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时c(Sn2+)=mol/L=0.0025mol/L,开始生成SnS沉淀溶液中c(S2-)=mol/L=4×10-23mol/L,此时溶液中c(Cu2+)=mol/L=2.5×10-13mol/L,故答案为:2.5×10-13。
17.(1)由于,加入Pb2+时发生反应:,c(S2-)减小,使平衡右移,FeS溶解,转化为沉淀
(2)10-19
(3)0.88
(4)
(1)由于,加入Pb2+时发生反应:,c(S2-)减小,使平衡右移,FeS溶解,转化为沉淀。
(2)由可知,FeS的饱和溶液中c(S2-)==10-9mol/L,若S2-和Pb2+结合成PbS沉淀,则所需c(Pb2+)最小浓度为=10-19mol/L。
(3)根据沉淀转化反应,含浓度为的该废水至合格,即浓度小于,所需的质量。
(4)将浓度为溶液与溶液等体积混合,则c()=10-4mol/L,根据可知,生成沉淀时等体积混合的溶液中Ba2+的最小浓度为,则所需溶液的最小浓度为=mol/L。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
沉淀溶解平衡 专项练
2025年高考化学一轮复习备考
一、单选题(共15题)
1.下列关于沉淀溶解平衡的说法正确的是
A.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
B.沉淀溶解平衡是可逆的
C.在平衡状态时
D.达到沉淀溶解平衡的溶液不一定是饱和溶液
2.石灰水是实验室中常用的一种化学试剂,其在室温下的溶度积Ksp[Ca(OH)2]=4.7×10-6,在不同温度下的溶解度变化如图所示。下列有关饱和澄清石灰水的说法错误的是
A. B.加入少量粉末,溶液变浑浊
C.在空气中敞口久置只析出 D.水浴加热,溶液变浑浊
3.已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10 mol2·L-2,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液为AgCl饱和溶液
D.将固体AgCl加入到KI溶液中,固体由白色变为黄色,AgCl完全转化为AgI,AgCl的溶解度小于AgI的溶解度
4.室温下,将溶液和溶液等体积充分混合,一段时间后过滤,得滤液a和沉淀b。取等量的滤液a于两支试管中,分别滴加相同体积、浓度均为的溶液和溶液,前者出现浑浊,后者溶液仍澄清。下列说法正确的是
A.从实验现象可以得出该温度下:
B.溶液中存在:
C.滤液a中一定存在:
D.滴加溶液后,所得清液中一定存在:
5.一定温度下,饱和溶液中存在,c(Sr2+)和的关系如图所示。下列说法错误的是
A.c点溶液的溶质只有
B.d点为该温度下的过饱和溶液
C.降低温度,曲线沿角平分线向左下方的e点方向移动
D.向b点的溶液中加入固体,溶液由b点向c点方向移动
6.硫化镉是一种难溶于水的黄色颜料,在水溶液中存在如下溶解平衡:,其沉淀溶解平衡曲线如图所示。下列说法错误的是
A.图中温度
B.图中各点对应的的关系为:
C.向m点的溶液中加入少量固体,溶液组成由m沿线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿线向p方向移动
7.已知相同温度下,。某温度下,饱和溶液中、与的关系如图所示。下列说法正确的是
A.线②代表与的关系
B.该温度下的值为
C.加适量固体可使溶液由点变到点
D.当时,则两溶液中
8.25℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 AgCl AgBr AgI Ag2S
颜色 白 浅黄 黄 黑
Ksp 1.8×10-10mol2·L-2 7.7×10-13mol2·L-2 1.5×10-16mol2·L-2 1.8×10-50mol2·L-2
下列叙述中不正确的是
A.向AgCl的白色悬浊液中加入0.1mol·L-1KI溶液,有黄色沉淀产生
B.在100mL1.8×10-6mol·L-1NaCl溶液中,加入1mL1×10-3mol·L-1AgNO3溶液,不能产生白色沉淀
C.25℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D.25℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
9.常温下,,常温下在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.加入可使溶液由a点变到b点
B.b点将有沉淀生成,平衡后溶液中一定等于
C.a点对应的等于c点对应的
D.d点溶液通过蒸发可以变到c点
10.化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:,下列说法正确的是
A.相同温度时,MnS的比CuS的小
B.该反应达到平衡时
C.设该反应的平衡常数为K,则
D.向平衡体系中加入少量固体后,减小,增大
11.常温下,某小组同学用如下实验探究的沉淀溶解平衡
实验装置
实验序号 Ⅰ Ⅱ
传感器种类 导电率传感器 pH传感器
实验操作 向蒸馏水中加入足量的粉末,一段时间后再加蒸馏水 向滴有酚酞的蒸馏水中加入粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸
实验数据
已知:酚酞的变色范围:pH<8.2无色;8.2≤pH≤10.0粉红色;pH>10红色
下列说法不正确的是
A.图1中a点导电率不为0的原因是:
B.图1中d点小于
C.实验Ⅱ中,溶液颜色先变红,后变为无色,最后溶液呈粉红色
D.实验Ⅱ中:加入的物质的量小于加入硫酸的物质的量
12.工业上利用锰矿(主要成分为,含、、、、、等杂质)制备金属锰的工艺流程如图所示。下列说法错误的是
开始沉淀pH 1.9 4.2 6.5
沉淀完全pH 3.2 6.7 8.5
已知:“脱硫”环节是在催化剂作用下将金属硫化物转化为氢氧化物。
A.“脱硫”过程中的反应为:
B.X为,滤渣Y的主要成分为
C.“除杂”工序是利用物质溶度积差异除去溶液中的和
D.“电解”所得阳极产物有两种,均可在流程中循环利用
13.一种烟气脱硫及去除水中的工艺流程如下图所示。室温下以的溶液吸收,通入所引起的溶液体积变化和水的挥发可忽略,溶液中含硫物种的浓度。室温下,已知,的电离常数分别为、。下列说法正确的是
A.溶液显碱性的原因:,
B.吸收所得的溶液中:
C.恰好转化为的溶液中:
D.“除铜”得到的上层清液中:
14.实验室利用钴渣[含Co(OH)3、Fe(OH)3等]制备Co3O4的工艺流程如图所示:
已知:,
下列说法正确的是
A.“溶解还原”过程中消耗的Na2SO3与生成Co2+的物质的量之比为1∶2
B.“纯化处理”时需将溶液调至强碱性,确保将铁元素完全除去
C.“沉钴”时,不用Na2C2O4溶液是为了防止溶液碱性太强而生成Co(OH)2沉淀
D.在空气中煅烧时,每生成1 mol Co3O4转移2 mol e-
15.已知(白色固体)和(黑色固体)均难溶于水,实验室通常用溶液作指示剂,利用标准溶液测定待测液的浓度。时,的沉淀溶解平衡曲线如图所示[图中,表示或]。
下列说法错误的是
A.溶液中:
B.曲线①表示的是
C.点所示的体系中,可以通过产生沉淀移动到点和点
D.滴定时,若产生黑色沉淀立即读数,导致测得的溶液浓度偏小
二、非选择题(共2题)
16.25℃时,用沉淀、两种金属离子(),所需最低浓度的对数值与的关系如图所示,请回答:
(1)25℃时 。
(2)25℃时向50mL的、浓度均为0.01mol/L的混合溶液中逐滴加入溶液,当溶液加到150mL时开始生成SnS沉淀,则此时溶液中浓度为 mol/L。
17.沉淀的生成及转化在实际生产中有重要作用。部分难溶电解质的溶度积见下表(均为数据,单位省略)。
约为 约为 约为 约为
利用作为沉淀剂除去某工业废水中的部分流程如图所示。
(1)结合化学用语,从平衡移动角度解释可用除去的原因: 。
(2)可使(1)中平衡发生移动所需的最小浓度 。
(3)处理含浓度为的该废水至合格(浓度小于)最少所需的质量是 mg。
(4)已知,。现将浓度为溶液与溶液等体积混合,则生成沉淀所需溶液的最小浓度为 。
参考答案:
1.B
A.沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,如AgCl溶于盐酸,Ag+和Cl-浓度不相等,A错误;
B.沉淀溶解平衡为可逆反应,改变条件时溶解平衡发生移动,B正确;
C.平衡为动态平衡,则在平衡状态时,C错误;
D.达到沉淀溶解平衡的溶液,溶质不能再溶解,则一定是饱和溶液,D错误;
2.C
A.饱和澄清石灰水中有溶解平衡,则,A正确;
B.加入少量粉末,增大,平衡逆向移动,生成,溶液变浑浊,B正确;
C.饱和澄清石灰水在空气中敞口久置,与空气中的CO2反应生成CaCO3沉淀,因此在空气中敞口久置析出和CaCO3,C错误;
D.由溶解度变化图像可知,的溶解度随温度的升高而减小,则加热饱和澄清石灰水,溶液变浑浊,D正确;
3.C
A.向饱和AgCl水溶液中加入盐酸,溶解度减小,但Ksp不变,Ksp只受温度影响,故A错误;
B.两种溶液混合,因为各溶液的浓度未知,所以c(Ag+)不一定等于c(Cl-),故B错误;
C.温度一定,当溶液中c(Ag+)·c(Cl-)=Ksp时,说明此溶液为AgCl饱和溶液,故C正确;
D.沉淀转化时是溶解度较小的沉淀转化为溶解度更小的沉淀,AgCl的溶解度大于AgI的溶解度,故D错误;
4.C
A.滤液a是氯化银饱和溶液,从实验现象可以得出硫化银比硫酸银更难溶,Ksp(Ag2SO4)>Ksp(Ag2S),故A项错误;
B.Na2S溶液中存在电荷守恒:c(Na+)+c(H+)=2c(S2 )+c(HS )+c(OH ),物料守恒:c(Na+)=2c(S2 )+2c(HS )+2c(H2S),两式联立,可得质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),故B项错误;
C.滤液a为氯化银的饱和溶液,所以过滤后所得滤液中一定存在:,故C项正确;
D.过滤后所得清液是AgCl饱和溶液,所以,而滴加硫酸钠溶液并未产生沉淀,说明
A.c点在溶度积曲线上,c(Sr2+)>,而饱和溶液中,(Sr2+)=,所以该溶液中的溶质除含外,还有其它锶的化合物,A错误;
B.d点时,(Sr2+)=,但都大于饱和溶液中的浓度(b点),所以该溶液为该温度下的过饱和溶液,B正确;
C.降低温度,的溶解平衡逆向移动,虽然(Sr2+)=但都比b点时小,所以曲线沿角平分线向左下方的e点方向移动,C正确;
D.向b点的溶液中加入固体,增大溶液中的c(Sr2+),使的溶解平衡逆向移动,达平衡时,c(Sr2+)>,所以溶液由b点向c点方向移动,D正确;
6.B
A.根据题干信息CdS(s)Cd2+(aq)+S2-(aq)可知CdS在水中溶解过程是一个吸热过程,升高温度平衡正向移动,故Ksp=c(Cd2+) c(S2-)增大,从图中可知T1<T2,A正确;
B.图象中m、n、p点均为在温度T1下所测离子浓度,故Ksp(m)=Ksp(n)=Ksp(p),B错误;
C.m点达到沉淀溶解平衡,加入少量Na2S固体,平衡逆向移动,c(S2-)增大,c(Cd2+)减小,溶液组成由m沿mpn线向p方向移动,C正确;
D.平衡CdS(s) Cd2++S2-正向吸热,温度降低时,q点对应饱和溶液溶解度下降,说明溶液中c(S2-)和c(Cd2+)同时减小,q点的饱和溶液的组成由q沿qp线向p方向移动,D正确;
7.B
A.由分析可知,线②代表与的关系,A项错误;
B.当溶液中时,,则,因此,B项正确;
C.向饱和溶液中加入适量固体后,溶液中增大,根据温度不变则不变可知,溶液中将减小,因此溶液对应图像上的点将由a点沿线②向左上方移动,C项错误;
D.由图可知,当溶液中时,两溶液中,D项错误;
8.D
A.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀,溶度积大小AgI<AgBr<AgCl,所以在AgCl悬浊液中加入KI溶液,会有AgI生成,即有黄色沉淀产生,故A正确;
B.加入1mL 1×10-3mol/LAgNO3溶液,c(Cl-)可认为保持不变,即c(Cl-)=1.8×10-6mol/L,而AgNO3溶液相当于稀释100倍,故c(Ag+)=1×10-5mol/L,c(Cl-) c(Ag+)=1.8×10-11<Ksp(AgCl),故没有沉淀生成,故B正确;
C.溶度积只与温度有关,所以25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同,故C正确;
D.由表中数据可知溶度积最大的是AgCl,其溶解度也最大,所以AgCl饱和溶液中c(Ag+)最大,故D错误;
9.C
A.从a点到b点,c(Ca2+)不变,增大,加入,增大硫酸根离子浓度,使CaSO4的溶解平衡逆向移动,c(Ca2+)降低,故A不选;
B.b点溶液中c(Ca2+)>,有沉淀生成,b点溶液中c(Ca2+)≠,所以平衡后溶液中不等于,故B不选;
C.只和温度有关,所以a点对应的等于c点对应的,故C选;
D.d点溶液蒸发,c(Ca2+)和同时增大,不能变到c点,故D不选;
10.C
A.难溶物发生转化时,通常生成物的溶度积比反应物小,所以相同温度时,MnS的比CuS的大,A不正确;
B.该反应达到平衡时>1,则,B不正确;
C.设该反应的平衡常数为K,K=,则,C正确;
D.向平衡体系中加入少量固体后,溶液中增大,平衡正向移动,则增大,D不正确;
11.D
A.H2O是弱电解质,能发生微弱的电离,电离方程式为H2O H++OH-,因此a点电导率不等于0,选项A正确;
B.cd段再加入少量蒸馏水,Mg2+和OH-浓度减小,使得d点小于,选项B正确;
C.由图像可知,AB段pH不断增大,氢氧化镁不断溶解,BC段pH不变,存在平衡,此时溶液pH>10,因此实验②中溶液变红,CD段加入稀硫酸,消耗氢氧化镁,pH减小,稀硫酸消耗完,氢氧化镁继续溶解,pH增大,最终溶液的pH值范围为9
12.A
A.“脱硫”过程中FeS被氧气氧化在碱性条件下生成硫单质与氢氧化铁, ,A错误;
B.脱硫过程二氧化硅与氢氧化钠溶液发生反应转化为硅酸钠,硅酸钠与硫酸反应会生成硅酸,滤渣X中还含有硫酸钙;酸浸时铁转化为硫酸铁,过滤后,在滤液中加MnO调节pH值使铁转化为,B正确;
C.难溶沉淀会向更难溶沉淀转化,“除杂”过程中加入MnS的目的是为了使Ni2+与Cu2+转化为NiS和CuS,利用了物质溶度积差异,C正确;
D.惰性电极“电解”MnSO4,会产生氧气和硫酸,这些所得阳极产物均可循环利用,D正确;
13.B
A.S2-的水解分步进行,以第一步水解为主,离子方程式为:,故A错误;
B.室温下以0.1mol·L-1NaOH溶液吸收H2S,吸收所得,即,此时加入的NaOH的物质的量等于H2S的物质的量,溶质全为NaHS, Ka2=1.1×10-12,HS-的水解平衡常数Kh==1.1×10-7,即HS-的水解程度大于电离程度,,故B正确;
C.NaOH恰好转化为Na2S的溶液中存在守恒,电荷守恒,综合得,故C错误;
D.“除铜”得到的上层清液中若,即,此时还有沉淀生成,不符合题意,故D错误;
14.C
A.溶解还原过程中三价铁离子和三价钴离子均被亚硫酸钠还原为+2价,2Co(OH)3+4H++═2Co2+++5H2O、2Fe(OH)3+4H++═2Fe 2+++5H2O,所以消耗的Na2SO3与生成Co2+的物质的量之比大于1∶2,A错误;
B.“纯化处理”时若将溶液调至强碱性,铁元素完全除去同时钴元素生成Co(OH)2沉淀降低产品的产率,B错误;
C.由于Na2C2O4溶液呈碱性,且碱性强于溶液,故“沉钴”时,若用溶液代替溶液,则可能由于溶液碱性太强而生成Co(OH)2沉淀引入杂质,C正确;
D.空气中煅烧发生反应为,每生成1 mol Co3O4转移4mol e-,D错误;
15.C
A.在Na2S溶液中存在物料守恒,A正确;
B.根据分析可知,曲线②表示的是FeS,曲线①表示的是ZnS,B正确;
C.c点所示的体系中,产生沉淀硫离子浓度也会减小,不会移动到a点和b点,C错误;
D.滴定时,若产生黑色沉淀立即读数,Na2S标准溶液偏小,导致测得的ZnSO4溶液浓度偏小,D正确;
故选C。
16.(1)10-35
(2)2.5×10-13
(1)由图可知,1gc(S2-)=-25时lgc(Cu2+)=-10,Ksp(CuS)=c(S2-) c(Cu2+)=10-25×10-10=10-35,故答案为:10-35;
(2)由图可知,Ksp(SnS)=c(S2-) c(Sn2+)=1×10-25=10-25,向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时c(Sn2+)=mol/L=0.0025mol/L,开始生成SnS沉淀溶液中c(S2-)=mol/L=4×10-23mol/L,此时溶液中c(Cu2+)=mol/L=2.5×10-13mol/L,故答案为:2.5×10-13。
17.(1)由于,加入Pb2+时发生反应:,c(S2-)减小,使平衡右移,FeS溶解,转化为沉淀
(2)10-19
(3)0.88
(4)
(1)由于,加入Pb2+时发生反应:,c(S2-)减小,使平衡右移,FeS溶解,转化为沉淀。
(2)由可知,FeS的饱和溶液中c(S2-)==10-9mol/L,若S2-和Pb2+结合成PbS沉淀,则所需c(Pb2+)最小浓度为=10-19mol/L。
(3)根据沉淀转化反应,含浓度为的该废水至合格,即浓度小于,所需的质量。
(4)将浓度为溶液与溶液等体积混合,则c()=10-4mol/L,根据可知,生成沉淀时等体积混合的溶液中Ba2+的最小浓度为,则所需溶液的最小浓度为=mol/L。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
