硫酸根离子的检验和含硫化合物的转化 专项练 2025年高考化学复习备考
文档属性
| 名称 | 硫酸根离子的检验和含硫化合物的转化 专项练 2025年高考化学复习备考 |  | |
| 格式 | docx | ||
| 文件大小 | 731.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-11 16:08:17 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
硫酸根离子的检验和含硫化合物的转化
专项练 2025年高考化学复习备考
一、单选题(共15题)
1.下列物质的俗称及其对应的化学式不正确的是
A.黄铁矿 FeS2 B.胆矾 CuSO4·5H2O
C.芒硝 Na2SO4·10H2O D.石膏 2CaSO4·H2O
2.在含有和的酸性溶液中,通入足量的后有白色沉淀生成,过滤后,向溶液中滴加溶液,无明显现象,下列说法正确的是
A.白色沉淀是和 B.溶液的酸性减弱
C.白色沉淀是 D.全部被氧化为
3.硫酸盐在我们生活中有很多应用,下列说法不正确的是
A.芒硝的化学式为Na2SO4 10H2O
B.重晶石的主要成分为BaCO3,可作医疗上的“钡餐”
C.“波尔多液”是一种常见的农药,是由胆矾和石灰乳混合制得
D.石膏(CaSO4 2H2O)受热形成熟石膏(2CaSO4 H2O)
4.下列关于溶液中某些常见离子检验的说法正确的是
A.加入溶液,有白色沉淀产生,证明一定含
B.加入溶液,有白色沉淀产生,证明一定含
C.进行焰色试验时,透过蓝色钴玻璃观察到紫色火焰,证明含,不含
D.加入浓溶液加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明一定含
5.为除去括号内的杂质,所选用的试剂或方法均正确的是
A.溶液():通入过量的
B.溶液():通入过量的
C.MgO固体():加入稀盐酸,过滤、洗涤、干燥
D.溶液():加入适量溶液充分反应后过滤
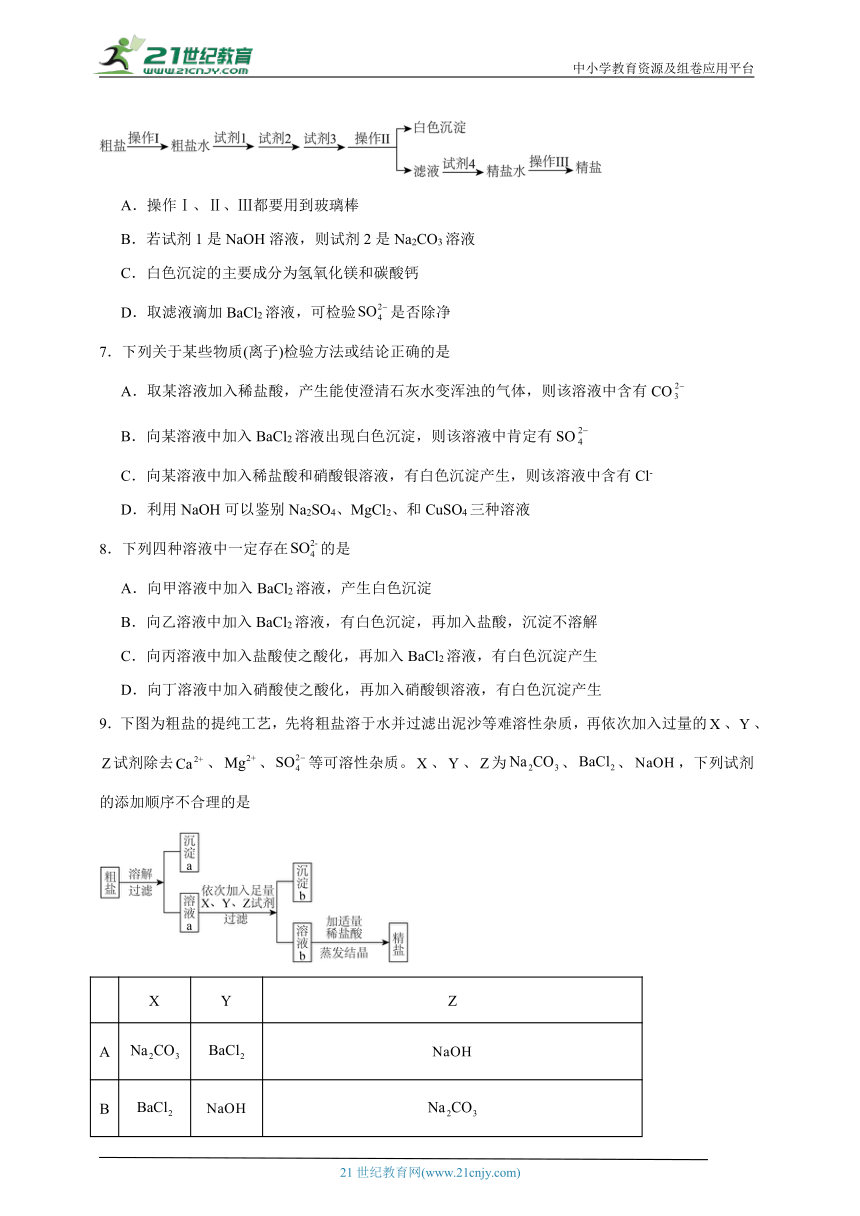
6.粗食盐中常含有钙盐、镁盐、硫酸盐等可溶性杂质,一种制备精盐的工艺流程如下图所示(所加试剂均过量),下列说法正确的是
A.操作Ⅰ、Ⅱ、Ⅲ都要用到玻璃棒
B.若试剂1是NaOH溶液,则试剂2是Na2CO3溶液
C.白色沉淀的主要成分为氢氧化镁和碳酸钙
D.取滤液滴加BaCl2溶液,可检验是否除净
7.下列关于某些物质(离子)检验方法或结论正确的是
A.取某溶液加入稀盐酸,产生能使澄清石灰水变浑浊的气体,则该溶液中含有CO
B.向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO
C.向某溶液中加入稀盐酸和硝酸银溶液,有白色沉淀产生,则该溶液中含有Cl-
D.利用NaOH可以鉴别Na2SO4、MgCl2、和CuSO4三种溶液
8.下列四种溶液中一定存在的是
A.向甲溶液中加入BaCl2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解
C.向丙溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸使之酸化,再加入硝酸钡溶液,有白色沉淀产生
9.下图为粗盐的提纯工艺,先将粗盐溶于水并过滤出泥沙等难溶性杂质,再依次加入过量的、、试剂除去、、等可溶性杂质。、、为、、,下列试剂的添加顺序不合理的是
A
B
C
D
A.A B.B C.C D.D
10.下列操作及现象、结论都正确的是
选项 操作及现象 结论
A. 向某无色溶液中滴加盐酸,产生的气体能使澄清石灰水变浑浊 原无色溶液中一定含有
B. 向某溶液中滴氯化钡溶液和稀硝酸,有白色沉淀 原溶液中一定含有
C. 硫酸氢钾溶液中加入紫色石蕊溶液,溶液变红色 属于酸
D. 硫酸铜溶液和氢氧化钠溶液混合,产生蓝色沉淀 生成了难溶于水的
A.A B.B C.C D.D
11.已知通入溶液无明显现象。某同学利用如图装置探究与溶液反应生成白色沉淀的条件。下列判断正确的是
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将氧化为沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入溶液中,保证气体与充分接触
12.下列实验现象和结论不相符的是
操作及现象 结论
A 向某溶液中加入溶液,产生红褐色沉淀 溶液中没有
B 向盛固体的试管中滴入少量水并用温度计检测,温度计读数降低 溶于水伴有吸热现象
C 氢气可在氯气中安静燃烧,发出苍白色火焰 燃烧不一定需要氧气
D 向某溶液中加入溶液,有白色沉淀生成 溶液中可能含有或
A.A B.B C.C D.D
13.某溶液X中可能含有、、、、、、中的几种,且每种离子的浓度相等。将溶液分两等份,向一份中加入浓的NaOH溶液并加热,产生的气体使湿润的红色石蕊试纸变蓝;向另一份溶液中滴加BaCl2溶液,有白色沉淀生成,再加足量的盐酸,沉淀完全溶解并产生气体。下列对溶液X的分析正确的是
A.可能含有
B.可能含有
C.肯定含有的离子是、、
D.肯定不含的离子只有、、
14.化石燃料燃烧会产生大气污染物及氮氧化物等,用硫酸铈循环法吸收的原理如图,下列说法错误的是
A.废气直接排放到空气中会形成硫酸型酸雨(pH<5.6)
B.反应①的离子方程式:
C.检验某溶液中是否含,可以选用盐酸酸化的溶液
D.理论上每吸收标准状况下消耗
15.物质类别与元素价态是学习元素及其化合物性质的重要认识视角。下图是硫元素的“价类二维图”,下列说法不正确的是
A.a和c反应可以生成b B.d能使品红溶液褪色
C.酸性:e>g D.h暴露空气中可转化为f
二、非选择题(共3题)
16.下图是自然界中不同价态硫元素之间的转化关系图。回答下列问题:
(1)硫元素在自然界中的存在形态有 和化合态,单质硫矿主要存在于 ; 硫单质有多种,正交硫和单斜硫,它们均为硫元素的 。
(2)H2SO4 的电离方程式为 。
(3)硫酸是重要的化工原料,接触法制硫酸主要分三步:
①煅烧黄铁矿(FeS2);_____FeS2 + _____O2_____Fe2O3 + _____SO2 ;
②SO2 的接触氧化; ;
③98.3% H2SO4 吸收:SO3 + H2O=H2SO4。
(4)Fe2O3 可用于焊接钢轨,写出反应的化学方程式 。
(5)写出铜与浓硫酸反应的的化学方程式为 ,若反应产生672mL(标准状况)还原性气体,转移电子的数目为 。
17.海水是人类重要的资源宝库。海水综合开发利用的部分过程如下:
回答下列问题:
(1)从海水中提取粗盐的操作名称为 。
(2)向苦卤中通入是为了提取溴,发生反应的离子方程式为 ,富集溴一般先用热空气和水蒸气吹出单质溴,这是利用单质溴的 (填“挥发性”或“密度比空气大”),再用纯碱溶液吸收溴,主要反应是(未配平),若吸收时,该反应中转移的电子的物质的量为 。
(3)工业生产中沉淀所用沉淀剂为 (填化学式),电解熔融制备Mg的化学方程式为 。
18.价-类二维图是梳理元素及其化合物性质的重要工具,以下是S及其常见化合物的价-类二维图,图示中横坐标表示物质类别,纵坐标表示其中硫元素的化合价
根据图示回答下列问题:
(1)Y的化学式为 。
(2)根据“价-类”二维图预测,下列能与反应且表现还原性的物质是 (填序号)
a. b.酸性溶液 c.溶液 d.
(3)分析的物质类别,写出它和过量溶液反应的离子方程式 。
(4)欲制备,从氧化还原角度分析,合理的是 (填序号)。
a. b. c. d.
参考答案:
1.D
A.黄铁矿的主要成分为二硫化亚铁,化学式为 FeS2,A正确;
B.胆矾的主要成分为五水硫酸铜,化学式为CuSO4·5H2O,B正确;
C.芒硝的主要成分为十水硫酸钠,化学式为Na2SO4·10H2O,C正确;
D.石膏的主要成分二水硫酸钙,化学式CaSO4·2H2O,D错误;
2.C
A.根据以上分析,因为溶液呈酸性,一定不会生成BaSO3沉淀,故A错误;
B.依据2Fe3++SO2+2H2O═2Fe2++SO+4H+可知溶液酸性增强,故B错误;
C.生成的白色沉淀为硫酸钡,故C正确;
D.二氧化硫足量,Fe3+全部被还原为Fe2+ ,故D错误;
3.B
重晶石的主要成分为BaSO4,故B错误;
4.D
A.能使银离子产生白色沉淀的离子有氯离子、硫酸根离子等,所以加入溶液,有白色沉淀产生,原溶液中不一定含,故A错误;
B.亚硫酸根、碳酸根、硫酸根和钡离子反应都能生成白色沉淀,所以加入溶液,有白色沉淀产生,原溶液不一定含,故B错误;
C.进行焰色试验时,透过蓝色钴玻璃观察到紫色火焰,透过蓝色钴玻璃目的是滤去黄色光的干扰,证明有K元素,不一定是,但不能说明没有Na元素,故C错误;
D.与浓溶液加热,生成氨气是铵盐的性质,可据此检验,故D正确;
5.B
A.溶液混有,通入过量的可将硫酸亚铁氧化,但引入杂质氯离子,A错误;
B.溶液中混有,可通入过量的与反应生成,B正确;
C.稀盐酸与和MgO均能反应,C错误;
D.与和均能反应,D错误;
6.A
A.操作Ⅰ为溶解,Ⅱ为过滤,Ⅲ为蒸发结晶均需要玻璃棒,玻璃棒的作用依次为搅拌、引流、搅拌,A正确;
B.Na2CO3溶液需要放在氯化钡之后,B错误;
C.白色沉淀还有碳酸钡、硫酸钡,C错误;
D.滤液中有过量碳酸钠,加入氯化钡产生白色沉淀,D错误;
7.D
A.取某溶液加入稀盐酸,产生能使澄清石灰水变浑浊的气体,该气体可为二氧化硫或二氧化碳,则该溶液中可能含有亚硫酸根离子或碳酸根离子或碳酸氢根离子等,A错误;
B.向某溶液中加入BaCl2溶液出现白色沉淀,溶液中也可能含银离子,沉淀为氯化银沉淀,不一定含硫酸根离子,B错误;
C.向某溶液中加入稀盐酸和硝酸银溶液,有白色沉淀产生,加入稀盐酸的时候引入了氯离子,因此无法确定该溶液中是否有氯离子,C错误;
D.NaOH和Na2SO4溶液不反应、和MgCl2溶液反应生成白色沉淀、和CuSO4溶液反应生成蓝色沉淀,现象不同,可以鉴别,D正确;
8.C
A.向甲溶液中加入BaCl2溶液,产生白色沉淀,甲溶液中不一定含有,可能有Ag+、、的干扰,A不符合题意;
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解,乙溶液中不一定含有,还可能有Ag+的干扰,B不符合题意;
C.向丙溶液中加入盐酸使之酸化,可以排除Ag+、、的干扰,再加入BaCl2溶液,有白色沉淀产生,说明丙溶液中一定含有,C符合题意;
D.由于硝酸能将氧化成,故向丁溶液中加入硝酸使之酸化,再加入硝酸钡溶液,有白色沉淀产生,不能说明丁溶液中一定含有,还可能有的干扰,D不符合题意;
9.A
用Na2CO3、NaOH、BaCl2溶液除去粗盐中的少量泥沙和Ca2+、Mg2+、等杂质离子,为了除杂更彻底,每次所用试剂都必须过量,这样必将带来新的杂质,故碳酸钠不光要除去Ca2+,还要除去过量的Ba2+,故决定了Na2CO3要在BaCl2的后面加,过滤出沉淀后再加入盐酸除去过量的CO和OH-,过量的盐酸可以适当加热就可以除去,试剂的添加顺序不合理的、、,故选A。
10.D
A.二氧化碳、二氧化硫均使石灰水变浑浊,由实验及现象可知,原无色溶液中不一定含有,故A错误;
B.硝酸可氧化亚硫酸根离子,不能检验硫酸根离子,应先后加入盐酸、氯化钡溶液检验硫酸根离子,故B错误;
C.硫酸氢钾溶液电离显酸性,滴加紫色石蕊溶液,溶液变红色,而KHSO4属于酸式盐,故C错误;
D.硫酸铜与氢氧化钠发生复分解反应生成氢氧化铜,产生蓝色沉淀,故D正确;
11.A
A.e、f两管中的试剂可以分别是浓氨水和氢氧化钠固体,产生氨气与SO2反应生成,能与Ba2+结合成BaSO3沉淀,故A正确;
B.乙中产生的不一定为氧化性气体,可以是氨气,得到沉淀为亚硫酸钡,故B错误;
C.玻璃管的作用是连通大气,平衡压力,以便左右两边产生的气体顺利导入,故C错误;
D.如果产生氨气,氨气极易溶于水防止倒吸,所以不能插入BaCl2溶液中,故D错误。
12.A
A.向某溶液中加入溶液,产生红褐色沉淀,说明溶液中甘油Fe3+,不能说明溶液中不定含有Fe2+,故A错误;
B.向盛固体的试管中滴入少量水并用温度计检测,温度计读数降低,说明碳酸氢钠溶液吸热,故B正确;
C.氢气可在氯气中安静燃烧,发出苍白色火焰,说明燃烧不一定需要氧气,故C正确;
D.加入氯化钡也可能生成氯化银沉淀或碳酸钡沉淀等,可能含有硫酸根离子或银离子,故D正确;
13.C
向溶液加入浓的NaOH溶液并加热,产生的气体使湿润的红色石蕊试纸变蓝,说明溶液中含有,则不含OH-;另取一份溶液滴加BaCl2溶液,有白色沉淀生成,再加足量的盐酸,沉淀完全溶解并产生气体,说明含有,不含有,则不含Ca2+;每种离子的浓度相等,则一定含有Na+;综上所述一定含有、、,一定不含有、、、Cl-。
14.C
A.SO2废气直接排放到空气中可发生反应SO2+H2OH2SO3、2H2SO3+O2=2H2SO4,从而形成硫酸型酸雨(pH<5.6),A项正确;
B.根据分析可知,反应①的离子方程式为2Ce4++SO2+2H2O=2Ce3+++4H+,B项正确;
C.检验的方法是:取待测溶液少许于试管中,先加入稀盐酸,无明显现象,再加入BaCl2溶液,若产生白色沉淀则含,所需试剂为稀盐酸、BaCl2溶液,C项错误;
D.标准状况下224mLSO2物质的量为=0.01mol,根据分析,总反应为2SO2+O2+2H2O=2H2SO4,理论上消耗O2物质的量为0.005mol,质量为0.005mol×32g/mol=0.16g,D项正确;
15.B
A.a为H2S和c为SO2发生氧化还原反应反应可以生成b单质S,生成黄色固体单质,故A正确;
B.d为SO3,没有漂白性,不能使品红溶液褪色,故B错误;
C.e为H2SO4,g为H2SO3,硫酸是强酸,亚硫酸是弱酸,则酸性:H2SO4>H2SO3,故C正确;
D.f为硫酸盐,h为亚硫酸盐,亚硫酸盐可通过氧气转化为硫酸盐,故D正确;
16.(1) 游离态 火山口附近 同素异形体
(2)
(3)
(4)
(5) 0.06NA
(1)由图可知,硫元素在自然界中的存在形态有游离态和化合态,单质硫矿主要存在于火山口; 硫单质有多种,正交硫和单斜硫,它们均为硫元素的形成的不同单质,为同素异形体;
(2)硫酸为强酸,可以完全电离,;
(3)①氧气具有氧化性,煅烧黄铁矿(FeS2)中,铁被氧化为氧化铁,铁化合价由+2变为+3,硫被氧化为二氧化硫,硫元素化合价由-1变为+4,氧元素化合价由0变为-2,结合电子守恒可知,反应为;
②SO2的接触氧化为二氧化硫在催化剂作用下被氧气氧化为三氧化硫,;
(4)铝和氧化铁高温生成铁和氧化铝,反应为;
(5)铜与浓硫酸加热反应生成硫酸铜和二氧化硫、水,化学方程式为,若反应产生672mL(标准状况)还原性气体,则生成二氧化硫为0.03mol,转移电子0.06mol,电子的数目为0.06NA。
17.(1)蒸发(结晶)
(2) 挥发性 5 mol
(3) (或CaO)
(1)海水中提取粗盐的操作名称蒸发(结晶)。
(2)苦卤中通入是置换溴离子使之成为单质溴,反应的离子方程式为。然后利用单质溴的沸点低、易挥发性,用热空气和水蒸气吹出单质溴。纯减溶液吸收单质溴,溴元素化合价0价变为-1价和+5价,反应中单质溴起氧化剂、还原剂作用,根据得失电子守恒,配平反应方程式,根据反应方程式可知,吸收时,5mol化合价0价溴变为-1价,1mol化合价0价溴变为+5价,那么该反应中转移的电子的物质的量为5 mol。
(3)工业生产中常选用生石灰或石灰水作沉淀剂,沉淀所用沉淀剂为(或CaO),电解熔融制备Mg的化学方程式为:。
18.(1)H2SO3
(2)b
(3)SO2+2OH-=H2O+SO
(4)b
(1)根据图像,Y中硫元素的化合价为+4价,属于酸,推知其为亚硫酸,化学式为H2SO3。
(2)a.和反应生成H2SO3,没有发生氧化还原反应,不能体现SO2的还原性,故a不选;
b.酸性溶液具有强氧化性,与SO2反应且SO2表现还原性,故b选;
c.溶液和反应生成亚硫酸氢钠,没有发生氧化还原反应,故c不选;
d.和反应生成CaSO3,没有发生氧化还原反应,不能体现SO2的还原性,故d不选;
故选b。
(3)SO2为酸性氧化物,可以和NaOH溶液反应,若氢氧化钠过量则生成正盐,反应的离子方程式为SO2+2OH-=H2O+SO。
(4)中S的平均化合价为+2价,制备反应物做氧化剂的S的化合价要高于+2价,作还原剂的S的化合价要低于+2价,同种元素发生氧化还原反应化合价向中间靠拢,但不能交叉,故符合题意的为,故答案为b。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
硫酸根离子的检验和含硫化合物的转化
专项练 2025年高考化学复习备考
一、单选题(共15题)
1.下列物质的俗称及其对应的化学式不正确的是
A.黄铁矿 FeS2 B.胆矾 CuSO4·5H2O
C.芒硝 Na2SO4·10H2O D.石膏 2CaSO4·H2O
2.在含有和的酸性溶液中,通入足量的后有白色沉淀生成,过滤后,向溶液中滴加溶液,无明显现象,下列说法正确的是
A.白色沉淀是和 B.溶液的酸性减弱
C.白色沉淀是 D.全部被氧化为
3.硫酸盐在我们生活中有很多应用,下列说法不正确的是
A.芒硝的化学式为Na2SO4 10H2O
B.重晶石的主要成分为BaCO3,可作医疗上的“钡餐”
C.“波尔多液”是一种常见的农药,是由胆矾和石灰乳混合制得
D.石膏(CaSO4 2H2O)受热形成熟石膏(2CaSO4 H2O)
4.下列关于溶液中某些常见离子检验的说法正确的是
A.加入溶液,有白色沉淀产生,证明一定含
B.加入溶液,有白色沉淀产生,证明一定含
C.进行焰色试验时,透过蓝色钴玻璃观察到紫色火焰,证明含,不含
D.加入浓溶液加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明一定含
5.为除去括号内的杂质,所选用的试剂或方法均正确的是
A.溶液():通入过量的
B.溶液():通入过量的
C.MgO固体():加入稀盐酸,过滤、洗涤、干燥
D.溶液():加入适量溶液充分反应后过滤
6.粗食盐中常含有钙盐、镁盐、硫酸盐等可溶性杂质,一种制备精盐的工艺流程如下图所示(所加试剂均过量),下列说法正确的是
A.操作Ⅰ、Ⅱ、Ⅲ都要用到玻璃棒
B.若试剂1是NaOH溶液,则试剂2是Na2CO3溶液
C.白色沉淀的主要成分为氢氧化镁和碳酸钙
D.取滤液滴加BaCl2溶液,可检验是否除净
7.下列关于某些物质(离子)检验方法或结论正确的是
A.取某溶液加入稀盐酸,产生能使澄清石灰水变浑浊的气体,则该溶液中含有CO
B.向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO
C.向某溶液中加入稀盐酸和硝酸银溶液,有白色沉淀产生,则该溶液中含有Cl-
D.利用NaOH可以鉴别Na2SO4、MgCl2、和CuSO4三种溶液
8.下列四种溶液中一定存在的是
A.向甲溶液中加入BaCl2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解
C.向丙溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸使之酸化,再加入硝酸钡溶液,有白色沉淀产生
9.下图为粗盐的提纯工艺,先将粗盐溶于水并过滤出泥沙等难溶性杂质,再依次加入过量的、、试剂除去、、等可溶性杂质。、、为、、,下列试剂的添加顺序不合理的是
A
B
C
D
A.A B.B C.C D.D
10.下列操作及现象、结论都正确的是
选项 操作及现象 结论
A. 向某无色溶液中滴加盐酸,产生的气体能使澄清石灰水变浑浊 原无色溶液中一定含有
B. 向某溶液中滴氯化钡溶液和稀硝酸,有白色沉淀 原溶液中一定含有
C. 硫酸氢钾溶液中加入紫色石蕊溶液,溶液变红色 属于酸
D. 硫酸铜溶液和氢氧化钠溶液混合,产生蓝色沉淀 生成了难溶于水的
A.A B.B C.C D.D
11.已知通入溶液无明显现象。某同学利用如图装置探究与溶液反应生成白色沉淀的条件。下列判断正确的是
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将氧化为沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入溶液中,保证气体与充分接触
12.下列实验现象和结论不相符的是
操作及现象 结论
A 向某溶液中加入溶液,产生红褐色沉淀 溶液中没有
B 向盛固体的试管中滴入少量水并用温度计检测,温度计读数降低 溶于水伴有吸热现象
C 氢气可在氯气中安静燃烧,发出苍白色火焰 燃烧不一定需要氧气
D 向某溶液中加入溶液,有白色沉淀生成 溶液中可能含有或
A.A B.B C.C D.D
13.某溶液X中可能含有、、、、、、中的几种,且每种离子的浓度相等。将溶液分两等份,向一份中加入浓的NaOH溶液并加热,产生的气体使湿润的红色石蕊试纸变蓝;向另一份溶液中滴加BaCl2溶液,有白色沉淀生成,再加足量的盐酸,沉淀完全溶解并产生气体。下列对溶液X的分析正确的是
A.可能含有
B.可能含有
C.肯定含有的离子是、、
D.肯定不含的离子只有、、
14.化石燃料燃烧会产生大气污染物及氮氧化物等,用硫酸铈循环法吸收的原理如图,下列说法错误的是
A.废气直接排放到空气中会形成硫酸型酸雨(pH<5.6)
B.反应①的离子方程式:
C.检验某溶液中是否含,可以选用盐酸酸化的溶液
D.理论上每吸收标准状况下消耗
15.物质类别与元素价态是学习元素及其化合物性质的重要认识视角。下图是硫元素的“价类二维图”,下列说法不正确的是
A.a和c反应可以生成b B.d能使品红溶液褪色
C.酸性:e>g D.h暴露空气中可转化为f
二、非选择题(共3题)
16.下图是自然界中不同价态硫元素之间的转化关系图。回答下列问题:
(1)硫元素在自然界中的存在形态有 和化合态,单质硫矿主要存在于 ; 硫单质有多种,正交硫和单斜硫,它们均为硫元素的 。
(2)H2SO4 的电离方程式为 。
(3)硫酸是重要的化工原料,接触法制硫酸主要分三步:
①煅烧黄铁矿(FeS2);_____FeS2 + _____O2_____Fe2O3 + _____SO2 ;
②SO2 的接触氧化; ;
③98.3% H2SO4 吸收:SO3 + H2O=H2SO4。
(4)Fe2O3 可用于焊接钢轨,写出反应的化学方程式 。
(5)写出铜与浓硫酸反应的的化学方程式为 ,若反应产生672mL(标准状况)还原性气体,转移电子的数目为 。
17.海水是人类重要的资源宝库。海水综合开发利用的部分过程如下:
回答下列问题:
(1)从海水中提取粗盐的操作名称为 。
(2)向苦卤中通入是为了提取溴,发生反应的离子方程式为 ,富集溴一般先用热空气和水蒸气吹出单质溴,这是利用单质溴的 (填“挥发性”或“密度比空气大”),再用纯碱溶液吸收溴,主要反应是(未配平),若吸收时,该反应中转移的电子的物质的量为 。
(3)工业生产中沉淀所用沉淀剂为 (填化学式),电解熔融制备Mg的化学方程式为 。
18.价-类二维图是梳理元素及其化合物性质的重要工具,以下是S及其常见化合物的价-类二维图,图示中横坐标表示物质类别,纵坐标表示其中硫元素的化合价
根据图示回答下列问题:
(1)Y的化学式为 。
(2)根据“价-类”二维图预测,下列能与反应且表现还原性的物质是 (填序号)
a. b.酸性溶液 c.溶液 d.
(3)分析的物质类别,写出它和过量溶液反应的离子方程式 。
(4)欲制备,从氧化还原角度分析,合理的是 (填序号)。
a. b. c. d.
参考答案:
1.D
A.黄铁矿的主要成分为二硫化亚铁,化学式为 FeS2,A正确;
B.胆矾的主要成分为五水硫酸铜,化学式为CuSO4·5H2O,B正确;
C.芒硝的主要成分为十水硫酸钠,化学式为Na2SO4·10H2O,C正确;
D.石膏的主要成分二水硫酸钙,化学式CaSO4·2H2O,D错误;
2.C
A.根据以上分析,因为溶液呈酸性,一定不会生成BaSO3沉淀,故A错误;
B.依据2Fe3++SO2+2H2O═2Fe2++SO+4H+可知溶液酸性增强,故B错误;
C.生成的白色沉淀为硫酸钡,故C正确;
D.二氧化硫足量,Fe3+全部被还原为Fe2+ ,故D错误;
3.B
重晶石的主要成分为BaSO4,故B错误;
4.D
A.能使银离子产生白色沉淀的离子有氯离子、硫酸根离子等,所以加入溶液,有白色沉淀产生,原溶液中不一定含,故A错误;
B.亚硫酸根、碳酸根、硫酸根和钡离子反应都能生成白色沉淀,所以加入溶液,有白色沉淀产生,原溶液不一定含,故B错误;
C.进行焰色试验时,透过蓝色钴玻璃观察到紫色火焰,透过蓝色钴玻璃目的是滤去黄色光的干扰,证明有K元素,不一定是,但不能说明没有Na元素,故C错误;
D.与浓溶液加热,生成氨气是铵盐的性质,可据此检验,故D正确;
5.B
A.溶液混有,通入过量的可将硫酸亚铁氧化,但引入杂质氯离子,A错误;
B.溶液中混有,可通入过量的与反应生成,B正确;
C.稀盐酸与和MgO均能反应,C错误;
D.与和均能反应,D错误;
6.A
A.操作Ⅰ为溶解,Ⅱ为过滤,Ⅲ为蒸发结晶均需要玻璃棒,玻璃棒的作用依次为搅拌、引流、搅拌,A正确;
B.Na2CO3溶液需要放在氯化钡之后,B错误;
C.白色沉淀还有碳酸钡、硫酸钡,C错误;
D.滤液中有过量碳酸钠,加入氯化钡产生白色沉淀,D错误;
7.D
A.取某溶液加入稀盐酸,产生能使澄清石灰水变浑浊的气体,该气体可为二氧化硫或二氧化碳,则该溶液中可能含有亚硫酸根离子或碳酸根离子或碳酸氢根离子等,A错误;
B.向某溶液中加入BaCl2溶液出现白色沉淀,溶液中也可能含银离子,沉淀为氯化银沉淀,不一定含硫酸根离子,B错误;
C.向某溶液中加入稀盐酸和硝酸银溶液,有白色沉淀产生,加入稀盐酸的时候引入了氯离子,因此无法确定该溶液中是否有氯离子,C错误;
D.NaOH和Na2SO4溶液不反应、和MgCl2溶液反应生成白色沉淀、和CuSO4溶液反应生成蓝色沉淀,现象不同,可以鉴别,D正确;
8.C
A.向甲溶液中加入BaCl2溶液,产生白色沉淀,甲溶液中不一定含有,可能有Ag+、、的干扰,A不符合题意;
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,沉淀不溶解,乙溶液中不一定含有,还可能有Ag+的干扰,B不符合题意;
C.向丙溶液中加入盐酸使之酸化,可以排除Ag+、、的干扰,再加入BaCl2溶液,有白色沉淀产生,说明丙溶液中一定含有,C符合题意;
D.由于硝酸能将氧化成,故向丁溶液中加入硝酸使之酸化,再加入硝酸钡溶液,有白色沉淀产生,不能说明丁溶液中一定含有,还可能有的干扰,D不符合题意;
9.A
用Na2CO3、NaOH、BaCl2溶液除去粗盐中的少量泥沙和Ca2+、Mg2+、等杂质离子,为了除杂更彻底,每次所用试剂都必须过量,这样必将带来新的杂质,故碳酸钠不光要除去Ca2+,还要除去过量的Ba2+,故决定了Na2CO3要在BaCl2的后面加,过滤出沉淀后再加入盐酸除去过量的CO和OH-,过量的盐酸可以适当加热就可以除去,试剂的添加顺序不合理的、、,故选A。
10.D
A.二氧化碳、二氧化硫均使石灰水变浑浊,由实验及现象可知,原无色溶液中不一定含有,故A错误;
B.硝酸可氧化亚硫酸根离子,不能检验硫酸根离子,应先后加入盐酸、氯化钡溶液检验硫酸根离子,故B错误;
C.硫酸氢钾溶液电离显酸性,滴加紫色石蕊溶液,溶液变红色,而KHSO4属于酸式盐,故C错误;
D.硫酸铜与氢氧化钠发生复分解反应生成氢氧化铜,产生蓝色沉淀,故D正确;
11.A
A.e、f两管中的试剂可以分别是浓氨水和氢氧化钠固体,产生氨气与SO2反应生成,能与Ba2+结合成BaSO3沉淀,故A正确;
B.乙中产生的不一定为氧化性气体,可以是氨气,得到沉淀为亚硫酸钡,故B错误;
C.玻璃管的作用是连通大气,平衡压力,以便左右两边产生的气体顺利导入,故C错误;
D.如果产生氨气,氨气极易溶于水防止倒吸,所以不能插入BaCl2溶液中,故D错误。
12.A
A.向某溶液中加入溶液,产生红褐色沉淀,说明溶液中甘油Fe3+,不能说明溶液中不定含有Fe2+,故A错误;
B.向盛固体的试管中滴入少量水并用温度计检测,温度计读数降低,说明碳酸氢钠溶液吸热,故B正确;
C.氢气可在氯气中安静燃烧,发出苍白色火焰,说明燃烧不一定需要氧气,故C正确;
D.加入氯化钡也可能生成氯化银沉淀或碳酸钡沉淀等,可能含有硫酸根离子或银离子,故D正确;
13.C
向溶液加入浓的NaOH溶液并加热,产生的气体使湿润的红色石蕊试纸变蓝,说明溶液中含有,则不含OH-;另取一份溶液滴加BaCl2溶液,有白色沉淀生成,再加足量的盐酸,沉淀完全溶解并产生气体,说明含有,不含有,则不含Ca2+;每种离子的浓度相等,则一定含有Na+;综上所述一定含有、、,一定不含有、、、Cl-。
14.C
A.SO2废气直接排放到空气中可发生反应SO2+H2OH2SO3、2H2SO3+O2=2H2SO4,从而形成硫酸型酸雨(pH<5.6),A项正确;
B.根据分析可知,反应①的离子方程式为2Ce4++SO2+2H2O=2Ce3+++4H+,B项正确;
C.检验的方法是:取待测溶液少许于试管中,先加入稀盐酸,无明显现象,再加入BaCl2溶液,若产生白色沉淀则含,所需试剂为稀盐酸、BaCl2溶液,C项错误;
D.标准状况下224mLSO2物质的量为=0.01mol,根据分析,总反应为2SO2+O2+2H2O=2H2SO4,理论上消耗O2物质的量为0.005mol,质量为0.005mol×32g/mol=0.16g,D项正确;
15.B
A.a为H2S和c为SO2发生氧化还原反应反应可以生成b单质S,生成黄色固体单质,故A正确;
B.d为SO3,没有漂白性,不能使品红溶液褪色,故B错误;
C.e为H2SO4,g为H2SO3,硫酸是强酸,亚硫酸是弱酸,则酸性:H2SO4>H2SO3,故C正确;
D.f为硫酸盐,h为亚硫酸盐,亚硫酸盐可通过氧气转化为硫酸盐,故D正确;
16.(1) 游离态 火山口附近 同素异形体
(2)
(3)
(4)
(5) 0.06NA
(1)由图可知,硫元素在自然界中的存在形态有游离态和化合态,单质硫矿主要存在于火山口; 硫单质有多种,正交硫和单斜硫,它们均为硫元素的形成的不同单质,为同素异形体;
(2)硫酸为强酸,可以完全电离,;
(3)①氧气具有氧化性,煅烧黄铁矿(FeS2)中,铁被氧化为氧化铁,铁化合价由+2变为+3,硫被氧化为二氧化硫,硫元素化合价由-1变为+4,氧元素化合价由0变为-2,结合电子守恒可知,反应为;
②SO2的接触氧化为二氧化硫在催化剂作用下被氧气氧化为三氧化硫,;
(4)铝和氧化铁高温生成铁和氧化铝,反应为;
(5)铜与浓硫酸加热反应生成硫酸铜和二氧化硫、水,化学方程式为,若反应产生672mL(标准状况)还原性气体,则生成二氧化硫为0.03mol,转移电子0.06mol,电子的数目为0.06NA。
17.(1)蒸发(结晶)
(2) 挥发性 5 mol
(3) (或CaO)
(1)海水中提取粗盐的操作名称蒸发(结晶)。
(2)苦卤中通入是置换溴离子使之成为单质溴,反应的离子方程式为。然后利用单质溴的沸点低、易挥发性,用热空气和水蒸气吹出单质溴。纯减溶液吸收单质溴,溴元素化合价0价变为-1价和+5价,反应中单质溴起氧化剂、还原剂作用,根据得失电子守恒,配平反应方程式,根据反应方程式可知,吸收时,5mol化合价0价溴变为-1价,1mol化合价0价溴变为+5价,那么该反应中转移的电子的物质的量为5 mol。
(3)工业生产中常选用生石灰或石灰水作沉淀剂,沉淀所用沉淀剂为(或CaO),电解熔融制备Mg的化学方程式为:。
18.(1)H2SO3
(2)b
(3)SO2+2OH-=H2O+SO
(4)b
(1)根据图像,Y中硫元素的化合价为+4价,属于酸,推知其为亚硫酸,化学式为H2SO3。
(2)a.和反应生成H2SO3,没有发生氧化还原反应,不能体现SO2的还原性,故a不选;
b.酸性溶液具有强氧化性,与SO2反应且SO2表现还原性,故b选;
c.溶液和反应生成亚硫酸氢钠,没有发生氧化还原反应,故c不选;
d.和反应生成CaSO3,没有发生氧化还原反应,不能体现SO2的还原性,故d不选;
故选b。
(3)SO2为酸性氧化物,可以和NaOH溶液反应,若氢氧化钠过量则生成正盐,反应的离子方程式为SO2+2OH-=H2O+SO。
(4)中S的平均化合价为+2价,制备反应物做氧化剂的S的化合价要高于+2价,作还原剂的S的化合价要低于+2价,同种元素发生氧化还原反应化合价向中间靠拢,但不能交叉,故符合题意的为,故答案为b。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
