【课时基础练】2.3 氧气的制备(含答案) 2024-2025学年化学沪教版九年级上册
文档属性
| 名称 | 【课时基础练】2.3 氧气的制备(含答案) 2024-2025学年化学沪教版九年级上册 |
|
|
| 格式 | docx | ||
| 文件大小 | 241.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-11 00:00:00 | ||
图片预览



文档简介
2.3.1 氧气的工业制法 用高锰酸钾制取氧气
工业生产、医疗卫生、科学研究等行业往往需要比较纯净的氧气。那么,你知道工业上是如何获得大量氧气的呢 实验室又是如何制取氧气的呢
【基础堂清】
1 工业上利用分离液态空气法制氧气,利用了液态氮与液态氧的不同之处是 ( )
A.熔点 B.沸点 C.密度 D.气味
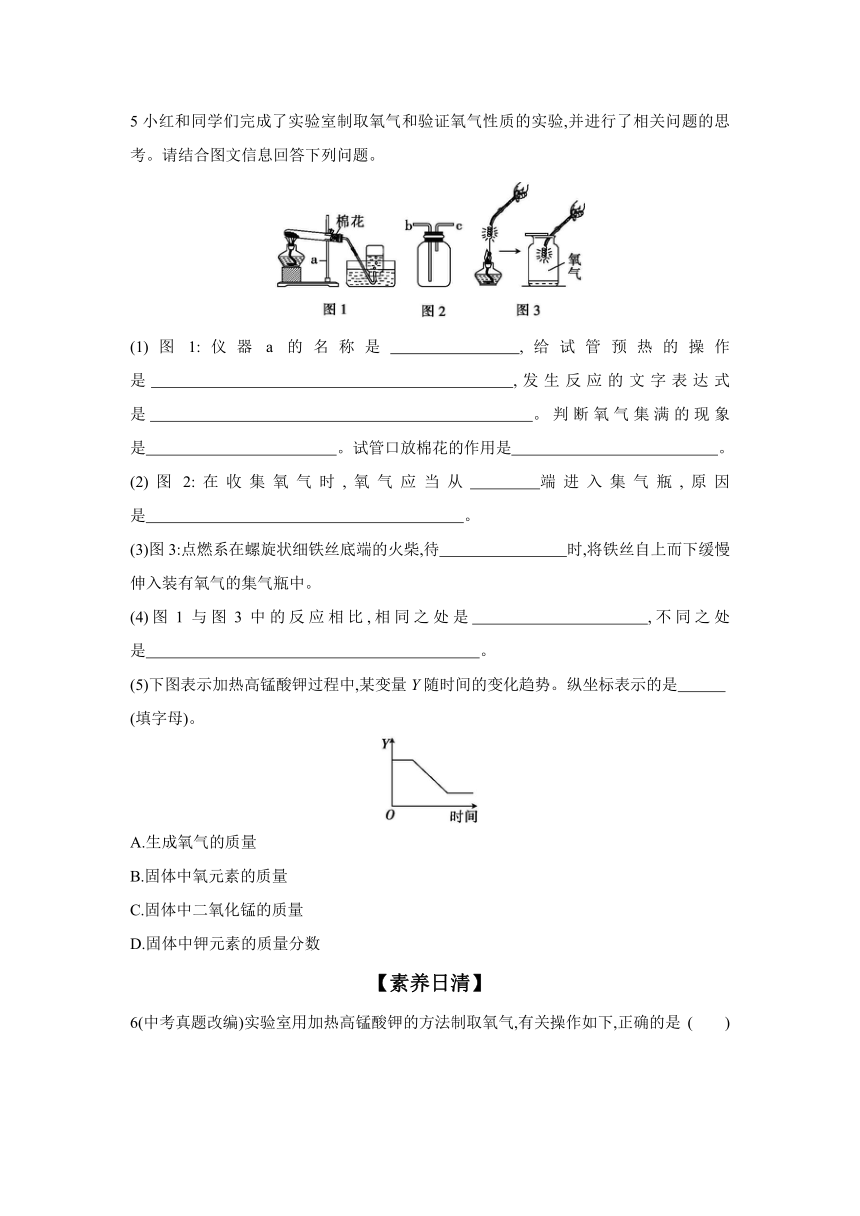
2下列加热高锰酸钾制取氧气的部分操作示意图中,正确的是 ( )
A.检查气密性 B.加热后立即收集
C.收满后移出集气瓶 D.结束时停止加热
3小明采用排水法收集氧气,若收集的氧气不纯,可能的原因是 ( )
A.停止加热后,先熄灭酒精灯再移出导管
B.检查装置气密性后再装试剂
C.加热时试管口没有略向下倾斜
D.导管口刚有气泡冒出就开始收集
4以下是实验室用高锰酸钾制取氧气并用排水法收集氧气的主要操作步骤:①将试管固定在铁架台上;②检查装置的气密性;③点燃酒精灯,先使试管受热均匀,然后对准试管中盛放试剂的部位加热;④将试剂装入试管,用带导管的单孔橡胶塞塞紧试管;⑤收集完毕,将导管从水槽中取出;⑥用排水法收集氧气;⑦熄灭酒精灯。请回答下列问题。
(1)该实验正确的操作顺序是 (填序号);固定试管时,试管口要略向下倾斜,防止 。
(2)可以用排水法收集氧气,体现了氧气 的性质。若想获得比较干燥的氧气,应该选用 法收集。
(3)验证一瓶无色气体是氧气的简单方法是 。
5小红和同学们完成了实验室制取氧气和验证氧气性质的实验,并进行了相关问题的思考。请结合图文信息回答下列问题。
(1)图1:仪器a的名称是 ,给试管预热的操作是 ,发生反应的文字表达式是 。判断氧气集满的现象是 。试管口放棉花的作用是 。
(2)图2:在收集氧气时,氧气应当从 端进入集气瓶,原因是 。
(3)图3:点燃系在螺旋状细铁丝底端的火柴,待 时,将铁丝自上而下缓慢伸入装有氧气的集气瓶中。
(4)图1与图3中的反应相比,相同之处是 ,不同之处是 。
(5)下图表示加热高锰酸钾过程中,某变量Y随时间的变化趋势。纵坐标表示的是
(填字母)。
A.生成氧气的质量
B.固体中氧元素的质量
C.固体中二氧化锰的质量
D.固体中钾元素的质量分数
【素养日清】
6(中考真题改编)实验室用加热高锰酸钾的方法制取氧气,有关操作如下,正确的是 ( )
A.试管口应该向上倾斜
B.铁夹夹在试管的中部
C.先移出导管再熄灭酒精灯
D.气泡均匀放出时开始收集
7氧气是一种化学性质比较活泼的气体,某实验小组同学通过右图装置制取氧气并验证氧气的性质。请结合图文信息回答下列问题。
(1)连接好装置后,下一步的操作是 ;反应的文字表达式为 。
(2)制得所需气体后,请你设计实验方案,验证该气体的一个化学性质。
【实验操作】
。
【实验现象】
。
【实验原理】
(用文字表达式表示)。
【实验结论】
。
8工业上常用“分离液态空气法”制取氧气,下图为工业上用“分离液态空气法”制取氧气的流程图。
(1)上图所示流程中,分离出氧气所发生的变化属于 变化。
(2)空气净化组件可除去空气中的水、二氧化碳、灰尘等。分离后的剩余气体中,除了氧气外可能还含有的杂质是 。
(3)氧气可用于医疗急救,体现了氧气的 (选填“物理性质”或“化学性质”)。
(4)一般将氧气液化后储存在钢瓶里,这样做的目的是 ;为保证氧气瓶的使用安全,应该注意 。
(5)采用上图方法制氧气,有 等优点。
2.3.2 用过氧化氢、氯酸钾制取氧气
制取气体时需要知道反应原理、选择试剂、选择发生装置和收集装置。我们可以选用高锰酸钾制取氧气,因为高锰酸钾中含有氧元素,加热后会分解产生氧气。过氧化氢、氯酸钾中也含有氧元素,那么我们可以用它们制取氧气吗 它们的反应条件相同吗 让我们走进化学课堂,一探究竟吧!
【基础堂清】
1如图所示,实验容器中涌出的柱状泡沫被称为“大象牙膏”。 下列说法中,正确的是( )
A.产生的泡沫可用于灭火
B.过氧化氢分解生成水和氧气
C.没有催化剂过氧化氢不会分解
D.反应前后催化剂的化学性质不同
2 小红在做家庭小实验时发现一个现象:单独加热白糖,白糖不易燃烧,若向白糖中加一点烟灰,白糖就很容易燃烧起来。要证明烟灰起催化作用,需要验证 ( )
A.燃烧前后烟灰的性质不变
B.燃烧前后白糖的质量和化学性质不变
C.燃烧前后白糖的质量不变
D.燃烧前后烟灰的质量和化学性质不变
3过氧化氢溶液常用作消毒剂。
(1)过氧化氢溶液属于 (选填“混合物”或“纯净物”)。
(2)过氧化氢不稳定,易分解。过氧化氢分解的文字表达式为 。
(3)用3%的过氧化氢溶液对不同金属进行腐蚀性实验,结果如下:
金属种类 不锈钢片 铝片 铜片
腐蚀速率(mg/h) 0.001 0.010 0.404
下列金属制品用该溶液浸泡消毒时,最易被腐蚀的是 (填字母)。
A.不锈钢锅 B.铝盆 C.铜锅
4化学创新小组的同学设计了以下实验,将加热至红热的铁丝伸入盛有过氧化氢溶液的集气瓶中,再向集气瓶中加入少量二氧化锰。下列分析合理的是( )
A.①中红热的铁丝、过氧化氢溶液均无明显变化
B.②中反应前后二氧化锰的质量和性质不变
C.②中铁丝剧烈燃烧,火星四射,生成黑色氧化铁
D.对比①②可得出燃烧剧烈程度与二氧化锰有关
【素养日清】
5(中考真题改编)下图是实验室制取气体常用的发生装置和收集装置,结合图示,回答下列问题:
(1)图中仪器甲的名称是 。
(2)若实验室用装置A制取氧气,反应的文字表达式为 ,二氧化锰在该反应中起了 作用。
(3)若实验室用装置B、D组合制取氧气,其反应的文字表达式为 ;若用装置E收集氧气,验满时,应将带火星的木条置于装置E的 (选填“a”或“b”)端。
(4)装置B、C均可用作实验室制取二氧化碳和氢气的发生装置,两者相比,装置C的优点是 。
6项目学习小组的同学做完二氧化锰催化分解过氧化氢溶液的实验后,对催化剂产生了浓厚的兴趣。在老师的指导下,同学们展开了如下探究活动。
活动一:过氧化氢溶液与二氧化锰的加入顺序
实验1:向盛有a g二氧化锰的试管中缓缓加入5 mL 5%的过氧化氢溶液;
实验2:向盛有5 mL 5%的过氧化氢溶液的试管中加入a g二氧化锰,试管中快速产生大量气泡。
实验1、2相比,可得到平稳气流的是 (填实验序号)。
活动二:寻找新的催化剂
实验3:向盛有5 mL 5%的过氧化氢溶液的试管中加入a g红砖粉末后,试管中有气泡产生。
(1)检验该气体成分的方法是 ,这是利用了该气体具有 的性质。
(2)待试管中不再产生气泡时,重新加入过氧化氢溶液,并再次检验气体,如此反复多次,观察现象,该实验的目的是 。
(3)将实验后的剩余物过滤,并将滤渣洗净、干燥、称量,所得固体质量仍为a g。
【实验结论】通过上述过程得出的结论是 。写出该反应的文字表达式: 。
【交流研讨】对比实验2与实验3,探究的问题是 。
【实验拓展】查阅资料得知,氧化铜、硫酸铜溶液、猪肝、马铃薯等都可以作过氧化氢分解的催化剂。下列有关催化剂的说法正确的是 (填字母)。
A.催化剂只能是固体
B.同一个化学反应可以有多种催化剂
C.催化剂就是二氧化锰
D.催化剂也可能减慢化学反应的速率
【参考答案】
基础堂清
1.B 2.A 3.D
4.(1)②④①③⑥⑤⑦ 冷凝水倒流使试管炸裂
(2)不易溶于水 向上排空气
(3)把带火星的木条伸入集气瓶中,木条复燃则为氧气
5.(1)铁架台 用酒精灯外焰在试管下方来回移动 高锰酸钾锰酸钾+二氧化锰+氧气 集气瓶口有大气泡冒出 防止加热时粉末进入导管
(2)b 氧气的密度比空气的大
(3)火柴梗快燃尽
(4)都需要提供热量 反应物(或生成物)种类不同 (合理即可)
(5)B
素养日清
6.C
7.(1)检查装置的气密性 高锰酸钾锰酸钾+二氧化锰+氧气
(2)【实验操作】将点燃的木炭放入燃烧匙中,将燃烧匙自上而下缓慢伸入装有氧气的集气瓶中(或将铁丝绕成螺旋状,末端系一根火柴,点燃火柴,待火柴梗快燃尽时由上而下缓慢伸入装有氧气的集气瓶中,合理即可)
【实验现象】木炭剧烈燃烧,发出白光,放出热量(或剧烈燃烧,火星四射,放出热量,生成黑色固体)
【实验原理】碳+氧气二氧化碳(或铁+氧气四氧化三铁,与上边对应,合理即可)
【实验结论】在点燃条件下,氧气能与木炭反应(在点燃条件下,氧气能与铁丝发生化学反应)
8.(1)物理
(2)稀有气体等
(3)化学性质
(4)便于运输和使用 远离易燃易爆物(合理即可)
(5)原料易得、成本低
【参考答案】
基础堂清
1.B 2.D
3.(1)混合物
(2)过氧化氢→水+氧气
(3)C
4.A
素养日清
5.(1)水槽
(2)氯酸钾氯化钾+氧气 催化
(3)过氧化氢水+氧气 b
(4)能够控制反应的发生与停止
6.实验2:实验1
实验3:(1)将带火星的木条伸入试管中,木条复燃,则为氧气 支持燃烧
(2)验证红砖粉末的化学性质没有改变
(3)红砖粉末能作过氧化氢分解的催化剂 过氧化氢水+氧气 催化剂的种类不同,过氧化氢的分解速率不同 BD
工业生产、医疗卫生、科学研究等行业往往需要比较纯净的氧气。那么,你知道工业上是如何获得大量氧气的呢 实验室又是如何制取氧气的呢
【基础堂清】
1 工业上利用分离液态空气法制氧气,利用了液态氮与液态氧的不同之处是 ( )
A.熔点 B.沸点 C.密度 D.气味
2下列加热高锰酸钾制取氧气的部分操作示意图中,正确的是 ( )
A.检查气密性 B.加热后立即收集
C.收满后移出集气瓶 D.结束时停止加热
3小明采用排水法收集氧气,若收集的氧气不纯,可能的原因是 ( )
A.停止加热后,先熄灭酒精灯再移出导管
B.检查装置气密性后再装试剂
C.加热时试管口没有略向下倾斜
D.导管口刚有气泡冒出就开始收集
4以下是实验室用高锰酸钾制取氧气并用排水法收集氧气的主要操作步骤:①将试管固定在铁架台上;②检查装置的气密性;③点燃酒精灯,先使试管受热均匀,然后对准试管中盛放试剂的部位加热;④将试剂装入试管,用带导管的单孔橡胶塞塞紧试管;⑤收集完毕,将导管从水槽中取出;⑥用排水法收集氧气;⑦熄灭酒精灯。请回答下列问题。
(1)该实验正确的操作顺序是 (填序号);固定试管时,试管口要略向下倾斜,防止 。
(2)可以用排水法收集氧气,体现了氧气 的性质。若想获得比较干燥的氧气,应该选用 法收集。
(3)验证一瓶无色气体是氧气的简单方法是 。
5小红和同学们完成了实验室制取氧气和验证氧气性质的实验,并进行了相关问题的思考。请结合图文信息回答下列问题。
(1)图1:仪器a的名称是 ,给试管预热的操作是 ,发生反应的文字表达式是 。判断氧气集满的现象是 。试管口放棉花的作用是 。
(2)图2:在收集氧气时,氧气应当从 端进入集气瓶,原因是 。
(3)图3:点燃系在螺旋状细铁丝底端的火柴,待 时,将铁丝自上而下缓慢伸入装有氧气的集气瓶中。
(4)图1与图3中的反应相比,相同之处是 ,不同之处是 。
(5)下图表示加热高锰酸钾过程中,某变量Y随时间的变化趋势。纵坐标表示的是
(填字母)。
A.生成氧气的质量
B.固体中氧元素的质量
C.固体中二氧化锰的质量
D.固体中钾元素的质量分数
【素养日清】
6(中考真题改编)实验室用加热高锰酸钾的方法制取氧气,有关操作如下,正确的是 ( )
A.试管口应该向上倾斜
B.铁夹夹在试管的中部
C.先移出导管再熄灭酒精灯
D.气泡均匀放出时开始收集
7氧气是一种化学性质比较活泼的气体,某实验小组同学通过右图装置制取氧气并验证氧气的性质。请结合图文信息回答下列问题。
(1)连接好装置后,下一步的操作是 ;反应的文字表达式为 。
(2)制得所需气体后,请你设计实验方案,验证该气体的一个化学性质。
【实验操作】
。
【实验现象】
。
【实验原理】
(用文字表达式表示)。
【实验结论】
。
8工业上常用“分离液态空气法”制取氧气,下图为工业上用“分离液态空气法”制取氧气的流程图。
(1)上图所示流程中,分离出氧气所发生的变化属于 变化。
(2)空气净化组件可除去空气中的水、二氧化碳、灰尘等。分离后的剩余气体中,除了氧气外可能还含有的杂质是 。
(3)氧气可用于医疗急救,体现了氧气的 (选填“物理性质”或“化学性质”)。
(4)一般将氧气液化后储存在钢瓶里,这样做的目的是 ;为保证氧气瓶的使用安全,应该注意 。
(5)采用上图方法制氧气,有 等优点。
2.3.2 用过氧化氢、氯酸钾制取氧气
制取气体时需要知道反应原理、选择试剂、选择发生装置和收集装置。我们可以选用高锰酸钾制取氧气,因为高锰酸钾中含有氧元素,加热后会分解产生氧气。过氧化氢、氯酸钾中也含有氧元素,那么我们可以用它们制取氧气吗 它们的反应条件相同吗 让我们走进化学课堂,一探究竟吧!
【基础堂清】
1如图所示,实验容器中涌出的柱状泡沫被称为“大象牙膏”。 下列说法中,正确的是( )
A.产生的泡沫可用于灭火
B.过氧化氢分解生成水和氧气
C.没有催化剂过氧化氢不会分解
D.反应前后催化剂的化学性质不同
2 小红在做家庭小实验时发现一个现象:单独加热白糖,白糖不易燃烧,若向白糖中加一点烟灰,白糖就很容易燃烧起来。要证明烟灰起催化作用,需要验证 ( )
A.燃烧前后烟灰的性质不变
B.燃烧前后白糖的质量和化学性质不变
C.燃烧前后白糖的质量不变
D.燃烧前后烟灰的质量和化学性质不变
3过氧化氢溶液常用作消毒剂。
(1)过氧化氢溶液属于 (选填“混合物”或“纯净物”)。
(2)过氧化氢不稳定,易分解。过氧化氢分解的文字表达式为 。
(3)用3%的过氧化氢溶液对不同金属进行腐蚀性实验,结果如下:
金属种类 不锈钢片 铝片 铜片
腐蚀速率(mg/h) 0.001 0.010 0.404
下列金属制品用该溶液浸泡消毒时,最易被腐蚀的是 (填字母)。
A.不锈钢锅 B.铝盆 C.铜锅
4化学创新小组的同学设计了以下实验,将加热至红热的铁丝伸入盛有过氧化氢溶液的集气瓶中,再向集气瓶中加入少量二氧化锰。下列分析合理的是( )
A.①中红热的铁丝、过氧化氢溶液均无明显变化
B.②中反应前后二氧化锰的质量和性质不变
C.②中铁丝剧烈燃烧,火星四射,生成黑色氧化铁
D.对比①②可得出燃烧剧烈程度与二氧化锰有关
【素养日清】
5(中考真题改编)下图是实验室制取气体常用的发生装置和收集装置,结合图示,回答下列问题:
(1)图中仪器甲的名称是 。
(2)若实验室用装置A制取氧气,反应的文字表达式为 ,二氧化锰在该反应中起了 作用。
(3)若实验室用装置B、D组合制取氧气,其反应的文字表达式为 ;若用装置E收集氧气,验满时,应将带火星的木条置于装置E的 (选填“a”或“b”)端。
(4)装置B、C均可用作实验室制取二氧化碳和氢气的发生装置,两者相比,装置C的优点是 。
6项目学习小组的同学做完二氧化锰催化分解过氧化氢溶液的实验后,对催化剂产生了浓厚的兴趣。在老师的指导下,同学们展开了如下探究活动。
活动一:过氧化氢溶液与二氧化锰的加入顺序
实验1:向盛有a g二氧化锰的试管中缓缓加入5 mL 5%的过氧化氢溶液;
实验2:向盛有5 mL 5%的过氧化氢溶液的试管中加入a g二氧化锰,试管中快速产生大量气泡。
实验1、2相比,可得到平稳气流的是 (填实验序号)。
活动二:寻找新的催化剂
实验3:向盛有5 mL 5%的过氧化氢溶液的试管中加入a g红砖粉末后,试管中有气泡产生。
(1)检验该气体成分的方法是 ,这是利用了该气体具有 的性质。
(2)待试管中不再产生气泡时,重新加入过氧化氢溶液,并再次检验气体,如此反复多次,观察现象,该实验的目的是 。
(3)将实验后的剩余物过滤,并将滤渣洗净、干燥、称量,所得固体质量仍为a g。
【实验结论】通过上述过程得出的结论是 。写出该反应的文字表达式: 。
【交流研讨】对比实验2与实验3,探究的问题是 。
【实验拓展】查阅资料得知,氧化铜、硫酸铜溶液、猪肝、马铃薯等都可以作过氧化氢分解的催化剂。下列有关催化剂的说法正确的是 (填字母)。
A.催化剂只能是固体
B.同一个化学反应可以有多种催化剂
C.催化剂就是二氧化锰
D.催化剂也可能减慢化学反应的速率
【参考答案】
基础堂清
1.B 2.A 3.D
4.(1)②④①③⑥⑤⑦ 冷凝水倒流使试管炸裂
(2)不易溶于水 向上排空气
(3)把带火星的木条伸入集气瓶中,木条复燃则为氧气
5.(1)铁架台 用酒精灯外焰在试管下方来回移动 高锰酸钾锰酸钾+二氧化锰+氧气 集气瓶口有大气泡冒出 防止加热时粉末进入导管
(2)b 氧气的密度比空气的大
(3)火柴梗快燃尽
(4)都需要提供热量 反应物(或生成物)种类不同 (合理即可)
(5)B
素养日清
6.C
7.(1)检查装置的气密性 高锰酸钾锰酸钾+二氧化锰+氧气
(2)【实验操作】将点燃的木炭放入燃烧匙中,将燃烧匙自上而下缓慢伸入装有氧气的集气瓶中(或将铁丝绕成螺旋状,末端系一根火柴,点燃火柴,待火柴梗快燃尽时由上而下缓慢伸入装有氧气的集气瓶中,合理即可)
【实验现象】木炭剧烈燃烧,发出白光,放出热量(或剧烈燃烧,火星四射,放出热量,生成黑色固体)
【实验原理】碳+氧气二氧化碳(或铁+氧气四氧化三铁,与上边对应,合理即可)
【实验结论】在点燃条件下,氧气能与木炭反应(在点燃条件下,氧气能与铁丝发生化学反应)
8.(1)物理
(2)稀有气体等
(3)化学性质
(4)便于运输和使用 远离易燃易爆物(合理即可)
(5)原料易得、成本低
【参考答案】
基础堂清
1.B 2.D
3.(1)混合物
(2)过氧化氢→水+氧气
(3)C
4.A
素养日清
5.(1)水槽
(2)氯酸钾氯化钾+氧气 催化
(3)过氧化氢水+氧气 b
(4)能够控制反应的发生与停止
6.实验2:实验1
实验3:(1)将带火星的木条伸入试管中,木条复燃,则为氧气 支持燃烧
(2)验证红砖粉末的化学性质没有改变
(3)红砖粉末能作过氧化氢分解的催化剂 过氧化氢水+氧气 催化剂的种类不同,过氧化氢的分解速率不同 BD
同课章节目录
