第一节原子结构模型
图片预览






文档简介
课件32张PPT。学习目标
1.了解氢原子光谱的特点,进一步认识卢瑟福和玻尔的原子结构模型。
2.了解原子核外电子的运动状态。
3.了解原子轨道和电子云的含义。第一节
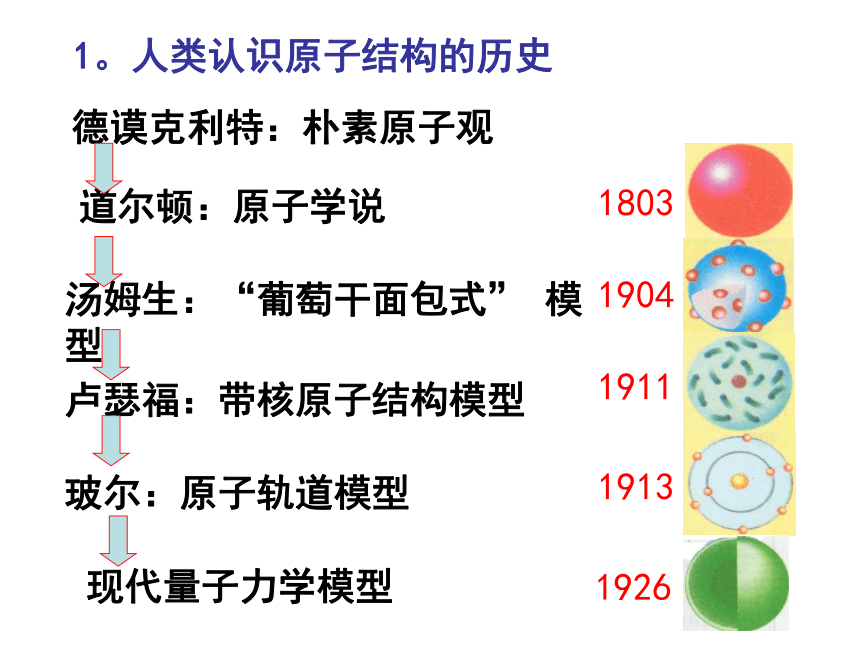
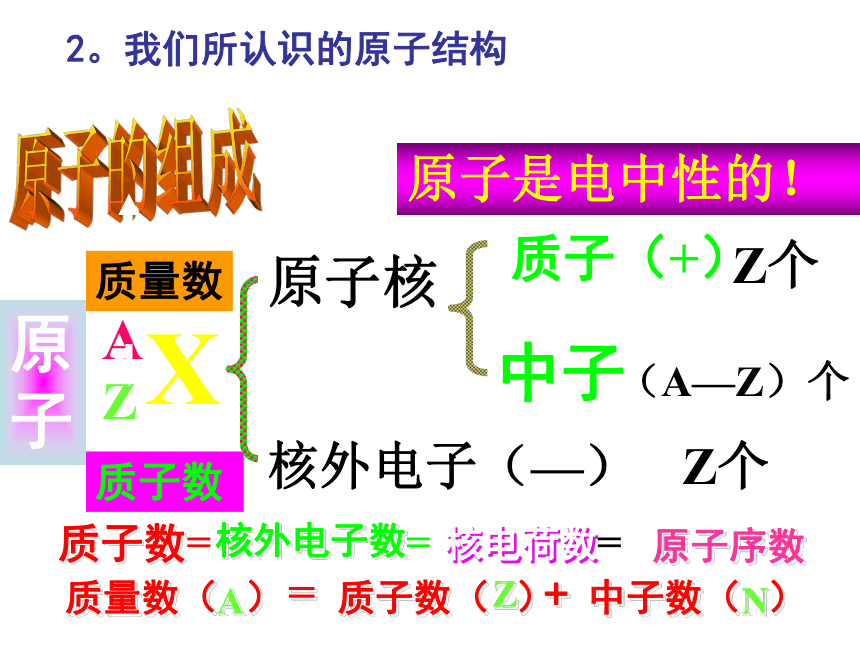
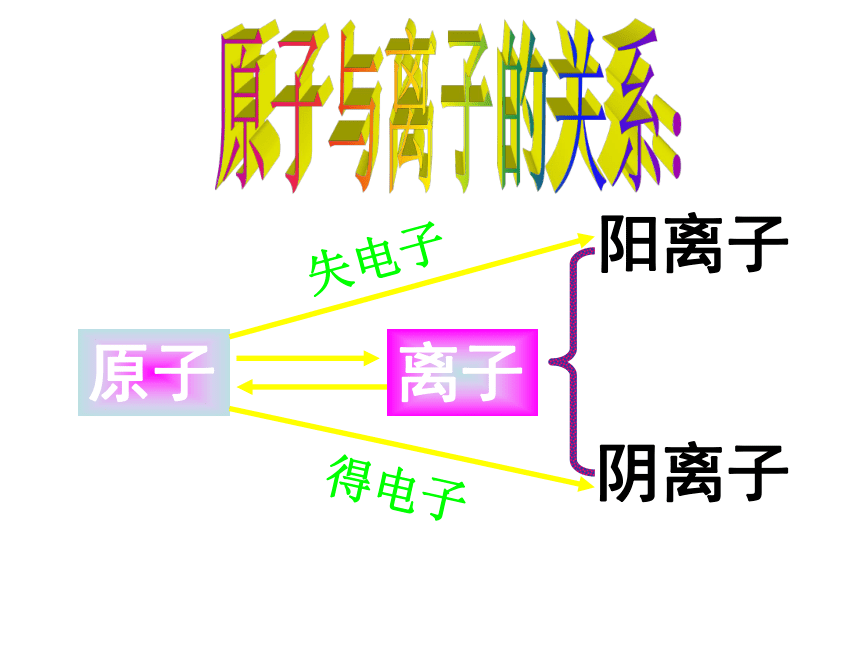
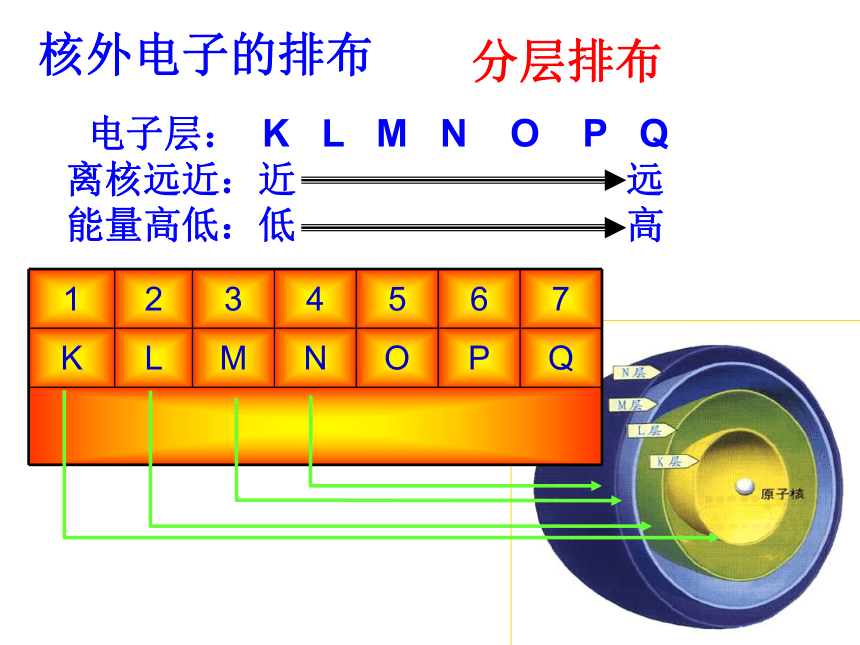
原子结构模型宇宙大爆炸宇宙大爆炸 1932年勒梅特首次提出了现代宇宙大爆炸理论:整个宇宙最初聚集在一个“原始原子”中,后来发生了大爆炸,碎片向四面八方散开,形成了我们的宇宙。大爆炸后两小时,诞生了大量的H、少量的He及极少量的Li,然后经过长或短的发展过程,以上元素发生原子核的熔合反应,分期分批的合成了其它元素。宇宙大爆炸德谟克利特:朴素原子观道尔顿:原子学说汤姆生:“葡萄干面包式” 模型卢瑟福:带核原子结构模型玻尔:原子轨道模型现代量子力学模型1。人类认识原子结构的历史质子数原子的组成原子原子核核外电子(—)质子(+)中子Z个(A—Z)个Z个原子是电中性的!+原子序数=质量数2。我们所认识的原子结构原子与离子的关系:原子离子阳离子阴离子失电子得电子核外电子的排布 电子层: K L M N O P Q
离核远近:近 远
能量高低:低 高分层排布核外电子排布规律:(1)能量最低原理:电子先排布在能量较低的电子层上。每层≤2n2个。最外层≤ 8个(K层时≤2个),如果最外层为8个(K层为2个)就达到了饱和稳定结构。次外层≤ 18个,倒数第三层≤ 32(2)各层最多容纳2n2 个电子(3)最外层不超过8个(K层2个)(4)次外层不超过18个,倒数第
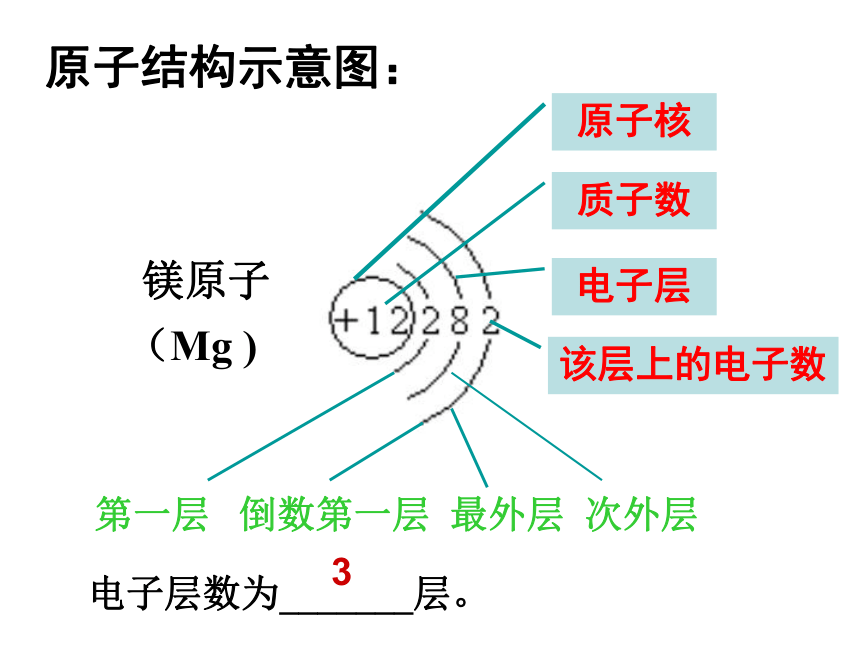
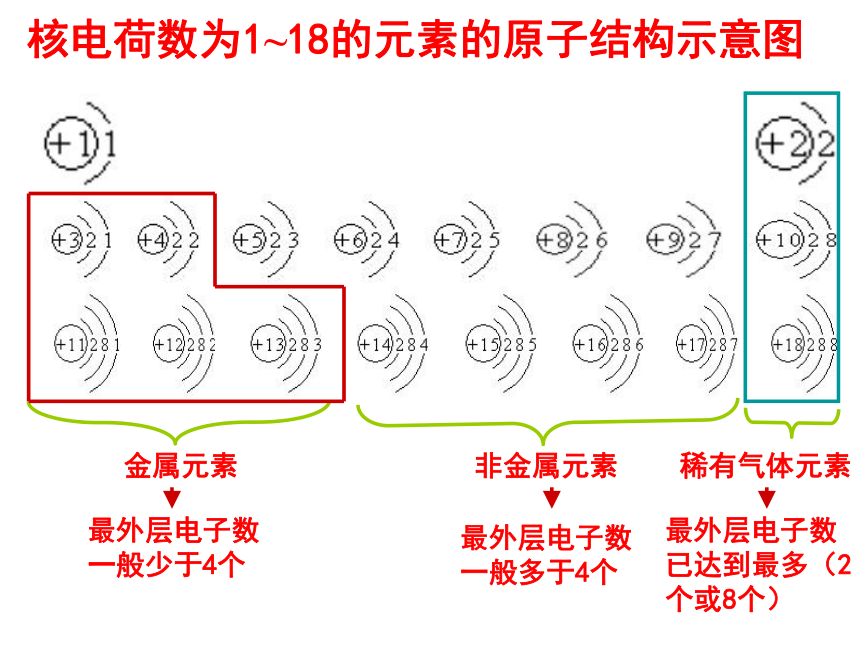
三层不超过32个。相互制约,相互联系排布规律(一低四不超)(1)能量最低原理原子结构示意图:镁原子(Mg )原子核质子数电子层该层上的电子数第一层 倒数第一层 最外层 次外层电子层数为_______层。3核电荷数为1~18的元素的原子结构示意图金属元素非金属元素稀有气体元素最外层电子数
一般少于4个最外层电子数
一般多于4个最外层电子数
已达到最多(2
个或8个)一、氢原子光谱和玻尔的原子结构模型1、氢原子光谱2、玻尔的原子结构模型
(1)基本观点
(2)解决的实验问题[联想·质疑]波尔只引入一个量子数n,能比较好地解释了氢原子线状光谱产生的原因;但复杂的光谱解释不了。实验事实: 原子轨道与四个量子数
(1)原子光谱带来的疑问?
①钠原子光谱在n=3到n=4之间会产生两(多)条谱线.
②氢原子光谱在n=1到n=2之间谱线实际上是两条靠得非常近的谱线.
③在磁场中所有原子光谱可能会分裂成多条谱线.
这些问题用玻尔的原子模型无法解释.
原子中电子的运动状态应用多个量子数来描述.
量子力学中单个电子的空间运动状态称为原子轨道.(1)电子分层排布的依据是什么?
(2)在多电子原子中,每一层上的电子能量一样吗?运动区域的形状一样吗?
(3)为什么每个电子层所能容纳的电子数最多为2n2(n为电子层数)?
?疑问(一)电子层(又称能层):分层依据:能量的较大差别;
电子运动的主要区域或离核远近的不同。二、量子力学对原子核外电子的运动状态的描述同一电子层内,电子能量也并非完全相同。2、能级——电子亚层K层:只有1个能级1sL层:有2个能级2s、2pM层:有3个能级3s、3p、3dN层:有4个能级4s、4p、4d、4f…(1)划分标准:能层中的电子能量并不完全相同,还可以分成不同的能级(2)能级的表示:s 、p 、d 、f、(3) 各能层所含能级规律: 1、每层的能级数值=电子层数
2、 能量高低规律:ns 即在原子核外一定能层的能级上,具有一定形状和伸展方向的电子所占据的空间。3、原子轨道形状及伸展方向(2)各能级原子轨道形状及伸展方向:S原子轨道S原子轨道是球形对称的.P原子轨道是纺锤形的 (也有把它叫哑铃型),每个P能级有3个原子轨道,它们相互垂直,分别以P x,Py,PZ表示. P原子轨道P能级的原子轨道 P能级的3个原子轨道P x,Py,PZ合在一起的情形. d能级的原子轨道有5个.d能级的原子轨道练习:找出下列条件下原子轨道的数目
n=1
B. n=2
C. n=3
1 1s4 2s 2px 2py 2pz 3s 3px 3py 3pz 3dxy 3dyz 3dxz
3dx2-y2 3dz2规律:每层的原子轨道数为层数的平方(n2)4、电子自旋: 原子核外电子还有一种称为“自旋”的运动。原子核外电子的自旋可以有两种不同的状态,通常人们用向上箭头“↑”和向下箭头“↓”来表示这两种不同的自旋状态。当然,“电子自旋”并非真像地球绕轴自旋一样,它只是代表电子的两种不同状态。练习:实验证明,同一原子中电子的运动状态均不相同.试推断:
每个原子轨道最多有几个电子?
每个电子层最多有多少个电子?
钠原子核外电子运动状态有几种?氯离子核外电子运动状态有几种?规律:每层最多容纳的电子数为=2×电子层数的平方(2n2)
宏观、微观运动的不同5、电子云 电子云——电子在核外空间一定范围内出现的机会的大小,好像带负电荷的云雾笼罩在原子核周围,人们形象的称为电子云。 可用统计(图示)的方法研究电子在核外出现的概率。 电子云:描述电子在核外单位体积内出现概率大小的图形。
电子云中的小点:
并不是表示原子核外的一个电子,而是表示电子在此空间出现的机率。
电子云密度大的地方说明电子出现的机会多,而电子云密度小的地方说明电子出现的机会少。1、关于“电子云”的描述中,正确的是
A、一个小黑点表示一个电子
B、一个小黑点代表电子在此出现过一次
C、电子云是带正电的云雾
D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少D巩固练习 核外电子的运动状态原子轨道能量高低规律:ns 1s<2s<3s<4s
2px=2py=2pz小结: 核外电子的运动状态小结:C、同是s轨道,在不同的能层中所能容纳的最多电子数是不
相同的1、下列关于电子层与原子轨道类型的说法中不正
确的是 ( ) A、原子核外电子的每一个电子层最多可容纳的电子数为2n2B、任一电子层的原子轨道总是从s轨道开始,而且原子轨道类型数目等于该电子层序数D、1个原子轨道里最多只能容纳2个电子练习√2、下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大 练习√
1.了解氢原子光谱的特点,进一步认识卢瑟福和玻尔的原子结构模型。
2.了解原子核外电子的运动状态。
3.了解原子轨道和电子云的含义。第一节
原子结构模型宇宙大爆炸宇宙大爆炸 1932年勒梅特首次提出了现代宇宙大爆炸理论:整个宇宙最初聚集在一个“原始原子”中,后来发生了大爆炸,碎片向四面八方散开,形成了我们的宇宙。大爆炸后两小时,诞生了大量的H、少量的He及极少量的Li,然后经过长或短的发展过程,以上元素发生原子核的熔合反应,分期分批的合成了其它元素。宇宙大爆炸德谟克利特:朴素原子观道尔顿:原子学说汤姆生:“葡萄干面包式” 模型卢瑟福:带核原子结构模型玻尔:原子轨道模型现代量子力学模型1。人类认识原子结构的历史质子数原子的组成原子原子核核外电子(—)质子(+)中子Z个(A—Z)个Z个原子是电中性的!+原子序数=质量数2。我们所认识的原子结构原子与离子的关系:原子离子阳离子阴离子失电子得电子核外电子的排布 电子层: K L M N O P Q
离核远近:近 远
能量高低:低 高分层排布核外电子排布规律:(1)能量最低原理:电子先排布在能量较低的电子层上。每层≤2n2个。最外层≤ 8个(K层时≤2个),如果最外层为8个(K层为2个)就达到了饱和稳定结构。次外层≤ 18个,倒数第三层≤ 32(2)各层最多容纳2n2 个电子(3)最外层不超过8个(K层2个)(4)次外层不超过18个,倒数第
三层不超过32个。相互制约,相互联系排布规律(一低四不超)(1)能量最低原理原子结构示意图:镁原子(Mg )原子核质子数电子层该层上的电子数第一层 倒数第一层 最外层 次外层电子层数为_______层。3核电荷数为1~18的元素的原子结构示意图金属元素非金属元素稀有气体元素最外层电子数
一般少于4个最外层电子数
一般多于4个最外层电子数
已达到最多(2
个或8个)一、氢原子光谱和玻尔的原子结构模型1、氢原子光谱2、玻尔的原子结构模型
(1)基本观点
(2)解决的实验问题[联想·质疑]波尔只引入一个量子数n,能比较好地解释了氢原子线状光谱产生的原因;但复杂的光谱解释不了。实验事实: 原子轨道与四个量子数
(1)原子光谱带来的疑问?
①钠原子光谱在n=3到n=4之间会产生两(多)条谱线.
②氢原子光谱在n=1到n=2之间谱线实际上是两条靠得非常近的谱线.
③在磁场中所有原子光谱可能会分裂成多条谱线.
这些问题用玻尔的原子模型无法解释.
原子中电子的运动状态应用多个量子数来描述.
量子力学中单个电子的空间运动状态称为原子轨道.(1)电子分层排布的依据是什么?
(2)在多电子原子中,每一层上的电子能量一样吗?运动区域的形状一样吗?
(3)为什么每个电子层所能容纳的电子数最多为2n2(n为电子层数)?
?疑问(一)电子层(又称能层):分层依据:能量的较大差别;
电子运动的主要区域或离核远近的不同。二、量子力学对原子核外电子的运动状态的描述同一电子层内,电子能量也并非完全相同。2、能级——电子亚层K层:只有1个能级1sL层:有2个能级2s、2pM层:有3个能级3s、3p、3dN层:有4个能级4s、4p、4d、4f…(1)划分标准:能层中的电子能量并不完全相同,还可以分成不同的能级(2)能级的表示:s 、p 、d 、f、(3) 各能层所含能级规律: 1、每层的能级数值=电子层数
2、 能量高低规律:ns
n=1
B. n=2
C. n=3
1 1s4 2s 2px 2py 2pz 3s 3px 3py 3pz 3dxy 3dyz 3dxz
3dx2-y2 3dz2规律:每层的原子轨道数为层数的平方(n2)4、电子自旋: 原子核外电子还有一种称为“自旋”的运动。原子核外电子的自旋可以有两种不同的状态,通常人们用向上箭头“↑”和向下箭头“↓”来表示这两种不同的自旋状态。当然,“电子自旋”并非真像地球绕轴自旋一样,它只是代表电子的两种不同状态。练习:实验证明,同一原子中电子的运动状态均不相同.试推断:
每个原子轨道最多有几个电子?
每个电子层最多有多少个电子?
钠原子核外电子运动状态有几种?氯离子核外电子运动状态有几种?规律:每层最多容纳的电子数为=2×电子层数的平方(2n2)
宏观、微观运动的不同5、电子云 电子云——电子在核外空间一定范围内出现的机会的大小,好像带负电荷的云雾笼罩在原子核周围,人们形象的称为电子云。 可用统计(图示)的方法研究电子在核外出现的概率。 电子云:描述电子在核外单位体积内出现概率大小的图形。
电子云中的小点:
并不是表示原子核外的一个电子,而是表示电子在此空间出现的机率。
电子云密度大的地方说明电子出现的机会多,而电子云密度小的地方说明电子出现的机会少。1、关于“电子云”的描述中,正确的是
A、一个小黑点表示一个电子
B、一个小黑点代表电子在此出现过一次
C、电子云是带正电的云雾
D、小黑点的疏密表示电子在核外空间单位体积内出现机会的多少D巩固练习 核外电子的运动状态原子轨道能量高低规律:ns
2px=2py=2pz小结: 核外电子的运动状态小结:C、同是s轨道,在不同的能层中所能容纳的最多电子数是不
相同的1、下列关于电子层与原子轨道类型的说法中不正
确的是 ( ) A、原子核外电子的每一个电子层最多可容纳的电子数为2n2B、任一电子层的原子轨道总是从s轨道开始,而且原子轨道类型数目等于该电子层序数D、1个原子轨道里最多只能容纳2个电子练习√2、下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多
D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大 练习√
