11.3_煤化工和乙炔。
图片预览







文档简介
课件28张PPT。11.3 煤化工和乙炔 一、煤和煤化工(一)煤的形成 煤是一种矿物燃料,是由远古时代植物经过漫长复杂的变化而转变成的固体可燃物。植物→泥炭(腐蚀泥)→褐煤→烟煤→无烟煤。煤是植物死亡后,在细菌的作用下逐渐变成黑色或褐色的有机物质,经过日积月累,形成一层厚厚的泥炭。随着地壳的变迁,这些泥炭被深深地埋在地下,在与空气完全隔绝的条件下,由于水分减少再加上地热和高压的作用,经过极其漫长的岁月之后,当时的泥炭就变成了今天的煤。煤的分类根据煤化程度将煤分为:
泥煤、褐煤、烟煤和无烟煤四类。泥煤褐煤无烟煤1.元素组成:主要含碳,还含少量的氢、 氮、硫、氧以及微量的硅、铝、钙、铁等
元素。2.物质组成(化学成分):煤是由有机物
和无机物组成的复杂混合物。(二)煤的成分木炭、焦炭等是碳的不纯单质,煤是有机物和无机物组成的复杂混合物。思考:煤和炭都是黑色固体,可燃,那么煤是不是就是炭呢?2、煤的干馏:把煤隔绝空气加强热使它
分解的过程,叫煤的干馏。(三)煤的综合利用1、煤的气化:煤在氧气不足的情况下部分
氧化,使煤中的有机物转化
为H2、CH4、CO 等气体物质。煤的综合利用有煤的气化、煤的干馏、煤的液化。(气体燃料、城市管道煤气)煤的干馏产品①焦炭:②煤焦油:③粗氨水④焦炉气:用于冶金、电石、
合成氨造气、燃料等。芳香烃的传统来源。 主要含H2、CH4;
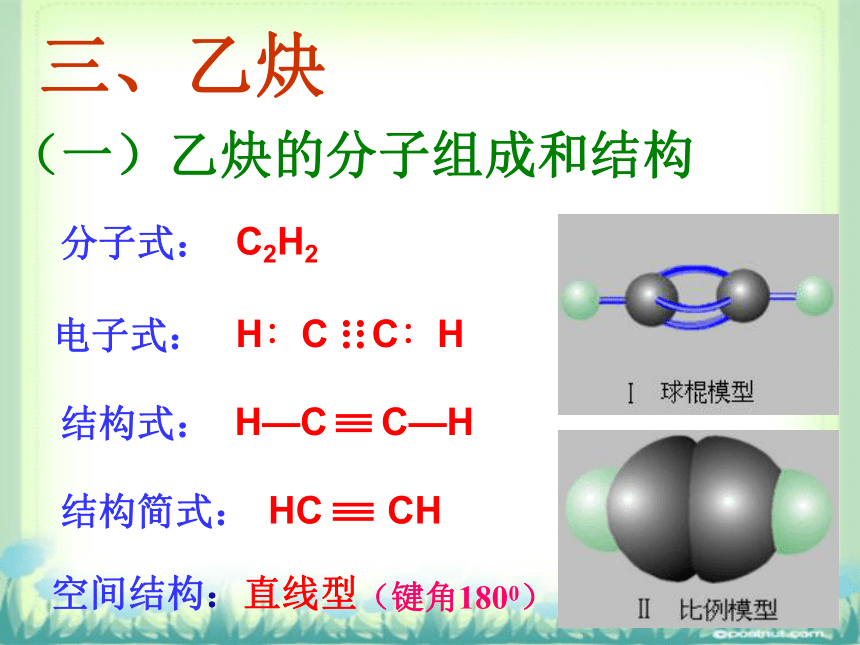
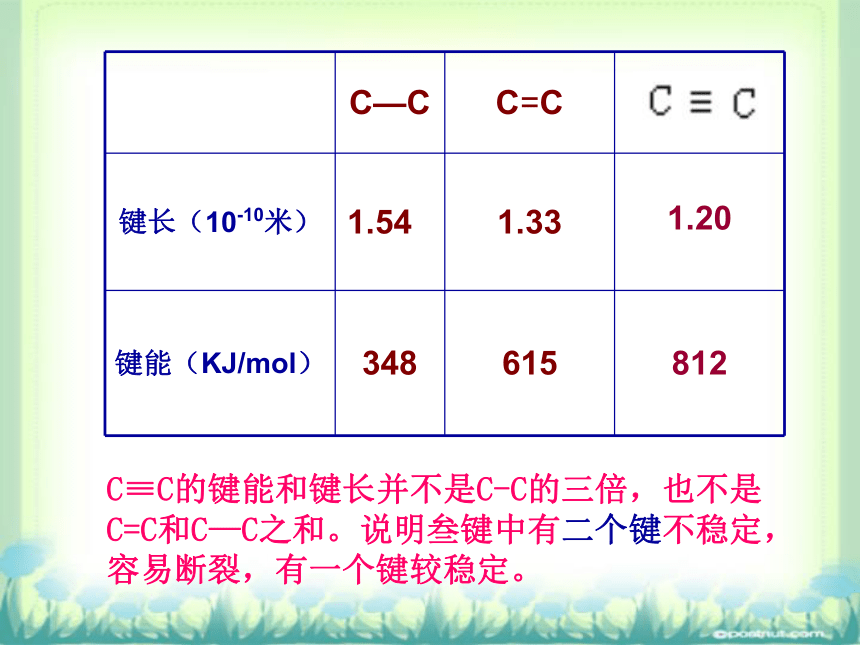
还含CO、CO2、C2H4等。可得氨水和铵盐,用于生产氮肥。(一)乙炔的分子组成和结构 空间结构:直线型C2H2 三、乙炔(键角1800)C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。说明叁键中有二个键不稳定,容易断裂,有一个键较稳定。(二)乙炔的实验室制法 电石(CaC2)和水 1、药品:CaC2+2H2O?CH?CH↑+Ca(OH)2+Q 2、原理:3、装置: 固 + 液→气能不能用启普发生器制取乙炔?不用启普发生器制取乙炔的原因: ①碳化钙与水反应剧烈,放热,容易使启普发生器炸裂;
②反应产物中有糊状Ca(OH)2,它能进入发生器底部, 使发生器失去作用.使用分液漏斗而不使用长颈漏斗的原因:
① 长颈漏斗不能控制水的用量;
② 生成的Ca(OH)2微溶于水, 易堵塞长
颈漏斗下端管口。 3. 反应装置: ? 水电石【说明】
①用“分液漏斗”代替“长颈漏斗” ——控制流量;
②用“饱和食盐水”代替“水”——减缓反应速率;
③制取时在导气管口附近塞入少量棉花——防止产生的泡沫涌入导管。
④所制乙炔气体有“臭味”
——
固 + 液→气4、收集:排水集气法5、净化: 产生H2S、PH3等杂质气体。NaOH溶液或硫酸铜溶液饱和食盐水6、干燥:浓硫酸、无水氯化钙 容器中放电石几块,滴水。将产生气体通入酸性高锰酸钾溶液和溴水中,最后再将气体点燃。【演示实验】:该烃燃烧时产生大量黑烟,火焰明亮该烃可使酸性KMnO4溶液和溴水褪色现象:(三)乙炔的物理性质 乙炔俗称电石气。纯净的乙炔是无色、无臭的气体,密度是1.16g/L(S.T.P),比空气稍轻,微溶于水,易溶于有机溶剂。由电石生成的乙炔因混有H2S、PH3等杂质而有“臭味”。(四)乙炔的化学性质:1、氧化反应:a、燃烧: 放出大量的热,乙炔在氧气里燃烧时产生的火焰叫氧炔焰,温度达30000C以上,用于切割和焊接金属。注意乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。b、 使酸性KMnO4溶液褪色2. 加成反应:a.使溴水褪色1, 2—二溴乙烯1, 1, 2, 2—四溴乙烷注意:叁键中有两根键较易断裂,反应时分步断裂、分步加成!制聚乙烯塑料制备塑料b、与H2、HCl等加成:CH2= CH2CH ? CH + H2催化剂CH2= CH2 + H2催化剂CH3?CH3CH2= CHClCH ? CH + HCl催化剂nCH2=CHCl高温、高压催化剂 CH2?CH Cln[ ]3.加聚反应:聚乙炔聚氯乙烯(五)乙炔的用途1、乙炔是一种重要的基本有机原料,可以
用来制备氯乙烯、聚氯乙烯等。2、乙炔燃烧时产生的氧炔焰可用来切割或
焊接金属。小结 1、定义:2、官能团:3、通式:CnH2n-2 (n≥2) (同二烯烃)4、通性 :四、炔烃①氧化、 ②加成、③加聚碳碳叁键分子中含有碳碳三键的链烃叫做炔烃(1)物理性质:①随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加。
② C小于等于4时为气态(2)化学性质:(与乙炔相似)1、下列说法错误的是( )
A. 乙烷、乙烯、乙炔完全燃烧时生成二氧化碳和水
B. 乙炔分子里的所有原子处在一条直线上
C. 电石必须防潮密封干燥保存
D. 实验室制取乙炔需要广口瓶、分液漏斗和酒精灯 D 2、某气态烃0.5mol能与1mol HCl氯化氢完全加成,
加成产物分子上的氢原子又可被
3mol Cl2取代,则气态烃可能是( )
A、CH ≡CH B、CH2=CH2 C、CH≡C—CH3 D、CH2=C(CH3)CH3 C分析:据题意1mol该烃能与2mol HCl加成,说明该烃中含有一个叁键或二个双键。加成后产物1mol又能被6mol Cl2取代,故说明加成后的产物有6mol H,原烃分子中含有4mol H原子。故答案为C。实验比较乙烷乙烯乙炔乙炔在氧气里燃烧产生的氧炔焰可用来切割或焊接金属。聚 氯 乙 烯 产 品聚氯乙烯薄膜1、生产中为什么常用氧炔焰来切割或焊接金属,而不用氧烷焰
或氧烯焰呢?请观察分析下面的热化学方程式,你发现了什么
问题:
CH4(气)+2 O2(气) → CO2(气)+ 2H2O(液)+ 890KJ
CH3-CH3(气)+ 7/2 O2(气)→ 2CO2(气)+ 3H2O(液)+ 1561KJ
CH2=CH2(气)+ 3 O2(气)→ 2CO2(气)+ 2H2O(液)+ 1411KJ
CH?CH (气)+ 5/2 O2(气)→ 2CO2(气)+ H2O(液)+ 1300KJ【开拓思考】 我们发现:等物质的量的乙烷、乙烯和乙炔完全燃烧的后,乙炔所消耗的氧气的物质的量最少,生成水的物质的量也最少。因此,在燃烧时用于提高氧的温度和使水汽化所消耗掉的反应热也最少,所以乙炔焰的温度最高,可达30000C以上。利用其燃烧热可切割或焊接金属。 现提供焦炭、生石灰、食盐、水四种化
学原料,请通过适当的化学反应合成聚氯
乙烯。探究活动:分析上图中硫酸铜溶液的作用是什么?
泥煤、褐煤、烟煤和无烟煤四类。泥煤褐煤无烟煤1.元素组成:主要含碳,还含少量的氢、 氮、硫、氧以及微量的硅、铝、钙、铁等
元素。2.物质组成(化学成分):煤是由有机物
和无机物组成的复杂混合物。(二)煤的成分木炭、焦炭等是碳的不纯单质,煤是有机物和无机物组成的复杂混合物。思考:煤和炭都是黑色固体,可燃,那么煤是不是就是炭呢?2、煤的干馏:把煤隔绝空气加强热使它
分解的过程,叫煤的干馏。(三)煤的综合利用1、煤的气化:煤在氧气不足的情况下部分
氧化,使煤中的有机物转化
为H2、CH4、CO 等气体物质。煤的综合利用有煤的气化、煤的干馏、煤的液化。(气体燃料、城市管道煤气)煤的干馏产品①焦炭:②煤焦油:③粗氨水④焦炉气:用于冶金、电石、
合成氨造气、燃料等。芳香烃的传统来源。 主要含H2、CH4;
还含CO、CO2、C2H4等。可得氨水和铵盐,用于生产氮肥。(一)乙炔的分子组成和结构 空间结构:直线型C2H2 三、乙炔(键角1800)C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。说明叁键中有二个键不稳定,容易断裂,有一个键较稳定。(二)乙炔的实验室制法 电石(CaC2)和水 1、药品:CaC2+2H2O?CH?CH↑+Ca(OH)2+Q 2、原理:3、装置: 固 + 液→气能不能用启普发生器制取乙炔?不用启普发生器制取乙炔的原因: ①碳化钙与水反应剧烈,放热,容易使启普发生器炸裂;
②反应产物中有糊状Ca(OH)2,它能进入发生器底部, 使发生器失去作用.使用分液漏斗而不使用长颈漏斗的原因:
① 长颈漏斗不能控制水的用量;
② 生成的Ca(OH)2微溶于水, 易堵塞长
颈漏斗下端管口。 3. 反应装置: ? 水电石【说明】
①用“分液漏斗”代替“长颈漏斗” ——控制流量;
②用“饱和食盐水”代替“水”——减缓反应速率;
③制取时在导气管口附近塞入少量棉花——防止产生的泡沫涌入导管。
④所制乙炔气体有“臭味”
——
固 + 液→气4、收集:排水集气法5、净化: 产生H2S、PH3等杂质气体。NaOH溶液或硫酸铜溶液饱和食盐水6、干燥:浓硫酸、无水氯化钙 容器中放电石几块,滴水。将产生气体通入酸性高锰酸钾溶液和溴水中,最后再将气体点燃。【演示实验】:该烃燃烧时产生大量黑烟,火焰明亮该烃可使酸性KMnO4溶液和溴水褪色现象:(三)乙炔的物理性质 乙炔俗称电石气。纯净的乙炔是无色、无臭的气体,密度是1.16g/L(S.T.P),比空气稍轻,微溶于水,易溶于有机溶剂。由电石生成的乙炔因混有H2S、PH3等杂质而有“臭味”。(四)乙炔的化学性质:1、氧化反应:a、燃烧: 放出大量的热,乙炔在氧气里燃烧时产生的火焰叫氧炔焰,温度达30000C以上,用于切割和焊接金属。注意乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。b、 使酸性KMnO4溶液褪色2. 加成反应:a.使溴水褪色1, 2—二溴乙烯1, 1, 2, 2—四溴乙烷注意:叁键中有两根键较易断裂,反应时分步断裂、分步加成!制聚乙烯塑料制备塑料b、与H2、HCl等加成:CH2= CH2CH ? CH + H2催化剂CH2= CH2 + H2催化剂CH3?CH3CH2= CHClCH ? CH + HCl催化剂nCH2=CHCl高温、高压催化剂 CH2?CH Cln[ ]3.加聚反应:聚乙炔聚氯乙烯(五)乙炔的用途1、乙炔是一种重要的基本有机原料,可以
用来制备氯乙烯、聚氯乙烯等。2、乙炔燃烧时产生的氧炔焰可用来切割或
焊接金属。小结 1、定义:2、官能团:3、通式:CnH2n-2 (n≥2) (同二烯烃)4、通性 :四、炔烃①氧化、 ②加成、③加聚碳碳叁键分子中含有碳碳三键的链烃叫做炔烃(1)物理性质:①随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加。
② C小于等于4时为气态(2)化学性质:(与乙炔相似)1、下列说法错误的是( )
A. 乙烷、乙烯、乙炔完全燃烧时生成二氧化碳和水
B. 乙炔分子里的所有原子处在一条直线上
C. 电石必须防潮密封干燥保存
D. 实验室制取乙炔需要广口瓶、分液漏斗和酒精灯 D 2、某气态烃0.5mol能与1mol HCl氯化氢完全加成,
加成产物分子上的氢原子又可被
3mol Cl2取代,则气态烃可能是( )
A、CH ≡CH B、CH2=CH2 C、CH≡C—CH3 D、CH2=C(CH3)CH3 C分析:据题意1mol该烃能与2mol HCl加成,说明该烃中含有一个叁键或二个双键。加成后产物1mol又能被6mol Cl2取代,故说明加成后的产物有6mol H,原烃分子中含有4mol H原子。故答案为C。实验比较乙烷乙烯乙炔乙炔在氧气里燃烧产生的氧炔焰可用来切割或焊接金属。聚 氯 乙 烯 产 品聚氯乙烯薄膜1、生产中为什么常用氧炔焰来切割或焊接金属,而不用氧烷焰
或氧烯焰呢?请观察分析下面的热化学方程式,你发现了什么
问题:
CH4(气)+2 O2(气) → CO2(气)+ 2H2O(液)+ 890KJ
CH3-CH3(气)+ 7/2 O2(气)→ 2CO2(气)+ 3H2O(液)+ 1561KJ
CH2=CH2(气)+ 3 O2(气)→ 2CO2(气)+ 2H2O(液)+ 1411KJ
CH?CH (气)+ 5/2 O2(气)→ 2CO2(气)+ H2O(液)+ 1300KJ【开拓思考】 我们发现:等物质的量的乙烷、乙烯和乙炔完全燃烧的后,乙炔所消耗的氧气的物质的量最少,生成水的物质的量也最少。因此,在燃烧时用于提高氧的温度和使水汽化所消耗掉的反应热也最少,所以乙炔焰的温度最高,可达30000C以上。利用其燃烧热可切割或焊接金属。 现提供焦炭、生石灰、食盐、水四种化
学原料,请通过适当的化学反应合成聚氯
乙烯。探究活动:分析上图中硫酸铜溶液的作用是什么?
