浙江省台州市山海协作体2024-2025学年高二上学期期中联考 化学试题(含答案)
文档属性
| 名称 | 浙江省台州市山海协作体2024-2025学年高二上学期期中联考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 499.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-13 13:58:47 | ||
图片预览


文档简介
绝密★考试结束前
2024学年第一学期台州市山海协作体期中联考
高二年级化学学科试题
考生须知:
1.本卷共8页满分100分,考试时间90分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Ag-108 Mg-24 Ca-40
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一个符合题目要求,不选、多选、错选均不得分)
1.下列属于弱电解质的是
A.饱和食盐水 B.冰醋酸 C.C2H5OH D.硫酸钡
2.关于热化学方程式,下列说法正确的是
A.热化学方程式:2SO2(g)+O2(g)2SO3(g) △H=-196.6kJ/mol,表示2molSO2和1molO2在一定条件下充分反应后达到平衡状态热量196.6kJ
B.△H的单位中“mol”是指反应物为1mol
C.已知:正戊烷(1)=新戊烷(l) △H<0,则等质量的正戊烷(1)和新戊烷(l)燃烧,正戊烷(l)放出的热量更多
D.常温常压下,1gH2燃烧放出的热量为143kJ,则H2燃烧的热化学方程式可表示为H2(g)+O2(g)=H2O(g) △H=-143kJ/mol
3.下列对化学反应速率增大原因的分析错误的是
A.对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多
B.升高温度,使反应物分子中活化分子百分数增大
C.向反应体系中加入相同浓度的反应物,使活化分子百分数增大
D.加入适宜的催化剂,使反应物分子中活化分子百分数增大
4.下列事实不能用勒夏特列原理解释的是
A.牙膏中添加氟化物可以起到预防龋齿的作用
B.将饱和的FeCl3溶液滴入沸腾的蒸馏水中有利于Fe(OH)3胶体的形成
C.向2mL0.1mol/L的K2CrO4溶液中加入2-3滴6mol/L的硫酸,溶液颜色由黄色变为橙色
D.工业生产广泛使用催化剂来加快反应速率
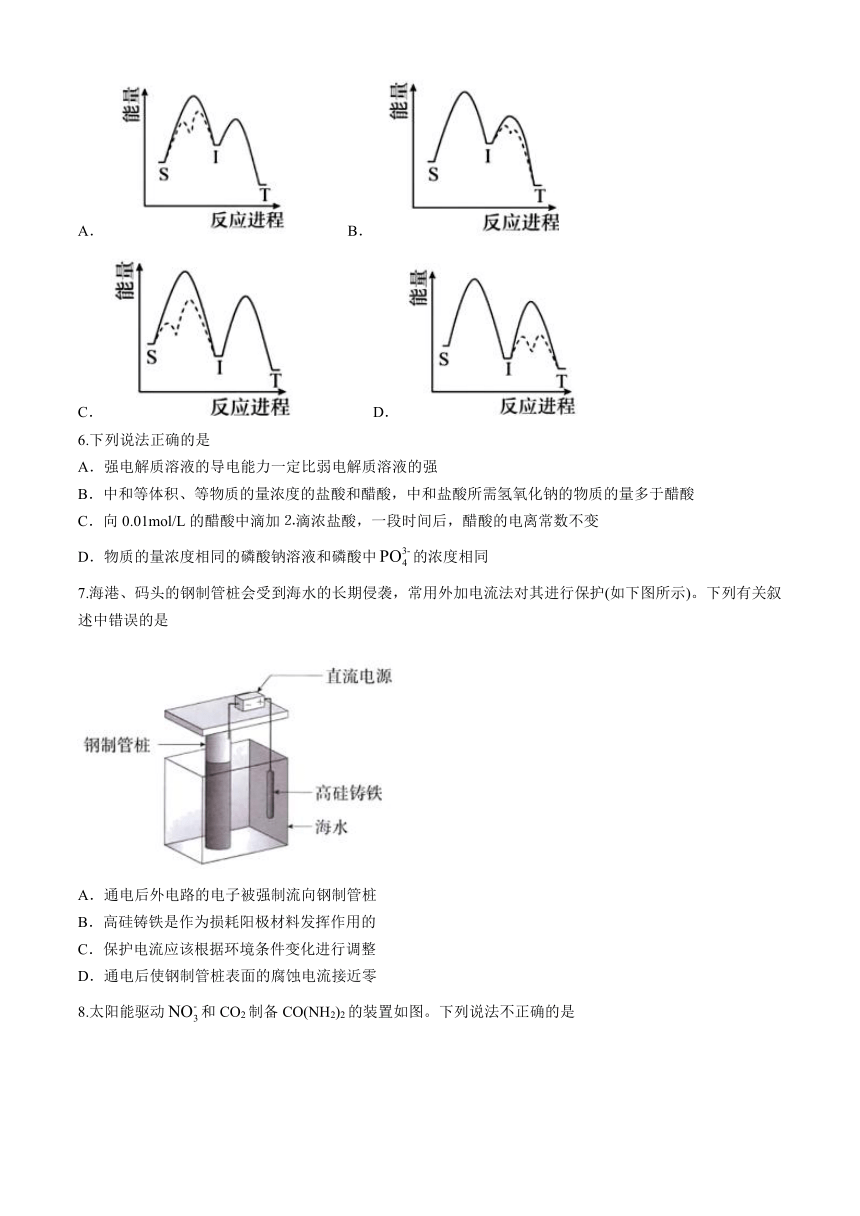
5.对反应S(g)T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,增大,减小。基于以上事实,可能的反应历程示意图为(—为无催化剂,---为有催化剂)
A. B.
C. D.
6.下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.中和等体积、等物质的量浓度的盐酸和醋酸,中和盐酸所需氢氧化钠的物质的量多于醋酸
C.向0.01mol/L的醋酸中滴加⒉滴浓盐酸,一段时间后,醋酸的电离常数不变
D.物质的量浓度相同的磷酸钠溶液和磷酸中的浓度相同
7.海港、码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如下图所示)。下列有关叙述中错误的是
A.通电后外电路的电子被强制流向钢制管桩
B.高硅铸铁是作为损耗阳极材料发挥作用的
C.保护电流应该根据环境条件变化进行调整
D.通电后使钢制管桩表面的腐蚀电流接近零
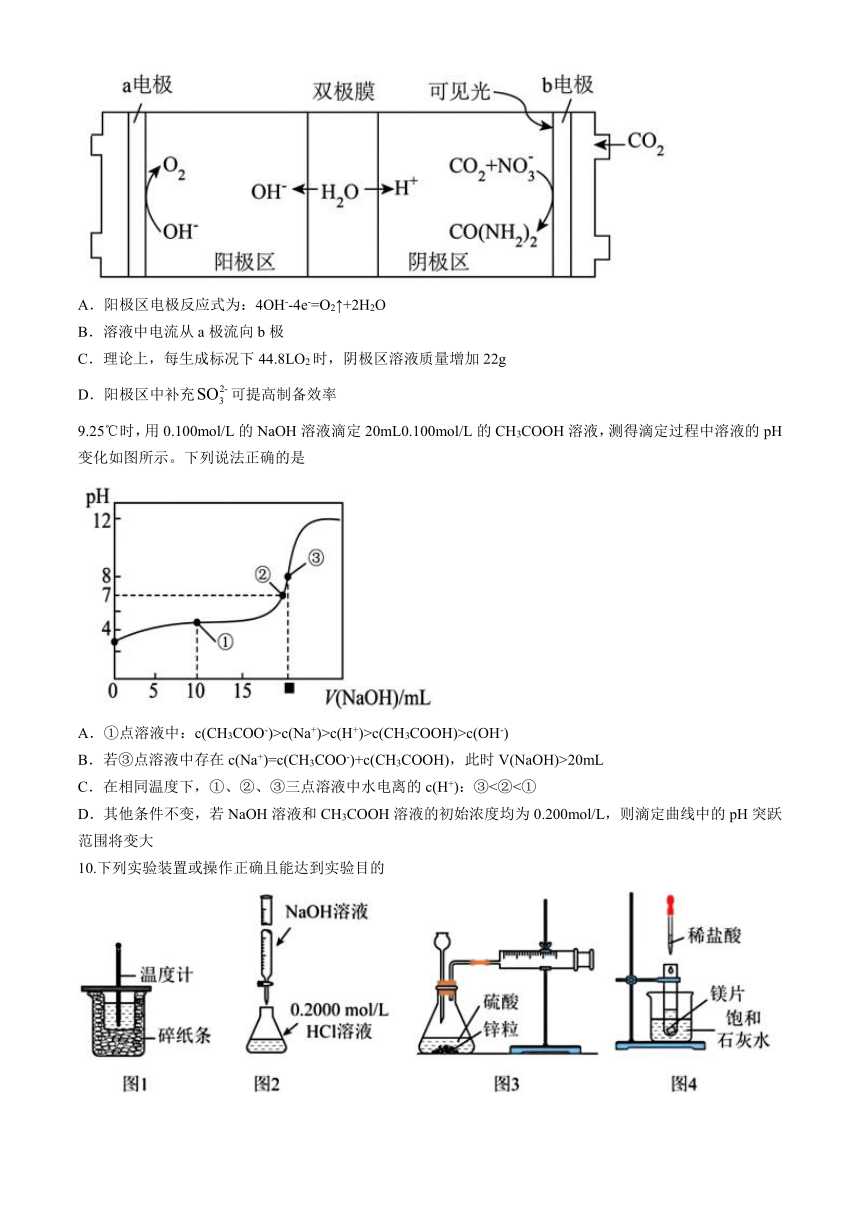
8.太阳能驱动和CO2制备CO(NH2)2的装置如图。下列说法不正确的是
A.阳极区电极反应式为:4OH--4e-=O2↑+2H2O
B.溶液中电流从a极流向b极
C.理论上,每生成标况下44.8LO2时,阴极区溶液质量增加22g
D.阳极区中补充可提高制备效率
9.25℃时,用0.100mol/L的NaOH溶液滴定20mL0.100mol/L的CH3COOH溶液,测得滴定过程中溶液的pH变化如图所示。下列说法正确的是
A.①点溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)>c(OH-)
B.若③点溶液中存在c(Na+)=c(CH3COO-)+c(CH3COOH),此时V(NaOH)>20mL
C.在相同温度下,①、②、③三点溶液中水电离的c(H+):③<②<①
D.其他条件不变,若NaOH溶液和CH3COOH溶液的初始浓度均为0.200mol/L,则滴定曲线中的pH突跃范围将变大
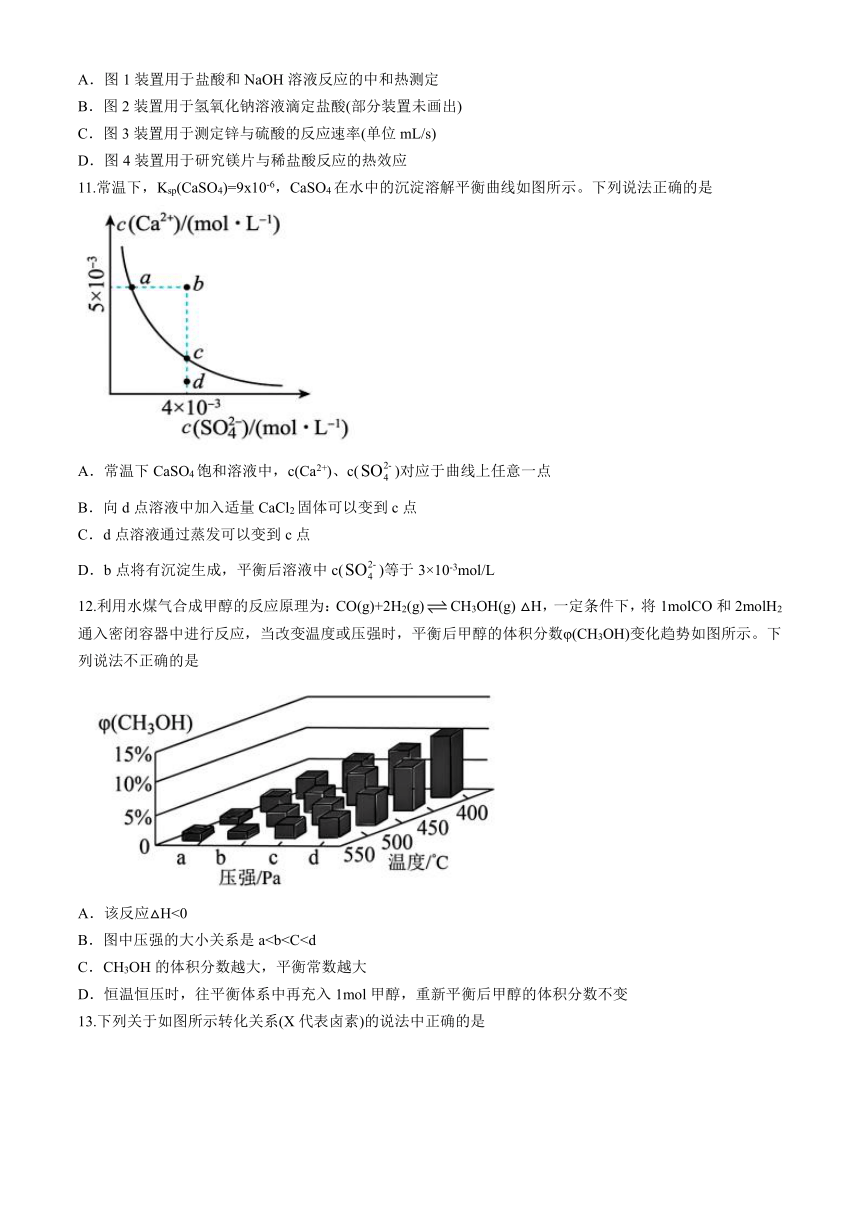
10.下列实验装置或操作正确且能达到实验目的
A.图1装置用于盐酸和NaOH溶液反应的中和热测定
B.图2装置用于氢氧化钠溶液滴定盐酸(部分装置未画出)
C.图3装置用于测定锌与硫酸的反应速率(单位mL/s)
D.图4装置用于研究镁片与稀盐酸反应的热效应
11.常温下,Ksp(CaSO4)=9x10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.常温下CaSO4饱和溶液中,c(Ca2+)、c()对应于曲线上任意一点
B.向d点溶液中加入适量CaCl2固体可以变到c点
C.d点溶液通过蒸发可以变到c点
D.b点将有沉淀生成,平衡后溶液中c()等于3×10-3mol/L
12.利用水煤气合成甲醇的反应原理为:CO(g)+2H2(g)CH3OH(g) △H,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
A.该反应△H<0
B.图中压强的大小关系是aC.CH3OH的体积分数越大,平衡常数越大
D.恒温恒压时,往平衡体系中再充入1mol甲醇,重新平衡后甲醇的体积分数不变
13.下列关于如图所示转化关系(X代表卤素)的说法中正确的是
A. △H1越小,HX就越稳定
B. △H1+△H2+△H3=0
C.按照Cl、Br、I的顺序,△H2依次增大
D.过程Ⅲ能量变化形式与高温煅烧石灰石的能量变化形式相同
14.常温下,往10mL0.1molLFeSO4溶液中通入H2S形成饱和溶液X,有微量FeS生成。溶液X中c(H2S)=0.1molL(溶液体积和FeSO4浓度的变化忽略不计)。已知:H2S电离常数Ka1=1.1×10-7、Ka2=1.3×10-13,Ksp(FeS)=6.3×10-18.下列说法不正确的是
A.溶液又中,c(S2-)=6.3×10-17mol/L
B.反应FeS(s)+2H+(aq)Fe2+(aq)+H2S(aq)的K=4.4×102
C.溶液X中,c(HS-)>c(OH-)
D.溶液X中存在2c(Fe2+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
15.叔丁基溴[(CH3)3CBr]在乙醇中反应的能量变化如图所示。
反应1:(CH3)3CBr(CH3)2C=CH2+HBr
反应2:C2H5OH+(CH3)3CBr(CH3)3COC2H5+HBr
下列说法不正确的是
A.(CH3)2C=CH2在乙醇中反应生成(CH3)3COC2H5时,反应的催化剂是H+
B.(CH3)2C=CH2在乙醇中反应生成(CH3)3COC2H5时,增加催化剂HBr的用量,可以提高(CH3)2C=CH2转化为(CH3)3COC2H5的选择性,减少副反应
C. (CH3)2C=CH2在乙醇中反应生成(CH3)3COC2H5时,决速步反应活化能为E6-E2
D.升高温度,(CH3)2C=CH2与乙醇反应转化率下降,(CH3)2C=CH2与HBr反应转化率升高
16.下列实验方案设计、现象和结论都正确的是
方案设计 现象和结论
A 分别取10mL0.lmol/LNa2S2O3溶液和5mL0.lmol/LNa2S2O3溶液、5mL蒸馏水于两支试管中,然后同时加入10mL0.1mol/LH2SO4溶液 前者出现浑浊的时间更短,说明增大Na2S2O3浓度,可以加快反应速率
B 用0.1mol/LNaOH溶液分别中和等体积的0.1mol/LH2SO4溶液和0.1mol/LCH3COOH溶液,H2SO4消耗的NaOH溶液多 酸性:H2SO4>CH3COOH
C 向2mL浓度均为0.1mol/L的CaCl2和BaCl2混合溶液中滴加少量0.1mol/LNa2CO3溶液,振荡,产生白色沉淀 溶度积常数:CaCO3>BaCO3
D 用pH试纸分别测定CH3COONa溶液和NaNO2溶液pH,CH3COONa溶液pH大 结合H能力:CH3COO->
非选择题部分
17.(9分)84消毒液是日常生活中常见的消毒剂,它的有效成分是NaClO,请回答:
(1)NalO溶液呈碱性的原因是:_________(用离子方程式表示)。
(2)将NaClO溶液加水稀释,的比值将______(“增大”、“减小”、“不变”)。
(3)NaClO溶液中各离子浓度从大到小的顺序为____________。
(4)已知25℃时,HClO的电离常数Ka=4.0×10-8,则NaClO的水解常数为________,当NaClO溶液中=4:1时,溶液的pH值为_______。
(5)在实验室中,将NaClO溶液滴加到尿素[CO(NH2)2]和NaOH(过量)的混合液中可制得N2H4,写出该反应的离子方程式____________。
18.(9分)某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的步骤如下(设该药片中的其他成分不与盐酸和氢氧化钠反应):
1、配制0.1000mol/L稀盐酸和0.1000mol/LNaOH溶液;
2、将一粒药片(0.1000g)研碎,放入锥形瓶中并加入20.00mL蒸馏水溶解;
3、向步骤2中的锥形瓶中加入25.00mL0.1000mol/L稀盐酸,并滴加2滴酚酞溶液;
4、用0.1000mol/LNaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
请回答下列问题:
(1)选用上图中仪器______(填“A”或“B”)盛放0.1000mol/LNaOH标准液。
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检查滴定管是否漏水→用蒸馏水洗涤→____→____→e→____→____→开始滴定
a.烘干 b.装入待装液至零刻度以上 c.调整滴定管液面至零刻度或零刻度以下d.记录起始读数 e.排除气泡 f.用待装液润洗滴定管2-3次
(3)滴定达到终点的现象是__________。
(4)某同学四次实验数据如下表所示:
实验编号 滴定前读数 滴定后读数
1 0.90 14.00
2 0.80 13.70
3 0.80 13.80
4 0.60 14.00
根据表中数据,计算该药片中碳酸钙的质量分数为__________。
(5)以下会导致测定结果偏低的是_______。
A.锥形瓶洗涤之后未干燥
B.滴定前读数时仰视,滴定后读数时俯视
C.滴定前未排出气泡,滴定后气泡消失
D.碱式滴定管使用前,水洗后未用待装液润洗
19.(15分)探究用铁盐溶液溶解银镜实验后的银:
①实验i:甲同学向有银镜的试管中逐滴加入过量0.2mol/LFe(NO3)3溶液(pH=2),银镜消失,溶液变为澄清,得出Fe3+能与Ag反应的结论。乙同学认为该实验不够严谨,原因是________(用离子方程式表示)。
②实验ii:乙同学改进实验,向另一支含有等量银镜的试管中逐滴加入过量0.1mol/L的Fe2(SO4)3溶液(pH=2),充分振荡,银镜逐渐消失,溶液黄色明显变浅,产生较多白色沉淀。
请回答:
(1)乙同学猜测该白色沉淀为Ag2SO4.取少量固体于试管中,加入足量的Na2C2O4溶液,白色沉淀变成红色(Ag2C2O4为红色沉淀),写出该沉淀转化的离子方程式:__________,该反应的平衡常数为______,根据计算结果,该反应______(填“能”或“不能"”)转化完全。[已知25℃时,Ag2C2O4、Ag2SO4的Ksp分别为2×10-12和1.2×10-5]
(2)取少量上层清液,加入下列_____溶液(填字母),若出现______现象,则充分说明Fe3+能与Ag反应。
A.KSCN B.K3[Fe(CN)6] C.BaCl2 D.K4[Fe(CN)6]
(3)丙同学查阅资料发现,Ag+、Fe3+的氧化性差异不大,一定条件下,Ag和Fe3+反应是可逆反应,设计如下电化学装置进行验证。
①其中石墨电极为_____(填“正极”或“负极”),电极反应式为_____。
②按上图组装好仪器并加入药品,观察到银电极有灰黑色固体析出,电流表A指针向右偏转,一段时间后指针归零,再向左池加入较浓______溶液,产生_____的现象说明Ag和Fe3+的反应为可逆反应。
③假设电池工作时右侧银电极质量变化为1.08g,理论上以电流强度为1.6A的恒定电流可以工作_________分钟
[已知:电荷量q(C)=电流Ⅰ(A)×时间t(s);NA=6.0×1023mol;e=1.60×10-19C]
20.(10分)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为:2NO2(g)+O3(g)N2O5(g)+O2(g)
(1)该脱硝反应正反应为______反应。(填“放热”或“吸热”)理由是:_______。
(2)某温度时,在体积为1L的刚性密闭容器中充入2molNO2和1molO3发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是______(填标号)。
A.NO2的消耗速率与O2的消耗速率相等
B.混合气体压强不再改变
C.混合气体的平均相对分子质量保持不变
D.N2O5与O2的物质的量浓度相等
②欲增加NO2的平衡转化率,可采取的措施有______(填标号)。
A.充入氦气 B.升高温度
C.充入2molNO2 D.充入2molNO2和1molO3
(3)若T1时将18molNO2和8molO3充入容积为2L的密闭容器中发生上述脱硝反应,O3的物质的量变化如下表所示。
物质的量/mol T1/℃
0 5min 10min 15min
O3 8.0 3.5 2.0 2.0
①在T1/℃条件下0-5min内,以NO2表示的该反应速率v(NO2)=_____mol/(L min),N2O5的平衡浓度为_____mol/L,该条件下的平衡常数K=_____L/mol。
②若15min时,保持T1不变,向该容器中再加入该四种反应混合物各1mol,则此时反应向________移动(填“正向”、“逆向"或“不”);
21.(9分)某团队研究在催化剂作用下,以NO和H2合成NH3,主要反应如下:反应Ⅰ:2NO(g)+5H2(g)2NH3(g)+2H2O(g) △H1=-756.9kJ·mol-1
反应Ⅱ:2NO(g)+2H2(g)N2(g)+2H2O(g) △H2=-664.5kJ·mol-1.
请回答下列问题:
(1)根据△H1和△H2,N2(g)+3H2(g)2NH3(g) △H=__kJ·mol-1
(2)若在恒温恒压密闭容器中只发生反应Ⅰ,下列条件能说明反应Ⅰ一定已达到平衡状态的是_______。
A﹒容器内气体平均密度不再发生变化
B.容器内NH3和H2O的质量比恒定
C.容器内某种气体的质量不再发生变化
D.反应放出的热量值达756.9kJ
(3)已知反应Ⅱ的速率方程式v正=k正p(NO)p(H2),v逆=k逆p(N2)p2(H2O)(其中k为速率常数,只跟温度和催化剂有关;p为对应物质的分压)。在T℃、100kPa条件下,向恒压密闭容器中充入2molNO和6molH2发生上述反应Ⅰ和Ⅱ,测得平衡时NO转化率为80%,N2的选择性为50%(N2的选择性=×100%),则平衡时反应Ⅱ的=_________。
(4)已知上述体系中,反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ的影响,即可认为反应Ⅰ建立平衡后始终处于平衡状态。图1表示一定条件下,体系中NH3的物质的量随反应时间的变化,若选择对反应Ⅰ催化效果更好的催化剂A,请在图1中画出催化剂A作用下,体系中NH3的物质的量随反应时间的变化。
(5)在密闭容器中充入2molNO和5molH2,催化剂作用下发生上述反应Ⅰ和Ⅱ,实验测得NO转化率和NH3选择性与温度的关系如图2所示,温度350℃到450℃时,NO转化率增大,但NH3选择性降低,主要原因是_______。
2024学年第一学期台州市山海协作体期中联考
高二年级化学学科参考答案
一、选择题(每小题3分,共48分)
题号 1 2 3 4 5 6 7 8
答案 B C C D A C B C
题号 9 10 11 12 13 14 15 16
答案 D D B C A D B A
二、填空题(共52分)
17.(共9分)
(1)ClO-+H2OHClO+OH-(1分)
(2)减小(1分)
(3)c(Na+)>c(ClO-)>c(OH-)>c(H+)(2分)
(4)2.5×10-7(2分) 8(1分)
(5)CO(NH2)2+ClO-+2OH-=+N2H4+Cl-+H2O(2分)
18.(共9分)
(1)A(1分)
(2)f、b(1分) c、d(1分)
(3)滴入最后半滴NaOH标准液,溶液由无色变为浅红色(1分),且半分钟内不褪色。(1分)
(4)60.00%(2分,精确度不做要求)
(5)CD(2分,写1个且正确给Ⅰ分,有错不给分)
19.(共15分)
①3Ag+4H++=3Ag++NO↑+2H2O(2分,化学式错误不得分,未配平1分,1不做要求)
(1)Ag2SO4+Ag2C2O4+ (2分) 6×106(1分) 能(1分)
(2)B(1分) 蓝色沉淀(1分)
(3)①负极(1分) Fe2+-e-=Fe3+(1分)
②Fe2(SO4)3(1分,合理即可) 银电极上固体逐渐减少(1分),电流表指针向左偏转,一段时间后指针归零。(1分)
③10(2分)
20.(共10分)
(1)放热(1分) △S<0且反应自发,△H<0(1分)
(2)①BC(2分) ②D(1分)
(3)①0.9(1分) 3(1分) 1(2分) ②正向(1分)
(4) (2分)
21.(9分)
(1)-92.4(1分,负号没有0分)
(2)AC(2分)
(3)或0.25(2分)
(5)反应Ⅰ和Ⅱ均为放热反应,温度350℃到450℃时体系未达平衡,温度升高,反应速率加快,NO转化率增大;反应Ⅰ达平衡,反应Ⅱ继续正向进行,使反应Ⅰ平衡逆移,选择性减小(或催化剂对反应Ⅰ的催化效率下降等)(2分)
2024学年第一学期台州市山海协作体期中联考
高二年级化学学科试题
考生须知:
1.本卷共8页满分100分,考试时间90分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Ag-108 Mg-24 Ca-40
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一个符合题目要求,不选、多选、错选均不得分)
1.下列属于弱电解质的是
A.饱和食盐水 B.冰醋酸 C.C2H5OH D.硫酸钡
2.关于热化学方程式,下列说法正确的是
A.热化学方程式:2SO2(g)+O2(g)2SO3(g) △H=-196.6kJ/mol,表示2molSO2和1molO2在一定条件下充分反应后达到平衡状态热量196.6kJ
B.△H的单位中“mol”是指反应物为1mol
C.已知:正戊烷(1)=新戊烷(l) △H<0,则等质量的正戊烷(1)和新戊烷(l)燃烧,正戊烷(l)放出的热量更多
D.常温常压下,1gH2燃烧放出的热量为143kJ,则H2燃烧的热化学方程式可表示为H2(g)+O2(g)=H2O(g) △H=-143kJ/mol
3.下列对化学反应速率增大原因的分析错误的是
A.对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多
B.升高温度,使反应物分子中活化分子百分数增大
C.向反应体系中加入相同浓度的反应物,使活化分子百分数增大
D.加入适宜的催化剂,使反应物分子中活化分子百分数增大
4.下列事实不能用勒夏特列原理解释的是
A.牙膏中添加氟化物可以起到预防龋齿的作用
B.将饱和的FeCl3溶液滴入沸腾的蒸馏水中有利于Fe(OH)3胶体的形成
C.向2mL0.1mol/L的K2CrO4溶液中加入2-3滴6mol/L的硫酸,溶液颜色由黄色变为橙色
D.工业生产广泛使用催化剂来加快反应速率
5.对反应S(g)T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,增大,减小。基于以上事实,可能的反应历程示意图为(—为无催化剂,---为有催化剂)
A. B.
C. D.
6.下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.中和等体积、等物质的量浓度的盐酸和醋酸,中和盐酸所需氢氧化钠的物质的量多于醋酸
C.向0.01mol/L的醋酸中滴加⒉滴浓盐酸,一段时间后,醋酸的电离常数不变
D.物质的量浓度相同的磷酸钠溶液和磷酸中的浓度相同
7.海港、码头的钢制管桩会受到海水的长期侵袭,常用外加电流法对其进行保护(如下图所示)。下列有关叙述中错误的是
A.通电后外电路的电子被强制流向钢制管桩
B.高硅铸铁是作为损耗阳极材料发挥作用的
C.保护电流应该根据环境条件变化进行调整
D.通电后使钢制管桩表面的腐蚀电流接近零
8.太阳能驱动和CO2制备CO(NH2)2的装置如图。下列说法不正确的是
A.阳极区电极反应式为:4OH--4e-=O2↑+2H2O
B.溶液中电流从a极流向b极
C.理论上,每生成标况下44.8LO2时,阴极区溶液质量增加22g
D.阳极区中补充可提高制备效率
9.25℃时,用0.100mol/L的NaOH溶液滴定20mL0.100mol/L的CH3COOH溶液,测得滴定过程中溶液的pH变化如图所示。下列说法正确的是
A.①点溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)>c(OH-)
B.若③点溶液中存在c(Na+)=c(CH3COO-)+c(CH3COOH),此时V(NaOH)>20mL
C.在相同温度下,①、②、③三点溶液中水电离的c(H+):③<②<①
D.其他条件不变,若NaOH溶液和CH3COOH溶液的初始浓度均为0.200mol/L,则滴定曲线中的pH突跃范围将变大
10.下列实验装置或操作正确且能达到实验目的
A.图1装置用于盐酸和NaOH溶液反应的中和热测定
B.图2装置用于氢氧化钠溶液滴定盐酸(部分装置未画出)
C.图3装置用于测定锌与硫酸的反应速率(单位mL/s)
D.图4装置用于研究镁片与稀盐酸反应的热效应
11.常温下,Ksp(CaSO4)=9x10-6,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.常温下CaSO4饱和溶液中,c(Ca2+)、c()对应于曲线上任意一点
B.向d点溶液中加入适量CaCl2固体可以变到c点
C.d点溶液通过蒸发可以变到c点
D.b点将有沉淀生成,平衡后溶液中c()等于3×10-3mol/L
12.利用水煤气合成甲醇的反应原理为:CO(g)+2H2(g)CH3OH(g) △H,一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后甲醇的体积分数φ(CH3OH)变化趋势如图所示。下列说法不正确的是
A.该反应△H<0
B.图中压强的大小关系是a
D.恒温恒压时,往平衡体系中再充入1mol甲醇,重新平衡后甲醇的体积分数不变
13.下列关于如图所示转化关系(X代表卤素)的说法中正确的是
A. △H1越小,HX就越稳定
B. △H1+△H2+△H3=0
C.按照Cl、Br、I的顺序,△H2依次增大
D.过程Ⅲ能量变化形式与高温煅烧石灰石的能量变化形式相同
14.常温下,往10mL0.1molLFeSO4溶液中通入H2S形成饱和溶液X,有微量FeS生成。溶液X中c(H2S)=0.1molL(溶液体积和FeSO4浓度的变化忽略不计)。已知:H2S电离常数Ka1=1.1×10-7、Ka2=1.3×10-13,Ksp(FeS)=6.3×10-18.下列说法不正确的是
A.溶液又中,c(S2-)=6.3×10-17mol/L
B.反应FeS(s)+2H+(aq)Fe2+(aq)+H2S(aq)的K=4.4×102
C.溶液X中,c(HS-)>c(OH-)
D.溶液X中存在2c(Fe2+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
15.叔丁基溴[(CH3)3CBr]在乙醇中反应的能量变化如图所示。
反应1:(CH3)3CBr(CH3)2C=CH2+HBr
反应2:C2H5OH+(CH3)3CBr(CH3)3COC2H5+HBr
下列说法不正确的是
A.(CH3)2C=CH2在乙醇中反应生成(CH3)3COC2H5时,反应的催化剂是H+
B.(CH3)2C=CH2在乙醇中反应生成(CH3)3COC2H5时,增加催化剂HBr的用量,可以提高(CH3)2C=CH2转化为(CH3)3COC2H5的选择性,减少副反应
C. (CH3)2C=CH2在乙醇中反应生成(CH3)3COC2H5时,决速步反应活化能为E6-E2
D.升高温度,(CH3)2C=CH2与乙醇反应转化率下降,(CH3)2C=CH2与HBr反应转化率升高
16.下列实验方案设计、现象和结论都正确的是
方案设计 现象和结论
A 分别取10mL0.lmol/LNa2S2O3溶液和5mL0.lmol/LNa2S2O3溶液、5mL蒸馏水于两支试管中,然后同时加入10mL0.1mol/LH2SO4溶液 前者出现浑浊的时间更短,说明增大Na2S2O3浓度,可以加快反应速率
B 用0.1mol/LNaOH溶液分别中和等体积的0.1mol/LH2SO4溶液和0.1mol/LCH3COOH溶液,H2SO4消耗的NaOH溶液多 酸性:H2SO4>CH3COOH
C 向2mL浓度均为0.1mol/L的CaCl2和BaCl2混合溶液中滴加少量0.1mol/LNa2CO3溶液,振荡,产生白色沉淀 溶度积常数:CaCO3>BaCO3
D 用pH试纸分别测定CH3COONa溶液和NaNO2溶液pH,CH3COONa溶液pH大 结合H能力:CH3COO->
非选择题部分
17.(9分)84消毒液是日常生活中常见的消毒剂,它的有效成分是NaClO,请回答:
(1)NalO溶液呈碱性的原因是:_________(用离子方程式表示)。
(2)将NaClO溶液加水稀释,的比值将______(“增大”、“减小”、“不变”)。
(3)NaClO溶液中各离子浓度从大到小的顺序为____________。
(4)已知25℃时,HClO的电离常数Ka=4.0×10-8,则NaClO的水解常数为________,当NaClO溶液中=4:1时,溶液的pH值为_______。
(5)在实验室中,将NaClO溶液滴加到尿素[CO(NH2)2]和NaOH(过量)的混合液中可制得N2H4,写出该反应的离子方程式____________。
18.(9分)某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的步骤如下(设该药片中的其他成分不与盐酸和氢氧化钠反应):
1、配制0.1000mol/L稀盐酸和0.1000mol/LNaOH溶液;
2、将一粒药片(0.1000g)研碎,放入锥形瓶中并加入20.00mL蒸馏水溶解;
3、向步骤2中的锥形瓶中加入25.00mL0.1000mol/L稀盐酸,并滴加2滴酚酞溶液;
4、用0.1000mol/LNaOH溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
请回答下列问题:
(1)选用上图中仪器______(填“A”或“B”)盛放0.1000mol/LNaOH标准液。
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检查滴定管是否漏水→用蒸馏水洗涤→____→____→e→____→____→开始滴定
a.烘干 b.装入待装液至零刻度以上 c.调整滴定管液面至零刻度或零刻度以下d.记录起始读数 e.排除气泡 f.用待装液润洗滴定管2-3次
(3)滴定达到终点的现象是__________。
(4)某同学四次实验数据如下表所示:
实验编号 滴定前读数 滴定后读数
1 0.90 14.00
2 0.80 13.70
3 0.80 13.80
4 0.60 14.00
根据表中数据,计算该药片中碳酸钙的质量分数为__________。
(5)以下会导致测定结果偏低的是_______。
A.锥形瓶洗涤之后未干燥
B.滴定前读数时仰视,滴定后读数时俯视
C.滴定前未排出气泡,滴定后气泡消失
D.碱式滴定管使用前,水洗后未用待装液润洗
19.(15分)探究用铁盐溶液溶解银镜实验后的银:
①实验i:甲同学向有银镜的试管中逐滴加入过量0.2mol/LFe(NO3)3溶液(pH=2),银镜消失,溶液变为澄清,得出Fe3+能与Ag反应的结论。乙同学认为该实验不够严谨,原因是________(用离子方程式表示)。
②实验ii:乙同学改进实验,向另一支含有等量银镜的试管中逐滴加入过量0.1mol/L的Fe2(SO4)3溶液(pH=2),充分振荡,银镜逐渐消失,溶液黄色明显变浅,产生较多白色沉淀。
请回答:
(1)乙同学猜测该白色沉淀为Ag2SO4.取少量固体于试管中,加入足量的Na2C2O4溶液,白色沉淀变成红色(Ag2C2O4为红色沉淀),写出该沉淀转化的离子方程式:__________,该反应的平衡常数为______,根据计算结果,该反应______(填“能”或“不能"”)转化完全。[已知25℃时,Ag2C2O4、Ag2SO4的Ksp分别为2×10-12和1.2×10-5]
(2)取少量上层清液,加入下列_____溶液(填字母),若出现______现象,则充分说明Fe3+能与Ag反应。
A.KSCN B.K3[Fe(CN)6] C.BaCl2 D.K4[Fe(CN)6]
(3)丙同学查阅资料发现,Ag+、Fe3+的氧化性差异不大,一定条件下,Ag和Fe3+反应是可逆反应,设计如下电化学装置进行验证。
①其中石墨电极为_____(填“正极”或“负极”),电极反应式为_____。
②按上图组装好仪器并加入药品,观察到银电极有灰黑色固体析出,电流表A指针向右偏转,一段时间后指针归零,再向左池加入较浓______溶液,产生_____的现象说明Ag和Fe3+的反应为可逆反应。
③假设电池工作时右侧银电极质量变化为1.08g,理论上以电流强度为1.6A的恒定电流可以工作_________分钟
[已知:电荷量q(C)=电流Ⅰ(A)×时间t(s);NA=6.0×1023mol;e=1.60×10-19C]
20.(10分)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为:2NO2(g)+O3(g)N2O5(g)+O2(g)
(1)该脱硝反应正反应为______反应。(填“放热”或“吸热”)理由是:_______。
(2)某温度时,在体积为1L的刚性密闭容器中充入2molNO2和1molO3发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是______(填标号)。
A.NO2的消耗速率与O2的消耗速率相等
B.混合气体压强不再改变
C.混合气体的平均相对分子质量保持不变
D.N2O5与O2的物质的量浓度相等
②欲增加NO2的平衡转化率,可采取的措施有______(填标号)。
A.充入氦气 B.升高温度
C.充入2molNO2 D.充入2molNO2和1molO3
(3)若T1时将18molNO2和8molO3充入容积为2L的密闭容器中发生上述脱硝反应,O3的物质的量变化如下表所示。
物质的量/mol T1/℃
0 5min 10min 15min
O3 8.0 3.5 2.0 2.0
①在T1/℃条件下0-5min内,以NO2表示的该反应速率v(NO2)=_____mol/(L min),N2O5的平衡浓度为_____mol/L,该条件下的平衡常数K=_____L/mol。
②若15min时,保持T1不变,向该容器中再加入该四种反应混合物各1mol,则此时反应向________移动(填“正向”、“逆向"或“不”);
21.(9分)某团队研究在催化剂作用下,以NO和H2合成NH3,主要反应如下:反应Ⅰ:2NO(g)+5H2(g)2NH3(g)+2H2O(g) △H1=-756.9kJ·mol-1
反应Ⅱ:2NO(g)+2H2(g)N2(g)+2H2O(g) △H2=-664.5kJ·mol-1.
请回答下列问题:
(1)根据△H1和△H2,N2(g)+3H2(g)2NH3(g) △H=__kJ·mol-1
(2)若在恒温恒压密闭容器中只发生反应Ⅰ,下列条件能说明反应Ⅰ一定已达到平衡状态的是_______。
A﹒容器内气体平均密度不再发生变化
B.容器内NH3和H2O的质量比恒定
C.容器内某种气体的质量不再发生变化
D.反应放出的热量值达756.9kJ
(3)已知反应Ⅱ的速率方程式v正=k正p(NO)p(H2),v逆=k逆p(N2)p2(H2O)(其中k为速率常数,只跟温度和催化剂有关;p为对应物质的分压)。在T℃、100kPa条件下,向恒压密闭容器中充入2molNO和6molH2发生上述反应Ⅰ和Ⅱ,测得平衡时NO转化率为80%,N2的选择性为50%(N2的选择性=×100%),则平衡时反应Ⅱ的=_________。
(4)已知上述体系中,反应Ⅰ为快速平衡,可认为不受慢反应Ⅱ的影响,即可认为反应Ⅰ建立平衡后始终处于平衡状态。图1表示一定条件下,体系中NH3的物质的量随反应时间的变化,若选择对反应Ⅰ催化效果更好的催化剂A,请在图1中画出催化剂A作用下,体系中NH3的物质的量随反应时间的变化。
(5)在密闭容器中充入2molNO和5molH2,催化剂作用下发生上述反应Ⅰ和Ⅱ,实验测得NO转化率和NH3选择性与温度的关系如图2所示,温度350℃到450℃时,NO转化率增大,但NH3选择性降低,主要原因是_______。
2024学年第一学期台州市山海协作体期中联考
高二年级化学学科参考答案
一、选择题(每小题3分,共48分)
题号 1 2 3 4 5 6 7 8
答案 B C C D A C B C
题号 9 10 11 12 13 14 15 16
答案 D D B C A D B A
二、填空题(共52分)
17.(共9分)
(1)ClO-+H2OHClO+OH-(1分)
(2)减小(1分)
(3)c(Na+)>c(ClO-)>c(OH-)>c(H+)(2分)
(4)2.5×10-7(2分) 8(1分)
(5)CO(NH2)2+ClO-+2OH-=+N2H4+Cl-+H2O(2分)
18.(共9分)
(1)A(1分)
(2)f、b(1分) c、d(1分)
(3)滴入最后半滴NaOH标准液,溶液由无色变为浅红色(1分),且半分钟内不褪色。(1分)
(4)60.00%(2分,精确度不做要求)
(5)CD(2分,写1个且正确给Ⅰ分,有错不给分)
19.(共15分)
①3Ag+4H++=3Ag++NO↑+2H2O(2分,化学式错误不得分,未配平1分,1不做要求)
(1)Ag2SO4+Ag2C2O4+ (2分) 6×106(1分) 能(1分)
(2)B(1分) 蓝色沉淀(1分)
(3)①负极(1分) Fe2+-e-=Fe3+(1分)
②Fe2(SO4)3(1分,合理即可) 银电极上固体逐渐减少(1分),电流表指针向左偏转,一段时间后指针归零。(1分)
③10(2分)
20.(共10分)
(1)放热(1分) △S<0且反应自发,△H<0(1分)
(2)①BC(2分) ②D(1分)
(3)①0.9(1分) 3(1分) 1(2分) ②正向(1分)
(4) (2分)
21.(9分)
(1)-92.4(1分,负号没有0分)
(2)AC(2分)
(3)或0.25(2分)
(5)反应Ⅰ和Ⅱ均为放热反应,温度350℃到450℃时体系未达平衡,温度升高,反应速率加快,NO转化率增大;反应Ⅰ达平衡,反应Ⅱ继续正向进行,使反应Ⅰ平衡逆移,选择性减小(或催化剂对反应Ⅰ的催化效率下降等)(2分)
同课章节目录
