1.1 课时3 电子云与原子轨道 泡利原理 洪特规则 能量最低原理 课件(共32张PPT)2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1 课时3 电子云与原子轨道 泡利原理 洪特规则 能量最低原理 课件(共32张PPT)2024-2025学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-13 00:00:00 | ||
图片预览









文档简介
(共32张PPT)
电子云与原子轨道
泡利原理
洪特规则
能量最低原理
第一章 原子结构与性质
1.知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
2.认识基态原子中核外电子的排布遵循能量最低原理、泡利原理和洪特规则,
3.能写出1~36号元素基态原子的轨道表示式,初步学会运用模型解决实际问题。
+
1913年,玻尔提出氢原子模型,电子在 上绕核运行。
线性轨道
只限于解释氢原子或类氢原子(单电子)的光谱
无法较好解释多电子原子的光谱
1926年,玻尔建立的线性轨道模型被量子力学推翻。
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可能出现。
我们不可能同时准确地测定一个核外电子在某一瞬间所处的位置和运动速率,但我们可以用统计的方法来判断电子在核外空间某区域出现机会的多少。
——核外电子运动空间的不确定性与概率
一、电子云与原子轨道
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
1.概率密度
公式: ρ =
(电子在某处出现的概率)
(该处的体积)
小点是1s电子在原子核外出现的概率密度的形象描述
氢原子1s电子的概率密度分布图
①小黑点表示电子在原子核外出现的概率密度。
②小点越密,表明概率密度越大。
③电子云图很难绘制,使用不方便,故常使用电子云轮廓图。
2.电子云
3.电子云轮廓图
将电子在原子核外空间出现的概率P=90% 的空间圈出来,绘制电子云的轮廓图,便可描绘电子云的形状。
氢原子的1s电子云轮廓绘制过程
x
y
z
4.原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
→各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道
形状一:s电子的原子轨道
s电子的原子轨道呈球形,能层序数越大,原子轨道的半径越大。
在空间有1个伸展方向,故s电子只有1个原子轨道。
x
y
z
x
y
z
x
y
z
x
y
z
1s
2s
3s
4s
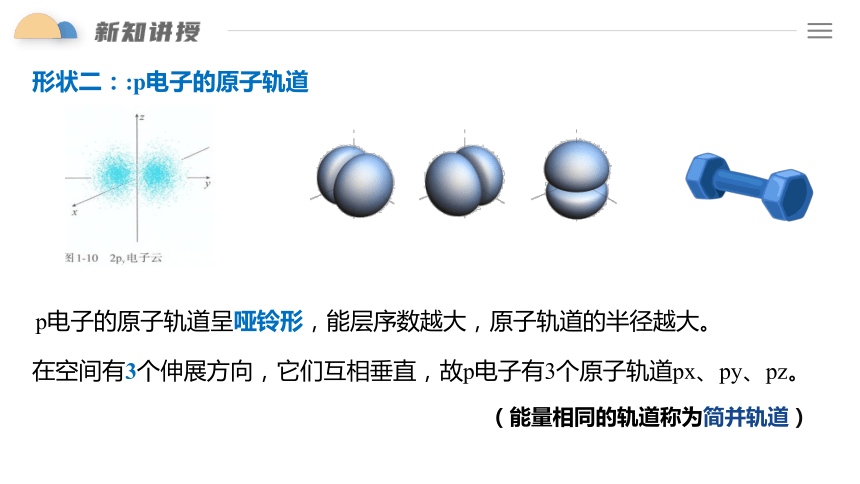
形状二::p电子的原子轨道
p电子的原子轨道呈哑铃形,能层序数越大,原子轨道的半径越大。
在空间有3个伸展方向,它们互相垂直,故p电子有3个原子轨道px、py、pz。
(能量相同的轨道称为简并轨道)
d轨道:
d轨道在空间有__个伸展方向,即d轨道共__个轨道。
5
5
f轨道:
f轨道形状更复杂,在空间有7个伸展方向,即f轨道共7个轨道。
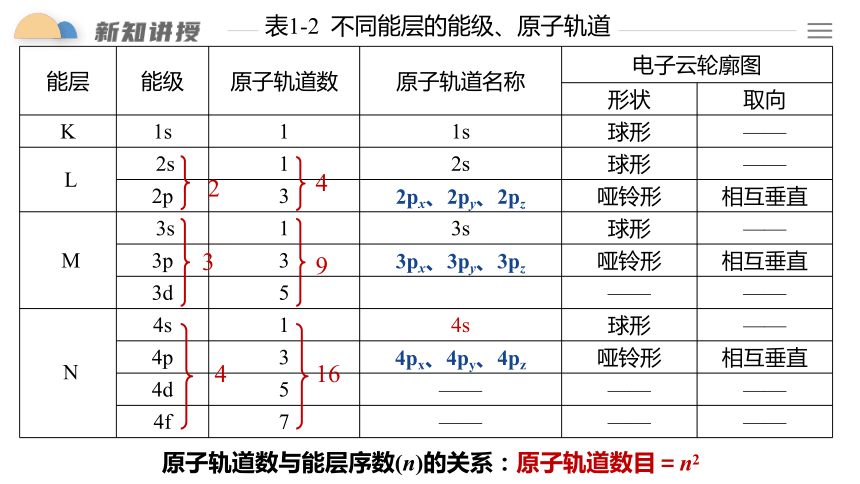
表1-2 不同能层的能级、原子轨道
能层 能级 原子轨道数 原子轨道名称 电子云轮廓图 形状 取向
K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 —— ——
N 4s 1 4s 球形 ——
4p 3 4px、4py、4pz 哑铃形 相互垂直
4d 5 —— —— ——
4f 7 —— —— ——
4
9
2
3
4
16
原子轨道数与能层序数(n)的关系:原子轨道数目=n2
①在原子中第n能层,电子占有的轨道数最多为n2。 ( )
②同一原子中的npx与npy轨道形状相同,半径相同且在空间相互垂直。( )
③电子云图中小黑点密度的大小可表示电子的多少。( )
④p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。( )
⑤2p、3p、4p能级的轨道数依次增多( )
1.判断正误(正确的打“√”,错误的打“×”)
2.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关说法正确的是( )
A、图1中的每个小黑点表示1个电子
B、图2表示1s电子只能在球体内出现
C、图2表明1s轨道呈球形,有无数对称轴
D、图1中的小黑点表示电子在核外所处的位置
C
3.下列说法中正确的是( )
A. 1s22s12p1表示的是激发态原子的核外电子排布
B. 3p2表示3p能级有两个原子轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级中的轨道数依次增多
A
4.基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为____、电子数为_____。
9
4
M
5.3px所代表的含义是( )
A、px轨道上有3个电子
B、第三电子层px轨道有3个伸展方向
C、px电子云有3个伸展方向
D、第三电子层沿x轴方向伸展的P轨道
D
能层数 K L M N O P Q n
能级数 1 2 3 4 5 6 7
轨道数 1 4 9 16 25 36 49
最多容纳电子数 2 8 18 32 50 72 98
n
n2
2n2
2个电子容纳在同一个轨道里,它们的空间运动状态是相同的。
【思考】为什么每个原子轨道中最多可容纳2个电子?
这2个电子的运动状态又是什么样呢?
二、电子自旋与泡利原理
1.电子自旋
(1)定义:1925年,乌伦贝克和哥德斯密根据实验事实提出假设:电子除了空间运动状态外,还存在一种运动状态叫自旋。
(2)两种取向:顺时针和逆时针两种取向(简称自旋相反)
符号表示:↑和↓表示自旋相反的电子
注:
(1)自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
(2)描述核外电子运动状态的四个角度
①能层
②能级
③电子云空间伸展方向
④电子自旋状态
原子轨道
(3)一个原子中不可能存在运动状态完全相同的2个电子
1、某基态原子的核外电子排布式为[Ar]3d104s24p4,下列说法错误的是( )
A.该元素原子核外共有34个运动状态不同的电子B.该元素原子的最高能层符号为N
C.该元素原子核外电子有18种空间运动状态
D.该元素原子价层电子排布式为3d104s24p4
D
运动状态=电子数
空间运动状态=轨道数之和
2.泡利原理
填多少
在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(也称泡利不相容原理)
能级 s p d f
原子轨道数
最多容纳电子数
如2s轨道上的电子排布为 , 不能表示为 。
1
7
5
3
2
14
10
6
怎么填
当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋状态相同。
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
(能量相同的原子轨道)
(自旋方向相同)
2p3的电子排布图
三、洪特规则
能量较低
状态稳定
全充满(p6,d10,f14)
全空时(p0,d0,f0 )
半充满(p3,d5,f7 )
注:在简并轨道上的电子排布处于全满、半充满、全空状态,具有较低的能量和较大的稳定性。
Cr:1s22s22p63s23p63d44s2
Cu:1s22s22p63s23p63d94s2
Cr:1s22s22p63s23p63d54s1
Cu:1s22s22p63s23p63d104s1
√
√
总结:洪特规则不仅适用于基态原子,也适用于基态离子。
洪特规则适用于电子填入简并轨道,并不适用于电子填入能量不同的轨道。
轨道表示式(电子排布图):是表述电子排布的一种图示。
H
H 1s1
O 1s22s22p4
原子轨道
简并轨道:能量相同的原子轨道
电子对
单电子(未成对电子)
自旋平行
能级符号
3、通常应在方框下方或上方标记能级符号,有时画出的能级上下错落,以
表达能量高低不同。
不要标记电子数
注意:1、用□或〇代表一个原子轨道,能量相同的原子轨道的方框相连。在方框
的下方用能级符号表示轨道所属能级。
2、各轨道按照离核由近到远,从左到右依次排列。
1.下列轨道表示式中哪个是硼的基态原子?为什么?
↑↓
↑↓
↑
1s 2s 2p
√
根据泡利原理,在一个原子轨道,最多容纳2个电子,且他们的自旋相反。
2.下列轨道表示式中哪个是氧的基态原子?为什么?
↑↓
↑↓
↑↓
↑
↑
1s 2s 2p
↑↓
↑↓
↑↓
↑
↓
1s 2s 2p
↑↓
↑↓
↑↓
↑↓
1s 2s 2p
√
根据洪特规则,基态原子里,填入简并轨道的电子总是先单独分占,且自旋平行。
四、能量最低原理
1、内容:在构建基态原子时,电子将尽可能占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理。
2、能级的能量高低顺序:如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s→2s→2p→3s→3p→4s→3d→4p”这一顺序)。
整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定。
3、能量相同的原子轨道在全充满、半充满、 全空状态时,体系的能量较低,原子较稳定。
1.下列原子或离子的电子排布式或轨道表示式正确的是________(填序号,下同),违反能量最低原理的是____,违反洪特规则的是____,违反泡利原理的是____。
① Ca2+:1s22s22p63s23p6
② F-:1s22s23p6
③ P:
④ Fe:1s22s22p63s23p63d64s2
⑤ Mg2+:1s22s22p6
⑥ C:
①④⑤
⑥
②
③
核外电子排布表示方法
能量最低原理
泡利原理
洪特规则
核外电子排布三原则
使整个原子能量最低
最多容纳2e-,且自旋相反
先单独分占,且自旋平行
原子结构示意图
电子排布式
简化电子排布式
价电子排布式
轨道表示式
直观反映出核内质子数、核外电子层数及各电子层上的电子数
直观反映能层,能级,能级上的电子数
能直观反映出电子的排布情况和自旋状态
填多少
怎么填
全满、半满、全空相对稳定
专题:原子核外电子排布的表示方法
原子(离子)结构示意图 意义 将每个能层上的电子总数表示在原子核外的式子
实例
电子 排布式 意义 用数字在能级符号右上角标明该能级上排布的电子数
实例 Al:1s22s22p63s23p1
简化 电子 排布式 意义 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示
实例 Al:[Ne] 3s23p1
专题:原子核外电子排布的表示方法
价电子 排布式 意义 主族元素的价层电子指最外层电子,价层电子排布式即外围电子排布式,副族元素还包括次外层的d电子及次次外层的f电子
实例 Al:3s23p1;
Cu:3d104s1
轨道 表示式(电子排布图) 意义 每个方框代表一个原子轨道,每个箭头代表一个电子
实例 Al
S:
专题:原子核外电子排布的表示方法
表示方法
原子结构示意图
电子式
电子排布式
简化电子排布式
价电子排布式
电子排布图
价电子排布图
以硫(S)为举例
S:1s22s22p63s23p4
[Ne]3s23p4
S:3s23p4
——七图式
1.下列有关碳原子的轨道表示式中,能量最低的是( )
A. B.
C. D.
D
2. 写出15P、25Mn的轨道表示式,并按要求填空。
15P: ,有 对电子对,有 个单电子。
25Mn:_____________________________________________________________,有 种空间运动状态,有 个单电子,属于半充满。
6
3
15
5
3.按要求填空。
(1)17Cl的电子排布式:__________________________。
(2)17Cl的价电子排布式:_________________________。
(3)17Cl-的电子式:___________。
1s22s22p63s23p5
3s23p5
(4)17Cl的价电子轨道表示式:__________________。
(5)17Cl的原子结构示意图:________。
电子云与原子轨道
泡利原理
洪特规则
能量最低原理
第一章 原子结构与性质
1.知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
2.认识基态原子中核外电子的排布遵循能量最低原理、泡利原理和洪特规则,
3.能写出1~36号元素基态原子的轨道表示式,初步学会运用模型解决实际问题。
+
1913年,玻尔提出氢原子模型,电子在 上绕核运行。
线性轨道
只限于解释氢原子或类氢原子(单电子)的光谱
无法较好解释多电子原子的光谱
1926年,玻尔建立的线性轨道模型被量子力学推翻。
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可能出现。
我们不可能同时准确地测定一个核外电子在某一瞬间所处的位置和运动速率,但我们可以用统计的方法来判断电子在核外空间某区域出现机会的多少。
——核外电子运动空间的不确定性与概率
一、电子云与原子轨道
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
1.概率密度
公式: ρ =
(电子在某处出现的概率)
(该处的体积)
小点是1s电子在原子核外出现的概率密度的形象描述
氢原子1s电子的概率密度分布图
①小黑点表示电子在原子核外出现的概率密度。
②小点越密,表明概率密度越大。
③电子云图很难绘制,使用不方便,故常使用电子云轮廓图。
2.电子云
3.电子云轮廓图
将电子在原子核外空间出现的概率P=90% 的空间圈出来,绘制电子云的轮廓图,便可描绘电子云的形状。
氢原子的1s电子云轮廓绘制过程
x
y
z
4.原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
→各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道
形状一:s电子的原子轨道
s电子的原子轨道呈球形,能层序数越大,原子轨道的半径越大。
在空间有1个伸展方向,故s电子只有1个原子轨道。
x
y
z
x
y
z
x
y
z
x
y
z
1s
2s
3s
4s
形状二::p电子的原子轨道
p电子的原子轨道呈哑铃形,能层序数越大,原子轨道的半径越大。
在空间有3个伸展方向,它们互相垂直,故p电子有3个原子轨道px、py、pz。
(能量相同的轨道称为简并轨道)
d轨道:
d轨道在空间有__个伸展方向,即d轨道共__个轨道。
5
5
f轨道:
f轨道形状更复杂,在空间有7个伸展方向,即f轨道共7个轨道。
表1-2 不同能层的能级、原子轨道
能层 能级 原子轨道数 原子轨道名称 电子云轮廓图 形状 取向
K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 —— ——
N 4s 1 4s 球形 ——
4p 3 4px、4py、4pz 哑铃形 相互垂直
4d 5 —— —— ——
4f 7 —— —— ——
4
9
2
3
4
16
原子轨道数与能层序数(n)的关系:原子轨道数目=n2
①在原子中第n能层,电子占有的轨道数最多为n2。 ( )
②同一原子中的npx与npy轨道形状相同,半径相同且在空间相互垂直。( )
③电子云图中小黑点密度的大小可表示电子的多少。( )
④p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。( )
⑤2p、3p、4p能级的轨道数依次增多( )
1.判断正误(正确的打“√”,错误的打“×”)
2.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关说法正确的是( )
A、图1中的每个小黑点表示1个电子
B、图2表示1s电子只能在球体内出现
C、图2表明1s轨道呈球形,有无数对称轴
D、图1中的小黑点表示电子在核外所处的位置
C
3.下列说法中正确的是( )
A. 1s22s12p1表示的是激发态原子的核外电子排布
B. 3p2表示3p能级有两个原子轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级中的轨道数依次增多
A
4.基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为____、电子数为_____。
9
4
M
5.3px所代表的含义是( )
A、px轨道上有3个电子
B、第三电子层px轨道有3个伸展方向
C、px电子云有3个伸展方向
D、第三电子层沿x轴方向伸展的P轨道
D
能层数 K L M N O P Q n
能级数 1 2 3 4 5 6 7
轨道数 1 4 9 16 25 36 49
最多容纳电子数 2 8 18 32 50 72 98
n
n2
2n2
2个电子容纳在同一个轨道里,它们的空间运动状态是相同的。
【思考】为什么每个原子轨道中最多可容纳2个电子?
这2个电子的运动状态又是什么样呢?
二、电子自旋与泡利原理
1.电子自旋
(1)定义:1925年,乌伦贝克和哥德斯密根据实验事实提出假设:电子除了空间运动状态外,还存在一种运动状态叫自旋。
(2)两种取向:顺时针和逆时针两种取向(简称自旋相反)
符号表示:↑和↓表示自旋相反的电子
注:
(1)自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
(2)描述核外电子运动状态的四个角度
①能层
②能级
③电子云空间伸展方向
④电子自旋状态
原子轨道
(3)一个原子中不可能存在运动状态完全相同的2个电子
1、某基态原子的核外电子排布式为[Ar]3d104s24p4,下列说法错误的是( )
A.该元素原子核外共有34个运动状态不同的电子B.该元素原子的最高能层符号为N
C.该元素原子核外电子有18种空间运动状态
D.该元素原子价层电子排布式为3d104s24p4
D
运动状态=电子数
空间运动状态=轨道数之和
2.泡利原理
填多少
在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(也称泡利不相容原理)
能级 s p d f
原子轨道数
最多容纳电子数
如2s轨道上的电子排布为 , 不能表示为 。
1
7
5
3
2
14
10
6
怎么填
当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋状态相同。
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
(能量相同的原子轨道)
(自旋方向相同)
2p3的电子排布图
三、洪特规则
能量较低
状态稳定
全充满(p6,d10,f14)
全空时(p0,d0,f0 )
半充满(p3,d5,f7 )
注:在简并轨道上的电子排布处于全满、半充满、全空状态,具有较低的能量和较大的稳定性。
Cr:1s22s22p63s23p63d44s2
Cu:1s22s22p63s23p63d94s2
Cr:1s22s22p63s23p63d54s1
Cu:1s22s22p63s23p63d104s1
√
√
总结:洪特规则不仅适用于基态原子,也适用于基态离子。
洪特规则适用于电子填入简并轨道,并不适用于电子填入能量不同的轨道。
轨道表示式(电子排布图):是表述电子排布的一种图示。
H
H 1s1
O 1s22s22p4
原子轨道
简并轨道:能量相同的原子轨道
电子对
单电子(未成对电子)
自旋平行
能级符号
3、通常应在方框下方或上方标记能级符号,有时画出的能级上下错落,以
表达能量高低不同。
不要标记电子数
注意:1、用□或〇代表一个原子轨道,能量相同的原子轨道的方框相连。在方框
的下方用能级符号表示轨道所属能级。
2、各轨道按照离核由近到远,从左到右依次排列。
1.下列轨道表示式中哪个是硼的基态原子?为什么?
↑↓
↑↓
↑
1s 2s 2p
√
根据泡利原理,在一个原子轨道,最多容纳2个电子,且他们的自旋相反。
2.下列轨道表示式中哪个是氧的基态原子?为什么?
↑↓
↑↓
↑↓
↑
↑
1s 2s 2p
↑↓
↑↓
↑↓
↑
↓
1s 2s 2p
↑↓
↑↓
↑↓
↑↓
1s 2s 2p
√
根据洪特规则,基态原子里,填入简并轨道的电子总是先单独分占,且自旋平行。
四、能量最低原理
1、内容:在构建基态原子时,电子将尽可能占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理。
2、能级的能量高低顺序:如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s→2s→2p→3s→3p→4s→3d→4p”这一顺序)。
整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定。
3、能量相同的原子轨道在全充满、半充满、 全空状态时,体系的能量较低,原子较稳定。
1.下列原子或离子的电子排布式或轨道表示式正确的是________(填序号,下同),违反能量最低原理的是____,违反洪特规则的是____,违反泡利原理的是____。
① Ca2+:1s22s22p63s23p6
② F-:1s22s23p6
③ P:
④ Fe:1s22s22p63s23p63d64s2
⑤ Mg2+:1s22s22p6
⑥ C:
①④⑤
⑥
②
③
核外电子排布表示方法
能量最低原理
泡利原理
洪特规则
核外电子排布三原则
使整个原子能量最低
最多容纳2e-,且自旋相反
先单独分占,且自旋平行
原子结构示意图
电子排布式
简化电子排布式
价电子排布式
轨道表示式
直观反映出核内质子数、核外电子层数及各电子层上的电子数
直观反映能层,能级,能级上的电子数
能直观反映出电子的排布情况和自旋状态
填多少
怎么填
全满、半满、全空相对稳定
专题:原子核外电子排布的表示方法
原子(离子)结构示意图 意义 将每个能层上的电子总数表示在原子核外的式子
实例
电子 排布式 意义 用数字在能级符号右上角标明该能级上排布的电子数
实例 Al:1s22s22p63s23p1
简化 电子 排布式 意义 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示
实例 Al:[Ne] 3s23p1
专题:原子核外电子排布的表示方法
价电子 排布式 意义 主族元素的价层电子指最外层电子,价层电子排布式即外围电子排布式,副族元素还包括次外层的d电子及次次外层的f电子
实例 Al:3s23p1;
Cu:3d104s1
轨道 表示式(电子排布图) 意义 每个方框代表一个原子轨道,每个箭头代表一个电子
实例 Al
S:
专题:原子核外电子排布的表示方法
表示方法
原子结构示意图
电子式
电子排布式
简化电子排布式
价电子排布式
电子排布图
价电子排布图
以硫(S)为举例
S:1s22s22p63s23p4
[Ne]3s23p4
S:3s23p4
——七图式
1.下列有关碳原子的轨道表示式中,能量最低的是( )
A. B.
C. D.
D
2. 写出15P、25Mn的轨道表示式,并按要求填空。
15P: ,有 对电子对,有 个单电子。
25Mn:_____________________________________________________________,有 种空间运动状态,有 个单电子,属于半充满。
6
3
15
5
3.按要求填空。
(1)17Cl的电子排布式:__________________________。
(2)17Cl的价电子排布式:_________________________。
(3)17Cl-的电子式:___________。
1s22s22p63s23p5
3s23p5
(4)17Cl的价电子轨道表示式:__________________。
(5)17Cl的原子结构示意图:________。
