3.1 课时1 铁的单质 课件(共24张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 3.1 课时1 铁的单质 课件(共24张PPT)2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-13 18:41:40 | ||
图片预览







文档简介
(共24张PPT)
铁的单质
第三章 铁 金属材料
宏观辨识与微观探析:
能依据物质类别和元素价态列举铁元素的典型代表物。能利用离子反应、氧化还原反应等概念对铁及其化合物的相关反应进行分类和分析说明。
证据推理与模型认知:
能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测铁及其化合物的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。
科学探究与创新意识:
结合应用实例,将铁和铁的氧化物的性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
前两年,网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。
这是不法商家添加的吗?如果不是,那厂家在食品中添加铁粉的目的是什么?
缺铁性贫血
缺铁性贫血主要是由于铁摄入不足或丢失过多致使血清铁明显减少、贮存铁极度减少所引起的一种贫血。
人体内的含铁化合物主要分为两类:即功能性铁和储存铁。功能性铁参与氧的运输,其余的铁与一些酶结合,分布于身体各器官。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。如果体内的铁不足以供给生命活动的需要,就会发生贫血。
以药物治疗为主,辅以纠正偏食,给予高蛋白、富含维生素、富含铁的食物。
铁元素在人体中又是以什么形式存在呢?
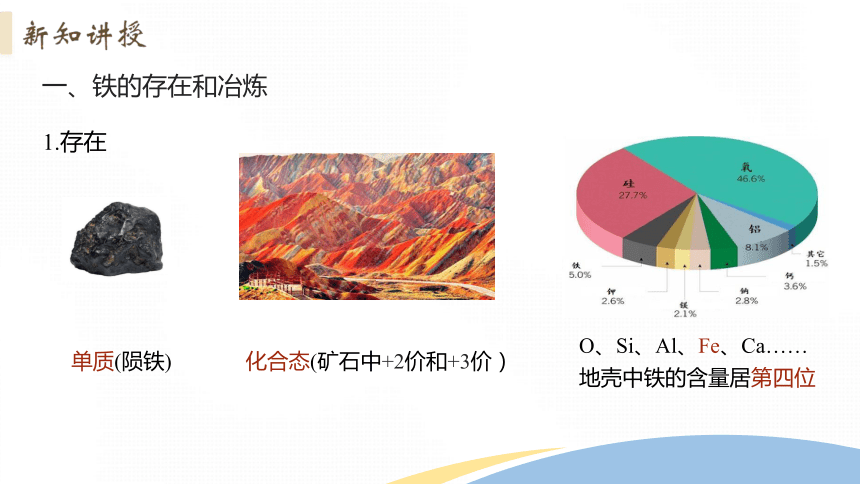
一、铁的存在和冶炼
单质(陨铁)
化合态(矿石中+2价和+3价)
地壳中铁的含量居第四位
O、Si、Al、Fe、Ca……
1.存在
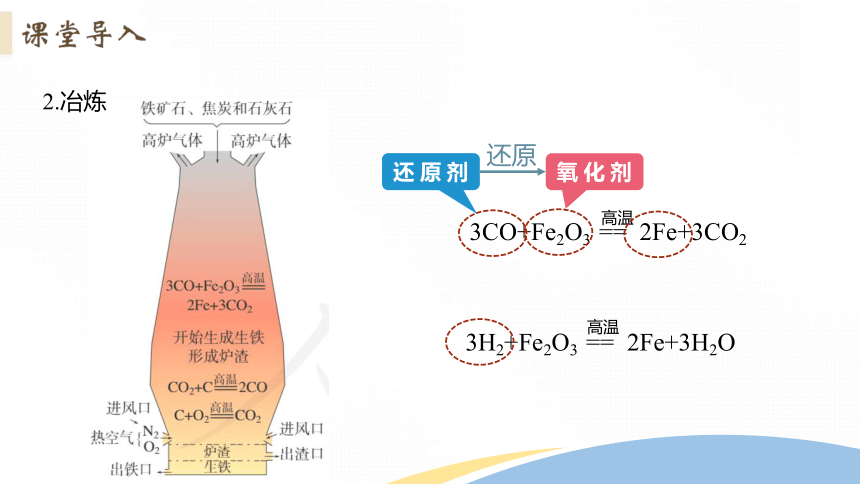
2.冶炼
3CO+Fe2O3 == 2Fe+3CO2
高温
还 原 剂
还原
3H2+Fe2O3 == 2Fe+3H2O
高温
氧 化 剂
常见的铁矿石
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
菱铁矿(FeCO3)
黄铁矿(FeS2)
二、铁的物理性质
银白色固体,有金属光泽,具有良好的延展性,是电和热的良导体,能被磁体吸引。
下图利用了铁的哪些物理性质?铁还有哪些物理性质?
其导电性不如铜和铝, 其熔、沸点较高。
三、铁的化学性质
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
基于物质类别研究单质的性质
铁的化学性质如何?
物质类型角度
金属单质
与非金属单质反应
与酸溶液反应
与某些盐溶液反应
三、铁的化学性质
我们学习过铁与一些物质的反应。在铁与氯气的反应,铁与盐酸的反应,铁与硫酸铜溶液的反应中,铁的化合价的变化有何异同?为什么会有这样的异同?
Fe + 2HCl——2FeCl2 + H2
2Fe + 3Cl2——2FeCl3
点燃
Fe + CuSO4——FeSO4 + Cu
为什么有的化学方程式中铁的化合价变成+2,有的变成+3?
三、铁的化学性质
基于元素价态角度
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
Fe-2e-→Fe2+
Fe-3e-→Fe3+
Fe
Fe2+
Fe3+
强氧化剂
弱氧化剂
Cl2、HNO3等
S、H+、Cu2+等
三、铁的化学性质
1.与某些非金属单质、非氧化性酸和盐溶液反应
①Fe与非金属单质反应
2Fe +3Cl2 ==== 2FeCl3
点燃
3Fe +2O2 ==== Fe3O4
点燃
Fe +S === FeS
三、铁的化学性质
1.与某些非金属单质、非氧化性酸和盐溶液反应
②Fe与酸反应(如稀H2SO4)
③Fe与盐溶液反应(如CuSO4溶液)
Fe + 2H+ === Fe2++ H2↑
Fe + Cu2+ === Fe2++ Cu
常温下,Fe(或Al)遇浓硫酸(或浓硝酸)会钝化,所谓金属钝化是因为金属表面形成致密的氧化膜,阻止反应的进一步发生。
常温下可以用铁桶或者铝制容器盛放浓硫酸或浓硝酸。
那么营养麦片中添加铁粉的目的
①抗氧化,保持麦片新鲜。
(利用铁粉与氧气的反应)
② 补铁。
(铁粉和胃酸发生反应,生成亚铁离子,被人体吸收)
1. 因为添加铁粉的含量极少,所以抗氧化效果并不佳。
2. 通过吃铁粉补充铁元素的做法并不科学,因为胃酸浓度不高,铁粉并不能完全被溶解,吸收率很低。
结论,营养麦片中添加适量铁粉不存在危害。但益处不大。这是商家的营销手段而已。
三、铁的化学性质
炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
?
2. 预测铁与水反应的产物是什么?从物质的类别和元素的价态的变化完成对反应的预测。
1. 铁和水在常温下能反应吗?如何提供水蒸气?如何提供反应所需的高温?
3. 如何验证铁与水反应生成的气体产物?
实验装置如图所示:
①先点燃 处的酒精灯,
再点燃 处的酒精灯。
②用燃着的火柴接触肥皂泡,观察到的现象是 , 证明生成了 。
③反应生成黑色磁性氧化物(Fe3O4)(如何验证?),化学方程式为
_______________________________。
湿棉花
铁粉
肥皂泡燃烧,听到爆鸣声
3Fe+4H2O(g) ==== Fe3O4+4H2
高温
2.实验探究高温下铁粉与水蒸气的反应
H2
问:上述实验装置中,湿棉花的作用是什么?
还原铁粉处酒精灯为什么配用金属套筒?
受热时提供反应所需的水蒸气。
聚集火焰,提高温度。
在钢铁厂的生产中,炽热的铁水注入模具之前,模具为什么必须进行充分的干燥处理?
在高温下,铁能与水发生反应。
铁粉与水蒸气的反应
实验装置的改进
铁 钠
非金属单质 2Fe + 3Cl2 2FeCl3 3Fe + 4O2 Fe3O4 2Na + Cl2 2NaCl
4Na + O2 = 2Na2O
2Na + O2 Na2O2
酸 Fe + 2HCl = FeCl2 + H2↑ 2Na + 2HCl = 2NaCl + H2↑
盐溶液 Fe + CuSO4 = FeSO4 + Cu 2Na + CuSO4 +2H2O =
Na2SO4 + Cu(OH)2 + H2↑
水 2Na + 2H2O = 2NaOH + H2↑
3Fe + 4H2O(g) Fe3O4 + 4H2
1.判断正误
(1)铁是人体中必需微量元素
(2)铁与AgNO3、ZnCl2等盐溶液均能发生反应生成Fe2+
(3)常温下,铁与水反应生成氢氧化亚铁与氢气
(4)铁在氧气中燃烧或与水蒸气反应生成Fe3O4
(5)分离铁粉与铜粉的混合物时,只能用化学方法
2.指定条件下,以铁为原料,不能一步制得的是
B
产物Fe3O4
铁的单质
第三章 铁 金属材料
宏观辨识与微观探析:
能依据物质类别和元素价态列举铁元素的典型代表物。能利用离子反应、氧化还原反应等概念对铁及其化合物的相关反应进行分类和分析说明。
证据推理与模型认知:
能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测铁及其化合物的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。
科学探究与创新意识:
结合应用实例,将铁和铁的氧化物的性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
前两年,网上流传出一段视频,有网友竟用吸铁石从麦片中吸出了铁粉。
这是不法商家添加的吗?如果不是,那厂家在食品中添加铁粉的目的是什么?
缺铁性贫血
缺铁性贫血主要是由于铁摄入不足或丢失过多致使血清铁明显减少、贮存铁极度减少所引起的一种贫血。
人体内的含铁化合物主要分为两类:即功能性铁和储存铁。功能性铁参与氧的运输,其余的铁与一些酶结合,分布于身体各器官。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。如果体内的铁不足以供给生命活动的需要,就会发生贫血。
以药物治疗为主,辅以纠正偏食,给予高蛋白、富含维生素、富含铁的食物。
铁元素在人体中又是以什么形式存在呢?
一、铁的存在和冶炼
单质(陨铁)
化合态(矿石中+2价和+3价)
地壳中铁的含量居第四位
O、Si、Al、Fe、Ca……
1.存在
2.冶炼
3CO+Fe2O3 == 2Fe+3CO2
高温
还 原 剂
还原
3H2+Fe2O3 == 2Fe+3H2O
高温
氧 化 剂
常见的铁矿石
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
菱铁矿(FeCO3)
黄铁矿(FeS2)
二、铁的物理性质
银白色固体,有金属光泽,具有良好的延展性,是电和热的良导体,能被磁体吸引。
下图利用了铁的哪些物理性质?铁还有哪些物理性质?
其导电性不如铜和铝, 其熔、沸点较高。
三、铁的化学性质
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
基于物质类别研究单质的性质
铁的化学性质如何?
物质类型角度
金属单质
与非金属单质反应
与酸溶液反应
与某些盐溶液反应
三、铁的化学性质
我们学习过铁与一些物质的反应。在铁与氯气的反应,铁与盐酸的反应,铁与硫酸铜溶液的反应中,铁的化合价的变化有何异同?为什么会有这样的异同?
Fe + 2HCl——2FeCl2 + H2
2Fe + 3Cl2——2FeCl3
点燃
Fe + CuSO4——FeSO4 + Cu
为什么有的化学方程式中铁的化合价变成+2,有的变成+3?
三、铁的化学性质
基于元素价态角度
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
Fe-2e-→Fe2+
Fe-3e-→Fe3+
Fe
Fe2+
Fe3+
强氧化剂
弱氧化剂
Cl2、HNO3等
S、H+、Cu2+等
三、铁的化学性质
1.与某些非金属单质、非氧化性酸和盐溶液反应
①Fe与非金属单质反应
2Fe +3Cl2 ==== 2FeCl3
点燃
3Fe +2O2 ==== Fe3O4
点燃
Fe +S === FeS
三、铁的化学性质
1.与某些非金属单质、非氧化性酸和盐溶液反应
②Fe与酸反应(如稀H2SO4)
③Fe与盐溶液反应(如CuSO4溶液)
Fe + 2H+ === Fe2++ H2↑
Fe + Cu2+ === Fe2++ Cu
常温下,Fe(或Al)遇浓硫酸(或浓硝酸)会钝化,所谓金属钝化是因为金属表面形成致密的氧化膜,阻止反应的进一步发生。
常温下可以用铁桶或者铝制容器盛放浓硫酸或浓硝酸。
那么营养麦片中添加铁粉的目的
①抗氧化,保持麦片新鲜。
(利用铁粉与氧气的反应)
② 补铁。
(铁粉和胃酸发生反应,生成亚铁离子,被人体吸收)
1. 因为添加铁粉的含量极少,所以抗氧化效果并不佳。
2. 通过吃铁粉补充铁元素的做法并不科学,因为胃酸浓度不高,铁粉并不能完全被溶解,吸收率很低。
结论,营养麦片中添加适量铁粉不存在危害。但益处不大。这是商家的营销手段而已。
三、铁的化学性质
炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
?
2. 预测铁与水反应的产物是什么?从物质的类别和元素的价态的变化完成对反应的预测。
1. 铁和水在常温下能反应吗?如何提供水蒸气?如何提供反应所需的高温?
3. 如何验证铁与水反应生成的气体产物?
实验装置如图所示:
①先点燃 处的酒精灯,
再点燃 处的酒精灯。
②用燃着的火柴接触肥皂泡,观察到的现象是 , 证明生成了 。
③反应生成黑色磁性氧化物(Fe3O4)(如何验证?),化学方程式为
_______________________________。
湿棉花
铁粉
肥皂泡燃烧,听到爆鸣声
3Fe+4H2O(g) ==== Fe3O4+4H2
高温
2.实验探究高温下铁粉与水蒸气的反应
H2
问:上述实验装置中,湿棉花的作用是什么?
还原铁粉处酒精灯为什么配用金属套筒?
受热时提供反应所需的水蒸气。
聚集火焰,提高温度。
在钢铁厂的生产中,炽热的铁水注入模具之前,模具为什么必须进行充分的干燥处理?
在高温下,铁能与水发生反应。
铁粉与水蒸气的反应
实验装置的改进
铁 钠
非金属单质 2Fe + 3Cl2 2FeCl3 3Fe + 4O2 Fe3O4 2Na + Cl2 2NaCl
4Na + O2 = 2Na2O
2Na + O2 Na2O2
酸 Fe + 2HCl = FeCl2 + H2↑ 2Na + 2HCl = 2NaCl + H2↑
盐溶液 Fe + CuSO4 = FeSO4 + Cu 2Na + CuSO4 +2H2O =
Na2SO4 + Cu(OH)2 + H2↑
水 2Na + 2H2O = 2NaOH + H2↑
3Fe + 4H2O(g) Fe3O4 + 4H2
1.判断正误
(1)铁是人体中必需微量元素
(2)铁与AgNO3、ZnCl2等盐溶液均能发生反应生成Fe2+
(3)常温下,铁与水反应生成氢氧化亚铁与氢气
(4)铁在氧气中燃烧或与水蒸气反应生成Fe3O4
(5)分离铁粉与铜粉的混合物时,只能用化学方法
2.指定条件下,以铁为原料,不能一步制得的是
B
产物Fe3O4
