2024-2025学年第一学期期中杭州地区(含周边)重点中学高二年级化学学科试题(PDF版,含答案)
文档属性
| 名称 | 2024-2025学年第一学期期中杭州地区(含周边)重点中学高二年级化学学科试题(PDF版,含答案) |

|
|
| 格式 | |||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-14 00:00:00 | ||
图片预览


文档简介
绝密★考试结束前
2024 学年第一学期期中杭州地区(含周边)重点中学
高二年级化学学科试题
考生须知:
1.本卷满分100分,考试时间90分钟;
2.答题时,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填写相应数字;
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。
5.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每小题只有一个选项符合题意,不选、多
选、错选均不得分)
1.下列物质中,含有共价键的离子化合物是
A. NaOH B. KCI C. H O D. CH
2.下列化学用语表述正确的是
A.质量数为238、中子数为146 的铀(U)核素: 146U
B. NaCl溶液中的水合离子:
C.用精密 pH试纸测得次氯酸钠溶液的 pH为10.4
D. CaC 的电子式:Ca2+[:C#C:]2-
3.不断进步的材料逐渐构筑了我们现代社会的文明。下列说法不正确的是
A.青铜比纯铜熔点低、硬度大,古代用青铜铸剑
B.硬铝密度小、强度高,具有较强的抗腐蚀能力,是制造飞机的理想材料
C.以高纯硅制成的光导纤维内窥镜可直接窥视有关器官部位的变化
D.碳纳米管比表面积大,强度高电学性能好,可用于生产复合材料、电池和传感器等
4.下列溶液中,能大量共存的离子组是
A.含有NaHSO 的溶液中:NH 、HCO;、Cl、SO}
B.浓氨水中:Cu2+、Zn2+、OH-、CH CO0-
C.在透明的溶液中:K+、Cu2+、NO;、SO}
D.溶有SO 气体的溶液中:K+、Na+、ClO、SO
5.设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1 L1 mol/L的K Cr O 溶液中Cr O数目为NA
B.30g NO和16g O 混合后,气体分子数小于NA
C. 0.01 mol/L NH H O(Kb=1.6×10-5),OH-数目为0.0004NA
D.室温下,1LCH COOH和NaOH混合液中,水电离氢离子数目为107NA,此时溶液可能呈酸性
高二化学试题卷 第 1 页 共 8 页
6.下列说法正确的是
A.将金属钠与硫粉在玻璃研钵中使劲研磨混匀,加热后才能剧烈反应并伴有浓烟
B.滴定实验中,一般将待测液置于锥形瓶中,待测液也可放在滴定管中滴定
C.区分CuSO 溶液和 Fe(OH) 胶体两瓶试剂,最佳方法是通过丁达尔效应
D.用pH计测定同温度同浓度的Na CO 溶液和 NaCN 溶液的 pH,可比较H CO 、HCN的酸性
强弱
7. a、b、c、d为原子半径依次增大的四种短周期主族元素,其中元素a的最高正价与最低负价的代
数和等于0,c的核电荷数是b的2倍,b、d能化合生成淡黄色的固体。下列有关判断不正确的
是
A.核电荷数大小:c>d>b>a
B. a与b形成的化合物之间存在氢键
C. b能分别与a、c、d形成具有漂白性的物质
D. c与a形成的化合物分子中,各原子均达到8电子稳定结构
8.下列说法正确的是
A.煤干馏的产品有焦炉气、煤油、焦炭等
B.蛋白质与浓硝酸作用时呈黄色,可用于蛋白质的检验
C.油脂可用于生产甘油是与其含有的碳碳双键有关
D. 1 mol 葡萄糖能在酒化酶的作用下水解生成2 mol CH CH OH和2 mol CO
9.下列化学反应与方程式不相符的是
A.实验室制氯气:K37CIO +6H3 Cl=K37Cl+33Cl T+3H O
B.碱性锌锰电池正极反应:MnO +H O+e*= MnO(OH)+OH
C.用饱和Na CO 溶液预处理水垢中的CaSO4: CO}+CaSO — CaCO +SO
D. 加热蓝色的CuCl 溶液,溶液变黄绿色:
[Cu(H O)4]2+(aq)[蓝色]+4Cl(aq)[CuCl ]2-(aq)[黄色]+4H O(1)△H>0
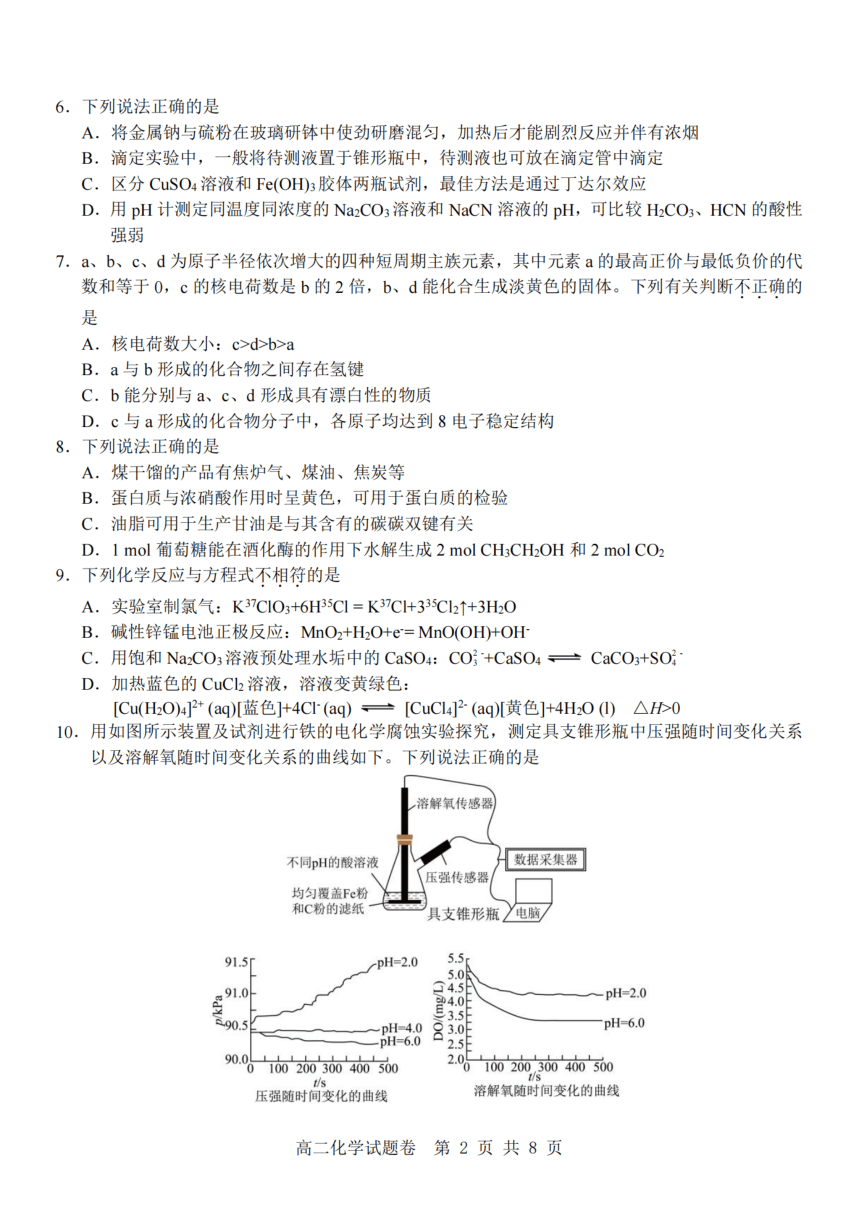
10.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系
以及溶解氧随时间变化关系的曲线如下。下列说法正确的是
溶解氧传感器
不同pH的酸溶液 数据采集器
压强传感器
均匀覆盖Fe粉
和C粉的滤纸 具支锥形瓶 电脑
91.5[ pH=2.0 5.5
5.0
91. .0 4.5 -pH=2.0
p/kPa 4.0E90. .5 pH-4.0 pH-6.0
pH=6.0 2.5
90.0 100200 300 400 500 2.05 100 200,300 400500
t/s t/s
压强随时间变化的曲线 溶解氧随时间变化的曲线
高二化学试题卷 第 2 页 共8 页
A.整个过程中,铁粉作为负极电极反应式均为:Fe-3e*=Fe3+
B. pH=2.0时,只发生析氢腐蚀,正极电极反应式为:2H++2e*=H t
C. pH=4.0时,正极电极反应式为:2H*+2e= H ↑和O +4H*+4e*=2H O
D.将均匀覆盖铁粉和碳粉的滤纸更换为只均匀覆盖纯铁粉的滤纸,压强随时间变化的曲线走
与原图相同
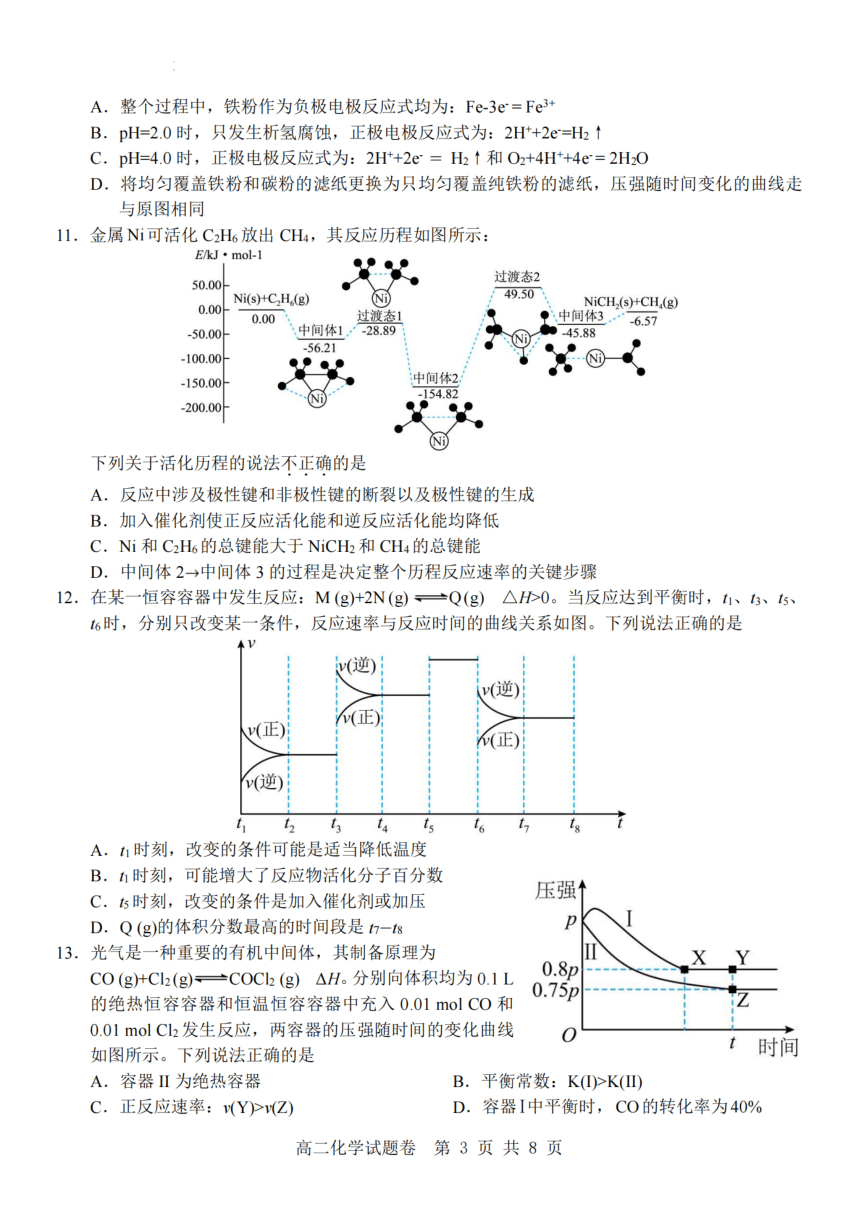
11.金属Ni可活化C H 放出CH ,其反应历程如图所示:
E/kJ·mol-1
50.00 过渡态2
0.00 Ni(s)+C H,(g)
N 49.50
0.00 过渡态1 中间体36CF(
-50.00 中间体1. -28.89 -45.88
-100.00 -56.21
-150.00 中间体2
154.82
-200.00
下列关于活化历程的说法不正确的是
A.反应中涉及极性键和非极性键的断裂以及极性键的生成
B. 加入催化剂使正反应活化能和逆反应活化能均降低
C. Ni和C H 的总键能大于NiCH 和CH 的总键能
D.中间体2→中间体3的过程是决定整个历程反应速率的关键步骤
12.在某一恒容容器中发生反应:M(g)+2N(g)—Q(g)△H>0。当反应达到平衡时,t、t 、Is、
16时,分别只改变某一条件,反应速率与反应时间的曲线关系如图。下列说法正确的是
V
(逆)
v(逆)
v(正)
v(正) (正)
(逆)
t234ls t t tg i
A.t 时刻,改变的条件可能是适当降低温度
B. t时刻,可能增大了反应物活化分子百分数
C. ts时刻,改变的条件是加入催化剂或加压 压强
D. Q(g)的体积分数最高的时间段是t7-18 p I
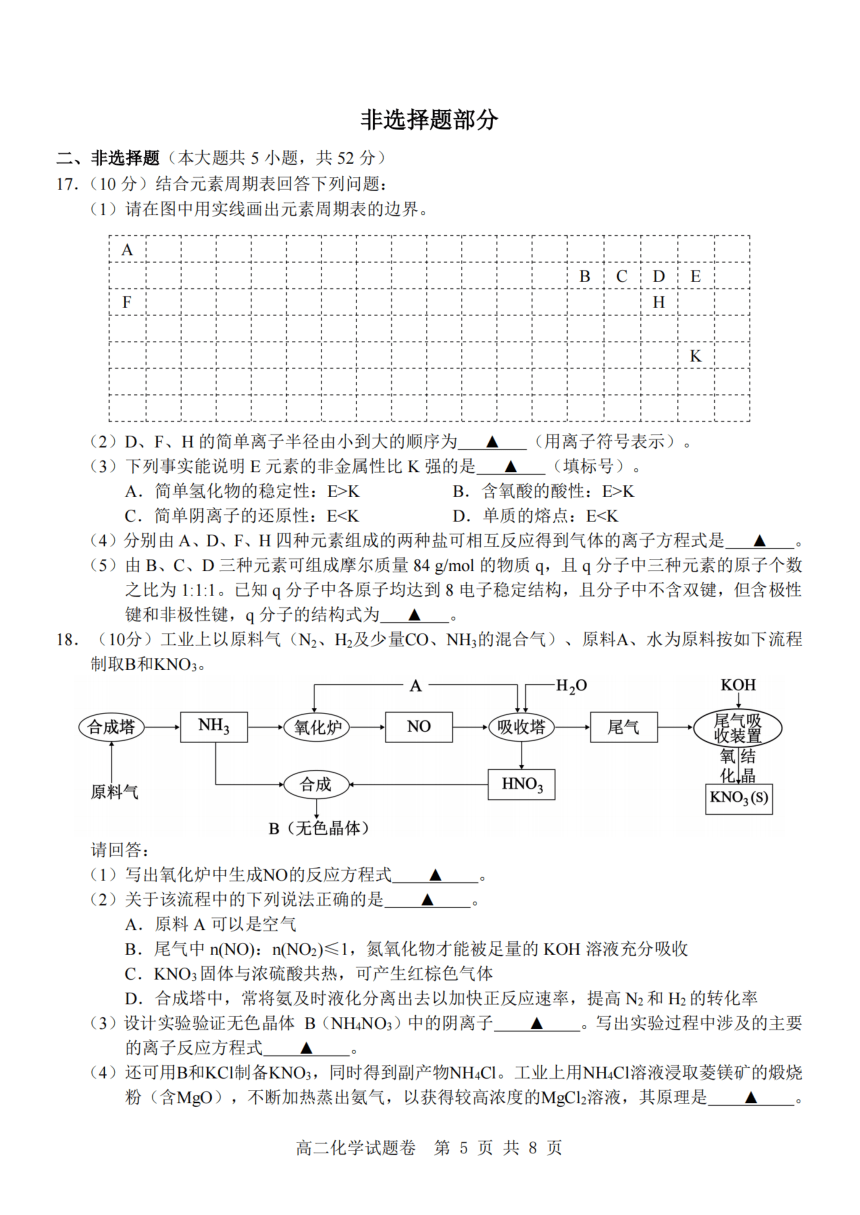
13.光气是一种重要的有机中间体,其制备原理为 I
0.8p X Y
CO(g)+Cl (g)—COCl (g)△H。分别向体积均为0.1 L
的绝热恒容容器和恒温恒容容器中充入0.01 mol CO和 0.75p Z
0.01 mol Cl 发生反应,两容器的压强随时间的变化曲线 O
如图所示。下列说法正确的是 t 时间
A.容器Ⅱ为绝热容器 B.平衡常数:K(1)>K(II)
C.正反应速率:v(Y)>v(Z) D.容器I中平衡时,CO的转化率为40%
高二化学试题卷 第 3 页 共8 页
14.25℃时,某小组做如下两组实验:
实验I:往0.10mol/LNa CO 溶液中通入CO 至pH=7;
实验Ⅱ:在1.0L0.10mol/L Na CO 溶液中加入0.01mol BaSO 固体,充分反应。
[已知:25℃,H CO 的电离常数Kai=4.5×10-7、Ka =4.7×10-11;Ksp(BaCO )=2.6×10-9、
Ksp(BaSO )=1.1×10-10。混合后溶液体积变化忽略不计]。下列说法不正确的是
A. 0.10mol/L Na CO 溶液中离子浓度大小为:c(Nat)>c(CO)>c(OH)>c(HCO;)>c(H+)
B.实验I结束后,溶液中c(CO})/c(HCO;)=4.7×104
C.实验Ⅱ的转化存在平衡常数: K=260
D. 实验Ⅱ中,改用饱和Na CO 溶液,Na CO 的平衡转化率减小
15.臭氧氧化法处理含氰废水的工艺原理如图所示。下列说法不正确的是
O
yNaHCO
H O
NaCNO N
多o O
I阶段 Ⅱ阶段
A. I阶段中1 mol NaCN 被氧化需消耗1 mol O
B. I阶段产生的NaCNO在Ⅲ阶段作为氧化剂参加反应
C. Ⅱ阶段反应为2NaCNO+H O+30 =2NaHCO +N +30
D.总反应的化学方程式为:2NaCN+H O+5O =2NaHCO +N +5O
16.室温下,下列探究方案能达到实验目的的是
选项 探究方案 实验目的
A 用不同浓度、等体积的 H O 溶液分别与相同浓度 探究浓度对反应速率的影响
相同体积的Na SO 溶液反应,观察现象
B 向铜与浓硝酸反应后的溶液中加水,观察溶液颜色 证明铜和浓硝酸反应后溶液呈
变化 现绿色的原因是铜离子浓度大
向10mL0.2mol/LNaOH溶液中滴加 2滴0.1mol/L
C 证明在相同温度下MgCl 溶液,产生白色沉淀。再滴加2滴0.1mol/L
Kp: Mg(OH) >Fe(OH)
FeCl 溶液,又生成红褐色沉淀
分别向等浓度的MgCl 和 AICl 溶液中滴加足量的
D NaOH 溶液,前者产生白色沉淀;后者先产生白色 证明Mg的金属性大于 Al
沉淀,沉淀后消失
高二化学试题卷 第 4 页 共8 页
非选择题部分
二、非选择题(本大题共5小题,共52分)
17.(10分)结合元素周期表回答下列问题:
(1)请在图中用实线画出元素周期表的边界。
A
B C D E
F H
K
(2)D、F、H的简单离子半径由小到大的顺序为_ ▲ (用离子符号表示)。
(3)下列事实能说明E元素的非金属性比K强的是_ ▲ (填标号)。
A.简单氢化物的稳定性:E>K B.含氧酸的酸性:E>K
C.简单阴离子的还原性:E(4)分别由A、D、F、H四种元素组成的两种盐可相互反应得到气体的离子方程式是_ ▲ 。
(5)由B、C、D三种元素可组成摩尔质量84 g/mol的物质q,且q分子中三种元素的原子个数
之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性
键和非极性键,q分子的结构式为 ▲ 。
18.(10分)工业上以原料气(N 、H 及少量CO、NH 的混合气)、原料A、水为原料按如下流程
制取B和KNO 。
A H O KOH
合成塔 NH 氧化炉 NO 吸收塔 尾气 尾气吸收装置
氧结
化晶
原料气 合成 HNO KNO (S)
B(无色晶体)
请回答:
(1)写出氧化炉中生成NO的反应方程式_ ▲ 。
(2)关于该流程中的下列说法正确的是_ ▲ 。
A.原料 A 可以是空气
B.尾气中 n(NO): n(NO )≤1,氮氧化物才能被足量的KOH 溶液充分吸收
C. KNO 固体与浓硫酸共热,可产生红棕色气体
D.合成塔中,常将氨及时液化分离出去以加快正反应速率,提高N 和H 的转化率
(3)设计实验验证无色晶体 B(NH。 NO )中的阴离子 ▲ 。写出实验过程中涉及的主要的离子反应方程式_ ▲
(4)还可用B和KCl制备KNO ,同时得到副产物NH Cl。工业上用NH Cl溶液浸取菱镁矿的煅烧
粉(含MgO),不断加热蒸出氨气,以获得较高浓度的MgCl 溶液,其原理是_ ▲ 。
高二化学试题卷 第 5页 共 8 页
19.(10分)乙烷、乙烯、乙炔是用途广泛的有机化工原料,乙烷、乙烯、乙炔的制备、转化与分
离的研究备受关注。回答下列问题:
(1)乙烯、乙炔可以催化加氢转化为乙烷:
I. C H (g)+2H (g)C H (g) △H= -311.4kJ/mol △S= -233.1 J/mol
Ⅱ. C H (g)+H (g)—C H (g) △H= -136.4kJ/mol △S= -120.8 J/mol
已知:△S计算方法也遵循盖斯定律,可类比△H计算方法
计算:C H (g)+H (g)— C H (g) △S= ▲ _,该反应自发的条件▲ ,298 K
时该反应△G= -14。1.5kJ/mol,但常温下乙炔与氢气混合并未观察到反应发生,可能的原因是 ▲
(2)一定温度和压强下发生反应C H (g)— C H (g)+H (g),C H 的平衡转化率为25 x
是以平衡物质的量分数代替平衡浓度计算的平衡常数,计算该反应Kx=_ ▲ 。
(3)BaC 与水反应可以制备乙炔:BaC +2H O= Ba(OH) +C H ,但是反应太剧烈不易控制,查
表可知 25℃时以下数据(已知 pKa=-lgKa):
物质 CH COOH C H (C Hs) NH H O C H OH
pKa 4.76 25 36 15.6 16
忽略体积变化的影响,下列措施中适用于制备乙炔且可以减缓反应速率的是_ ▲ 。
A.降低体系压强 B.改用(C Hs) NH与 BaC 反应
C.加入少量CH COOH D. 改用C H OH与 BaC 反应
(4)某课题组研究乙烷和乙烯混合气的分离。常温常压下,将C H 和C H 等体积混合,以一
定流速通过某吸附剂,测得两种气体出口浓度(c)与进口浓度(co)之比随时间变化关系如图所
示。下列推断合理的是_ ▲ 。
2.0-
P
1.5-
al b
§1.0
0.5- C H C H
0.0-
0 30 60 90120
t/min
A.该吸附剂有效工作时间约40min,40min后需要更换新的吸附剂
B. a-b对应的时间段内,吸附的C H 逐渐被C H 替代
C.吸附剂吸附C H 的平衡常数相对吸附C H 的平衡常数更大
D. a点时,乙烷的吸附速率与脱附速率相等
20.(10分)叠氮化钠(NaN )是汽车安全气囊最理想的气体发生剂原料。如图是工业水合肼法制叠氮
化钠的工艺流程:
NaNO 溶液 ① CH CH OH
CH CH,OH 露ato器A溶液
③
蒸馏 B溶液结品、过滤、洗涤、干燥产品
已知:①HNO 受热易分解:
高二化学试题卷 第 6页 共8 页
②有关物质的物理性质如表:
物质 沸点/℃ 溶解性
CH CH OH 78.3 与水互溶
水合肼(N H H O) 113.5 与水、醇互溶,不溶于乙醚和氯仿
亚硝酸乙酯(CH CH ONO) 17 难溶于水,可溶于乙醇、乙醚
NaN 300 易溶于水,难溶于乙醇
回答下列问题:
(1)步骤②制备。NaN 的装置如图1所示,图中仪器 a的作用是冷凝回流,其回流的主要物质是▲
(2)写出步骤②中生成 NaN 的化学反。 应方程式 ▲ 。(3)下列说法不正确的是_ ▲ a一 温度计
A.反应①需控制适宜温度,温度过高和过低都不利
于该反应进行 CH CH ONO,K
K同
B.步骤②反应时,应先打开K 、K ,关闭K ,充 Ki 亦K
分反应后,关闭Ki、K ,再打开K ,蒸馏分离
磁力 N H H O
出乙醇 搅拌子 NaOH溶液
C.已知反应②为放热反应,且温度在 20℃左右反应 图1
的转化率最高,可采取的措施是冷水浴或缓慢通入气体
D.步骤④过滤得到NaN 晶体后,可用蒸馏水洗涤晶体
(4)已知:N;与Fe3+反应灵敏,可以生成红色配合物,该红色配合物的吸光度与N;在一定浓度
范围内的关系如图2所示,可利用该“c(N;)—吸光度”曲线确定样品溶液中的c(N;),从而确
定样品溶液中c(NaN )。实验步骤如下:从下列选项中选择合理的仪器和操作,补全如下步
骤[“_ ▲ ”上填写一件最关键仪器,“(▲ )”内填写一种操作,均用字母表示]
0.8 0.76
0.7 06
0.6
0.5 -04 4
吸光度0.40.3 0.28
0.2 0.12
0.1
ol
0.0 1.0 2.0 3.0 4.05.0 6.0
c(N)(0102mol/L)
图2
i.配制100mL 待测NaN 溶液
打开玻璃塞,加入适量蒸馏水,盖紧玻璃塞,倒立后正立→( ▲ )→用_ ▲
称取0.360g样品置于烧杯中,加入适量蒸馏水充分溶解→(▲ )→将溶液转移到
▲ 中→( ▲ )→( ▲ )→( ▲ )→(▲ )
仪器:a. 100 mL容量瓶;b. 250 mL 容量瓶;c.量筒;d.分析天平;e.托盘天平
操作:f.轻轻摇动,使溶液混合均匀
g.用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并转移洗涤液
高二化学试题卷 第 7 页 共8 页
h.加水后定容
i.将玻璃塞旋转180°,倒立后正立
j. 盖好玻璃塞,反复上下颠倒,摇匀
k.待冷却至室温
ii.测定待测 NaN 溶液与Fe3+形成的红色配合物的吸光度
(5)取5.00 mL NaN 待测溶液,加入足量的FeCl 溶液,摇匀后测得吸光度为0.6,则样品的质
量分数为 ▲ (用百分数表示,答案精确到小数点后1位)。
21.(12分)醋酸是日常生活中常见的酸,也是一种重要的溶剂。
(1)一定条件下,冰醋酸加水稀释过程中溶液导电能力随加水体积 b
变化曲线如右。 图所示,则a、b、c三点溶液中,c(H+)由大到小 导电能力 a为_ ▲
(2)Arrhenius 提出:溶剂在液态下能自发发生电离,产生溶剂阳离 o
子与溶剂阴离子的现象,称为自耦电离,如液态水的自耦电离 加水量
方程式为:2H O=H O*+OH。在冰醋酸中也存在类似的自耦电离。
①试写出冰醋酸自耦电离的方程式_ ▲ ;
②高氯酸、硫酸、盐酸和硝酸都是强酸,其酸性在水溶液中差别不大,但在冰醋酸做溶剂
时却能区分强弱。表中是某温度下这四种酸在冰醋酸中的电离常数:
酸 HCIO H SO HCI HNO
Ka 1.6×10- Kai=6.3×10-9 Kai>>Ka 1.6×10-9 4.2×10-10
如将纯硝酸和纯硫。酸混合,可以得到硝基正离子NO ,请根据以上数据写出该反应的离子方程式_ ▲
若保持温度不变,将少量H SO 溶于冰醋酸中,关于所得溶液下列说法正确的是_ ▲ 。
A.加入少量冰醋酸,c(HSO )与c(SO)均减小
B. 加入少量H SO ,H SO 的电离程度增大
C.加入少量CH COONa固体,c(HSO;)与c(SO)的比值减小
D. 加入少量 Na SO 固体,c(CH CO0)减小 A
(3)维持pH的稳定对生命体的生理活动、化学电源的高效工作
等具有重要意义。维持pH稳定的缓冲溶液应用在某种液钒 锌 石墨
电池中能稳定电池的输出电流,该电池装置示意图如右图所
示,电池的总反应如下:
ZnSO CH,COOH VOSO-HSO
Zn+2VOS0.+2H SO 电一znSO:+V SO);+2H 0 CH,COONa溶液 溶液
A室 质子交换膜 B室
①放电时,B室中c(H+)_ ▲ (填“增大”、“减小”或“不
变”)。
②充电时,A室中的c(H+)变化缓慢的原因▲ 。
高二化学试题卷 第 8页 共8 页
2024 学年第一学期期中杭州地区(含周边)重点中学
高二年级化学学科参考答案
一、选择题(本大题共16小题,每小题3分,共48分)
1 2 3 4 5 6 7 8
A D C C B B D B
9 10 11 12 13 14 15 16
A C C B C D B D
二、非选择题(本大题共5小题,共52分)
17.(10分)
(1)(2分)
A
B C D E
F H
K
(2)Na+(3)AC(2分)
(4)H*+HSO;=SO f+H O(2分)
(5)N三C-0-O-C=N(2分)
18.(10分)
(1)4NH +502=4NO+6H O(2分)
(2)ABC(2分)
(3)取少量该无色晶体B于试管中,加水溶解,向试管中加入稀硫酸,无明显现象,加入少量
铜片,在试管口有红棕色气体产生,则说明该晶体中含有NO;。(2分)
3Cu+8H++2NO;=3Cu2++2NOT+4H O(2分)
(4)NH 水解产生H+溶解MgO,加热蒸出氨气促使平衡右移(2分,其他合理解释也给分)
19.(10分)
(1)△S= -112.3 J/mol(1分),低温(1分),活化能高反应速率太慢(2分)
(2)1/15(2分)
(3)D(2分)
(4)BD(2分)
高二化学参考答案 第 1 页 共 2 页
20.(10分)
(1)亚硝酸乙酯(2分)
(2)CH CH ONO+N H H O+NaOH=NaN +CH CH OH+3H O
(或CH CH ONO+N H +NaOH=NaN +CH CH OH+2H O)(2分)
(3)D(2分)
(4)i、d、k、a、g、f、h、j(2分)
(5)72.2 分)
21.(12分)
(1)b>a>c(2分)
(2)①2CH COOHCH COOH +CH CO0(2分)
②HNO +H SO NO +HSO;+H O(2分,“=”或“”均可)。
AC(2分)
(3)①减小(2分)
②充电时,H+通过质子膜从B室进入A室,A室溶液中的CH CO0与H*结合CH COOH
(或“CH COOH-CH COONa溶液有缓冲作用”),从而使c(H+)的变化减缓(2分)
高二化学参考答案 第 2 页 共 2 页
2024 学年第一学期期中杭州地区(含周边)重点中学
高二年级化学学科试题
考生须知:
1.本卷满分100分,考试时间90分钟;
2.答题时,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填写相应数字;
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。
5.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每小题只有一个选项符合题意,不选、多
选、错选均不得分)
1.下列物质中,含有共价键的离子化合物是
A. NaOH B. KCI C. H O D. CH
2.下列化学用语表述正确的是
A.质量数为238、中子数为146 的铀(U)核素: 146U
B. NaCl溶液中的水合离子:
C.用精密 pH试纸测得次氯酸钠溶液的 pH为10.4
D. CaC 的电子式:Ca2+[:C#C:]2-
3.不断进步的材料逐渐构筑了我们现代社会的文明。下列说法不正确的是
A.青铜比纯铜熔点低、硬度大,古代用青铜铸剑
B.硬铝密度小、强度高,具有较强的抗腐蚀能力,是制造飞机的理想材料
C.以高纯硅制成的光导纤维内窥镜可直接窥视有关器官部位的变化
D.碳纳米管比表面积大,强度高电学性能好,可用于生产复合材料、电池和传感器等
4.下列溶液中,能大量共存的离子组是
A.含有NaHSO 的溶液中:NH 、HCO;、Cl、SO}
B.浓氨水中:Cu2+、Zn2+、OH-、CH CO0-
C.在透明的溶液中:K+、Cu2+、NO;、SO}
D.溶有SO 气体的溶液中:K+、Na+、ClO、SO
5.设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1 L1 mol/L的K Cr O 溶液中Cr O数目为NA
B.30g NO和16g O 混合后,气体分子数小于NA
C. 0.01 mol/L NH H O(Kb=1.6×10-5),OH-数目为0.0004NA
D.室温下,1LCH COOH和NaOH混合液中,水电离氢离子数目为107NA,此时溶液可能呈酸性
高二化学试题卷 第 1 页 共 8 页
6.下列说法正确的是
A.将金属钠与硫粉在玻璃研钵中使劲研磨混匀,加热后才能剧烈反应并伴有浓烟
B.滴定实验中,一般将待测液置于锥形瓶中,待测液也可放在滴定管中滴定
C.区分CuSO 溶液和 Fe(OH) 胶体两瓶试剂,最佳方法是通过丁达尔效应
D.用pH计测定同温度同浓度的Na CO 溶液和 NaCN 溶液的 pH,可比较H CO 、HCN的酸性
强弱
7. a、b、c、d为原子半径依次增大的四种短周期主族元素,其中元素a的最高正价与最低负价的代
数和等于0,c的核电荷数是b的2倍,b、d能化合生成淡黄色的固体。下列有关判断不正确的
是
A.核电荷数大小:c>d>b>a
B. a与b形成的化合物之间存在氢键
C. b能分别与a、c、d形成具有漂白性的物质
D. c与a形成的化合物分子中,各原子均达到8电子稳定结构
8.下列说法正确的是
A.煤干馏的产品有焦炉气、煤油、焦炭等
B.蛋白质与浓硝酸作用时呈黄色,可用于蛋白质的检验
C.油脂可用于生产甘油是与其含有的碳碳双键有关
D. 1 mol 葡萄糖能在酒化酶的作用下水解生成2 mol CH CH OH和2 mol CO
9.下列化学反应与方程式不相符的是
A.实验室制氯气:K37CIO +6H3 Cl=K37Cl+33Cl T+3H O
B.碱性锌锰电池正极反应:MnO +H O+e*= MnO(OH)+OH
C.用饱和Na CO 溶液预处理水垢中的CaSO4: CO}+CaSO — CaCO +SO
D. 加热蓝色的CuCl 溶液,溶液变黄绿色:
[Cu(H O)4]2+(aq)[蓝色]+4Cl(aq)[CuCl ]2-(aq)[黄色]+4H O(1)△H>0
10.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系
以及溶解氧随时间变化关系的曲线如下。下列说法正确的是
溶解氧传感器
不同pH的酸溶液 数据采集器
压强传感器
均匀覆盖Fe粉
和C粉的滤纸 具支锥形瓶 电脑
91.5[ pH=2.0 5.5
5.0
91. .0 4.5 -pH=2.0
p/kPa 4.0E90. .5 pH-4.0 pH-6.0
pH=6.0 2.5
90.0 100200 300 400 500 2.05 100 200,300 400500
t/s t/s
压强随时间变化的曲线 溶解氧随时间变化的曲线
高二化学试题卷 第 2 页 共8 页
A.整个过程中,铁粉作为负极电极反应式均为:Fe-3e*=Fe3+
B. pH=2.0时,只发生析氢腐蚀,正极电极反应式为:2H++2e*=H t
C. pH=4.0时,正极电极反应式为:2H*+2e= H ↑和O +4H*+4e*=2H O
D.将均匀覆盖铁粉和碳粉的滤纸更换为只均匀覆盖纯铁粉的滤纸,压强随时间变化的曲线走
与原图相同
11.金属Ni可活化C H 放出CH ,其反应历程如图所示:
E/kJ·mol-1
50.00 过渡态2
0.00 Ni(s)+C H,(g)
N 49.50
0.00 过渡态1 中间体36CF(
-50.00 中间体1. -28.89 -45.88
-100.00 -56.21
-150.00 中间体2
154.82
-200.00
下列关于活化历程的说法不正确的是
A.反应中涉及极性键和非极性键的断裂以及极性键的生成
B. 加入催化剂使正反应活化能和逆反应活化能均降低
C. Ni和C H 的总键能大于NiCH 和CH 的总键能
D.中间体2→中间体3的过程是决定整个历程反应速率的关键步骤
12.在某一恒容容器中发生反应:M(g)+2N(g)—Q(g)△H>0。当反应达到平衡时,t、t 、Is、
16时,分别只改变某一条件,反应速率与反应时间的曲线关系如图。下列说法正确的是
V
(逆)
v(逆)
v(正)
v(正) (正)
(逆)
t234ls t t tg i
A.t 时刻,改变的条件可能是适当降低温度
B. t时刻,可能增大了反应物活化分子百分数
C. ts时刻,改变的条件是加入催化剂或加压 压强
D. Q(g)的体积分数最高的时间段是t7-18 p I
13.光气是一种重要的有机中间体,其制备原理为 I
0.8p X Y
CO(g)+Cl (g)—COCl (g)△H。分别向体积均为0.1 L
的绝热恒容容器和恒温恒容容器中充入0.01 mol CO和 0.75p Z
0.01 mol Cl 发生反应,两容器的压强随时间的变化曲线 O
如图所示。下列说法正确的是 t 时间
A.容器Ⅱ为绝热容器 B.平衡常数:K(1)>K(II)
C.正反应速率:v(Y)>v(Z) D.容器I中平衡时,CO的转化率为40%
高二化学试题卷 第 3 页 共8 页
14.25℃时,某小组做如下两组实验:
实验I:往0.10mol/LNa CO 溶液中通入CO 至pH=7;
实验Ⅱ:在1.0L0.10mol/L Na CO 溶液中加入0.01mol BaSO 固体,充分反应。
[已知:25℃,H CO 的电离常数Kai=4.5×10-7、Ka =4.7×10-11;Ksp(BaCO )=2.6×10-9、
Ksp(BaSO )=1.1×10-10。混合后溶液体积变化忽略不计]。下列说法不正确的是
A. 0.10mol/L Na CO 溶液中离子浓度大小为:c(Nat)>c(CO)>c(OH)>c(HCO;)>c(H+)
B.实验I结束后,溶液中c(CO})/c(HCO;)=4.7×104
C.实验Ⅱ的转化存在平衡常数: K=260
D. 实验Ⅱ中,改用饱和Na CO 溶液,Na CO 的平衡转化率减小
15.臭氧氧化法处理含氰废水的工艺原理如图所示。下列说法不正确的是
O
yNaHCO
H O
NaCNO N
多o O
I阶段 Ⅱ阶段
A. I阶段中1 mol NaCN 被氧化需消耗1 mol O
B. I阶段产生的NaCNO在Ⅲ阶段作为氧化剂参加反应
C. Ⅱ阶段反应为2NaCNO+H O+30 =2NaHCO +N +30
D.总反应的化学方程式为:2NaCN+H O+5O =2NaHCO +N +5O
16.室温下,下列探究方案能达到实验目的的是
选项 探究方案 实验目的
A 用不同浓度、等体积的 H O 溶液分别与相同浓度 探究浓度对反应速率的影响
相同体积的Na SO 溶液反应,观察现象
B 向铜与浓硝酸反应后的溶液中加水,观察溶液颜色 证明铜和浓硝酸反应后溶液呈
变化 现绿色的原因是铜离子浓度大
向10mL0.2mol/LNaOH溶液中滴加 2滴0.1mol/L
C 证明在相同温度下MgCl 溶液,产生白色沉淀。再滴加2滴0.1mol/L
Kp: Mg(OH) >Fe(OH)
FeCl 溶液,又生成红褐色沉淀
分别向等浓度的MgCl 和 AICl 溶液中滴加足量的
D NaOH 溶液,前者产生白色沉淀;后者先产生白色 证明Mg的金属性大于 Al
沉淀,沉淀后消失
高二化学试题卷 第 4 页 共8 页
非选择题部分
二、非选择题(本大题共5小题,共52分)
17.(10分)结合元素周期表回答下列问题:
(1)请在图中用实线画出元素周期表的边界。
A
B C D E
F H
K
(2)D、F、H的简单离子半径由小到大的顺序为_ ▲ (用离子符号表示)。
(3)下列事实能说明E元素的非金属性比K强的是_ ▲ (填标号)。
A.简单氢化物的稳定性:E>K B.含氧酸的酸性:E>K
C.简单阴离子的还原性:E
(5)由B、C、D三种元素可组成摩尔质量84 g/mol的物质q,且q分子中三种元素的原子个数
之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性
键和非极性键,q分子的结构式为 ▲ 。
18.(10分)工业上以原料气(N 、H 及少量CO、NH 的混合气)、原料A、水为原料按如下流程
制取B和KNO 。
A H O KOH
合成塔 NH 氧化炉 NO 吸收塔 尾气 尾气吸收装置
氧结
化晶
原料气 合成 HNO KNO (S)
B(无色晶体)
请回答:
(1)写出氧化炉中生成NO的反应方程式_ ▲ 。
(2)关于该流程中的下列说法正确的是_ ▲ 。
A.原料 A 可以是空气
B.尾气中 n(NO): n(NO )≤1,氮氧化物才能被足量的KOH 溶液充分吸收
C. KNO 固体与浓硫酸共热,可产生红棕色气体
D.合成塔中,常将氨及时液化分离出去以加快正反应速率,提高N 和H 的转化率
(3)设计实验验证无色晶体 B(NH。 NO )中的阴离子 ▲ 。写出实验过程中涉及的主要的离子反应方程式_ ▲
(4)还可用B和KCl制备KNO ,同时得到副产物NH Cl。工业上用NH Cl溶液浸取菱镁矿的煅烧
粉(含MgO),不断加热蒸出氨气,以获得较高浓度的MgCl 溶液,其原理是_ ▲ 。
高二化学试题卷 第 5页 共 8 页
19.(10分)乙烷、乙烯、乙炔是用途广泛的有机化工原料,乙烷、乙烯、乙炔的制备、转化与分
离的研究备受关注。回答下列问题:
(1)乙烯、乙炔可以催化加氢转化为乙烷:
I. C H (g)+2H (g)C H (g) △H= -311.4kJ/mol △S= -233.1 J/mol
Ⅱ. C H (g)+H (g)—C H (g) △H= -136.4kJ/mol △S= -120.8 J/mol
已知:△S计算方法也遵循盖斯定律,可类比△H计算方法
计算:C H (g)+H (g)— C H (g) △S= ▲ _,该反应自发的条件▲ ,298 K
时该反应△G= -14。1.5kJ/mol,但常温下乙炔与氢气混合并未观察到反应发生,可能的原因是 ▲
(2)一定温度和压强下发生反应C H (g)— C H (g)+H (g),C H 的平衡转化率为25 x
是以平衡物质的量分数代替平衡浓度计算的平衡常数,计算该反应Kx=_ ▲ 。
(3)BaC 与水反应可以制备乙炔:BaC +2H O= Ba(OH) +C H ,但是反应太剧烈不易控制,查
表可知 25℃时以下数据(已知 pKa=-lgKa):
物质 CH COOH C H (C Hs) NH H O C H OH
pKa 4.76 25 36 15.6 16
忽略体积变化的影响,下列措施中适用于制备乙炔且可以减缓反应速率的是_ ▲ 。
A.降低体系压强 B.改用(C Hs) NH与 BaC 反应
C.加入少量CH COOH D. 改用C H OH与 BaC 反应
(4)某课题组研究乙烷和乙烯混合气的分离。常温常压下,将C H 和C H 等体积混合,以一
定流速通过某吸附剂,测得两种气体出口浓度(c)与进口浓度(co)之比随时间变化关系如图所
示。下列推断合理的是_ ▲ 。
2.0-
P
1.5-
al b
§1.0
0.5- C H C H
0.0-
0 30 60 90120
t/min
A.该吸附剂有效工作时间约40min,40min后需要更换新的吸附剂
B. a-b对应的时间段内,吸附的C H 逐渐被C H 替代
C.吸附剂吸附C H 的平衡常数相对吸附C H 的平衡常数更大
D. a点时,乙烷的吸附速率与脱附速率相等
20.(10分)叠氮化钠(NaN )是汽车安全气囊最理想的气体发生剂原料。如图是工业水合肼法制叠氮
化钠的工艺流程:
NaNO 溶液 ① CH CH OH
CH CH,OH 露ato器A溶液
③
蒸馏 B溶液结品、过滤、洗涤、干燥产品
已知:①HNO 受热易分解:
高二化学试题卷 第 6页 共8 页
②有关物质的物理性质如表:
物质 沸点/℃ 溶解性
CH CH OH 78.3 与水互溶
水合肼(N H H O) 113.5 与水、醇互溶,不溶于乙醚和氯仿
亚硝酸乙酯(CH CH ONO) 17 难溶于水,可溶于乙醇、乙醚
NaN 300 易溶于水,难溶于乙醇
回答下列问题:
(1)步骤②制备。NaN 的装置如图1所示,图中仪器 a的作用是冷凝回流,其回流的主要物质是▲
(2)写出步骤②中生成 NaN 的化学反。 应方程式 ▲ 。(3)下列说法不正确的是_ ▲ a一 温度计
A.反应①需控制适宜温度,温度过高和过低都不利
于该反应进行 CH CH ONO,K
K同
B.步骤②反应时,应先打开K 、K ,关闭K ,充 Ki 亦K
分反应后,关闭Ki、K ,再打开K ,蒸馏分离
磁力 N H H O
出乙醇 搅拌子 NaOH溶液
C.已知反应②为放热反应,且温度在 20℃左右反应 图1
的转化率最高,可采取的措施是冷水浴或缓慢通入气体
D.步骤④过滤得到NaN 晶体后,可用蒸馏水洗涤晶体
(4)已知:N;与Fe3+反应灵敏,可以生成红色配合物,该红色配合物的吸光度与N;在一定浓度
范围内的关系如图2所示,可利用该“c(N;)—吸光度”曲线确定样品溶液中的c(N;),从而确
定样品溶液中c(NaN )。实验步骤如下:从下列选项中选择合理的仪器和操作,补全如下步
骤[“_ ▲ ”上填写一件最关键仪器,“(▲ )”内填写一种操作,均用字母表示]
0.8 0.76
0.7 06
0.6
0.5 -04 4
吸光度0.40.3 0.28
0.2 0.12
0.1
ol
0.0 1.0 2.0 3.0 4.05.0 6.0
c(N)(0102mol/L)
图2
i.配制100mL 待测NaN 溶液
打开玻璃塞,加入适量蒸馏水,盖紧玻璃塞,倒立后正立→( ▲ )→用_ ▲
称取0.360g样品置于烧杯中,加入适量蒸馏水充分溶解→(▲ )→将溶液转移到
▲ 中→( ▲ )→( ▲ )→( ▲ )→(▲ )
仪器:a. 100 mL容量瓶;b. 250 mL 容量瓶;c.量筒;d.分析天平;e.托盘天平
操作:f.轻轻摇动,使溶液混合均匀
g.用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并转移洗涤液
高二化学试题卷 第 7 页 共8 页
h.加水后定容
i.将玻璃塞旋转180°,倒立后正立
j. 盖好玻璃塞,反复上下颠倒,摇匀
k.待冷却至室温
ii.测定待测 NaN 溶液与Fe3+形成的红色配合物的吸光度
(5)取5.00 mL NaN 待测溶液,加入足量的FeCl 溶液,摇匀后测得吸光度为0.6,则样品的质
量分数为 ▲ (用百分数表示,答案精确到小数点后1位)。
21.(12分)醋酸是日常生活中常见的酸,也是一种重要的溶剂。
(1)一定条件下,冰醋酸加水稀释过程中溶液导电能力随加水体积 b
变化曲线如右。 图所示,则a、b、c三点溶液中,c(H+)由大到小 导电能力 a为_ ▲
(2)Arrhenius 提出:溶剂在液态下能自发发生电离,产生溶剂阳离 o
子与溶剂阴离子的现象,称为自耦电离,如液态水的自耦电离 加水量
方程式为:2H O=H O*+OH。在冰醋酸中也存在类似的自耦电离。
①试写出冰醋酸自耦电离的方程式_ ▲ ;
②高氯酸、硫酸、盐酸和硝酸都是强酸,其酸性在水溶液中差别不大,但在冰醋酸做溶剂
时却能区分强弱。表中是某温度下这四种酸在冰醋酸中的电离常数:
酸 HCIO H SO HCI HNO
Ka 1.6×10- Kai=6.3×10-9 Kai>>Ka 1.6×10-9 4.2×10-10
如将纯硝酸和纯硫。酸混合,可以得到硝基正离子NO ,请根据以上数据写出该反应的离子方程式_ ▲
若保持温度不变,将少量H SO 溶于冰醋酸中,关于所得溶液下列说法正确的是_ ▲ 。
A.加入少量冰醋酸,c(HSO )与c(SO)均减小
B. 加入少量H SO ,H SO 的电离程度增大
C.加入少量CH COONa固体,c(HSO;)与c(SO)的比值减小
D. 加入少量 Na SO 固体,c(CH CO0)减小 A
(3)维持pH的稳定对生命体的生理活动、化学电源的高效工作
等具有重要意义。维持pH稳定的缓冲溶液应用在某种液钒 锌 石墨
电池中能稳定电池的输出电流,该电池装置示意图如右图所
示,电池的总反应如下:
ZnSO CH,COOH VOSO-HSO
Zn+2VOS0.+2H SO 电一znSO:+V SO);+2H 0 CH,COONa溶液 溶液
A室 质子交换膜 B室
①放电时,B室中c(H+)_ ▲ (填“增大”、“减小”或“不
变”)。
②充电时,A室中的c(H+)变化缓慢的原因▲ 。
高二化学试题卷 第 8页 共8 页
2024 学年第一学期期中杭州地区(含周边)重点中学
高二年级化学学科参考答案
一、选择题(本大题共16小题,每小题3分,共48分)
1 2 3 4 5 6 7 8
A D C C B B D B
9 10 11 12 13 14 15 16
A C C B C D B D
二、非选择题(本大题共5小题,共52分)
17.(10分)
(1)(2分)
A
B C D E
F H
K
(2)Na+
(4)H*+HSO;=SO f+H O(2分)
(5)N三C-0-O-C=N(2分)
18.(10分)
(1)4NH +502=4NO+6H O(2分)
(2)ABC(2分)
(3)取少量该无色晶体B于试管中,加水溶解,向试管中加入稀硫酸,无明显现象,加入少量
铜片,在试管口有红棕色气体产生,则说明该晶体中含有NO;。(2分)
3Cu+8H++2NO;=3Cu2++2NOT+4H O(2分)
(4)NH 水解产生H+溶解MgO,加热蒸出氨气促使平衡右移(2分,其他合理解释也给分)
19.(10分)
(1)△S= -112.3 J/mol(1分),低温(1分),活化能高反应速率太慢(2分)
(2)1/15(2分)
(3)D(2分)
(4)BD(2分)
高二化学参考答案 第 1 页 共 2 页
20.(10分)
(1)亚硝酸乙酯(2分)
(2)CH CH ONO+N H H O+NaOH=NaN +CH CH OH+3H O
(或CH CH ONO+N H +NaOH=NaN +CH CH OH+2H O)(2分)
(3)D(2分)
(4)i、d、k、a、g、f、h、j(2分)
(5)72.2 分)
21.(12分)
(1)b>a>c(2分)
(2)①2CH COOHCH COOH +CH CO0(2分)
②HNO +H SO NO +HSO;+H O(2分,“=”或“”均可)。
AC(2分)
(3)①减小(2分)
②充电时,H+通过质子膜从B室进入A室,A室溶液中的CH CO0与H*结合CH COOH
(或“CH COOH-CH COONa溶液有缓冲作用”),从而使c(H+)的变化减缓(2分)
高二化学参考答案 第 2 页 共 2 页
同课章节目录
