课题3 二氧化碳的实验室制取 第2课时 课件 (共24张PPT)2024-2025学年人教版九年级化学上册
文档属性
| 名称 | 课题3 二氧化碳的实验室制取 第2课时 课件 (共24张PPT)2024-2025学年人教版九年级化学上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-15 22:00:30 | ||
图片预览




文档简介
(共24张PPT)
九年级化学 上册·人教版2024
第六单元 碳和碳的氧化物
课题3 二氧化碳的实验室制取
第2课时
学习内容导览
实验室制取气体的一般思路和方法
学习目标
1.比较实验室里制取氧气和二氧化碳的方法,归纳实验室里制取气体的一般思路和方法。
2.根据实验室制取气体的一般思路和方法推测氢气等陌生气体的实验室制法。
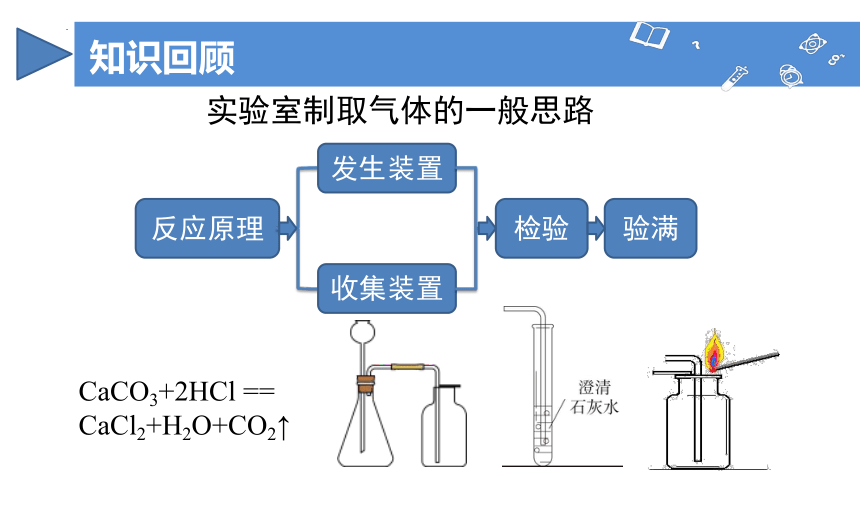
知识回顾
实验室制取气体的一般思路
反应原理
发生装置
收集装置
检验
验满
CaCO3+2HCl == CaCl2+H2O+CO2↑
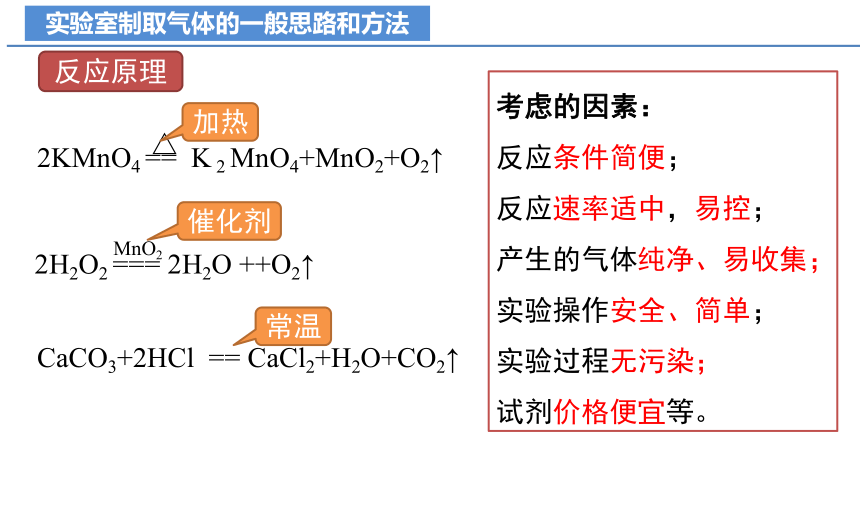
实验室制取气体的一般思路和方法
反应原理
2KMnO4 == K 2 MnO4+MnO2+O2↑
△
2H2O2 === 2H2O ++O2↑
MnO2
CaCO3+2HCl == CaCl2+H2O+CO2↑
考虑的因素:
反应条件简便;
反应速率适中,易控;
产生的气体纯净、易收集;
实验操作安全、简单;
实验过程无污染;
试剂价格便宜等。
加热
催化剂
常温
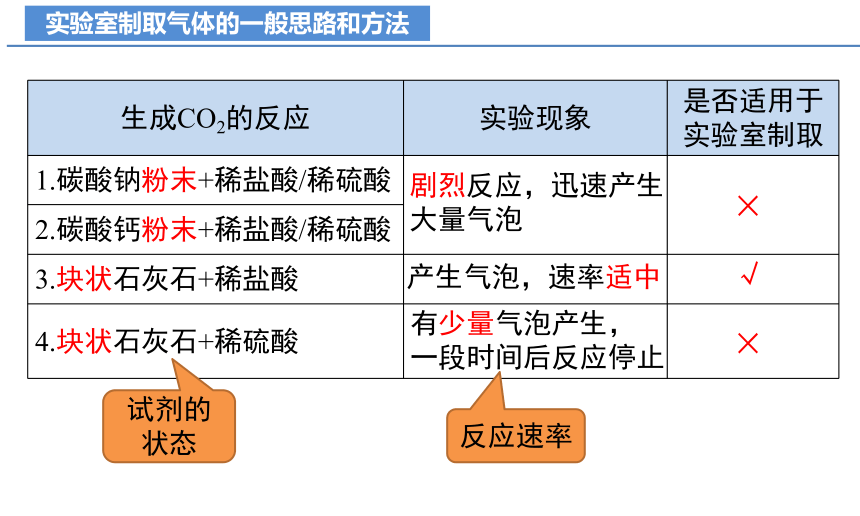
实验室制取气体的一般思路和方法
生成CO2的反应 实验现象 是否适用于实验室制取
1.碳酸钠粉末+稀盐酸/稀硫酸
2.碳酸钙粉末+稀盐酸/稀硫酸 3.块状石灰石+稀盐酸
4.块状石灰石+稀硫酸
剧烈反应,迅速产生大量气泡
产生气泡,速率适中
有少量气泡产生,
一段时间后反应停止
×
√
×
试剂的状态
反应速率
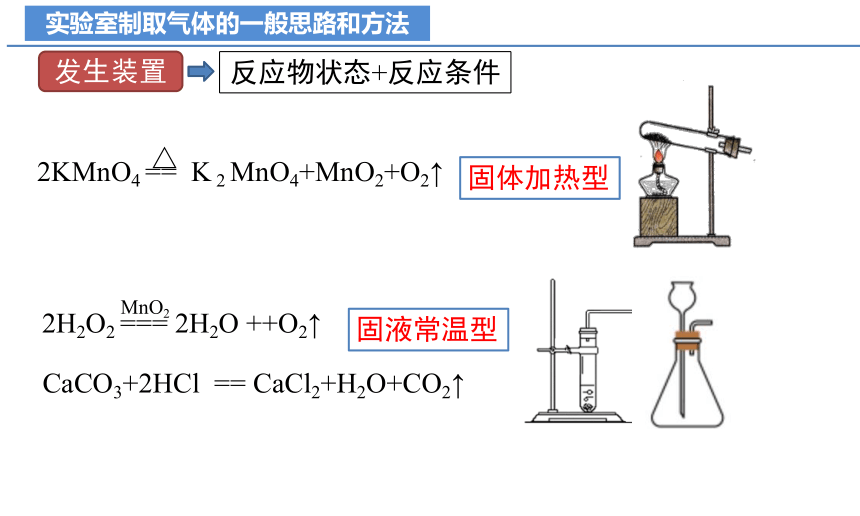
实验室制取气体的一般思路和方法
发生装置
反应物状态+反应条件
2KMnO4 == K 2 MnO4+MnO2+O2↑
△
2H2O2 === 2H2O ++O2↑
MnO2
CaCO3+2HCl == CaCl2+H2O+CO2↑
固体加热型
固液常温型
实验室制取气体的一般思路和方法
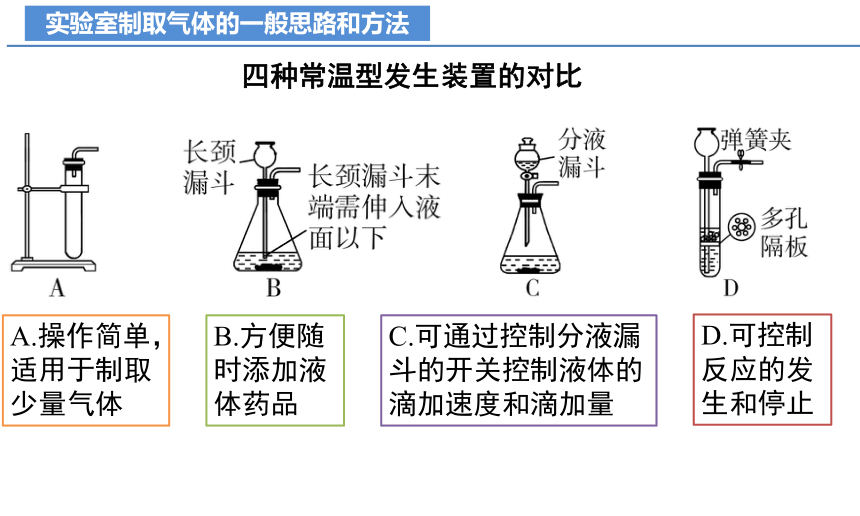
四种常温型发生装置的对比
A.操作简单,适用于制取少量气体
B.方便随时添加液体药品
C.可通过控制分液漏斗的开关控制液体的滴加速度和滴加量
D.可控制反应的发生和停止
实验室制取气体的一般思路和方法
收集装置
气体的性质
向上排空气法
向下排空气法
排水法
气体密度,
是否与空气反应
气体溶解性,是否与水反应
实验室制取气体的一般思路和方法
收集装置
气体的性质
性质 收集装置
CO2
O2
密度比空气大,
能溶于水,且与水反应
密度比空气大,
不易溶于水,且不与水反应
实验室制取气体的一般思路和方法
收集装置
气体的性质
多功能瓶
此装置可用作气体收集装置
若用此装置采取排空气法收集氧气或二氧化碳,气体应从______(填“a”或“b”)端通入。
b
若先将此装置盛满水,用排水法收集气体,可用于收集_______,气体应从______(填“a”或“b”)端通入。
氧气
a
实验室制取气体的一般思路和方法
除了发生装置和收集装置,如有必要,还应考虑设置除杂装置和尾气处理装置等
除去杂质HCl
除去杂质H2O
实验室制取气体的一般思路和方法
气体检验和验满
气体的性质
将带火星的木条放在集气瓶口,若木条复燃,则O2已满。
将带火星的木条放入集气瓶中,若木条复燃,则证明为O2。
检验O2
验满O2
O2支持燃烧
实验室制取气体的一般思路和方法
气体检验和验满
气体的性质
将燃着的木条放在集气瓶口,若木条熄灭,则CO2已满。
将气体通入到澄清石灰水中,若石灰水变浑浊,则气体为CO2。
澄清石灰水
检验CO2
验满CO2
Ca(OH)2+ CO2 == CaCO3 ↓+H2O
CO2不可燃,不支持燃烧
实验室制取气体的一般思路和方法
2.设计实验装置
1.确定反应原理
3.验证制取的气体
发生装置
收集装置
依据:反应物的状态和反应条件
依据:气体的密度和溶解性等
气体的检验和验满
依据:气体性质
总结:实验室制取气体的一般思路和方法
反应速率、安全性等
1.如图是实验室常用的气体发生装置和收集装置,请回答下列问题:
(1)仪器①的名称是___________。
(2)实验室既可用于制取氧气又可用于制取二氧化碳的发生装置和收集装置的组合为___________(填装置序号)。
巩固练习
检验
BD
集气瓶
巩固练习
检验
(3)实验室制取气体时,下列因素中,不需要考虑的是___________(填序号)。
a.所要制取气体的颜色
b.试剂容易获得,能生成所要制取的气体
c.反应条件易于控制,反应速率适中
d.操作简便易行,安全可靠,节能环保
a
实验室制取气体的一般思路和方法
实验室制取氢气
交流讨论:下列两种反应都产生H2,哪种适合用于实验室制取H2?
2H2O === O2 ↑+2H2↑
通电
Zn + H2SO4 === ZnSO4 +H2↑
生成物中有两种气体,不能收集到纯净的氢气
1.确定反应原理
实验室用锌粒和稀硫酸制取氢气
实验室制取气体的一般思路和方法
实验室制取氢气
2.确定发生装置
Zn + H2SO4 === ZnSO4 +H2↑
锌粒为
块状固体
稀硫酸为液体
反应条件:常温
固液常温型
实验室制取气体的一般思路和方法
实验室制取氢气
2.确定收集装置
颜色 气味 密度 溶解性
无色
无臭
比空气的小
难溶于水
氢气的性质
向下排空气法
排水法
实验室制取气体的一般思路和方法
实验室制取氢气的装置
Zn + H2SO4 == ZnSO4 + H2↑
巩固练习
2.在气体制取的复习课中,老师给出如下装置示意图,请你回答下列问题:
(1)实验室若用锌粒与稀硫酸反应制取氢气,则应选择的发生装置和收集装置的组合是____________(填字母代号)。
(2)若用装置D收集二氧化碳,其验满的方法是______。
AC或AE
将燃着的木条放到集气瓶口,若木条熄灭,则CO2已集满
巩固练习
检验
3.我们在实验室里常用下列装置来制取和收集气体:
A B C D E F
②实验室常用加热固体甲和固体乙的混合物来制取气体丙,则制取丙选用的发生装置是 ;若收集气体丙时只能用E装置知丙的性质可能有_______________、___________________________……
A
能溶于水
密度比空气的大
①硫化氢(H2S)是一种密度比空气大且溶于水的气体,实验室常用块状固体硫化亚铁(FeS)与稀硫酸反应制取硫化氢,实验室制取硫化氢的发生装置是 ,收集装置 。
B或C
E
九年级化学·人教版
谢谢观看
九年级化学 上册·人教版2024
第六单元 碳和碳的氧化物
课题3 二氧化碳的实验室制取
第2课时
学习内容导览
实验室制取气体的一般思路和方法
学习目标
1.比较实验室里制取氧气和二氧化碳的方法,归纳实验室里制取气体的一般思路和方法。
2.根据实验室制取气体的一般思路和方法推测氢气等陌生气体的实验室制法。
知识回顾
实验室制取气体的一般思路
反应原理
发生装置
收集装置
检验
验满
CaCO3+2HCl == CaCl2+H2O+CO2↑
实验室制取气体的一般思路和方法
反应原理
2KMnO4 == K 2 MnO4+MnO2+O2↑
△
2H2O2 === 2H2O ++O2↑
MnO2
CaCO3+2HCl == CaCl2+H2O+CO2↑
考虑的因素:
反应条件简便;
反应速率适中,易控;
产生的气体纯净、易收集;
实验操作安全、简单;
实验过程无污染;
试剂价格便宜等。
加热
催化剂
常温
实验室制取气体的一般思路和方法
生成CO2的反应 实验现象 是否适用于实验室制取
1.碳酸钠粉末+稀盐酸/稀硫酸
2.碳酸钙粉末+稀盐酸/稀硫酸 3.块状石灰石+稀盐酸
4.块状石灰石+稀硫酸
剧烈反应,迅速产生大量气泡
产生气泡,速率适中
有少量气泡产生,
一段时间后反应停止
×
√
×
试剂的状态
反应速率
实验室制取气体的一般思路和方法
发生装置
反应物状态+反应条件
2KMnO4 == K 2 MnO4+MnO2+O2↑
△
2H2O2 === 2H2O ++O2↑
MnO2
CaCO3+2HCl == CaCl2+H2O+CO2↑
固体加热型
固液常温型
实验室制取气体的一般思路和方法
四种常温型发生装置的对比
A.操作简单,适用于制取少量气体
B.方便随时添加液体药品
C.可通过控制分液漏斗的开关控制液体的滴加速度和滴加量
D.可控制反应的发生和停止
实验室制取气体的一般思路和方法
收集装置
气体的性质
向上排空气法
向下排空气法
排水法
气体密度,
是否与空气反应
气体溶解性,是否与水反应
实验室制取气体的一般思路和方法
收集装置
气体的性质
性质 收集装置
CO2
O2
密度比空气大,
能溶于水,且与水反应
密度比空气大,
不易溶于水,且不与水反应
实验室制取气体的一般思路和方法
收集装置
气体的性质
多功能瓶
此装置可用作气体收集装置
若用此装置采取排空气法收集氧气或二氧化碳,气体应从______(填“a”或“b”)端通入。
b
若先将此装置盛满水,用排水法收集气体,可用于收集_______,气体应从______(填“a”或“b”)端通入。
氧气
a
实验室制取气体的一般思路和方法
除了发生装置和收集装置,如有必要,还应考虑设置除杂装置和尾气处理装置等
除去杂质HCl
除去杂质H2O
实验室制取气体的一般思路和方法
气体检验和验满
气体的性质
将带火星的木条放在集气瓶口,若木条复燃,则O2已满。
将带火星的木条放入集气瓶中,若木条复燃,则证明为O2。
检验O2
验满O2
O2支持燃烧
实验室制取气体的一般思路和方法
气体检验和验满
气体的性质
将燃着的木条放在集气瓶口,若木条熄灭,则CO2已满。
将气体通入到澄清石灰水中,若石灰水变浑浊,则气体为CO2。
澄清石灰水
检验CO2
验满CO2
Ca(OH)2+ CO2 == CaCO3 ↓+H2O
CO2不可燃,不支持燃烧
实验室制取气体的一般思路和方法
2.设计实验装置
1.确定反应原理
3.验证制取的气体
发生装置
收集装置
依据:反应物的状态和反应条件
依据:气体的密度和溶解性等
气体的检验和验满
依据:气体性质
总结:实验室制取气体的一般思路和方法
反应速率、安全性等
1.如图是实验室常用的气体发生装置和收集装置,请回答下列问题:
(1)仪器①的名称是___________。
(2)实验室既可用于制取氧气又可用于制取二氧化碳的发生装置和收集装置的组合为___________(填装置序号)。
巩固练习
检验
BD
集气瓶
巩固练习
检验
(3)实验室制取气体时,下列因素中,不需要考虑的是___________(填序号)。
a.所要制取气体的颜色
b.试剂容易获得,能生成所要制取的气体
c.反应条件易于控制,反应速率适中
d.操作简便易行,安全可靠,节能环保
a
实验室制取气体的一般思路和方法
实验室制取氢气
交流讨论:下列两种反应都产生H2,哪种适合用于实验室制取H2?
2H2O === O2 ↑+2H2↑
通电
Zn + H2SO4 === ZnSO4 +H2↑
生成物中有两种气体,不能收集到纯净的氢气
1.确定反应原理
实验室用锌粒和稀硫酸制取氢气
实验室制取气体的一般思路和方法
实验室制取氢气
2.确定发生装置
Zn + H2SO4 === ZnSO4 +H2↑
锌粒为
块状固体
稀硫酸为液体
反应条件:常温
固液常温型
实验室制取气体的一般思路和方法
实验室制取氢气
2.确定收集装置
颜色 气味 密度 溶解性
无色
无臭
比空气的小
难溶于水
氢气的性质
向下排空气法
排水法
实验室制取气体的一般思路和方法
实验室制取氢气的装置
Zn + H2SO4 == ZnSO4 + H2↑
巩固练习
2.在气体制取的复习课中,老师给出如下装置示意图,请你回答下列问题:
(1)实验室若用锌粒与稀硫酸反应制取氢气,则应选择的发生装置和收集装置的组合是____________(填字母代号)。
(2)若用装置D收集二氧化碳,其验满的方法是______。
AC或AE
将燃着的木条放到集气瓶口,若木条熄灭,则CO2已集满
巩固练习
检验
3.我们在实验室里常用下列装置来制取和收集气体:
A B C D E F
②实验室常用加热固体甲和固体乙的混合物来制取气体丙,则制取丙选用的发生装置是 ;若收集气体丙时只能用E装置知丙的性质可能有_______________、___________________________……
A
能溶于水
密度比空气的大
①硫化氢(H2S)是一种密度比空气大且溶于水的气体,实验室常用块状固体硫化亚铁(FeS)与稀硫酸反应制取硫化氢,实验室制取硫化氢的发生装置是 ,收集装置 。
B或C
E
九年级化学·人教版
谢谢观看
同课章节目录
