沪教版(2024)九年级上学期第4章 认识化学反应 综合练习(含解析)
文档属性
| 名称 | 沪教版(2024)九年级上学期第4章 认识化学反应 综合练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-17 00:00:00 | ||
图片预览



文档简介
沪教版(2024)九年级上学期 第四章 综合练习
一、选择题
1.将15.5g KClO3和MnO2的混合物加热,待完全反应后得到10.7g固体物质,根据质量守恒定律,生成O2的质量是
A.6.9 g B.6.1 g C.4.8 g D.9.6 g
2.使燃料充分燃烧的方法,错误的是
A.提供足量的氧气 B.降低燃料的着火点
C.固体燃料粉碎 D.液体燃料喷成雾状
3.2023年1月15日,辽宁盘锦浩业化工有限公司烷基化装置在维修过程中发生泄漏爆炸着火,并造成了人员伤亡和重大财产损失。下列说法中不符合科学道理的是
A.煤气泄漏需要关闭阀门并开窗通风,必要时可打开排气扇加速空气流动
B.室内起火时,应用湿毛巾捂住口鼻蹲下靠近地面或沿着墙壁跑离着火区
C.点燃氢气等可燃性气体前一定要先检验纯度
D.家里电器着火时,先关闭电源,再灭火
4.下列变化符合质量守恒定律的是
①镁在空气中燃烧生成氧化镁的质量比镁大
②水加热沸腾一段时间后质量变小
③4克氢气在34克氧气中燃烧生成36克水
A.①③ B.①②③ C.② D.①②
5.化学方程式C+O2CO2有关说法正确的是
A.在点燃的条件下,碳加氧气等于二氧化碳
B.在点燃的条件下,每1个碳和2个氧气反应生成2个二氧化碳
C.在点燃的条件下,每1克碳和1克氧气反应生成2克二氧化碳
D.在点燃的条件下,每1mol碳和1mol氧气反应生成1mol二氧化碳
6.建立宏观和微观的联系是化学思维方式。如图为某反应的微观示意图,有关说法错误的是
A.该示意图表示一氧化碳与氧气发生的反应
B.该反应前后各元素的化合价均发生改变
C.参加反应的一氧化碳和氧气的质量比为
D.一氧化碳可燃,二氧化碳不可燃,因为它们分子构成不同
7.下列情况中所采取的灭火方法,不正确的是
A.身上衣服着火时可就地打滚 B.电器设备失火,可立即用水浇灭
C.炒菜时锅里的油着火,可用锅盖盖灭 D.用液态二氧化碳灭火器扑灭图书档案的火灾
8.下列灭火方法所用原理与其他三个不同的是
A.用砂子盖灭燃着的木柴 B.用灯帽盖灭酒精灯
C.油锅中的油着火用锅盖盖灭 D.森林火灾时将火场周围树木砍伐掉
9.3g有机物X与充足的氧气在密闭容器内完全燃烧,生成8.8g二氧化碳和5.4g水蒸气。下列说法中不正确的是
A.3g有机物X中碳元素的质量为2.4g B.生成的CO2和H2O的分子数之比为3:2
C.有机物X中含有碳、氢两种元素 D.3g有机物完全燃烧消耗的氧气为11.2g
10.2024年2月24日南京火灾给人们敲响了安全警钟,下列说法或做法错误的是
A.高层住宅着火,如果楼内有电梯,不能乘坐电梯逃生
B.甲烷是天然气的主要成分,与空气混合后遇明火可能会发生爆炸
C.火灾发生后应用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开火灾现场
D.通过降低可燃物的着火点可以灭火
11.在通电和催化条件下,甲酸与氧气反应的微观示意图如下,下列说法错误的是
A.该反应中,甲酸的相对分子质量为
B.一个H2O2分子由两个氢原子和一个氧分子结合形成
C.反应的化学方程式:
D.该反应中的催化剂对反应物和生成物的质量比没有影响
12.2023年杭州亚运会主火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内的零排放,科学家利用某纳米纤维催化剂将二氧化碳转化为绿色甲醇(CH3OH),其微观示意图如下(图中的分子恰好完全反应)。下列说法错误的是
A.生成物丙中氧元素的质量分数为50%
B.该反应有助于实现“碳中和”
C.该反应的化学方程式为3H2+CO2CH3OH+H2O
D.生成物丙和丁的质量比为1:1
13.下图是氢气在氯气中燃烧的微观示意图,下列说法正确的是
A.原子是最小的粒子,不可以再分
B.化学反应前后,原子的种类、数目不变
C.此反应是两种分子生成一种分子,属于分解反应
D.保持氯化氢化学性质的最小粒子是氢原子和氧原子
14.下列装置及实验(天平未画出)能用来验证质量守恒定律的是
A.镁条燃烧 B.红磷燃烧
C.水和油混合 D.制取氧气
15.已知FeC2O4(固体)受热分解产生铁的氧化物和气体。将28.8gFeC2O4隔绝空气充分加热,冷却、称得残余固体14.4g。下列说法不正确的是
A.残余固体中含11.2g铁元素
B.FeC2O4(固体)分解产生的气体是混合物
C.分解产生的气体质量为14.4g
D.残余固体是Fe2O3
二、实验题
16.某化学兴趣小组在老师指导下进行课外实验,利用如图1所示装置来探究磷单质在空气中燃烧后氧气浓度变化情况。
【提出问题】足量红磷在密闭的三颈烧瓶内燃烧熄灭后,容器中是否有氧气剩余?
【猜想假设】猜想①:有氧气剩余;猜想②:无氧气剩余。
【实验验证】该小组同学按图1组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,用高能激光笔照射,白磷开始燃烧。
(1)红磷在空气中燃烧,发生反应的基本类型为 反应。
【实验结论】
(2)猜想 正确。
【交流讨论】
(3)根据实验结论,用“燃磷法测定空气中氧气含量”时,选择 (填“红磷”或“白磷”)更合适。
(4)测定空气中氧气含量的实验中,不能用木炭代替磷的原因是 (用文字表达式表示)。
【拓展延伸】为提高测定空气中氧气含量实验的精确度,化学兴趣小组在查阅相关资料后改用“暖宝宝”对实验进行了如图2的创新改进。
【查阅资料】暖宝宝中含有脱氧剂,在空气中能与氧气发生缓慢氧化,放出热量,几乎能耗尽容器中的氧气。
【实验方案】在实际容积为的集气瓶里先加入的水,右侧连接装有空气的注射器(注射器活塞与内壁摩擦非常小,可忽略不计)。
重复3次上述实验,记录数据如表。
实验次数 1 2 3
注射器剩余气体读数
(5)根据表中的实验数据计算,空气中氧气含量为 (用百分数表示)。
(6)实验后必须等到 时,才可以记录注射器内剩余气体的体积。
三、科学探究题
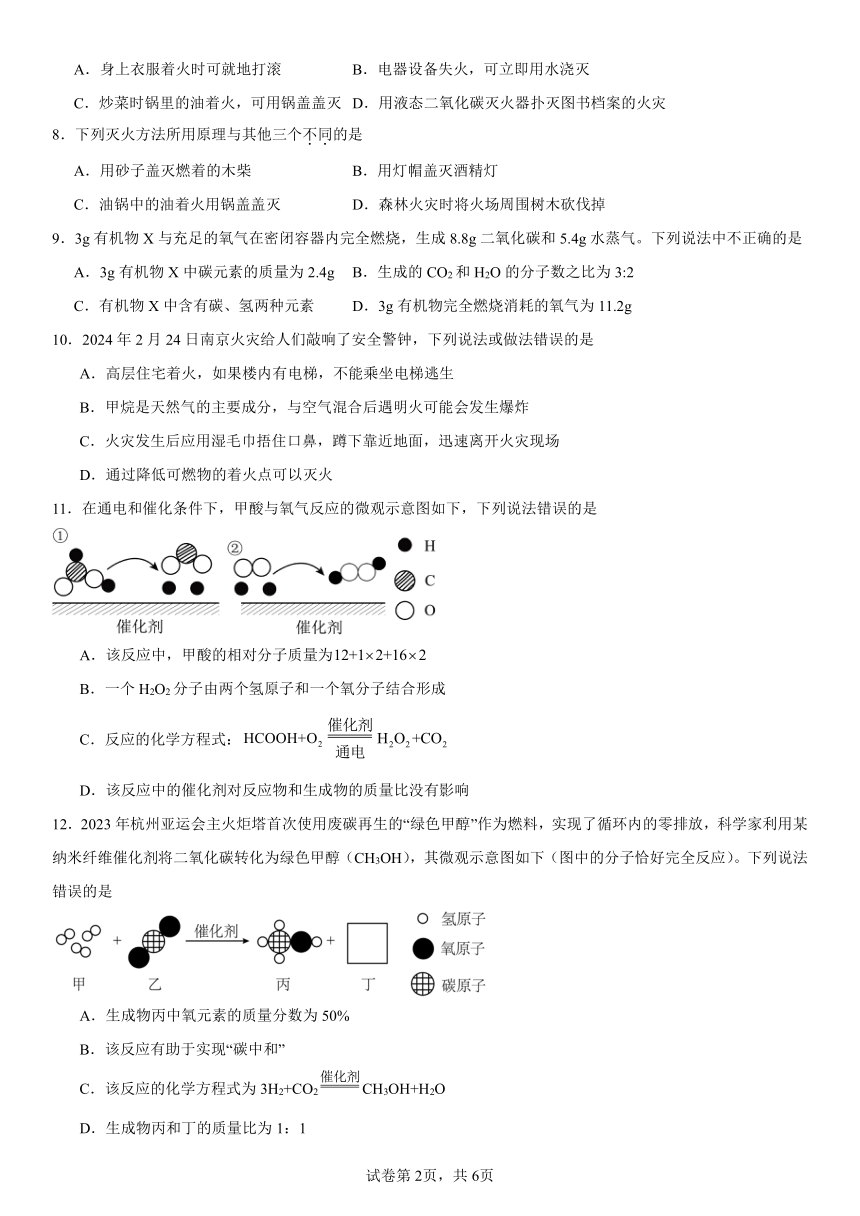
17.为了探究燃烧的条件,某兴趣小组活动中,同学们按图1装置进行探究。
图1装置 (填“能”或“不能”)说明燃烧需要可燃物,如果能,写出能证明该结论的实验现象(如果不能,说明可能猜想): 。
探究过程中,大家对磷燃烧生成的大量白烟是否危害人体健康提出疑问。
【查阅资料】白磷的着火点是40℃,红磷的着火点是240℃,燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,可能与空气中水蒸气反应,生成有毒的偏磷酸(HPO3)。
【变流与讨论】白烟对人体健康有害,该实验装置必须改进。
【改进与实验】同学们按改进后的图2装置进行实验。
请你帮助他们将下表补充完整。
现象 解释
a试管中白磷燃烧,热水中白磷没有燃烧。 b试管中红磷没有燃烧。 b试管中红磷没有燃烧的原因是 热水中白磷都没有燃烧的原因是
【反思与评价】
(1)改进后的图2装置与图1装置相比,优点是 。
(2)小林同学指出图2装置仍有不足之处,并设计了图3装置,其中气球的作用是 。
四、综合应用题
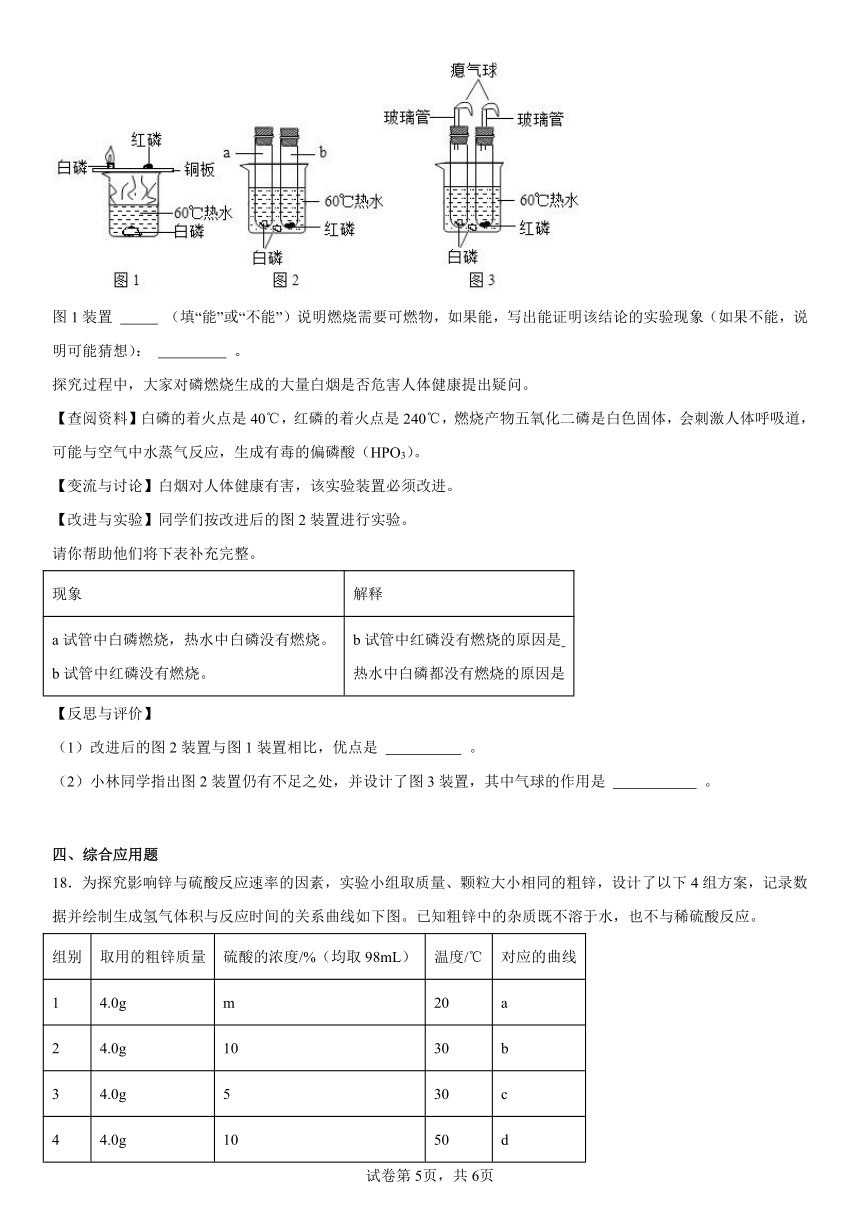
18.为探究影响锌与硫酸反应速率的因素,实验小组取质量、颗粒大小相同的粗锌,设计了以下4组方案,记录数据并绘制生成氢气体积与反应时间的关系曲线如下图。已知粗锌中的杂质既不溶于水,也不与稀硫酸反应。
组别 取用的粗锌质量 硫酸的浓度/%(均取98mL) 温度/℃ 对应的曲线
1 4.0g m 20 a
2 4.0g 10 30 b
3 4.0g 5 30 c
4 4.0g 10 50 d
(1)通过第1组和第3组实验可以探究温度对锌与硫酸反应速率的影响,则m的数值为 。据此可知温度与反应速率的关系是 。
(2)能探究硫酸浓度对锌与硫酸反应速率的影响的组别是 。(填序号)
(3)根据你对本实验的理解,请在坐标图中画出第4组实验对应的大致曲线d。
(4)实验条件下890mLH2折合为0.08g,请计算出本实验所用4.0g粗锌中锌的质量分数。(用化学方程式计算,写出完整的计算过程)
试卷第6页,共6页
试卷第1页,共6页
参考答案:
1.C
【详解】根据质量守恒定律,反应前后的质量差为生成的氧气的质量,即15.5g-10.7g=4.8g;故选C。
2.B
【详解】A、供应足量的氧气,增大氧气的浓度,能使燃料充分燃烧,说法正确,故选项不符合题意;
B、可燃物的着火点是物质本身固有属性,物质不变其着火点也不能改变,说法错误,故选项符合题意;
C、把固体燃料粉碎,增大了与氧气的接触面积,能使燃料充分燃烧,说法正确,故选项不符合题意;
D、把液体燃料喷成雾状,增大了与氧气的接触面积,能使燃料充分燃烧,说法正确,故选项不符合题意。
故选B。
3.A
【详解】A、煤气具有可燃性,混有一定量的空气,遇到明火或电火花,容易发生爆炸,故煤气泄漏需要关闭阀门并开窗通风,不可打开排气扇,防止发生爆炸,符合题意;
B、室内起火时,应用湿毛巾捂住口鼻,过滤有毒烟尘,二氧化碳受热密度变小,故高空中二氧化碳含量较高,故应蹲下靠近地面或沿着墙壁跑离着火区,不符合题意;
C、氢气具有可燃性,混有一定量的空气,遇到明火,容易发生爆炸,故点燃氢气等可燃性气体前一定要先检验纯度,不符合题意;
D、家里电器着火时,先关闭电源,再灭火,不能立即用水浇灭,防止触电,不符合题意。
故选A。
4.A
【详解】①镁在空气中燃烧和空气中氧气反应,故生成固体氧化镁的质量比固体镁质量大,正确;
②水加热沸腾是一个物理变化,不能用质量守恒解释,错误;
③
由化学方程式体现的质量关系可知,4克氢气在34克氧气中燃烧恰好反应生成36克水,正确。
故选A。
【点睛】任何化学变化都遵循质量守恒定律。
5.D
【分析】根据分析
【详解】A、该反应表示,在点燃的条件下,碳和氧气生成二氧化碳,选项错误;
B、微观上表示一个碳原子和一个氧分子分解出的2个氧原子结合为一个二氧化碳分子,选项错误;
C、在点燃的条件下,每12克碳和32克氧气反应生成44克二氧化碳,选项错误;
D、根据化学方程式可知三者的微粒个数比是1:1:1,即在点燃的条件下,每1mol碳和1mol氧气反应生成1mol二氧化碳,选项正确;
故选:D
6.C
【分析】由微观示意图可知,反应物为一氧化碳和氧气,产物为二氧化碳,一氧化碳与氧气在点燃条件下生成二氧化碳,方程式为。
【详解】A、由分析可知,该反应反应物为一氧化碳和氧气,说法正确;
B、反应物一氧化碳中氧元素为-2价,碳元素为+2价,氧气中氧元素为0价,产物二氧化碳中氧元素为-2价,碳元素为+4价,氧元素和碳元素的化合价在反应前后都发生改变,说法正确;
C、参加反应的一氧化碳和氧气的质量比=2×(12+16):(16×2)=7:4,说法错误;
D、一氧化碳可燃,二氧化碳不可燃,一氧化碳由一氧化碳分子构成,二氧化碳由二氧化碳分子构成,分子不同,所以二者化学性质不同,说法正确。
故选:C。
7.B
【详解】A、就地打滚可以使身上燃烧物随翻滚而与空气隔绝,达到灭火的目的,说法正确,不符合题意;
B、向着火的电器上浇水,可能会因水的导电性而使扑火者触电,或引发电路短路布引起更大面积的燃烧,说法不正确,符合题意;
C、炒菜时锅里的油着火,用锅盖盖住可以使可燃物与空气隔绝达到灭火目的,说法正确,不符合题意;
D、液态二氧化碳灭火时,液态二氧化碳马上变成气体不残留任何残留物,可以更好地保护图书档案,说法正确,不符合题意。
故选B。
8.D
【分析】根据灭火的方法分析:灭火的方法有:(1)与空气(或氧气)隔绝;(2)降温到可燃物的着火点以下;(3)清除可燃物分析判断。
【详解】A、往着火的木柴上覆盖沙子,利用的原理是隔绝空气或氧气;
B、实验室用灯帽盖灭酒精灯,利用的原理是空气或氧气;
C、油锅着火用锅盖盖灭,利用的原理是空气或氧气;
D、森林火灾时将火场周围树木砍伐掉是设置隔离带,从而灭森林大火,利用的原理是清除可燃物;
综上所述分析,故选D。
9.B
【详解】A、二氧化碳中碳元素的质量为8.8g××100%=2.4g,根据质量守恒定律,反应前后元素种类和质量不变,则3g有机物X中碳元素的质量为2.4g,故选项说法正确;
B、生成的CO2和H2O的分子数之比为:=2:3,故选项说法不正确;
C、5.4g水中氢元素的质量为5.4g××100%=0.6g,生成物中碳元素和氢元素的质量和为2.4g+0.6g=3g,恰好与有机物的质量相等,因此有机物中不含氧元素,则有机物X中含有碳、氢两种元素,故选项说法正确;
D、根据质量守恒定律,3g有机物完全燃烧消耗的氧气的质量为5.4g+8.8g-3g=11.2g,故选项说法正确。
故选B。
10.D
【详解】A、高层住宅着火时,不能乘坐电梯逃生,该选项做法正确;
B、甲烷为天然气的主要成分,甲烷为可燃性气体,与空气混合后遇明火可能会发生爆炸,该选项说法正确;
C、火灾发生后应用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开火灾现场,避免吸入浓烟和有毒气体,该选项做法正确;
D、着火点为物质的固有属性,不能改变,该选项说法错误。
故选D。
11.B
【详解】A、根据图示,甲酸的化学式为HCOOH,故甲酸的相对分子质量为12+1×2+16×2=46,该选项说法正确;
B、一个过氧化氢分子是由2个氢原子与2个氧原子构成的,该选项说法错误;
C、根据图示,该过程反应为甲酸与氧气反应生成二氧化碳与过氧化氢,该反应的化学方程式为:,该选项说法正确;
D、在化学反应中,催化剂只改变反应速率,不改变生成物的量,故该反应中的催化剂对反应物和生成物的质量比没有影响,该选项说法正确;
故选B。
12.D
【详解】A、丙是甲醇(CH3OH),其中氧元素的质量分数为,说法正确;
B、该反应能够消耗二氧化碳,有助于实现“碳中和”,说法正确;
C、由反应的微观示意图可知,该反应是在催化剂的作用下,氢气和二氧化碳反应生成甲醇和水;该反应的化学方程式为3H2+CO2CH3OH+H2O,说法正确;
D、根据化学方程式可知,生成物丙(甲醇)和丁(水)的质量比为32:18≠1:1,说法错误。
故选D。
13.B
【详解】A、在化学变化中,原子为最小的粒子,不可再分,但实际上原子还可分为原子核和核外电子,该选项说法不正确;
B、化学反应前后,原子的种类和数目不变,该选项说法正确;
C、由图可知,该反应为两种分子生成一种分子的反应,属于化合反应,该选项说法不正确;
D、氯化氢是由氯化氢分子构成,则保持氯化氢化学性质的最小粒子为氯化氢分子,该选项说法不正确。
故选B。
14.B
【详解】A、镁条在空气中燃烧生成氧化镁,由于有空气中的气体参加反应,不能直接用于验证质量守恒定律,A选项错误;
B、红磷与氧气在点燃条件下反应生成五氧化二磷,有氧气消耗,且在密闭的环境中进行该实验,能直接用于验证质量守恒定律,B选项正确;
C、水和油混合,不发生化学反应,不能用来验证质量守恒定律,C选项错误;
D、双氧水在二氧化锰的催化作用下生成水和氧气,生成的氧气逸出,不能直接用于验证质量守恒定律,D选项错误。
故填:B。
15.D
【详解】A、28.8g FeC2O4中铁元素的质量为,依据质量守恒定律可知,残余固体含铁元素11.2g,说法正确,不符合题意;
B、生成气体的质量为28.8g-14.4g=14.4g,28.8g FeC2O4中碳元素的质量为,依据质量守恒定律可知,生成气体中碳元素质量也为4.8g,则生成气体中氧元素的质量为14.4g-4.8g=9.6g,所以气体中碳原子与氧原子的个数比为,则该气体为CO和CO2的混合物,说法正确,不符合题意;
C、依据质量守恒定律可知,生成气体的质量为28.8g-14.4g=14.4g,说法正确,不符合题意;
D、残余固体中氧元素的质量为14.4g-11.2g=3.2g,设残余固体的化学式为FexOy,则,解得x:y=1:1,所以化学式为FeO,说法错误,符合题意。
故选D。
16.(1)化合
(2)①
(3)白磷
(4)
(5)20.8%
(6)装置冷却至室温或温度计示数达到室温或注射器活塞不再移动(合理即可)
【详解】(1)红磷和氧气反应生成五氧化二磷,反应符合“多变一”的特征,属于化合反应;
(2)利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,用高能激光笔照射,白磷开始燃烧,说明在第一次燃烧后仍有氧气剩余,猜想①正确;
(3)用“燃烧法测定空气中氧气含量”时,选择白磷更合适,理由是白磷消耗氧气更彻底;
(4)木炭会与氧气反应生成二氧化碳气体,导致无法测出氧气的含量,文字表达式为:;
(5)注射器剩余气体读数:(18.7mL+18.9mL+18.8mL)=18.8mL,空气中氧气含量为:;
(6)实验后必须等到反应完全,稳定之后才能读数,即装置冷却至室温或温度计示数达到室温或注射器活塞不再移动时,才可以记录注射器内剩余气体的体积。
17. 能 白磷燃烧,而铜板没有燃烧(或不能;铜板未燃烧可能没有达到其着火点) 温度没有达到着火点 没有与氧气接触 环保,不污染空气 平衡试管内的压强,防止白磷燃烧时放热使橡皮塞弹飞(或其他合理答案)
【详解】图1装置实验中有对比实验,白磷和红磷都是可燃物,但铜板没有可燃性,因此通过现象白磷燃烧,而铜板没有燃烧可以证明燃烧需要可燃物;当然铜板没有燃烧也可能是因为温度没有达到着火点;故填:能;白磷燃烧,而铜板没有燃烧(或不能;铜板未燃烧可能没有达到其着火点)。
【改进与实验】燃烧必须达到三个条件:①物质本身具有可燃性,②可燃物与助燃物充分地接触,③达到可燃物的着火点。所以投入水中的白磷虽然温度达到着火点,但是在水中与空气隔绝,所以不会燃烧;试管b中的红磷尽管与空气接触,但是温度没有达到它的着火点,所以不会燃烧。故填:温度没有达到着火点;没有与氧气接触。
【反思与评价】(1)改进后的图2装置与图1装置比较燃烧后的产物在试管中不会散发到空气里,所以优点是能防止白磷燃烧产生的五氧化二磷逸散,危害人体健康,故填:环保,不污染空气;(2)在反应过程中白磷燃烧放出热量,气体受热膨胀,试管内的压强变大,所以图装置中气球的作用是避免橡皮塞因试管内气体热膨胀而被冲开气球弹性较大,因此可缓冲压强;故填:平衡试管内的压强,防止白磷燃烧时放热使橡皮塞弹飞。
18.(1) 5 在其他条件相同的情况下,温度越高,反应速率越快
(2)第2组和第3组
(3)
(4)解:设本实验所用4.0g粗锌中锌的质量为x。
x=2.6g
本实验所用4.0g粗锌中锌的质量分数为
答:本实验所用4.0g粗锌中锌的质量分数为52%。
【详解】(1)第1组、第3组实验:取用粗锌的质量相同、温度不同,要探究温度对锌与稀硫酸反应速率的影响,根据控制变量的思想,需要控制硫酸的浓度相同,则m的数值为5;由据氢气体积与反应时间的关系曲线可知,温度为30℃时,反应速率快,则温度与反应速率的关系是在其他条件相同的情况下,温度越高,反应速率越快,故填:5;在其他条件相同的情况下,温度越高,反应速率越快;
(2)探究硫酸浓度对锌与硫酸反应速率的影响,需要硫酸浓度不同,控制取用粗锌的质量、温度相同,满足的组别是第2组和第3组,故填:第2组和第3组;
(3)
通过实验可知,在其他条件相同的情况下,酸的浓度越大,反应速率越快;温度越高,反应速率越快, 4组实验中第四组酸的浓度最大、温度最高,所以反应速率最快,曲线d图为,故填:;
(4)见答案。
答案第6页,共7页
答案第7页,共7页
一、选择题
1.将15.5g KClO3和MnO2的混合物加热,待完全反应后得到10.7g固体物质,根据质量守恒定律,生成O2的质量是
A.6.9 g B.6.1 g C.4.8 g D.9.6 g
2.使燃料充分燃烧的方法,错误的是
A.提供足量的氧气 B.降低燃料的着火点
C.固体燃料粉碎 D.液体燃料喷成雾状
3.2023年1月15日,辽宁盘锦浩业化工有限公司烷基化装置在维修过程中发生泄漏爆炸着火,并造成了人员伤亡和重大财产损失。下列说法中不符合科学道理的是
A.煤气泄漏需要关闭阀门并开窗通风,必要时可打开排气扇加速空气流动
B.室内起火时,应用湿毛巾捂住口鼻蹲下靠近地面或沿着墙壁跑离着火区
C.点燃氢气等可燃性气体前一定要先检验纯度
D.家里电器着火时,先关闭电源,再灭火
4.下列变化符合质量守恒定律的是
①镁在空气中燃烧生成氧化镁的质量比镁大
②水加热沸腾一段时间后质量变小
③4克氢气在34克氧气中燃烧生成36克水
A.①③ B.①②③ C.② D.①②
5.化学方程式C+O2CO2有关说法正确的是
A.在点燃的条件下,碳加氧气等于二氧化碳
B.在点燃的条件下,每1个碳和2个氧气反应生成2个二氧化碳
C.在点燃的条件下,每1克碳和1克氧气反应生成2克二氧化碳
D.在点燃的条件下,每1mol碳和1mol氧气反应生成1mol二氧化碳
6.建立宏观和微观的联系是化学思维方式。如图为某反应的微观示意图,有关说法错误的是
A.该示意图表示一氧化碳与氧气发生的反应
B.该反应前后各元素的化合价均发生改变
C.参加反应的一氧化碳和氧气的质量比为
D.一氧化碳可燃,二氧化碳不可燃,因为它们分子构成不同
7.下列情况中所采取的灭火方法,不正确的是
A.身上衣服着火时可就地打滚 B.电器设备失火,可立即用水浇灭
C.炒菜时锅里的油着火,可用锅盖盖灭 D.用液态二氧化碳灭火器扑灭图书档案的火灾
8.下列灭火方法所用原理与其他三个不同的是
A.用砂子盖灭燃着的木柴 B.用灯帽盖灭酒精灯
C.油锅中的油着火用锅盖盖灭 D.森林火灾时将火场周围树木砍伐掉
9.3g有机物X与充足的氧气在密闭容器内完全燃烧,生成8.8g二氧化碳和5.4g水蒸气。下列说法中不正确的是
A.3g有机物X中碳元素的质量为2.4g B.生成的CO2和H2O的分子数之比为3:2
C.有机物X中含有碳、氢两种元素 D.3g有机物完全燃烧消耗的氧气为11.2g
10.2024年2月24日南京火灾给人们敲响了安全警钟,下列说法或做法错误的是
A.高层住宅着火,如果楼内有电梯,不能乘坐电梯逃生
B.甲烷是天然气的主要成分,与空气混合后遇明火可能会发生爆炸
C.火灾发生后应用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开火灾现场
D.通过降低可燃物的着火点可以灭火
11.在通电和催化条件下,甲酸与氧气反应的微观示意图如下,下列说法错误的是
A.该反应中,甲酸的相对分子质量为
B.一个H2O2分子由两个氢原子和一个氧分子结合形成
C.反应的化学方程式:
D.该反应中的催化剂对反应物和生成物的质量比没有影响
12.2023年杭州亚运会主火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内的零排放,科学家利用某纳米纤维催化剂将二氧化碳转化为绿色甲醇(CH3OH),其微观示意图如下(图中的分子恰好完全反应)。下列说法错误的是
A.生成物丙中氧元素的质量分数为50%
B.该反应有助于实现“碳中和”
C.该反应的化学方程式为3H2+CO2CH3OH+H2O
D.生成物丙和丁的质量比为1:1
13.下图是氢气在氯气中燃烧的微观示意图,下列说法正确的是
A.原子是最小的粒子,不可以再分
B.化学反应前后,原子的种类、数目不变
C.此反应是两种分子生成一种分子,属于分解反应
D.保持氯化氢化学性质的最小粒子是氢原子和氧原子
14.下列装置及实验(天平未画出)能用来验证质量守恒定律的是
A.镁条燃烧 B.红磷燃烧
C.水和油混合 D.制取氧气
15.已知FeC2O4(固体)受热分解产生铁的氧化物和气体。将28.8gFeC2O4隔绝空气充分加热,冷却、称得残余固体14.4g。下列说法不正确的是
A.残余固体中含11.2g铁元素
B.FeC2O4(固体)分解产生的气体是混合物
C.分解产生的气体质量为14.4g
D.残余固体是Fe2O3
二、实验题
16.某化学兴趣小组在老师指导下进行课外实验,利用如图1所示装置来探究磷单质在空气中燃烧后氧气浓度变化情况。
【提出问题】足量红磷在密闭的三颈烧瓶内燃烧熄灭后,容器中是否有氧气剩余?
【猜想假设】猜想①:有氧气剩余;猜想②:无氧气剩余。
【实验验证】该小组同学按图1组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,用高能激光笔照射,白磷开始燃烧。
(1)红磷在空气中燃烧,发生反应的基本类型为 反应。
【实验结论】
(2)猜想 正确。
【交流讨论】
(3)根据实验结论,用“燃磷法测定空气中氧气含量”时,选择 (填“红磷”或“白磷”)更合适。
(4)测定空气中氧气含量的实验中,不能用木炭代替磷的原因是 (用文字表达式表示)。
【拓展延伸】为提高测定空气中氧气含量实验的精确度,化学兴趣小组在查阅相关资料后改用“暖宝宝”对实验进行了如图2的创新改进。
【查阅资料】暖宝宝中含有脱氧剂,在空气中能与氧气发生缓慢氧化,放出热量,几乎能耗尽容器中的氧气。
【实验方案】在实际容积为的集气瓶里先加入的水,右侧连接装有空气的注射器(注射器活塞与内壁摩擦非常小,可忽略不计)。
重复3次上述实验,记录数据如表。
实验次数 1 2 3
注射器剩余气体读数
(5)根据表中的实验数据计算,空气中氧气含量为 (用百分数表示)。
(6)实验后必须等到 时,才可以记录注射器内剩余气体的体积。
三、科学探究题
17.为了探究燃烧的条件,某兴趣小组活动中,同学们按图1装置进行探究。
图1装置 (填“能”或“不能”)说明燃烧需要可燃物,如果能,写出能证明该结论的实验现象(如果不能,说明可能猜想): 。
探究过程中,大家对磷燃烧生成的大量白烟是否危害人体健康提出疑问。
【查阅资料】白磷的着火点是40℃,红磷的着火点是240℃,燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,可能与空气中水蒸气反应,生成有毒的偏磷酸(HPO3)。
【变流与讨论】白烟对人体健康有害,该实验装置必须改进。
【改进与实验】同学们按改进后的图2装置进行实验。
请你帮助他们将下表补充完整。
现象 解释
a试管中白磷燃烧,热水中白磷没有燃烧。 b试管中红磷没有燃烧。 b试管中红磷没有燃烧的原因是 热水中白磷都没有燃烧的原因是
【反思与评价】
(1)改进后的图2装置与图1装置相比,优点是 。
(2)小林同学指出图2装置仍有不足之处,并设计了图3装置,其中气球的作用是 。
四、综合应用题
18.为探究影响锌与硫酸反应速率的因素,实验小组取质量、颗粒大小相同的粗锌,设计了以下4组方案,记录数据并绘制生成氢气体积与反应时间的关系曲线如下图。已知粗锌中的杂质既不溶于水,也不与稀硫酸反应。
组别 取用的粗锌质量 硫酸的浓度/%(均取98mL) 温度/℃ 对应的曲线
1 4.0g m 20 a
2 4.0g 10 30 b
3 4.0g 5 30 c
4 4.0g 10 50 d
(1)通过第1组和第3组实验可以探究温度对锌与硫酸反应速率的影响,则m的数值为 。据此可知温度与反应速率的关系是 。
(2)能探究硫酸浓度对锌与硫酸反应速率的影响的组别是 。(填序号)
(3)根据你对本实验的理解,请在坐标图中画出第4组实验对应的大致曲线d。
(4)实验条件下890mLH2折合为0.08g,请计算出本实验所用4.0g粗锌中锌的质量分数。(用化学方程式计算,写出完整的计算过程)
试卷第6页,共6页
试卷第1页,共6页
参考答案:
1.C
【详解】根据质量守恒定律,反应前后的质量差为生成的氧气的质量,即15.5g-10.7g=4.8g;故选C。
2.B
【详解】A、供应足量的氧气,增大氧气的浓度,能使燃料充分燃烧,说法正确,故选项不符合题意;
B、可燃物的着火点是物质本身固有属性,物质不变其着火点也不能改变,说法错误,故选项符合题意;
C、把固体燃料粉碎,增大了与氧气的接触面积,能使燃料充分燃烧,说法正确,故选项不符合题意;
D、把液体燃料喷成雾状,增大了与氧气的接触面积,能使燃料充分燃烧,说法正确,故选项不符合题意。
故选B。
3.A
【详解】A、煤气具有可燃性,混有一定量的空气,遇到明火或电火花,容易发生爆炸,故煤气泄漏需要关闭阀门并开窗通风,不可打开排气扇,防止发生爆炸,符合题意;
B、室内起火时,应用湿毛巾捂住口鼻,过滤有毒烟尘,二氧化碳受热密度变小,故高空中二氧化碳含量较高,故应蹲下靠近地面或沿着墙壁跑离着火区,不符合题意;
C、氢气具有可燃性,混有一定量的空气,遇到明火,容易发生爆炸,故点燃氢气等可燃性气体前一定要先检验纯度,不符合题意;
D、家里电器着火时,先关闭电源,再灭火,不能立即用水浇灭,防止触电,不符合题意。
故选A。
4.A
【详解】①镁在空气中燃烧和空气中氧气反应,故生成固体氧化镁的质量比固体镁质量大,正确;
②水加热沸腾是一个物理变化,不能用质量守恒解释,错误;
③
由化学方程式体现的质量关系可知,4克氢气在34克氧气中燃烧恰好反应生成36克水,正确。
故选A。
【点睛】任何化学变化都遵循质量守恒定律。
5.D
【分析】根据分析
【详解】A、该反应表示,在点燃的条件下,碳和氧气生成二氧化碳,选项错误;
B、微观上表示一个碳原子和一个氧分子分解出的2个氧原子结合为一个二氧化碳分子,选项错误;
C、在点燃的条件下,每12克碳和32克氧气反应生成44克二氧化碳,选项错误;
D、根据化学方程式可知三者的微粒个数比是1:1:1,即在点燃的条件下,每1mol碳和1mol氧气反应生成1mol二氧化碳,选项正确;
故选:D
6.C
【分析】由微观示意图可知,反应物为一氧化碳和氧气,产物为二氧化碳,一氧化碳与氧气在点燃条件下生成二氧化碳,方程式为。
【详解】A、由分析可知,该反应反应物为一氧化碳和氧气,说法正确;
B、反应物一氧化碳中氧元素为-2价,碳元素为+2价,氧气中氧元素为0价,产物二氧化碳中氧元素为-2价,碳元素为+4价,氧元素和碳元素的化合价在反应前后都发生改变,说法正确;
C、参加反应的一氧化碳和氧气的质量比=2×(12+16):(16×2)=7:4,说法错误;
D、一氧化碳可燃,二氧化碳不可燃,一氧化碳由一氧化碳分子构成,二氧化碳由二氧化碳分子构成,分子不同,所以二者化学性质不同,说法正确。
故选:C。
7.B
【详解】A、就地打滚可以使身上燃烧物随翻滚而与空气隔绝,达到灭火的目的,说法正确,不符合题意;
B、向着火的电器上浇水,可能会因水的导电性而使扑火者触电,或引发电路短路布引起更大面积的燃烧,说法不正确,符合题意;
C、炒菜时锅里的油着火,用锅盖盖住可以使可燃物与空气隔绝达到灭火目的,说法正确,不符合题意;
D、液态二氧化碳灭火时,液态二氧化碳马上变成气体不残留任何残留物,可以更好地保护图书档案,说法正确,不符合题意。
故选B。
8.D
【分析】根据灭火的方法分析:灭火的方法有:(1)与空气(或氧气)隔绝;(2)降温到可燃物的着火点以下;(3)清除可燃物分析判断。
【详解】A、往着火的木柴上覆盖沙子,利用的原理是隔绝空气或氧气;
B、实验室用灯帽盖灭酒精灯,利用的原理是空气或氧气;
C、油锅着火用锅盖盖灭,利用的原理是空气或氧气;
D、森林火灾时将火场周围树木砍伐掉是设置隔离带,从而灭森林大火,利用的原理是清除可燃物;
综上所述分析,故选D。
9.B
【详解】A、二氧化碳中碳元素的质量为8.8g××100%=2.4g,根据质量守恒定律,反应前后元素种类和质量不变,则3g有机物X中碳元素的质量为2.4g,故选项说法正确;
B、生成的CO2和H2O的分子数之比为:=2:3,故选项说法不正确;
C、5.4g水中氢元素的质量为5.4g××100%=0.6g,生成物中碳元素和氢元素的质量和为2.4g+0.6g=3g,恰好与有机物的质量相等,因此有机物中不含氧元素,则有机物X中含有碳、氢两种元素,故选项说法正确;
D、根据质量守恒定律,3g有机物完全燃烧消耗的氧气的质量为5.4g+8.8g-3g=11.2g,故选项说法正确。
故选B。
10.D
【详解】A、高层住宅着火时,不能乘坐电梯逃生,该选项做法正确;
B、甲烷为天然气的主要成分,甲烷为可燃性气体,与空气混合后遇明火可能会发生爆炸,该选项说法正确;
C、火灾发生后应用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开火灾现场,避免吸入浓烟和有毒气体,该选项做法正确;
D、着火点为物质的固有属性,不能改变,该选项说法错误。
故选D。
11.B
【详解】A、根据图示,甲酸的化学式为HCOOH,故甲酸的相对分子质量为12+1×2+16×2=46,该选项说法正确;
B、一个过氧化氢分子是由2个氢原子与2个氧原子构成的,该选项说法错误;
C、根据图示,该过程反应为甲酸与氧气反应生成二氧化碳与过氧化氢,该反应的化学方程式为:,该选项说法正确;
D、在化学反应中,催化剂只改变反应速率,不改变生成物的量,故该反应中的催化剂对反应物和生成物的质量比没有影响,该选项说法正确;
故选B。
12.D
【详解】A、丙是甲醇(CH3OH),其中氧元素的质量分数为,说法正确;
B、该反应能够消耗二氧化碳,有助于实现“碳中和”,说法正确;
C、由反应的微观示意图可知,该反应是在催化剂的作用下,氢气和二氧化碳反应生成甲醇和水;该反应的化学方程式为3H2+CO2CH3OH+H2O,说法正确;
D、根据化学方程式可知,生成物丙(甲醇)和丁(水)的质量比为32:18≠1:1,说法错误。
故选D。
13.B
【详解】A、在化学变化中,原子为最小的粒子,不可再分,但实际上原子还可分为原子核和核外电子,该选项说法不正确;
B、化学反应前后,原子的种类和数目不变,该选项说法正确;
C、由图可知,该反应为两种分子生成一种分子的反应,属于化合反应,该选项说法不正确;
D、氯化氢是由氯化氢分子构成,则保持氯化氢化学性质的最小粒子为氯化氢分子,该选项说法不正确。
故选B。
14.B
【详解】A、镁条在空气中燃烧生成氧化镁,由于有空气中的气体参加反应,不能直接用于验证质量守恒定律,A选项错误;
B、红磷与氧气在点燃条件下反应生成五氧化二磷,有氧气消耗,且在密闭的环境中进行该实验,能直接用于验证质量守恒定律,B选项正确;
C、水和油混合,不发生化学反应,不能用来验证质量守恒定律,C选项错误;
D、双氧水在二氧化锰的催化作用下生成水和氧气,生成的氧气逸出,不能直接用于验证质量守恒定律,D选项错误。
故填:B。
15.D
【详解】A、28.8g FeC2O4中铁元素的质量为,依据质量守恒定律可知,残余固体含铁元素11.2g,说法正确,不符合题意;
B、生成气体的质量为28.8g-14.4g=14.4g,28.8g FeC2O4中碳元素的质量为,依据质量守恒定律可知,生成气体中碳元素质量也为4.8g,则生成气体中氧元素的质量为14.4g-4.8g=9.6g,所以气体中碳原子与氧原子的个数比为,则该气体为CO和CO2的混合物,说法正确,不符合题意;
C、依据质量守恒定律可知,生成气体的质量为28.8g-14.4g=14.4g,说法正确,不符合题意;
D、残余固体中氧元素的质量为14.4g-11.2g=3.2g,设残余固体的化学式为FexOy,则,解得x:y=1:1,所以化学式为FeO,说法错误,符合题意。
故选D。
16.(1)化合
(2)①
(3)白磷
(4)
(5)20.8%
(6)装置冷却至室温或温度计示数达到室温或注射器活塞不再移动(合理即可)
【详解】(1)红磷和氧气反应生成五氧化二磷,反应符合“多变一”的特征,属于化合反应;
(2)利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,用高能激光笔照射,白磷开始燃烧,说明在第一次燃烧后仍有氧气剩余,猜想①正确;
(3)用“燃烧法测定空气中氧气含量”时,选择白磷更合适,理由是白磷消耗氧气更彻底;
(4)木炭会与氧气反应生成二氧化碳气体,导致无法测出氧气的含量,文字表达式为:;
(5)注射器剩余气体读数:(18.7mL+18.9mL+18.8mL)=18.8mL,空气中氧气含量为:;
(6)实验后必须等到反应完全,稳定之后才能读数,即装置冷却至室温或温度计示数达到室温或注射器活塞不再移动时,才可以记录注射器内剩余气体的体积。
17. 能 白磷燃烧,而铜板没有燃烧(或不能;铜板未燃烧可能没有达到其着火点) 温度没有达到着火点 没有与氧气接触 环保,不污染空气 平衡试管内的压强,防止白磷燃烧时放热使橡皮塞弹飞(或其他合理答案)
【详解】图1装置实验中有对比实验,白磷和红磷都是可燃物,但铜板没有可燃性,因此通过现象白磷燃烧,而铜板没有燃烧可以证明燃烧需要可燃物;当然铜板没有燃烧也可能是因为温度没有达到着火点;故填:能;白磷燃烧,而铜板没有燃烧(或不能;铜板未燃烧可能没有达到其着火点)。
【改进与实验】燃烧必须达到三个条件:①物质本身具有可燃性,②可燃物与助燃物充分地接触,③达到可燃物的着火点。所以投入水中的白磷虽然温度达到着火点,但是在水中与空气隔绝,所以不会燃烧;试管b中的红磷尽管与空气接触,但是温度没有达到它的着火点,所以不会燃烧。故填:温度没有达到着火点;没有与氧气接触。
【反思与评价】(1)改进后的图2装置与图1装置比较燃烧后的产物在试管中不会散发到空气里,所以优点是能防止白磷燃烧产生的五氧化二磷逸散,危害人体健康,故填:环保,不污染空气;(2)在反应过程中白磷燃烧放出热量,气体受热膨胀,试管内的压强变大,所以图装置中气球的作用是避免橡皮塞因试管内气体热膨胀而被冲开气球弹性较大,因此可缓冲压强;故填:平衡试管内的压强,防止白磷燃烧时放热使橡皮塞弹飞。
18.(1) 5 在其他条件相同的情况下,温度越高,反应速率越快
(2)第2组和第3组
(3)
(4)解:设本实验所用4.0g粗锌中锌的质量为x。
x=2.6g
本实验所用4.0g粗锌中锌的质量分数为
答:本实验所用4.0g粗锌中锌的质量分数为52%。
【详解】(1)第1组、第3组实验:取用粗锌的质量相同、温度不同,要探究温度对锌与稀硫酸反应速率的影响,根据控制变量的思想,需要控制硫酸的浓度相同,则m的数值为5;由据氢气体积与反应时间的关系曲线可知,温度为30℃时,反应速率快,则温度与反应速率的关系是在其他条件相同的情况下,温度越高,反应速率越快,故填:5;在其他条件相同的情况下,温度越高,反应速率越快;
(2)探究硫酸浓度对锌与硫酸反应速率的影响,需要硫酸浓度不同,控制取用粗锌的质量、温度相同,满足的组别是第2组和第3组,故填:第2组和第3组;
(3)
通过实验可知,在其他条件相同的情况下,酸的浓度越大,反应速率越快;温度越高,反应速率越快, 4组实验中第四组酸的浓度最大、温度最高,所以反应速率最快,曲线d图为,故填:;
(4)见答案。
答案第6页,共7页
答案第7页,共7页
同课章节目录
