2016春高中化学(人教版必修二)教学课件:1.2 元素周期律(共38张PPT)
文档属性
| 名称 | 2016春高中化学(人教版必修二)教学课件:1.2 元素周期律(共38张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 383.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-18 22:09:05 | ||
图片预览











文档简介
课件38张PPT。第二节元素周期律
一、原子核外电子的排布宏观、微观运动的不同原子核外电子运动用电子云描述
用出现机会的大小描述氢原子的电子云一.核外电子运动的特征--电子云电子云:是用统计的方法对核外电子运动规律所作的一种描述。
描述方法:用小黑点的密度大小表示电子在某处出现机会的多少。
过程:给原子拍照,叠加。
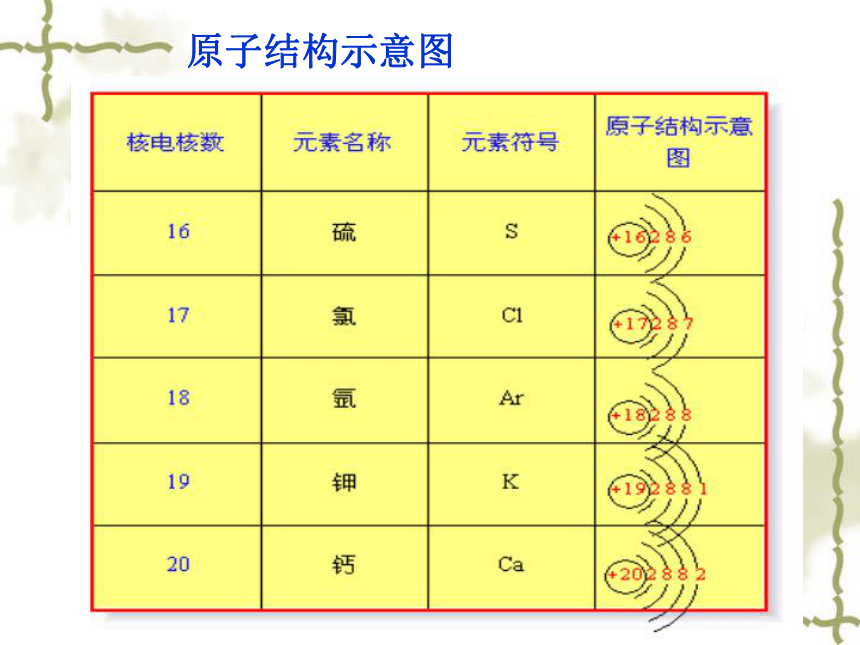
结果:很像在原子核外有一层疏密不等的“云”。电子层符号:K L M N O P Q电子层序数(n):1 2 3 4 5 6 7电子离核的距离电子具有的能量二.核外电子的分层排布(又叫分层运动)2.核外电子排布规律K→ L → M→N → O → P → Q2→ 8 →18→32→50→ 2n2…1 → 2 → 3 →4 → 5 → 6 → 7电子总是尽先排布在能量最低的电子层里。每个电子层最多只能排布2n2个电子。称有气体元素原子电子层排布[练习]填写课本上表格中相关内容K层为最外层时,最多只能容纳2个电子。
其它各层为最外层时,最多只能容纳8个电子。
次外层最多不超过18个电子。
倒数第三层最多不超过32个电子.每个电子层最多只能排布2n2个电子。电子总是尽先排布在能量最低的电子层里。[小结] 核外电子排布规律原子结构示意图 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285原子结构示意图练习:P93页-填表课堂小节1.理解电子云每一个小黑点只代表电子在该处出现一次,并不代表有一个电子。2.理解多电子原子的核外电子的运动特征:分层排布K层为最外层时,最多只能容纳2个电子。
其它各层为最外层时,最多只能容纳8个电子。
次外层最多不超过18个电子。
倒数第三层最多不超过32个电子.每个电子层最多只能排布2n2个电子。电子总是尽先排布在能量最低的电子层里。3.掌握核外电子排布规律课堂练习11.下列原子结构示意图中,正确的是( )2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )
A.14 B.15 C.16 D.17
3.下列叙述正确的是( )
A.电子在原子核外作高速圆周运动
B.电子云示意图中的小黑点表示一个电子
C. 次外层电子数一定是2或8
D.最外层只有一个电子的原子不一定是碱金属元素的原子答案:1.B 2.A 3.DBAD课堂练习21.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;______
(3)C元素的次外层电子数是最外层电子数的1/4;________
课堂练习31.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为( )
A.6 B.8 C.12 D.16
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~10的元素中。满足上述关系的元素共有( )
A.1对 B.2对 C.3对 D.4对
3.A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为( )
A. A2B3 B. BA2 C. AB4 D.B3A2ACBD课堂练习41.有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是_____答案:H、O、Al、S、K二、元素周期律教学目的:1.了解原子核外电子的排布与元素
性质的关系。2.认识元素周期律的内容,掌握元素金属性、非金属性强弱的判定方法。教学重点:元素周期律的内涵;元素性质与原
子结构的关系 1、同主族元素,随着核电核数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,失电子能力逐渐 ,金属性 ;得电子能力(第ⅣA—ⅦA族)逐渐 ,非金属性逐渐 。
增多增大减弱增强增强减弱减弱知识回顾: 2、 Na的金属性比K的金属性 ,如何用实验事实判定Na、K的金属性强弱?弱(1)比较Na、K与水反应的剧烈程度(2)比较NaOH与 KOH的碱性强弱金属性强弱判定依据:(1)单质与水(或酸)反应置换氢的难易程度
(2)它们的最高价氧化物的水化物—氢氧化物的碱性强弱。
3、 Cl的非金属性比Br的非金属性 ,如何判定Cl 、Br的非金属性强弱? (1)比较Cl2、Br2与氢气反应的难易程度(2)比较HCl、HBr的稳定性(3)比较HClO4与HBrO4的酸性强弱强 (1)单质与氢气反应的难易程度(2)气态氢化物的稳定性(3)最高价氧化物的水化物的酸性强弱非金属性强弱判定依据:4、画出第三周期元素的原子结构示意图 思考:结合元素的原子结构特点,推测同周期元素的金属性与非金属性的递变趋势? 元素周期表中,同周期元素从左到右,电子层数 ,原子核电荷数 ,对核外电子层的引力 ,原子半径 ,原子核对最外层电子的引力逐渐 ,失电子能力 ,金属性 ;得电子能力 (第ⅣA—ⅦA族) ,非金属性 。
不变增多增强减小增大减弱增强增强减弱1、取一小块镁带,用砂纸磨去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞溶液。观察现象。过一会儿加热试管至水沸腾。观察现象。探究实验:加热前, ;加热至水沸腾后, 。 无明显现象产生大量气泡,溶液变红色 2、 取一小段镁带和一小片铝,用砂纸磨去它们表面的氧化膜,分别放入两支试管,在各加入2mL1mol/L盐酸。观察发生的现象。Mg+2HCl=MgCl2+H2↑2Al+6HCl=2AlCl3+3H2↑反应比较剧烈,产生
大量气泡。产生气泡,反应较慢 金属性逐渐 . 结 论: Na Mg Al减弱 下列元素单质中,最难和水反应产生氢气的是( )
A. Na B. Mg C. Al D. K练习:C3、结论Si P S Cl非金属性逐渐 。增强 下列元素单质中,最易和氢气反应生成氢化物的是( )
A. S B. P C. Cl D. I练习:C综合结论: 金属性逐渐 ,非金属性逐渐 。Na Mg Al Si P S Cl 元素的性质随着原子序数的递增而呈周期性变化,这一规律叫做元素周期律。 减弱增强知识整合:金 非 稀
属 属 有
性 金 气
性 体
元
素
非金属性逐渐ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0族
周 族
期金属性逐渐 1234567增强增强增
强增
强1.A、B、C、D是同周期的四种主族元素,A和B的最高价氧化物的水化物均呈碱性,且碱性B>A,C和D的最高价氧化物的水化物呈酸性,且酸性C>D,则它们的原子序数由大到小的顺序是( )
A、CDBA B、DCBA C、CDAB D、DCAB●跟踪练习:C2.用“>”或“<”回答问题:
①酸性:H2CO3 H2SiO3 H2SiO3 H3PO4
②碱性:Ca(OH)2 Mg(OH)2 Mg(OH)2 Al(OH)3
③气态氢化物稳定性:H2O H2S H2S HCl
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越 ;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越 ;
③元素的 性越强,其对应气态氢化物的稳定性越 。><><>>强强非金属强谢谢!
用出现机会的大小描述氢原子的电子云一.核外电子运动的特征--电子云电子云:是用统计的方法对核外电子运动规律所作的一种描述。
描述方法:用小黑点的密度大小表示电子在某处出现机会的多少。
过程:给原子拍照,叠加。
结果:很像在原子核外有一层疏密不等的“云”。电子层符号:K L M N O P Q电子层序数(n):1 2 3 4 5 6 7电子离核的距离电子具有的能量二.核外电子的分层排布(又叫分层运动)2.核外电子排布规律K→ L → M→N → O → P → Q2→ 8 →18→32→50→ 2n2…1 → 2 → 3 →4 → 5 → 6 → 7电子总是尽先排布在能量最低的电子层里。每个电子层最多只能排布2n2个电子。称有气体元素原子电子层排布[练习]填写课本上表格中相关内容K层为最外层时,最多只能容纳2个电子。
其它各层为最外层时,最多只能容纳8个电子。
次外层最多不超过18个电子。
倒数第三层最多不超过32个电子.每个电子层最多只能排布2n2个电子。电子总是尽先排布在能量最低的电子层里。[小结] 核外电子排布规律原子结构示意图 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。+15第1层第2层第3层K层L层M层285原子结构示意图练习:P93页-填表课堂小节1.理解电子云每一个小黑点只代表电子在该处出现一次,并不代表有一个电子。2.理解多电子原子的核外电子的运动特征:分层排布K层为最外层时,最多只能容纳2个电子。
其它各层为最外层时,最多只能容纳8个电子。
次外层最多不超过18个电子。
倒数第三层最多不超过32个电子.每个电子层最多只能排布2n2个电子。电子总是尽先排布在能量最低的电子层里。3.掌握核外电子排布规律课堂练习11.下列原子结构示意图中,正确的是( )2.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )
A.14 B.15 C.16 D.17
3.下列叙述正确的是( )
A.电子在原子核外作高速圆周运动
B.电子云示意图中的小黑点表示一个电子
C. 次外层电子数一定是2或8
D.最外层只有一个电子的原子不一定是碱金属元素的原子答案:1.B 2.A 3.DBAD课堂练习21.根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;______
(3)C元素的次外层电子数是最外层电子数的1/4;________
课堂练习31.某元素原子核外L层电子数是其它层电子数之和的2倍,则该元素的核电荷数为( )
A.6 B.8 C.12 D.16
2.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~10的元素中。满足上述关系的元素共有( )
A.1对 B.2对 C.3对 D.4对
3.A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5个,则A与B形成的化合物的化学式为( )
A. A2B3 B. BA2 C. AB4 D.B3A2ACBD课堂练习41.有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是_____答案:H、O、Al、S、K二、元素周期律教学目的:1.了解原子核外电子的排布与元素
性质的关系。2.认识元素周期律的内容,掌握元素金属性、非金属性强弱的判定方法。教学重点:元素周期律的内涵;元素性质与原
子结构的关系 1、同主族元素,随着核电核数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,失电子能力逐渐 ,金属性 ;得电子能力(第ⅣA—ⅦA族)逐渐 ,非金属性逐渐 。
增多增大减弱增强增强减弱减弱知识回顾: 2、 Na的金属性比K的金属性 ,如何用实验事实判定Na、K的金属性强弱?弱(1)比较Na、K与水反应的剧烈程度(2)比较NaOH与 KOH的碱性强弱金属性强弱判定依据:(1)单质与水(或酸)反应置换氢的难易程度
(2)它们的最高价氧化物的水化物—氢氧化物的碱性强弱。
3、 Cl的非金属性比Br的非金属性 ,如何判定Cl 、Br的非金属性强弱? (1)比较Cl2、Br2与氢气反应的难易程度(2)比较HCl、HBr的稳定性(3)比较HClO4与HBrO4的酸性强弱强 (1)单质与氢气反应的难易程度(2)气态氢化物的稳定性(3)最高价氧化物的水化物的酸性强弱非金属性强弱判定依据:4、画出第三周期元素的原子结构示意图 思考:结合元素的原子结构特点,推测同周期元素的金属性与非金属性的递变趋势? 元素周期表中,同周期元素从左到右,电子层数 ,原子核电荷数 ,对核外电子层的引力 ,原子半径 ,原子核对最外层电子的引力逐渐 ,失电子能力 ,金属性 ;得电子能力 (第ⅣA—ⅦA族) ,非金属性 。
不变增多增强减小增大减弱增强增强减弱1、取一小块镁带,用砂纸磨去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞溶液。观察现象。过一会儿加热试管至水沸腾。观察现象。探究实验:加热前, ;加热至水沸腾后, 。 无明显现象产生大量气泡,溶液变红色 2、 取一小段镁带和一小片铝,用砂纸磨去它们表面的氧化膜,分别放入两支试管,在各加入2mL1mol/L盐酸。观察发生的现象。Mg+2HCl=MgCl2+H2↑2Al+6HCl=2AlCl3+3H2↑反应比较剧烈,产生
大量气泡。产生气泡,反应较慢 金属性逐渐 . 结 论: Na Mg Al减弱 下列元素单质中,最难和水反应产生氢气的是( )
A. Na B. Mg C. Al D. K练习:C3、结论Si P S Cl非金属性逐渐 。增强 下列元素单质中,最易和氢气反应生成氢化物的是( )
A. S B. P C. Cl D. I练习:C综合结论: 金属性逐渐 ,非金属性逐渐 。Na Mg Al Si P S Cl 元素的性质随着原子序数的递增而呈周期性变化,这一规律叫做元素周期律。 减弱增强知识整合:金 非 稀
属 属 有
性 金 气
性 体
元
素
非金属性逐渐ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0族
周 族
期金属性逐渐 1234567增强增强增
强增
强1.A、B、C、D是同周期的四种主族元素,A和B的最高价氧化物的水化物均呈碱性,且碱性B>A,C和D的最高价氧化物的水化物呈酸性,且酸性C>D,则它们的原子序数由大到小的顺序是( )
A、CDBA B、DCBA C、CDAB D、DCAB●跟踪练习:C2.用“>”或“<”回答问题:
①酸性:H2CO3 H2SiO3 H2SiO3 H3PO4
②碱性:Ca(OH)2 Mg(OH)2 Mg(OH)2 Al(OH)3
③气态氢化物稳定性:H2O H2S H2S HCl
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越 ;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越 ;
③元素的 性越强,其对应气态氢化物的稳定性越 。><><>>强强非金属强谢谢!
