2016春高中化学(人教版必修一)教学课件:2.3 氧化还原反应(共25张PPT)
文档属性
| 名称 | 2016春高中化学(人教版必修一)教学课件:2.3 氧化还原反应(共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 161.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-18 22:12:58 | ||
图片预览







文档简介
课件25张PPT。第二章 化学物质及其变化 第三节 氧化还原反应第一课时学习要点能通过化合价的升降判断氧化还原反应 了解氧化还原反应的本质掌握氧化还原反应的概念思考与交流1.请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么?CuO+H2 =Cu+H2O 中CuO失氧,发生还原反应;H2得氧,发生氧化反应。2CuO+C=2Cu+CO2中CuO失氧,发生还原反应;C得氧,发生氧化反应。分类标准:得氧失氧一、从得氧失氧的角度分析:2.氧化反应和还原反应是分别独立进行的吗?氧化反应和还原反应总是同时进行的。思考与交流+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O二、从化合价升降角度分析:[问题]下列反应是否属于氧化还原反应?
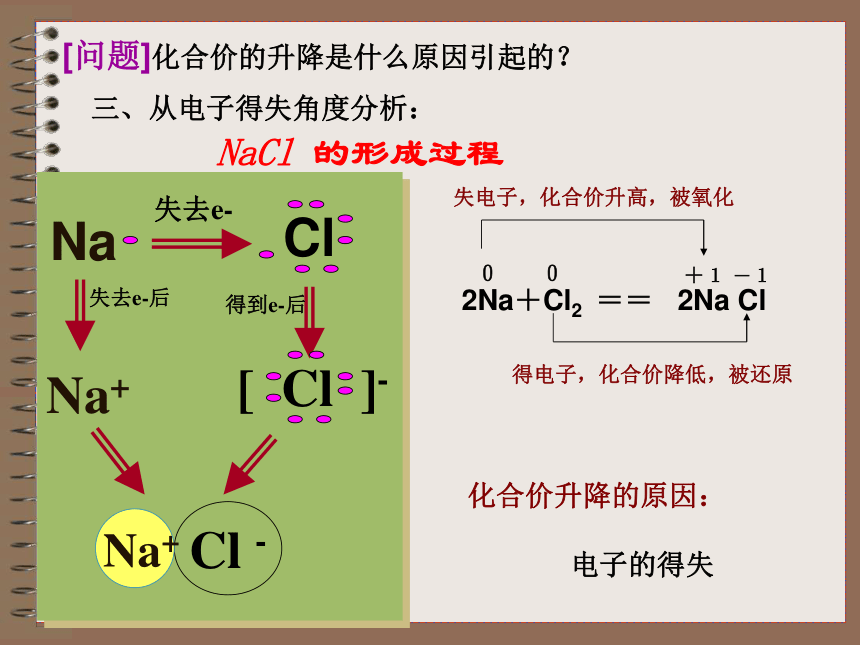
2Na+Cl2 === 2NaCl
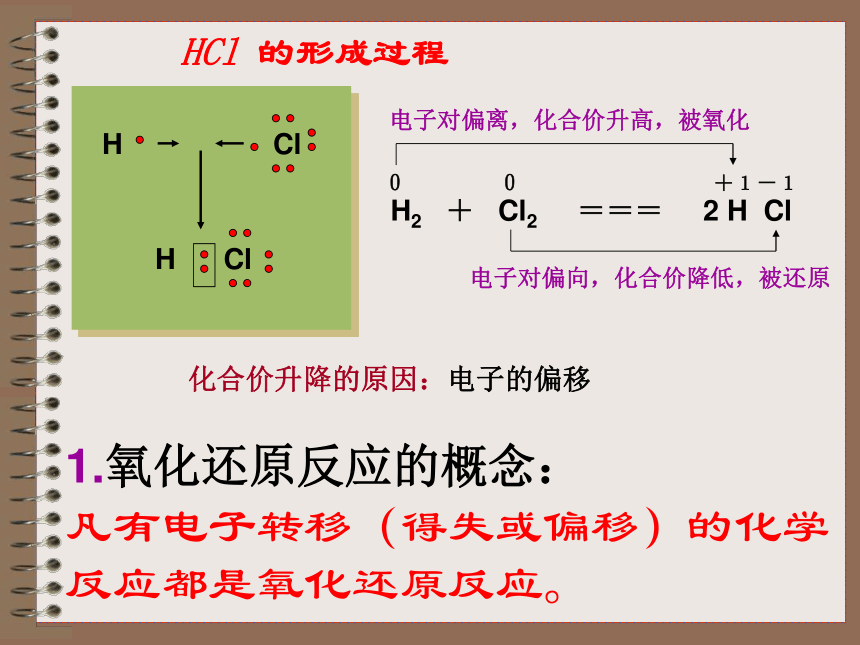
2H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+三、从电子得失角度分析:1.氧化还原反应的概念:
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。HCl 的形成过程化合价升降的原因:电子的偏移H Cl小结 ◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧
被还原的化学反应是氧化还原反应。
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还
原反应。
说明:氧化还原反应的本质是电子转移。
判断氧化还原反应的关键是准确判断化合价的变化,请标出下列物质中各元素的化合价:H2O H2O2 KMnO4 SO2 H2SO4
SO32- HNO3 NO2 NO3- NH3
NH4+ HClO Ca(ClO)2 KClO3 H2SO3
KI KIO3 Na2O2 Fe2(SO4)3 2 .下列反应中属于氧化还原反应的是( )
A Na2CO3 + 2HCl == 2NaCl + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
F.CuSO4·5H2O == CuSO4 + 5H2OCDE练习一:C1. 下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2 +H2O
B.CaCO3+2HCl=2NaCl+CO2 ↑ +H2O
C.2Fe2O3+3C 4Fe+3CO2↑
D.Ca(OH)2+CO2=CaCO3 ↓ + H2O 4、下列化工生产过程所发生的反应不属于氧化 还原反应的是( )
A.用氯气和消石灰制漂白粉
B.用纯碱、石灰石和石英制普通玻璃
C.用石油炼制过程脱硫得到的硫磺制造硫酸
D.用金属钠从四氯化钛(TiCl4)中提炼金属钛3、氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐 DB第二课时学习要点学会电子转移方向和数目的表示方法 了解常见氧化剂和还原剂牢记氧化还原反应中两条概念主线四大基本反应类型与氧化还原反应的关系1.下列化学反应中,属于氧化还原反应的是( )
A.Na2CO3+CaCl2===CaCO3↓+2NaCl
B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3 Na2CO3+CO2↑+H2O
D.CaO+H2O===Ca(OH)2回顾练习:2.分析下列氧化还原反应,回答:
Fe+CuSO4===Cu+FeSO4
此反应中,Fe___电子,化合价____,被_____,发生了_____反应;CuSO4 ___电子,化合价____,被_____,发生了_____反应。B失升高氧化氧化降低还原还原得2.氧化剂和还原剂 还原剂:失去电子(或电子对偏离)的物质
【所含元素化合价升高的物质】例.指出下列反应中的氧化剂和还原剂.
MnO2+4HCl=MnCl2+Cl2↑+2H2O氧化剂:得到电子(或电子对偏向)的物质
【所含元素化合价降低的物质】氧化剂还原剂3.氧化性和还原性氧化性:氧化剂夺电子的性质(或称氧化能力)
还原性:还原剂失电子的性质(或还原能力) 氧化剂具有氧化性
还原剂具有还原性氧化还原反应中各概念之间的关系(主线)氧化剂得电子价降低被还原氧化性还原反应还原剂失电子价升高被氧化还原性氧化反应①活泼的非金属单质如:Cl2、 O2等。
②化合物如:浓H2SO4、HNO3、KMnO4、FeCl3。常见的氧化剂有:常见的还原剂有:①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C。
③化合物:CO。 电子得失守恒及线桥表示方法氧化还原反应中氧化剂得电子总数等于还原剂失电子总数表示方法1:双线桥法表示方法2:单线桥法2Cu+O2=2CuO失去2e-×2得到2e-×24e-2Cu+O2=2CuO标出下列反应的电子转移方向和数目(2)用单线桥法:
2Fe + 3Cl2 = 2FeCl3分析表格,找出四种基本反应类型与氧化还原反应的关系[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××氧化还原反应与四种基本反应的关系化合反应分解反应复分解反应置换反应 化 学 反 应氧化还原反应非氧化还原反应交叉分类图(1)氧化还原反应与四种基本反应的关系交叉分类图(2)分解反应化合反应置换反应复分解反应氧化还原反应化合反应分解反应复分解反应置换反应氧化还原反应非氧化还原反应交叉分类图(3)课堂小结
2Na+Cl2 === 2NaCl
2H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+三、从电子得失角度分析:1.氧化还原反应的概念:
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。HCl 的形成过程化合价升降的原因:电子的偏移H Cl小结 ◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧
被还原的化学反应是氧化还原反应。
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还
原反应。
说明:氧化还原反应的本质是电子转移。
判断氧化还原反应的关键是准确判断化合价的变化,请标出下列物质中各元素的化合价:H2O H2O2 KMnO4 SO2 H2SO4
SO32- HNO3 NO2 NO3- NH3
NH4+ HClO Ca(ClO)2 KClO3 H2SO3
KI KIO3 Na2O2 Fe2(SO4)3 2 .下列反应中属于氧化还原反应的是( )
A Na2CO3 + 2HCl == 2NaCl + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
F.CuSO4·5H2O == CuSO4 + 5H2OCDE练习一:C1. 下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2 +H2O
B.CaCO3+2HCl=2NaCl+CO2 ↑ +H2O
C.2Fe2O3+3C 4Fe+3CO2↑
D.Ca(OH)2+CO2=CaCO3 ↓ + H2O 4、下列化工生产过程所发生的反应不属于氧化 还原反应的是( )
A.用氯气和消石灰制漂白粉
B.用纯碱、石灰石和石英制普通玻璃
C.用石油炼制过程脱硫得到的硫磺制造硫酸
D.用金属钠从四氯化钛(TiCl4)中提炼金属钛3、氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐 DB第二课时学习要点学会电子转移方向和数目的表示方法 了解常见氧化剂和还原剂牢记氧化还原反应中两条概念主线四大基本反应类型与氧化还原反应的关系1.下列化学反应中,属于氧化还原反应的是( )
A.Na2CO3+CaCl2===CaCO3↓+2NaCl
B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3 Na2CO3+CO2↑+H2O
D.CaO+H2O===Ca(OH)2回顾练习:2.分析下列氧化还原反应,回答:
Fe+CuSO4===Cu+FeSO4
此反应中,Fe___电子,化合价____,被_____,发生了_____反应;CuSO4 ___电子,化合价____,被_____,发生了_____反应。B失升高氧化氧化降低还原还原得2.氧化剂和还原剂 还原剂:失去电子(或电子对偏离)的物质
【所含元素化合价升高的物质】例.指出下列反应中的氧化剂和还原剂.
MnO2+4HCl=MnCl2+Cl2↑+2H2O氧化剂:得到电子(或电子对偏向)的物质
【所含元素化合价降低的物质】氧化剂还原剂3.氧化性和还原性氧化性:氧化剂夺电子的性质(或称氧化能力)
还原性:还原剂失电子的性质(或还原能力) 氧化剂具有氧化性
还原剂具有还原性氧化还原反应中各概念之间的关系(主线)氧化剂得电子价降低被还原氧化性还原反应还原剂失电子价升高被氧化还原性氧化反应①活泼的非金属单质如:Cl2、 O2等。
②化合物如:浓H2SO4、HNO3、KMnO4、FeCl3。常见的氧化剂有:常见的还原剂有:①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C。
③化合物:CO。 电子得失守恒及线桥表示方法氧化还原反应中氧化剂得电子总数等于还原剂失电子总数表示方法1:双线桥法表示方法2:单线桥法2Cu+O2=2CuO失去2e-×2得到2e-×24e-2Cu+O2=2CuO标出下列反应的电子转移方向和数目(2)用单线桥法:
2Fe + 3Cl2 = 2FeCl3分析表格,找出四种基本反应类型与氧化还原反应的关系[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××氧化还原反应与四种基本反应的关系化合反应分解反应复分解反应置换反应 化 学 反 应氧化还原反应非氧化还原反应交叉分类图(1)氧化还原反应与四种基本反应的关系交叉分类图(2)分解反应化合反应置换反应复分解反应氧化还原反应化合反应分解反应复分解反应置换反应氧化还原反应非氧化还原反应交叉分类图(3)课堂小结
