2025鲁教版高中化学必修第二册强化练习题--第2课时 元素周期表(含答案)
文档属性
| 名称 | 2025鲁教版高中化学必修第二册强化练习题--第2课时 元素周期表(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 378.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
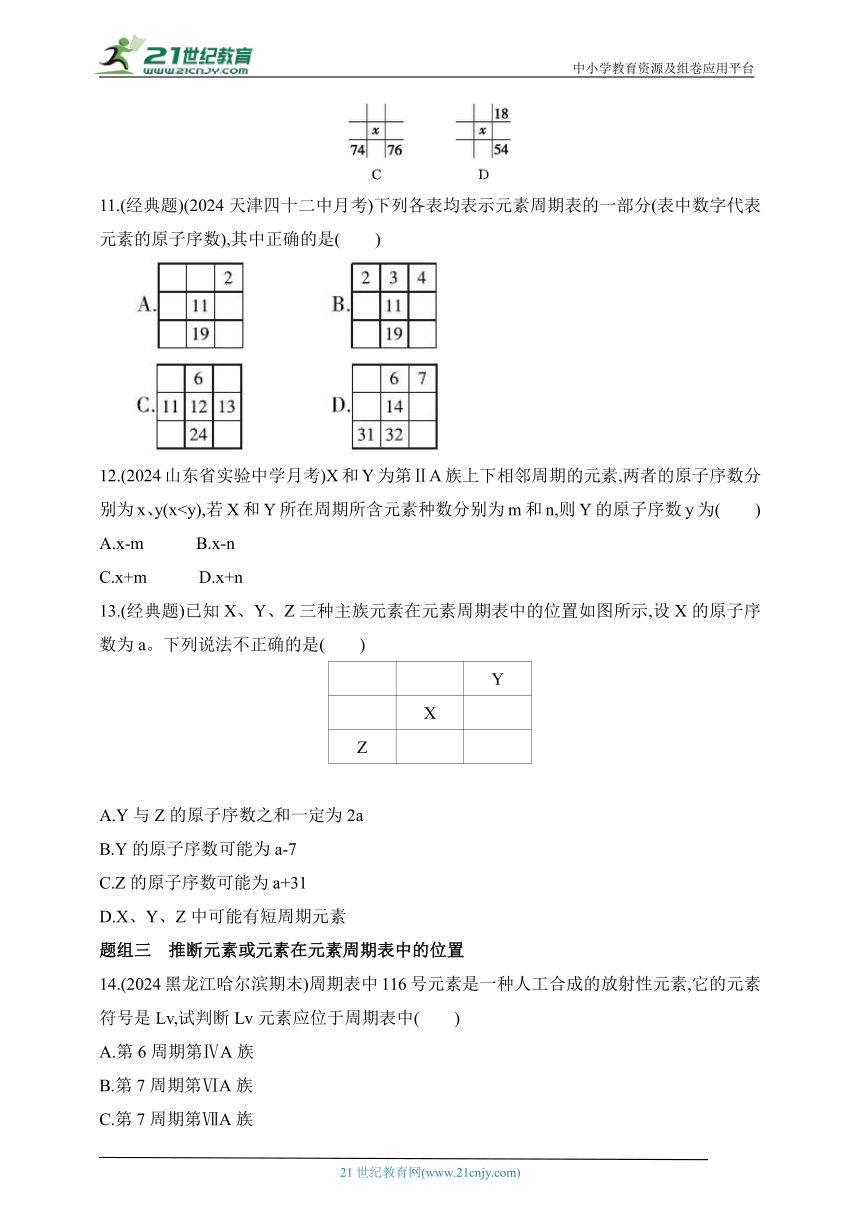
| 更新时间 | 2024-11-19 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁教版高中化学必修第二册
第2课时 元素周期表
基础过关练
题组一 元素周期表的相关知识
1.(2024福建三明阶段练习)下列关于元素周期表说法错误的是( )
A.元素周期表中有7个周期,周期序数等于该周期元素原子的核外电子层数
B.除He外,其他稀有气体元素原子的最外层电子数均为8
C.元素周期表有18个族,族序数等于该族元素原子的最外层电子数
D.通过元素周期表,可以了解元素名称、元素符号、相对原子质量
2.(2024安徽淮北期末)下列说法中,正确的是( )
A.最外层电子数为1的原子都为金属元素的原子
B.最外层电子数为8的微粒一定是稀有气体元素的原子
C.镧系元素在元素周期表的同一格内,所以它们互为同位素
D.在元素周期表中含元素最多的族是第ⅢB族
3.(2024福建福安一中月考)“中国紫”硅酸铜钡(BaCuSi2O6)被认为是人工制造的。下列元素都属于短周期元素的是( )
A.Si和O B.Ba和Si
C.Cu和O D.Ba和Cu
4.(2024河南南阳期中)对学过的知识不断地进行归纳和总结是一种重要的学习方法,下面是某同学对周期表进行的有关总结,其中正确的是 ( )
A.在短周期中同族上下相邻的两元素的原子序数之差都为8
B.元素周期表中共18个纵列,7个横行,也有18个族和7个周期
C.ⅠA族元素都是碱金属元素,ⅦA族元素都是卤素
D.同周期ⅡA族元素和ⅣA族元素的原子序数之差有2、12和26三种可能
5.(2024广东广州期末)下列关于元素周期表的叙述,正确的是( )
A.元素周期表共有7个横行,称为周期;共有16个纵列,称为族
B.前20号元素称为短周期元素
C.副族元素中,没有非金属元素
D.最外层电子数相同的元素一定位于同一族
6.(2024山东聊城开学考试)“玉兔号”月球车上的太阳能电池板主要材料为硅。硅元素在元素周期表中的部分信息如图,下列说法不正确的是( )
A.硅的元素符号为Si
B.硅元素属于金属元素
C.硅元素的相对原子质量为28.09
D.硅原子的质子数为14
7.(2024浙江杭州期末)下列说法正确的是( )
A.当L层上的电子数为奇数时,M层上不可能有电子
B.第3周期和第4周期所容纳元素种数相同
C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大
D.第Ⅷ族共占三列,依次是第7、8、9列
8.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子数为奇数的原子所对应元素所在族的序数与该元素原子的K层电子数相等
B.L层电子数为奇数的原子所对应元素所在族的序数与该元素原子的L层电子数相等
C.L层电子数为偶数的原子所对应主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子数为奇数的原子所对应主族元素所在族的序数与该元素原子的M层电子数相等
题组二 元素周期表中元素之间原子序数的关系
9.(2024四川成都开学考试)如图为元素周期表中前四周期的一部分,若D元素的核电荷数为x,则这四种元素的核电荷数之和为( )
A.4x+10 B.4x+12
C.4x+14 D.4x+16
10.(2024河北衡水阶段练习)如图均是元素周期表的一部分(数字为原子序数),其中x为35的是( )
11.(经典题)(2024天津四十二中月考)下列各表均表示元素周期表的一部分(表中数字代表元素的原子序数),其中正确的是( )
12.(2024山东省实验中学月考)X和Y为第ⅡA族上下相邻周期的元素,两者的原子序数分别为x、y(xA.x-m B.x-n
C.x+m D.x+n
13.(经典题)已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。下列说法不正确的是( )
Y
X
Z
A.Y与Z的原子序数之和一定为2a
B.Y的原子序数可能为a-7
C.Z的原子序数可能为a+31
D.X、Y、Z中可能有短周期元素
题组三 推断元素或元素在元素周期表中的位置
14.(2024黑龙江哈尔滨期末)周期表中116号元素是一种人工合成的放射性元素,它的元素符号是Lv,试判断Lv元素应位于周期表中( )
A.第6周期第ⅣA族
B.第7周期第ⅥA族
C.第7周期第ⅦA族
D.第8周期第ⅥA族
15.(2024山东菏泽阶段练习)中国科学院院士张青莲教授主持测定的铟(49In)等9种元素相对原子质量的新值被采用为国际新标准。下列说法错误的是( )
A.In原子次外层有8个电子
B.In位于第5周期ⅢA族
C.原子半径:Rb>In
DIn的中子数与质子数的差值为17
16.(经典题)(2024广东佛山一中月考)0.05 mol某金属单质与足量的盐酸反应,放出1.12 L H2(标准状况),并转变为具有Ne原子电子层结构的离子,该金属元素在元素周期表中的位置是 ( )
A.第三周期第ⅠA族
B.第三周期第ⅡA族
C.第四周期第ⅠA族
D.第四周期第ⅡA族
17.(2024安徽阜阳期末)X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]-。下列说法正确的是( )
A.元素Z的最高正化合价为+6
B.气态氢化物的热稳定性:W>Z
C.X、Y、Z形成的化合物一定为共价化合物
D.化合物R2Z2与R2W中阴、阳离子个数比都为1∶2
18.(2024四川雅安阶段练习)下表是元素周期表中的部分元素。
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
回答下列问题:
(1)非金属性最强的元素是 (填元素符号);最外层电子数是次外层电子数2倍的元素是 (填元素符号),这种元素的一种核素可用于测定文物年代,这种核素符号为 。
(2)与⑥同主族的下一周期的元素是 (填元素符号),它在元素周期表中的位置是 ,它的原子结构示意图为 。
19.短周期元素Q、R、T、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与主族序数相等。
(1)W在元素周期表中的位置是 ,Q、R、T三种元素原子半径由大到小的顺序为 (用元素符号表示),Q的最高价氧化物的化学式为 。
(2)原子序数比R大1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为 。
题组四 焰色试验
20.(2024山东东营开学考试)焰色试验可以判断试样所含有的某些金属元素,蘸取某溶液灼烧,火焰呈现黄色,则溶液中一定不含的元素是( )
A.K B.Na
C.Fe D.Cu
21.(2024河北邢台阶段练习)焰色试验是检验某些金属元素常用的方法,下列关于焰色试验的说法正确的是( )
A.实验时需要用硫酸洗净的玻璃棒蘸取待测液在酒精灯火焰上灼烧
B.焰色试验属于化学变化
C.用某溶液进行焰色试验时,透过蓝色的钴玻璃观察到火焰颜色为浅紫色,说明原溶液中含有K元素
D.用焰色试验能快速鉴别NaOH溶液和NaCl溶液
22.(教材深研拓展)下列说法正确的是( )
A.没有铂丝可用无锈铁丝代替进行焰色试验
B.分别灼烧NaCl和CaCl2时火焰颜色相同
C.焰色试验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.非金属单质灼烧时呈现无色火焰
能力提升练
题组一 根据信息推断元素在元素周期表中的位置
1.(经典题)(2024山西吕梁期末)在周期表中,“相邻”元素即同周期左右紧挨,或同族上下紧挨,下列元素与第三周期第ⅥA族元素不一定“相邻”的是( )
A.电子总数是最内层电子数4倍的元素
B.最外层电子数是最内层电子数2.5倍的短周期主族元素
C.最外层电子数是次外层电子数一半的主族元素
D.质子数为34的元素
2.(2024湖北荆州期末)几种短周期主族元素的原子半径和主要化合价如图所示。
回答下列问题:
(1)A的简单离子的结构示意图为 。
(2)AB2与A的简单氢化物反应生成A2和B的氢化物,写出反应的化学方程式: ;在标准状况下,生成11.2 L A2气体时转移电子的物质的量为 mol。
(3)D的单质在A2中燃烧的产物和CO2反应的化学方程式为 。
(4)A、B、E的简单离子半径由大到小的顺序为 (用离子符号表示)。
(5)B的单质与A的简单氢化物能发生置换反应,写出反应的化学方程式: 。
题组二 元素推断与元素周期表的应用
3.如图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子最外层电子数与其内层电子数之比为7∶10,则下列说法不正确的是 ( )
A.氢气在W单质中燃烧发出苍白色火焰
B.Y元素的两种同素异形体常温下都是气体
C.W、Z分别与Y形成的二元化合物均不止一种
D.简单阴离子半径从大到小的排列顺序为X>Y>Z>W
4.(2024河南商丘期末)W、X、Y、Z是原子序数依次增大的短周期主族元素,W与X、Y、Z不同周期,W为地壳中含量最多的元素,Y与W同主族,X的化合物焰色为黄色。下列说法错误的是( )
A.反应条件不同,W、X形成的常见单质间反应时生成物不同
B.W与X形成的化合物中阴、阳离子个数比为1∶1
C.Y与W形成的化合物属于酸性氧化物
D.原子半径由大到小的顺序为X>Y>Z>W
5.(2024湖南长沙月考,)W、X、Y、Z为原子序数依次增大的短周期主族元素,W2-与Ne原子的电子层结构相同,W、X、Y在元素周期表中的相对位置如图所示。下列有关叙述中正确的是 ( )
W
X Y
A.W、Y形成的化合物与水反应生成的一定是强酸
B.元素Y、Z形成的简单离子电子层数相同
C.含元素Z的化合物都具有漂白性
D.W、X形成的化合物易溶于水
答案与分层梯度式解析
第2课时 元素周期表
基础过关练
1.C 元素周期表中有7个周期,原子结构中,电子层数=周期序数,则原子的核外电子层数等于该元素所在周期序数,故A正确;除He外,其他稀有气体元素原子最外层电子数均为8,故B正确;元素周期表有16个族,族序数不一定等于该族元素原子的最外层电子数,如0族,故C错误;通过元素周期表可以获知某元素的原子序数、元素名称、元素符号和相对原子质量等,故D正确。
2.D 最外层电子数为1的原子不一定为金属元素的原子,如H,A错误;最外层电子数为8的微粒不一定是稀有气体元素的原子,如镁离子、硫离子等,B错误;质子数相同、中子数不同的核素互为同位素,镧系元素的质子数不同,所以它们不互为同位素,C错误;第ⅢB族包含镧系和锕系,是元素周期表中含元素最多的族,D正确。
3.A 前3个周期的元素属于短周期元素。Si是第3周期的元素,O是第2周期的元素,Si和O都是短周期元素;Ba是第6周期的元素,Cu是第4周期的元素,二者均不是短周期元素,故A正确。
4.D H、Li两元素原子序数相差2,A错误;元素周期表中一共有18个纵列,7个横行,有16个族和7个周期,B错误;ⅠA族中的氢元素不是碱金属元素,C错误;同周期ⅡA族元素和ⅣA族元素的原子序数之差有2、12和26三种可能,D正确。
5.C 元素周期表共有7个横行,也就是7个周期;共有18个纵列,16个族,故A错误。前18号元素称为短周期元素,故B错误。副族元素中,没有非金属元素,故C正确。He和Mg最外层电子数都是2,但不在同一族,故D错误。
6.B 根据题图信息可知硅的元素符号为Si,故A正确;硅元素属于非金属元素,故B错误;根据题图信息得到硅元素的相对原子质量为28.09,故C正确;根据题图知硅原子的质子数为14,故D正确。
7.A 当L层上的电子数为奇数时,说明L层电子没有排满,M层上不可能有电子,故A正确;第3周期容纳8种元素,第4周期容纳18种元素,故B错误;同一周期,随着核电荷数的增加,主族元素的原子半径逐渐减小,故C错误;第Ⅷ族共占三列,依次是第8、9、10列,故D错误。
8.C K层电子数为奇数的原子只有H,氢元素所在族的序数与该元素原子的K层电子数相等,故A正确;L层电子数为奇数的原子有Li、B、N、F,元素所在族序数与这些元素原子的L层电子数相等,故B正确;Na所在的族为ⅠA族,该元素原子的L层电子数为8,其族序数与L层电子数不相等,故C错误;M层电子数为奇数的主族元素有Na、Al、P、Cl,元素所在族的序数与该元素原子的M层电子数相等,故D正确。
9.C 结合元素周期表结构知题图中A、B、C、D在元素周期表右侧部分,A为第2周期元素(破题关键),D、B为第3周期元素,C为第4周期元素,若D元素的核电荷数为x,则A的核电荷数为x-8+1,B的核电荷数为x+2,C的核电荷数为x+18+1,则这四种元素的核电荷数之和为x-8+1+x+x+2+x+18+1=4x+14,故C符合题意。
10.D 原子序数为35的元素为Br,位于周期表中第四周期第ⅦA族(破题关键)。16号元素位于第三周期ⅥA族,x位于第四周期0族,A错误;26号元素位于第四周期Ⅷ族,x位于第五周期Ⅷ族,B错误;74号元素位于第六周期ⅥB族,x位于第五周期ⅦB族,C错误;18号元素位于第三周期0族,x位于第四周期ⅦA族,D正确。
名师点津 本题考查元素位置及各周期元素种数的应用,加强学生灵活运用已构建的化学模型解决实际问题的能力。
11.D 11、19号元素位于周期表最左边,而2号元素位于周期表最右边,A、B错误;6、12、24号元素不在同一族,C错误;31号元素位于第ⅢA族,6、14、32号元素均位于第ⅣA族,7号元素位于第ⅤA族,D正确。
12.C X、Y同在ⅡA族,Y在X的下一周期,X和Y的原子序数之差恰好为X所在周期的元素种数,则Y的原子序数为x+m,C项正确。
13.A 由题图所示的X、Y、Z三种主族元素在元素周期表中的位置可知,X、Y、Z三种主族元素处于元素周期表右侧,Y不可能是第1周期元素,至少为第2周期元素,Z一定不处于短周期。若Y为第2周期元素,则X、Z分别为第3、4周期元素,X的原子序数为a,Y的原子序数为a-7,Z的原子序数为a+17,Y与Z的原子序数之和为2a+10;若Y为第3周期元素,则X、Z分别为第4、5周期元素,X的原子序数为a,Y的原子序数为a-17,Z的原子序数为a+17,Y与Z的原子序数之和为2a;若Y为第4周期元素,则X、Z分别为第5、6周期元素,X的原子序数为a,Y的原子序数为a-17,Z的原子序数为a+31,Y与Z的原子序数之和为2a+14;若Y为第5周期元素,则X、Z分别为第6、7周期元素,X的原子序数为a,Y的原子序数为a-31,Z的原子序数为a+31,Y与Z的原子序数之和为2a,A错误;Y的原子序数可能为a-7,B正确;Z的原子序数可能为a+31,C正确;X、Y都有可能是短周期元素,Z一定是长周期元素,D正确。
14.B Lv的原子序数为116,118号元素位于第7周期0族,结合周期表结构知116号元素位于元素周期表的第7周期第ⅥA族,故选B。
15.A In的原子序数为49,位于第5周期ⅢA族,次外层有18个电子,A错误、B正确;Rb与In都处于第5周期,同周期主族元素,核电荷数越大,原子半径越小,则原子半径:Rb>In,C正确In的中子数为115-49=66,质子数为49,中子数与质子数的差值为17,D正确。
16.B 根据题意,设反应后金属元素的化合价为x,由得失电子守恒可知0.05 mol×(x-0)=×2×(1-0),解得x=+2,再根据该离子具有Ne原子电子层结构,故该金属元素的原子序数为10+2=12,为Mg元素,位于元素周期表第三周期第ⅡA族。
17.D X、Y、Z、R、W为原子序数依次增大的短周期元素,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]-,X、Y分别为H、N,R的原子半径是同周期主族元素中最大的,R是第3周期的Na,Z、W为同族元素,分析可知Z、W分别为O和S。元素Z为O,O无最高正价,故A错误;气态氢化物的热稳定性:H2O>H2S,故B错误;X、Y、Z形成的化合物可以是共价化合物,如HNO3,也可以是离子化合物,如NH4NO3,故C错误;R2Z2、R2W分别为Na2O2、Na2S,二者中阴、阳离子个数比都为1∶2,故D正确。
18.答案 (1)F CC
(2)Ca 第4周期第ⅡA族
解析 根据题表可知①为C,②为N,③为O,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为S,⑨为Cl,⑩为Ar。(1)非金属性最强的元素是F;最外层电子数是次外层电子数2倍的元素是C,考古时会利用C测定一些文物的年代。(2)⑥为Mg,与Mg同主族的下一周期的元素是Ca;位于周期表中第4周期第ⅡA族,Ca的原子结构示意图为。
19.答案 (1)第3周期ⅥA族 Al>C>N CO2
(2)2H2O2 2H2O+O2↑
解析 根据短周期元素Q、R、T、W在元素周期表中的相对位置可知,Q、R位于第2周期,T、W位于第3周期,T所处的周期序数与主族序数相等,所以T位于第3周期ⅢA族,为Al,结合各元素的相对位置可知,Q为C,R为N,W为S。
(1)S处于元素周期表中第3周期ⅥA族;C、N、Al三种元素原子的半径从大到小的顺序为Al>C>N;碳元素的最高价为+4价,最高价氧化物为CO2。
(2)原子序数比R大1的元素是O,其一种氢化物能分解成另一种氢化物,两种氢化物分别为H2O2和H2O,反应的化学方程式为2H2O2 2H2O+O2↑。
20.D 蘸取某溶液灼烧,火焰呈现黄色,则该溶液中一定含有钠元素;钾元素的焰色呈浅紫色,容易被黄色覆盖,溶液中可能含有钾元素;灼烧铁时火焰不呈现特殊颜色,溶液中可能含有铁元素;铜元素的焰色呈蓝绿色,所以该溶液中一定不含Cu元素,故选D。
21.C 焰色试验一般是用稀盐酸洗铂丝或无锈铁丝,A错误;焰色试验没有新物质生成,属于物理变化,B错误;透过蓝色钴玻璃可观察到K元素的焰色为浅紫色,C正确;无法通过焰色试验鉴别NaOH溶液和NaCl溶液,D错误。
22.A 由于Fe元素灼烧时火焰不呈现特殊颜色,所以没有铂丝可用无锈铁丝代替进行焰色试验,A正确;分别灼烧NaCl和CaCl2时火焰颜色不相同,B错误;焰色试验为物理变化,C错误;氢气在空气中燃烧时产生淡蓝色火焰,D错误。
能力提升练
1.B 第三周期第ⅥA族元素为S,与S元素“相邻”的元素为O、P、Cl和Se。电子总数是最内层电子数4倍的元素为O,与S元素“相邻”;最外层电子数是最内层电子数2.5倍的短周期主族元素,最外层电子数为5,可以为N元素或P元素,不一定与S元素“相邻”;最外层电子数是次外层电子数一半的主族元素为Si或Li,与S元素一定不“相邻”;质子数为34的元素为Se,与S元素“相邻”。
2.答案 (1)
(2)OF2+H2O O2+2HF 1
(3)Li2O+CO2 Li2CO3
(4)O2->F->Na+
(5)2F2+2H2O 4HF+O2
解析 B、C同主族,B原子半径小于C,主要化合价均为-1价,所以B为F、C为Cl,D、E同主族,D原子半径小于E,主要化合价均为+1价,原子半径均大于F,所以D为Li、E为Na,A主要化合价为-2价,结合其原子半径可知A为O。(1)A为O,其简单离子的结构示意图为。(2)AB2与A的简单氢化物反应生成A2和B的氢化物,反应的化学方程式为OF2+H2O O2+2HF;OF2中O为+2价,反应OF2+H2O O2+2HF中,O2既是氧化产物又是还原产物,生成标准状况下11.2 L O2(即0.5 mol),转移1 mol电子。(3)Li单质在O2中燃烧的产物为Li2O,Li2O和CO2反应的化学方程式为Li2O+CO2 Li2CO3。(4)A、B、E的简单离子分别为O2-、F-、Na+,其电子层结构相同,电子层结构相同的微粒,核电荷数越大,半径越小,所以半径由大到小的顺序为O2->F->Na+。(5)F2与H2O反应生成HF和O2,化学方程式为2F2+2H2O 4HF+O2。
3.D W为短周期元素,其原子最外层电子数与其内层电子数之比为7∶10,则W原子内层电子总数为10,最外层电子数为7,W是Cl元素;由X、Y、Z、W在元素周期表中的位置关系可知,Z为S元素,Y为O元素,X为N元素。氢气在氯气中燃烧发出苍白色火焰,故A正确; Y为O元素,Y元素形成的两种常见单质为氧气和臭氧,在常温下都是气体,故B正确;硫、氯分别与氧元素形成的二元化合物均不止一种,故C正确;核外电子排布相同,核电荷数越大离子半径越小,所以简单阴离子半径X>Y、Z>W,一般电子层数越多,离子半径越大,所以简单阴离子半径从大到小的排列顺序为Z>W>X>Y,故D错误。
4.B W为地壳中含量最多的元素,则W为O,X的化合物焰色为黄色,则X为Na,Y与W同主族,则Y为S,W、X、Y、Z为原子序数依次增大的短周期主族元素,则Z为Cl。常温下Na与O2反应生成Na2O,加热条件下反应生成Na2O2,A项正确;W与X形成的化合物有Na2O和Na2O2两种,这两种化合物的阴、阳离子个数比均为1∶2,B项错误;SO2、SO3均为酸性氧化物,C项正确;对于主族元素,一般电子层数越多,原子半径越大,当电子层数相同时,核电荷数越大,原子半径越小,原子半径:Na>S>Cl>O,D项正确。
5.B W2-与Ne原子的电子层结构相同,则W为O;根据W、X、Y在元素周期表中的相对位置可知Y为S,X为Al;W、X、Y、Z为原子序数依次增大的短周期主族元素,则Z为Cl。W、Y分别为O、S,二者形成的化合物与水反应不一定得到强酸,如SO2与水反应生成H2SO3,H2SO3是弱酸,A错误;Y、Z分别为S、Cl,S2-、Cl-均有3个电子层,B正确;Z为Cl,含Cl的化合物不一定有漂白性,如NaCl无漂白性,C错误;W、X分别为O、Al,二者形成的化合物为Al2O3,Al2O3难溶于水,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁教版高中化学必修第二册
第2课时 元素周期表
基础过关练
题组一 元素周期表的相关知识
1.(2024福建三明阶段练习)下列关于元素周期表说法错误的是( )
A.元素周期表中有7个周期,周期序数等于该周期元素原子的核外电子层数
B.除He外,其他稀有气体元素原子的最外层电子数均为8
C.元素周期表有18个族,族序数等于该族元素原子的最外层电子数
D.通过元素周期表,可以了解元素名称、元素符号、相对原子质量
2.(2024安徽淮北期末)下列说法中,正确的是( )
A.最外层电子数为1的原子都为金属元素的原子
B.最外层电子数为8的微粒一定是稀有气体元素的原子
C.镧系元素在元素周期表的同一格内,所以它们互为同位素
D.在元素周期表中含元素最多的族是第ⅢB族
3.(2024福建福安一中月考)“中国紫”硅酸铜钡(BaCuSi2O6)被认为是人工制造的。下列元素都属于短周期元素的是( )
A.Si和O B.Ba和Si
C.Cu和O D.Ba和Cu
4.(2024河南南阳期中)对学过的知识不断地进行归纳和总结是一种重要的学习方法,下面是某同学对周期表进行的有关总结,其中正确的是 ( )
A.在短周期中同族上下相邻的两元素的原子序数之差都为8
B.元素周期表中共18个纵列,7个横行,也有18个族和7个周期
C.ⅠA族元素都是碱金属元素,ⅦA族元素都是卤素
D.同周期ⅡA族元素和ⅣA族元素的原子序数之差有2、12和26三种可能
5.(2024广东广州期末)下列关于元素周期表的叙述,正确的是( )
A.元素周期表共有7个横行,称为周期;共有16个纵列,称为族
B.前20号元素称为短周期元素
C.副族元素中,没有非金属元素
D.最外层电子数相同的元素一定位于同一族
6.(2024山东聊城开学考试)“玉兔号”月球车上的太阳能电池板主要材料为硅。硅元素在元素周期表中的部分信息如图,下列说法不正确的是( )
A.硅的元素符号为Si
B.硅元素属于金属元素
C.硅元素的相对原子质量为28.09
D.硅原子的质子数为14
7.(2024浙江杭州期末)下列说法正确的是( )
A.当L层上的电子数为奇数时,M层上不可能有电子
B.第3周期和第4周期所容纳元素种数相同
C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大
D.第Ⅷ族共占三列,依次是第7、8、9列
8.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子数为奇数的原子所对应元素所在族的序数与该元素原子的K层电子数相等
B.L层电子数为奇数的原子所对应元素所在族的序数与该元素原子的L层电子数相等
C.L层电子数为偶数的原子所对应主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子数为奇数的原子所对应主族元素所在族的序数与该元素原子的M层电子数相等
题组二 元素周期表中元素之间原子序数的关系
9.(2024四川成都开学考试)如图为元素周期表中前四周期的一部分,若D元素的核电荷数为x,则这四种元素的核电荷数之和为( )
A.4x+10 B.4x+12
C.4x+14 D.4x+16
10.(2024河北衡水阶段练习)如图均是元素周期表的一部分(数字为原子序数),其中x为35的是( )
11.(经典题)(2024天津四十二中月考)下列各表均表示元素周期表的一部分(表中数字代表元素的原子序数),其中正确的是( )
12.(2024山东省实验中学月考)X和Y为第ⅡA族上下相邻周期的元素,两者的原子序数分别为x、y(x
C.x+m D.x+n
13.(经典题)已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。下列说法不正确的是( )
Y
X
Z
A.Y与Z的原子序数之和一定为2a
B.Y的原子序数可能为a-7
C.Z的原子序数可能为a+31
D.X、Y、Z中可能有短周期元素
题组三 推断元素或元素在元素周期表中的位置
14.(2024黑龙江哈尔滨期末)周期表中116号元素是一种人工合成的放射性元素,它的元素符号是Lv,试判断Lv元素应位于周期表中( )
A.第6周期第ⅣA族
B.第7周期第ⅥA族
C.第7周期第ⅦA族
D.第8周期第ⅥA族
15.(2024山东菏泽阶段练习)中国科学院院士张青莲教授主持测定的铟(49In)等9种元素相对原子质量的新值被采用为国际新标准。下列说法错误的是( )
A.In原子次外层有8个电子
B.In位于第5周期ⅢA族
C.原子半径:Rb>In
DIn的中子数与质子数的差值为17
16.(经典题)(2024广东佛山一中月考)0.05 mol某金属单质与足量的盐酸反应,放出1.12 L H2(标准状况),并转变为具有Ne原子电子层结构的离子,该金属元素在元素周期表中的位置是 ( )
A.第三周期第ⅠA族
B.第三周期第ⅡA族
C.第四周期第ⅠA族
D.第四周期第ⅡA族
17.(2024安徽阜阳期末)X、Y、Z、R、W为原子序数依次增大的短周期元素,Z、W为同族元素,R的原子半径是同周期主族元素中最大的,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]-。下列说法正确的是( )
A.元素Z的最高正化合价为+6
B.气态氢化物的热稳定性:W>Z
C.X、Y、Z形成的化合物一定为共价化合物
D.化合物R2Z2与R2W中阴、阳离子个数比都为1∶2
18.(2024四川雅安阶段练习)下表是元素周期表中的部分元素。
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
回答下列问题:
(1)非金属性最强的元素是 (填元素符号);最外层电子数是次外层电子数2倍的元素是 (填元素符号),这种元素的一种核素可用于测定文物年代,这种核素符号为 。
(2)与⑥同主族的下一周期的元素是 (填元素符号),它在元素周期表中的位置是 ,它的原子结构示意图为 。
19.短周期元素Q、R、T、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与主族序数相等。
(1)W在元素周期表中的位置是 ,Q、R、T三种元素原子半径由大到小的顺序为 (用元素符号表示),Q的最高价氧化物的化学式为 。
(2)原子序数比R大1的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为 。
题组四 焰色试验
20.(2024山东东营开学考试)焰色试验可以判断试样所含有的某些金属元素,蘸取某溶液灼烧,火焰呈现黄色,则溶液中一定不含的元素是( )
A.K B.Na
C.Fe D.Cu
21.(2024河北邢台阶段练习)焰色试验是检验某些金属元素常用的方法,下列关于焰色试验的说法正确的是( )
A.实验时需要用硫酸洗净的玻璃棒蘸取待测液在酒精灯火焰上灼烧
B.焰色试验属于化学变化
C.用某溶液进行焰色试验时,透过蓝色的钴玻璃观察到火焰颜色为浅紫色,说明原溶液中含有K元素
D.用焰色试验能快速鉴别NaOH溶液和NaCl溶液
22.(教材深研拓展)下列说法正确的是( )
A.没有铂丝可用无锈铁丝代替进行焰色试验
B.分别灼烧NaCl和CaCl2时火焰颜色相同
C.焰色试验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.非金属单质灼烧时呈现无色火焰
能力提升练
题组一 根据信息推断元素在元素周期表中的位置
1.(经典题)(2024山西吕梁期末)在周期表中,“相邻”元素即同周期左右紧挨,或同族上下紧挨,下列元素与第三周期第ⅥA族元素不一定“相邻”的是( )
A.电子总数是最内层电子数4倍的元素
B.最外层电子数是最内层电子数2.5倍的短周期主族元素
C.最外层电子数是次外层电子数一半的主族元素
D.质子数为34的元素
2.(2024湖北荆州期末)几种短周期主族元素的原子半径和主要化合价如图所示。
回答下列问题:
(1)A的简单离子的结构示意图为 。
(2)AB2与A的简单氢化物反应生成A2和B的氢化物,写出反应的化学方程式: ;在标准状况下,生成11.2 L A2气体时转移电子的物质的量为 mol。
(3)D的单质在A2中燃烧的产物和CO2反应的化学方程式为 。
(4)A、B、E的简单离子半径由大到小的顺序为 (用离子符号表示)。
(5)B的单质与A的简单氢化物能发生置换反应,写出反应的化学方程式: 。
题组二 元素推断与元素周期表的应用
3.如图是元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子最外层电子数与其内层电子数之比为7∶10,则下列说法不正确的是 ( )
A.氢气在W单质中燃烧发出苍白色火焰
B.Y元素的两种同素异形体常温下都是气体
C.W、Z分别与Y形成的二元化合物均不止一种
D.简单阴离子半径从大到小的排列顺序为X>Y>Z>W
4.(2024河南商丘期末)W、X、Y、Z是原子序数依次增大的短周期主族元素,W与X、Y、Z不同周期,W为地壳中含量最多的元素,Y与W同主族,X的化合物焰色为黄色。下列说法错误的是( )
A.反应条件不同,W、X形成的常见单质间反应时生成物不同
B.W与X形成的化合物中阴、阳离子个数比为1∶1
C.Y与W形成的化合物属于酸性氧化物
D.原子半径由大到小的顺序为X>Y>Z>W
5.(2024湖南长沙月考,)W、X、Y、Z为原子序数依次增大的短周期主族元素,W2-与Ne原子的电子层结构相同,W、X、Y在元素周期表中的相对位置如图所示。下列有关叙述中正确的是 ( )
W
X Y
A.W、Y形成的化合物与水反应生成的一定是强酸
B.元素Y、Z形成的简单离子电子层数相同
C.含元素Z的化合物都具有漂白性
D.W、X形成的化合物易溶于水
答案与分层梯度式解析
第2课时 元素周期表
基础过关练
1.C 元素周期表中有7个周期,原子结构中,电子层数=周期序数,则原子的核外电子层数等于该元素所在周期序数,故A正确;除He外,其他稀有气体元素原子最外层电子数均为8,故B正确;元素周期表有16个族,族序数不一定等于该族元素原子的最外层电子数,如0族,故C错误;通过元素周期表可以获知某元素的原子序数、元素名称、元素符号和相对原子质量等,故D正确。
2.D 最外层电子数为1的原子不一定为金属元素的原子,如H,A错误;最外层电子数为8的微粒不一定是稀有气体元素的原子,如镁离子、硫离子等,B错误;质子数相同、中子数不同的核素互为同位素,镧系元素的质子数不同,所以它们不互为同位素,C错误;第ⅢB族包含镧系和锕系,是元素周期表中含元素最多的族,D正确。
3.A 前3个周期的元素属于短周期元素。Si是第3周期的元素,O是第2周期的元素,Si和O都是短周期元素;Ba是第6周期的元素,Cu是第4周期的元素,二者均不是短周期元素,故A正确。
4.D H、Li两元素原子序数相差2,A错误;元素周期表中一共有18个纵列,7个横行,有16个族和7个周期,B错误;ⅠA族中的氢元素不是碱金属元素,C错误;同周期ⅡA族元素和ⅣA族元素的原子序数之差有2、12和26三种可能,D正确。
5.C 元素周期表共有7个横行,也就是7个周期;共有18个纵列,16个族,故A错误。前18号元素称为短周期元素,故B错误。副族元素中,没有非金属元素,故C正确。He和Mg最外层电子数都是2,但不在同一族,故D错误。
6.B 根据题图信息可知硅的元素符号为Si,故A正确;硅元素属于非金属元素,故B错误;根据题图信息得到硅元素的相对原子质量为28.09,故C正确;根据题图知硅原子的质子数为14,故D正确。
7.A 当L层上的电子数为奇数时,说明L层电子没有排满,M层上不可能有电子,故A正确;第3周期容纳8种元素,第4周期容纳18种元素,故B错误;同一周期,随着核电荷数的增加,主族元素的原子半径逐渐减小,故C错误;第Ⅷ族共占三列,依次是第8、9、10列,故D错误。
8.C K层电子数为奇数的原子只有H,氢元素所在族的序数与该元素原子的K层电子数相等,故A正确;L层电子数为奇数的原子有Li、B、N、F,元素所在族序数与这些元素原子的L层电子数相等,故B正确;Na所在的族为ⅠA族,该元素原子的L层电子数为8,其族序数与L层电子数不相等,故C错误;M层电子数为奇数的主族元素有Na、Al、P、Cl,元素所在族的序数与该元素原子的M层电子数相等,故D正确。
9.C 结合元素周期表结构知题图中A、B、C、D在元素周期表右侧部分,A为第2周期元素(破题关键),D、B为第3周期元素,C为第4周期元素,若D元素的核电荷数为x,则A的核电荷数为x-8+1,B的核电荷数为x+2,C的核电荷数为x+18+1,则这四种元素的核电荷数之和为x-8+1+x+x+2+x+18+1=4x+14,故C符合题意。
10.D 原子序数为35的元素为Br,位于周期表中第四周期第ⅦA族(破题关键)。16号元素位于第三周期ⅥA族,x位于第四周期0族,A错误;26号元素位于第四周期Ⅷ族,x位于第五周期Ⅷ族,B错误;74号元素位于第六周期ⅥB族,x位于第五周期ⅦB族,C错误;18号元素位于第三周期0族,x位于第四周期ⅦA族,D正确。
名师点津 本题考查元素位置及各周期元素种数的应用,加强学生灵活运用已构建的化学模型解决实际问题的能力。
11.D 11、19号元素位于周期表最左边,而2号元素位于周期表最右边,A、B错误;6、12、24号元素不在同一族,C错误;31号元素位于第ⅢA族,6、14、32号元素均位于第ⅣA族,7号元素位于第ⅤA族,D正确。
12.C X、Y同在ⅡA族,Y在X的下一周期,X和Y的原子序数之差恰好为X所在周期的元素种数,则Y的原子序数为x+m,C项正确。
13.A 由题图所示的X、Y、Z三种主族元素在元素周期表中的位置可知,X、Y、Z三种主族元素处于元素周期表右侧,Y不可能是第1周期元素,至少为第2周期元素,Z一定不处于短周期。若Y为第2周期元素,则X、Z分别为第3、4周期元素,X的原子序数为a,Y的原子序数为a-7,Z的原子序数为a+17,Y与Z的原子序数之和为2a+10;若Y为第3周期元素,则X、Z分别为第4、5周期元素,X的原子序数为a,Y的原子序数为a-17,Z的原子序数为a+17,Y与Z的原子序数之和为2a;若Y为第4周期元素,则X、Z分别为第5、6周期元素,X的原子序数为a,Y的原子序数为a-17,Z的原子序数为a+31,Y与Z的原子序数之和为2a+14;若Y为第5周期元素,则X、Z分别为第6、7周期元素,X的原子序数为a,Y的原子序数为a-31,Z的原子序数为a+31,Y与Z的原子序数之和为2a,A错误;Y的原子序数可能为a-7,B正确;Z的原子序数可能为a+31,C正确;X、Y都有可能是短周期元素,Z一定是长周期元素,D正确。
14.B Lv的原子序数为116,118号元素位于第7周期0族,结合周期表结构知116号元素位于元素周期表的第7周期第ⅥA族,故选B。
15.A In的原子序数为49,位于第5周期ⅢA族,次外层有18个电子,A错误、B正确;Rb与In都处于第5周期,同周期主族元素,核电荷数越大,原子半径越小,则原子半径:Rb>In,C正确In的中子数为115-49=66,质子数为49,中子数与质子数的差值为17,D正确。
16.B 根据题意,设反应后金属元素的化合价为x,由得失电子守恒可知0.05 mol×(x-0)=×2×(1-0),解得x=+2,再根据该离子具有Ne原子电子层结构,故该金属元素的原子序数为10+2=12,为Mg元素,位于元素周期表第三周期第ⅡA族。
17.D X、Y、Z、R、W为原子序数依次增大的短周期元素,X、Y、Z、W形成的化合物可表示为[YX4]+[XWZ4]-,X、Y分别为H、N,R的原子半径是同周期主族元素中最大的,R是第3周期的Na,Z、W为同族元素,分析可知Z、W分别为O和S。元素Z为O,O无最高正价,故A错误;气态氢化物的热稳定性:H2O>H2S,故B错误;X、Y、Z形成的化合物可以是共价化合物,如HNO3,也可以是离子化合物,如NH4NO3,故C错误;R2Z2、R2W分别为Na2O2、Na2S,二者中阴、阳离子个数比都为1∶2,故D正确。
18.答案 (1)F CC
(2)Ca 第4周期第ⅡA族
解析 根据题表可知①为C,②为N,③为O,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为S,⑨为Cl,⑩为Ar。(1)非金属性最强的元素是F;最外层电子数是次外层电子数2倍的元素是C,考古时会利用C测定一些文物的年代。(2)⑥为Mg,与Mg同主族的下一周期的元素是Ca;位于周期表中第4周期第ⅡA族,Ca的原子结构示意图为。
19.答案 (1)第3周期ⅥA族 Al>C>N CO2
(2)2H2O2 2H2O+O2↑
解析 根据短周期元素Q、R、T、W在元素周期表中的相对位置可知,Q、R位于第2周期,T、W位于第3周期,T所处的周期序数与主族序数相等,所以T位于第3周期ⅢA族,为Al,结合各元素的相对位置可知,Q为C,R为N,W为S。
(1)S处于元素周期表中第3周期ⅥA族;C、N、Al三种元素原子的半径从大到小的顺序为Al>C>N;碳元素的最高价为+4价,最高价氧化物为CO2。
(2)原子序数比R大1的元素是O,其一种氢化物能分解成另一种氢化物,两种氢化物分别为H2O2和H2O,反应的化学方程式为2H2O2 2H2O+O2↑。
20.D 蘸取某溶液灼烧,火焰呈现黄色,则该溶液中一定含有钠元素;钾元素的焰色呈浅紫色,容易被黄色覆盖,溶液中可能含有钾元素;灼烧铁时火焰不呈现特殊颜色,溶液中可能含有铁元素;铜元素的焰色呈蓝绿色,所以该溶液中一定不含Cu元素,故选D。
21.C 焰色试验一般是用稀盐酸洗铂丝或无锈铁丝,A错误;焰色试验没有新物质生成,属于物理变化,B错误;透过蓝色钴玻璃可观察到K元素的焰色为浅紫色,C正确;无法通过焰色试验鉴别NaOH溶液和NaCl溶液,D错误。
22.A 由于Fe元素灼烧时火焰不呈现特殊颜色,所以没有铂丝可用无锈铁丝代替进行焰色试验,A正确;分别灼烧NaCl和CaCl2时火焰颜色不相同,B错误;焰色试验为物理变化,C错误;氢气在空气中燃烧时产生淡蓝色火焰,D错误。
能力提升练
1.B 第三周期第ⅥA族元素为S,与S元素“相邻”的元素为O、P、Cl和Se。电子总数是最内层电子数4倍的元素为O,与S元素“相邻”;最外层电子数是最内层电子数2.5倍的短周期主族元素,最外层电子数为5,可以为N元素或P元素,不一定与S元素“相邻”;最外层电子数是次外层电子数一半的主族元素为Si或Li,与S元素一定不“相邻”;质子数为34的元素为Se,与S元素“相邻”。
2.答案 (1)
(2)OF2+H2O O2+2HF 1
(3)Li2O+CO2 Li2CO3
(4)O2->F->Na+
(5)2F2+2H2O 4HF+O2
解析 B、C同主族,B原子半径小于C,主要化合价均为-1价,所以B为F、C为Cl,D、E同主族,D原子半径小于E,主要化合价均为+1价,原子半径均大于F,所以D为Li、E为Na,A主要化合价为-2价,结合其原子半径可知A为O。(1)A为O,其简单离子的结构示意图为。(2)AB2与A的简单氢化物反应生成A2和B的氢化物,反应的化学方程式为OF2+H2O O2+2HF;OF2中O为+2价,反应OF2+H2O O2+2HF中,O2既是氧化产物又是还原产物,生成标准状况下11.2 L O2(即0.5 mol),转移1 mol电子。(3)Li单质在O2中燃烧的产物为Li2O,Li2O和CO2反应的化学方程式为Li2O+CO2 Li2CO3。(4)A、B、E的简单离子分别为O2-、F-、Na+,其电子层结构相同,电子层结构相同的微粒,核电荷数越大,半径越小,所以半径由大到小的顺序为O2->F->Na+。(5)F2与H2O反应生成HF和O2,化学方程式为2F2+2H2O 4HF+O2。
3.D W为短周期元素,其原子最外层电子数与其内层电子数之比为7∶10,则W原子内层电子总数为10,最外层电子数为7,W是Cl元素;由X、Y、Z、W在元素周期表中的位置关系可知,Z为S元素,Y为O元素,X为N元素。氢气在氯气中燃烧发出苍白色火焰,故A正确; Y为O元素,Y元素形成的两种常见单质为氧气和臭氧,在常温下都是气体,故B正确;硫、氯分别与氧元素形成的二元化合物均不止一种,故C正确;核外电子排布相同,核电荷数越大离子半径越小,所以简单阴离子半径X>Y、Z>W,一般电子层数越多,离子半径越大,所以简单阴离子半径从大到小的排列顺序为Z>W>X>Y,故D错误。
4.B W为地壳中含量最多的元素,则W为O,X的化合物焰色为黄色,则X为Na,Y与W同主族,则Y为S,W、X、Y、Z为原子序数依次增大的短周期主族元素,则Z为Cl。常温下Na与O2反应生成Na2O,加热条件下反应生成Na2O2,A项正确;W与X形成的化合物有Na2O和Na2O2两种,这两种化合物的阴、阳离子个数比均为1∶2,B项错误;SO2、SO3均为酸性氧化物,C项正确;对于主族元素,一般电子层数越多,原子半径越大,当电子层数相同时,核电荷数越大,原子半径越小,原子半径:Na>S>Cl>O,D项正确。
5.B W2-与Ne原子的电子层结构相同,则W为O;根据W、X、Y在元素周期表中的相对位置可知Y为S,X为Al;W、X、Y、Z为原子序数依次增大的短周期主族元素,则Z为Cl。W、Y分别为O、S,二者形成的化合物与水反应不一定得到强酸,如SO2与水反应生成H2SO3,H2SO3是弱酸,A错误;Y、Z分别为S、Cl,S2-、Cl-均有3个电子层,B正确;Z为Cl,含Cl的化合物不一定有漂白性,如NaCl无漂白性,C错误;W、X分别为O、Al,二者形成的化合物为Al2O3,Al2O3难溶于水,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
