2025鲁教版高中化学必修第二册强化练习题--题型整合练 “位、构、性”在元素周期律中的综合应用
文档属性
| 名称 | 2025鲁教版高中化学必修第二册强化练习题--题型整合练 “位、构、性”在元素周期律中的综合应用 |  | |
| 格式 | docx | ||
| 文件大小 | 860.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-19 16:19:29 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁教版高中化学必修第二册
题型整合练 “位、构、性”在元素周期律中的综合应用
题型1 元素周期表片段型
1.(2024山东德州月考)甲~辛等主族元素在周期表中的相对位置如表。甲与戊的原子序数相差3,己是地壳中含量第二多的元素,丙与庚属同周期元素。下列判断正确的是( )
A.乙为K元素,庚为Ga元素
B.丙的焰色为黄色
C.丙与庚的原子核外电子数相差12
D.丁的最高价氧化物对应的水化物能与碱发生反应
2.已知短周期主族元素X、Y、Z、W的原子序数依次增大,其在元素周期表中的相对位置如图所示。下列说法正确的是( )
X
Y Z W
A.W元素的原子半径在同周期主族元素中是最小的
B.X元素原子的最高化合价为+6价
C.Z的原子序数是X的3倍
D.Y的氢氧化物的化学式为Y(OH)2
3.(经典题)(2023山东滨州北镇中学月考)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的简单氢化物可与其最高价含氧酸反应生成一种正盐。下列说法正确的是 ( )
W X
Y Z
A.元素W、X的单质在放电条件下生成红棕色气体
B.Z的氧化物对应水化物的酸性一定强于Y的
C.X、Y两元素的最高正价相等
D.四种元素的简单氢化物中,X的简单氢化物沸点最高
4.(易错题)(2024四川绵阳月考)元素W、X、Y、Z、T在周期表中位置如图所示,其中W、X、Y、Z为短周期元素,X的一种氧化物是红棕色、有刺激性气味的有毒气体。下列说法正确的是 ( )
A.氢化物的稳定性:Y>X
B.Z的不同价态氧化物对应的水化物中,Z的化合价越高氧化性越强
C.W的氧化物是两性氧化物,因为它与碱、酸均能反应
D.T单质具有半导体特性,与Y元素可形成两种化合物TY和TY2
5.(2024河北衡水武强中学期末)短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的3倍。下列说法不正确的是( )
A.原子半径:Z>W>X>Y
B.简单氢化物的稳定性:X>Y>W>Z
C.最高价氧化物对应水化物的酸性:X>W>Z
D.非金属性:Z6.(不定项)(2024安徽阜阳期末)短周期主族元素X、Y、A、B、C在元素周期表中的位置如图所示,其原子最外层电子数符合X+Y+C=A+B,下列说法错误的是( )
A.Y元素位于第3周期ⅣA族
B.简单氢化物的热稳定性强弱顺序为XC.元素氧化物对应水化物的酸性:B>C
D.简单离子的还原性由弱到强的顺序为A-题型2 文字表述型
7.(2024湖北武汉期末)现有四种前20号元素的相关信息如表所示。
元素 相关信息
W 在前20号主族元素中,原子半径最大
X W+与X2-具有相同的电子层结构
Y 原子最外层电子数是内层电子数的2倍
Z 地壳中含量最多的元素
下列说法错误的是 ( )
A.简单氢化物的沸点:Z>X
B.W、X、Y都能与Z形成多种化合物
C.Y与Z组成的常见分子,均为酸性氧化物
D.W的最高价氧化物的水化物为强碱
8.(2024江西宜春宜丰中学期中)短周期主族元素X、Y、Z、W的原子序数依次增大。X的气态氢化物能使湿润的红色石蕊试纸变蓝,Z是地壳中含量第二的元素,Y、Z的最外层电子数之和为10,Y和W在元素周期表中相邻。下列说法正确的是 ( )
A.ZY2易溶于水
B.简单离子半径:XC.最高价氧化物对应的水化物的酸性:XD.Y2和Y3互为同素异形体
题型3 特殊形状的元素周期表型
9.(2024黑龙江龙东五校期末)某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第1周期除外),每个“·”代表一种元素,“”相连代表同族元素。X、Y、Z、R、M为原子半径依次减小的五种短周期主族元素,Y的最外层电子数比最内层电子数多1,且Y为第3周期元素,下列说法正确的是( )
A.原子序数:X>Y>Z
B.Z与M形成的化合物,各原子均满足8电子稳定结构
C.在同一周期中,X最高价氧化物对应的水化物碱性最强
D.X、R形成的两种常见化合物中均只含有离子键
10.(2023山东枣庄八中月考)元素周期表的形式多种多样,如图是扇形元素周期表的一部分(①~⑩为前36号元素)。对比中学常见元素周期表,思考扇形元素周期表的填充规律。下列说法中正确的是( )
A.简单离子的半径:②>⑧>⑨
B.⑥的金属性比⑦的弱
C.元素⑩位于常见元素周期表第4周期Ⅷ族
D.①分别与③④⑤形成的简单化合物的稳定性依次减弱
微项目 海带提碘与海水提溴
基础过关练
1.(2024福建三明阶段练习)海洋是巨大的资源宝库,可以从中提取钾、镁、溴、氯、碘等元素。下列说法正确的是( )
A.海带中富含碘元素,在海带中碘以单质形式存在
B.空气吹出法提取溴利用了溴的挥发性
C.海带提碘和海水提溴的关键步骤只有氧化,无需富集
D.分别向碘水、溴水中加入CCl4,振荡后下层均呈现紫色
2.(2024河南郑州阶段练习)海水提溴常用“空气吹出法”,其流程如图:
下列说法错误的是( )
A.“吹出”步骤主要是利用了空气中O2的氧化性
B.“吸收”时发生主要反应的离子方程式为Br2+SO2+2H2O 4H++2Br-+S
C.从“氧化Ⅰ”至“吸收”这几步操作的目的是富集Br元素
D.“氧化Ⅱ”后分离出的溶液X可循环使用,其中溶质主要为H2SO4和HCl
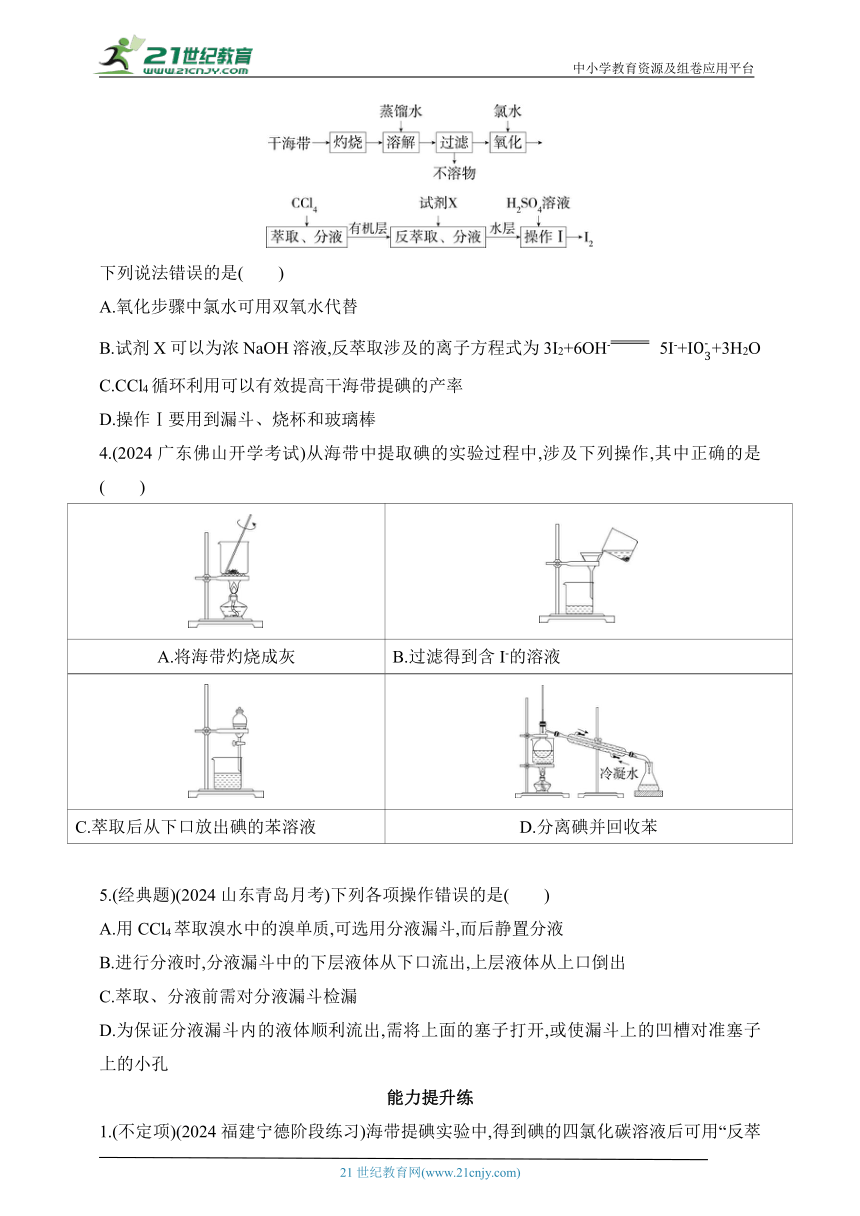
3.(2024山东烟台开学考试)从干海带中提取碘的实验流程如图:
下列说法错误的是( )
A.氧化步骤中氯水可用双氧水代替
B.试剂X可以为浓NaOH溶液,反萃取涉及的离子方程式为3I2+6OH- 5I-+I+3H2O
C.CCl4循环利用可以有效提高干海带提碘的产率
D.操作Ⅰ要用到漏斗、烧杯和玻璃棒
4.(2024广东佛山开学考试)从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
A.将海带灼烧成灰 B.过滤得到含I-的溶液
C.萃取后从下口放出碘的苯溶液 D.分离碘并回收苯
5.(经典题)(2024山东青岛月考)下列各项操作错误的是( )
A.用CCl4萃取溴水中的溴单质,可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出
C.萃取、分液前需对分液漏斗检漏
D.为保证分液漏斗内的液体顺利流出,需将上面的塞子打开,或使漏斗上的凹槽对准塞子上的小孔
能力提升练
1.(不定项)(2024福建宁德阶段练习)海带提碘实验中,得到碘的四氯化碳溶液后可用“反萃取法”萃取、富集碘单质,实验步骤如下(已知:3I2+6NaOH 5NaI+NaIO3+3H2O)。下列说法错误的是( )
碘的四氯
化碳溶液含I-、I
的水溶液含I2的
悬浊液固态碘单质
A.步骤①还可以用酒精做萃取剂
B.分液时水层从分液漏斗下口放出
C.步骤②中发生反应的离子方程式为6H++5I-+I 3I2↓+3H2O
D.步骤③操作中需要的玻璃仪器为漏斗、烧杯和玻璃棒
2.(2024吉林长春月考)一种海水提溴的工艺流程如图所示。下列说法错误的是( )
A.“氧化”和“转化”工序中Cl2的主要作用相同
B.水相Ⅱ中含有H+和Cl-
C.“洗脱”工序可完成R3NCl的再生
D.保存液溴时加适量水的主要作用是防止溴单质被氧化
3.(2024北京师范大学附中统练)溴及其化合物广泛应用于医药、农药和阻燃剂等生产中。一种利用空气吹出法从海水中提取溴的工艺流程如图:
浓缩
海水酸化
海水含溴
空气含溴溶液…→产品溴
已知:ⅰ.与Na2CO3反应时,Br2转化为Br和Br-。
ⅱ.HBrO3为强酸。
下列说法不正确的是( )
A.酸化海水通入Cl2提取溴的反应为Cl2+2Br- 2Cl-+Br2
B.脱氯过程脱除1 mol Cl2可能消耗 mol FeBr2
C.用Na2CO3溶液吸收足量Br2蒸气后,所得产物中的含碳粒子主要是HC
D.H2SO4酸化时重新得到Br2的反应中氧化剂和还原剂的物质的量之比为1∶5
4.(不定项)(2024山东德州平原月考)利用离子交换法从海带中提取碘是一种较为先进的制碘工艺。如图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
已知:①I2+I- 。
②强碱性阴离子树脂(用R—Cl表示,Cl-可被其他更易被吸附的阴离子替代)对多碘离子()有很强的交换吸附能力;步骤“交换吸附”发生的反应为R—Cl+ R—I3+Cl-。
下列说法正确的是( )
A.在方框表示的六个过程中有2个是氧化还原反应
B.“氧化”过程可以加入过量H2O2
C.“洗脱”过程生成的NaI和NaIO3的物质的量之比为5∶1
D.“酸化氧化”过程若选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则NaNO2与NaI的质量比应不小于
5.(2024山东潍坊阶段练习)溴主要用于制造汽油抗爆剂、照相感光材料、药物、试剂和农药等。在生产中用下列方法制取液溴。
已知:吸收液中的溶质主要成分是NaBr、NaBrO3。
回答下列问题:
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含Br2的海水”中溴的质量分数 (填“高”或“低”)。
(2)步骤③的操作是 ;经过该操作获得含Br2的空气,利用了Br2 的性质。
步骤⑥的蒸馏过程中,溴出口温度要控制在80~90 ℃,温度过高或过低都不利于生产,请解释原因: 。
(3)步骤④和⑤的目的是 ;步骤④用浓的NaOH溶液发生反应的离子方程式为 。
(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是 ,然后操作名称是 。
6.(2024山东东营胜利第一中学阶段检测)碘元素在海带中以碘化物的形式存在,从海带中提取碘单质,工艺流程如图。
请回答下列问题:
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角、玻璃棒外,还要用到的主要仪器是 (填名称)。
(2)步骤⑤操作中,静置、分层后,下层溶液的颜色为 。
(3)步骤④中的H2O2可用以下 (填字母)试剂代替。
a.Cl2 b.Na2SO3 c.NaCl
(4)步骤⑤中,选择用CCl4来萃取碘的理由是 。
(5)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为 ,每消耗1 mol I2转移电子数为 (设NA为阿伏加德罗常数的值)。
(6)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是 ;为得到较多较高纯度的单质碘,A容器中可盛放的试剂为 (填字母)。
a.冷水 b.热水 c.热氢氧化钠溶液
答案与分层梯度式解析
题型整合练 “位、构、性”在元素周期律中的综合应用
1.C 己是地壳中含量第二多的元素,己为Si(破题关键);戊与己同主族,戊为C;甲与戊原子序数相差3,甲为Li;根据元素位置关系知乙为Na、丁为Mg、辛为Al、丙为K、庚为Ga。根据上述分析可知,A错误;丙为K,透过蓝色钴玻璃观察K的焰色为紫色,B错误;丙为K,原子序数为19,庚为Ga,原子序数为31,原子核外电子数相差12,C正确;丁为Mg,其最高价氧化物对应的水化物为氢氧化镁,不能与碱反应,D错误。
2.A 由这四种短周期主族元素在元素周期表中的相对位置可知:X为O元素,Y为Al元素,Z为S元素,W为Cl元素。同一周期主族元素,从左到右原子半径逐渐减小,氯元素的原子半径在同周期主族元素中是最小的,故A正确;氧元素没有最高正价,故B错误;硫的原子序数是16,氧的原子序数是8,16是8的2倍,故C错误;铝的氢氧化物的化学式为Al(OH)3,故D错误。
3.D 短周期元素W的简单氢化物可与其最高价含氧酸反应生成一种正盐,推知W是N元素(破题关键),根据元素的相对位置可知X是O元素,Y是S元素,Z是Cl元素。N2与O2在放电条件下发生反应生成无色气体NO,故A错误;没有说明是否是最高价氧化物对应的水化物,无法比较酸性强弱,故B错误;O元素没有最高正价,故C错误;四种元素形成的简单氢化物中,常温下,H2O为液体,其余为气体,H2O沸点最高,故D正确。
4.D X的一种氧化物是红棕色、有刺激性气味的有毒气体,X为N(破题关键),根据各元素在周期表中的位置可知,W为Si,T为Ge,Y为O,Z为Cl。非金属性越强,简单氢化物越稳定,因此稳定性:H2O>NH3,但O的另一种氢化物H2O2易分解,稳定性比NH3差(易错点),A错误;Cl的氧化物对应的水化物中,HClO氧化性最强,B错误;SiO2是酸性氧化物,不是两性氧化物,C错误;Ge位于周期表金属元素和非金属元素的交界处附近,其单质具有半导体特性,Ge与O能形成GeO和GeO2,D正确。
易错分析 遇到“氢化物的稳定性”问题时一定要注意,简单氢化物的稳定性与元素非金属性有关,而不是所有氢化物,比如O的氢化物有H2O和H2O2,后者稳定性较差,与O的非金属性强不相关。
5.B 根据元素在周期表中的位置可知W为第3周期元素,设W的最外层电子数为x,依据题意有2+8+x=3x,解得x=5,即W为P元素(破题关键);则X、Y、Z分别为N、O、Si。同周期从左到右,主族元素原子半径逐渐减小,同主族,自上而下,原子半径逐渐增大,则原子半径:Z>W>X>Y,A正确;根据非金属性:Y>X>W>Z,可知简单氢化物的稳定性:Y>X>W>Z,B错误、D正确;由非金属性可确定最高价氧化物对应水化物的酸性:X>W>Z,C正确。
6.BC 短周期主族元素X、Y、A、B、C在元素周期表中的位置如题图所示,其原子最外层电子数符合X+Y+C=A+B,设X最外层电子数为a,可得a+a+a+2=a+3+a+3,得a=4,X、Y、A、B、C分别为C、Si、F、Cl、S,据此解答。Y为Si元素,位于第3周期ⅣA族,A正确;非金属性:F>Cl>C>Si,简单氢化物的热稳定性强弱顺序为SiH47.C W在前20号主族元素中,原子半径最大,则W为K元素,W+与X2-具有相同的电子层结构,则X为S元素,Y原子最外层电子数是内层电子数的2倍,则Y为C元素,Z是地壳中含量最多的元素,则Z为O元素,据此分析解答。X为S元素,Z为O元素,两者的简单氢化物分别为H2S和H2O,H2O常温下为液态,H2S为气态,则沸点:H2O>H2S,A正确;K、S、C分别可与O形成多种化合物,B正确;C与O组成的CO属于不成盐氧化物,C错误;K位于元素周期表第ⅠA族,在Na的下一周期,金属性比Na强,KOH的碱性比NaOH强,D正确。
8.D 根据X的气态氢化物能使湿润的红色石蕊试纸变蓝可知X为N元素;Z是地壳中含量第二的元素,Z为Si元素;由Y、Z的最外层电子数之和为10可知,Y的最外层电子数为6,Y的原子序数小于Z,则Y为O元素;由Y和W在周期表中相邻可知,W为S元素。ZY2为SiO2,SiO2不溶于水,A错误;微粒半径:O2-Si,则最高价氧化物对应水化物的酸性:HNO3>H2SiO3,C错误;O2和O3互为同素异形体,D正确。
9.C 根据Y的最外层电子数比最内层电子数多1,且Y为第3周期元素可知,Y为Al;根据八角星的结构,可知X为Na,Z为Cl,R为O;M位于第1周期,与Na同主族,M为H。原子序数:Z(Cl)>Y(Al)>X(Na),A错误;Cl与H形成的化合物为HCl,其中H原子没有达到8电子稳定结构,B错误;Na为第3周期元素,在第3周期中,Na的最高价氧化物对应的水化物碱性最强,C正确;Na2O2中含共价键,D错误。
名师点睛
10.C 根据扇形元素周期表的一部分可知,1、2、3、4代表周期,最外周的汉字数字代表纵列,与常见元素周期表对照,由元素在周期表中的位置可知,①为H元素,②为Na元素,③为C元素,④为N元素,⑤为O元素,⑥为Mg元素,⑦为Al元素,⑧为S元素,⑨为Cl元素,⑩为Fe元素;②、⑧、⑨分别是Na、S、Cl元素,简单离子半径的大小顺序是S2->Cl->Na+,故A错误;⑥、⑦分别是Mg、Al,金属性Mg>Al,故B错误;元素⑩是铁元素,位于常见元素周期表第4周期Ⅷ族,故C正确;①分别与③、④、⑤形成的简单化合物为CH4、NH3、H2O,元素的非金属性越强,简单氢化物越稳定,非金属性:C微项目 海带提碘与海水提溴
基础过关练
1.B 海带中含有的碘元素以碘化物的形式存在,A错误;溴易挥发,可鼓入热空气使溴挥发出来,B正确;氧化与富集均为海带提碘和海水提溴的关键步骤,C错误;碘的CCl4溶液为紫色,溴的CCl4溶液为橙红色,D错误。
2.A 热空气吹出溴单质,主要是利用了溴易挥发的性质,与空气中O2的氧化性无关,故A错误;热空气吹出的溴单质用SO2、H2O吸收,发生的主要反应的离子方程式为Br2+SO2+2H2O 4H++2Br-+S,故B正确;“氧化Ⅰ”得到的溶液中Br2的浓度不高,需要富集,即从“氧化Ⅰ”至“吸收”这几步操作的目的是富集Br元素,故C正确;“吸收”中发生的主要反应为Br2+SO2+2H2O 2HBr+H2SO4,“氧化Ⅱ”发生的反应为Cl2+2HBr Br2+2HCl,“氧化Ⅱ”后分离出的溶液X可循环使用,其中溶质主要为H2SO4和HCl,故D正确。
3.C H2O2具有氧化性,氧化步骤中氯水可用双氧水代替,故A正确;试剂X可以为浓NaOH溶液,反萃取涉及的离子方程式为3I2+6OH- 5I-+I+3H2O,故B正确;CCl4可循环利用,但与提高干海带提碘的产率无关,故C错误;操作Ⅰ为过滤,需要用到的玻璃仪器有漏斗、烧杯和玻璃棒,故D正确。
4.D 将海带灼烧成灰应该在坩埚中进行,A错误;过滤时应该用玻璃棒引流,B错误;碘的苯溶液密度小于水的密度,在上层,进行分液时,分液漏斗中的下层液体先从下口流出,再将上层液体从上口倒出,C错误;碘与苯互溶,二者沸点相差较大,分离碘并回收苯,可以进行蒸馏操作,D正确。
5.D 往分液漏斗内的溴水中加入CCl4,振荡、静置后进行分液,A正确;进行分液时,分液漏斗中的下层液体先从下口流出,再将上层液体从上口倒出,B正确;使用分液漏斗前,需检查是否漏液,所以萃取、分液前需对分液漏斗检漏,C正确;保持分液漏斗内外压强相等,才能使分液漏斗内的液体顺利流出,操作时,需将上面的塞子打开,或使磨口塞上的凹槽对准漏斗上的小孔,D错误。
能力提升练
1.AB 酒精和水可以以任意比例互溶,所以酒精不能作为碘的萃取剂,故A错误;四氯化碳密度比水大,萃取后四氯化碳层在下、水层在上,分液时水层从分液漏斗上口倒出,故B错误;水层中含有的碘离子和碘酸根离子在加入45%的硫酸溶液后,发生反应生成单质碘,离子方程式为6H++5I-+I 3I2↓+3H2O,故C正确;过滤操作需要的玻璃仪器有漏斗、烧杯和玻璃棒,故D正确。
2.D “氧化”和“转化”工序中Cl2的主要作用相同,都是将溴离子氧化生成溴单质,故A正确;根据流程图可知,还原时二氧化硫与R3N[ClBr2]反应生成硫酸、HBr、R3NCl,R3NCl再与HBr反应生成HCl和R3NBr,故水相Ⅱ中含H+和Cl-,故B正确;用盐酸洗脱R3NBr生成HBr和R3NCl,“洗脱”工序可完成R3NCl的再生,故C正确;保存液溴时加适量水的主要作用是防止溴单质挥发,故D错误。
3.C 由流程可知,海水浓缩、酸化后通入氯气发生反应:2Br-+Cl2 Br2+2Cl-,用热空气吹出溴,得到含有溴的空气,将含溴空气通入FeBr2溶液脱氯,再与Na2CO3溶液反应,Br2转化为Br和Br-,再用硫酸酸化,Br和Br-在酸性环境下反应生成Br2,经过一系列操作得到产品溴,据此分析解答。酸化海水通入Cl2,Cl2将溴离子氧化为溴单质,发生反应:Cl2+2Br- 2Cl-+Br2,故A正确;脱氯过程中可能发生反应:3Cl2+2FeBr2 2FeCl3+2Br2,此时脱除1 mol氯气消耗 mol FeBr2,故B正确;Na2CO3溶液吸收足量Br2蒸气,反应生成Br、Br-,HBrO3为强酸,故吸收足量溴蒸气,所得产物中的含碳粒子主要是CO2,故C错误;H2SO4酸化时发生反应:Br+5Br-+6H+ 3Br2+3H2O,反应中Br做氧化剂,Br-做还原剂,氧化剂和还原剂的物质的量之比为1∶5,故D正确。
4.CD 在方框表示的六个过程中有4个是氧化还原反应,只有“交换吸附”“NaCl洗脱(树脂再生)”不是氧化还原反应,故A错误;若H2O2过量,H2O2会将I-全部氧化生成I2,无法发生反应I2+I- ,从而导致后续反应无法进行,故B错误;“洗脱”过程涉及反应:3I2+6NaOH 5NaI+NaIO3+3H2O,生成的NaI和NaIO3的物质的量之比为5∶1,故C正确;“酸化氧化”过程若选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,该无色气体为NO,反应为2N+2I-+4H+ 2NO↑+I2+2H2O,n(NaNO2)∶n(NaI)=1∶1,质量之比为69∶150=23∶50,为使碘化钠充分反应,NaNO2和NaI的质量比应不小于,故D正确。
5.答案 (1)高 (2)热空气吹出 易挥发 温度过高,大量水蒸气随之蒸出,溴蒸气中水分增加;温度过低,溴的产率低 (3)富集(增大溶液中溴单质的浓度) 3Br2+6OH- 5Br-+Br+3H2O (4)饱和NaBr溶液 分液
解析 海水提盐后的苦卤中含有溴离子,通入氯气,将溴离子氧化为溴单质,用热空气吹出溴单质,再用氢氧化钠溶液吸收溴单质,吸收液中的溶质主要成分是NaBr、NaBrO3,向其中加入稀硫酸,发生反应:5Br-+Br+6H+ 3Br2+3H2O,反应生成了溴单质,得到溴水混合物,此时经过溴的富集,“溴水混合物”中溴的质量分数比“含Br2的海水”中溴的质量分数要高,经过蒸馏,得到溴蒸气,冷凝分离后得到液溴和粗溴水,粗溴水可以循环利用。(1)经上述分析知,经过溴的富集,第⑤步后的“溴水混合物”中溴的质量分数比“含Br2的海水”中溴的质量分数高。(2)步骤③是从含溴单质的海水中得到含溴单质的空气,又因为Br2易挥发,所以步骤③的操作是热空气吹出。温度过高,大量水蒸气排出,溴蒸气中水分增加,温度过低,溴的产率低,所以溴出口温度要控制在80~90 ℃,温度过高或过低都不利于生产。(3)步骤①②之后并未直接用含Br2的海水进行蒸馏得到液溴,主要是因为步骤②后“含Br2的海水”中溴的浓度低,蒸馏时会消耗大量能量,而经过步骤③④⑤富集溴后再蒸馏,消耗的能量低,步骤④⑤实际上是溴的富集过程,与直接蒸馏“含溴的海水”相比,富集后再蒸馏效率更高,消耗能量更少,成本更低。(4)因为还原性:Cl-6.答案 (1)坩埚
(2)紫红色(或紫色)
(3)a
(4)CCl4与水互不相溶且与水不反应,碘在CCl4中的溶解度比在水中大
(5)3I2+6OH- 5I-+INA
(6)升华法 a
解析 (1)灼烧需要在坩埚中进行,所以步骤①操作时,除需要酒精灯、三脚架、泥三角、玻璃棒外,还要用到的主要仪器是坩埚。
(2)四氯化碳密度大于水,在下层,则静置、分层后,下层溶液的颜色为紫红色或紫色。
(3)步骤④中的H2O2的作用为将碘离子氧化为碘单质,Cl2可将I-氧化为I2,Na2SO3、NaCl均不能氧化碘离子。
(4)萃取剂的选用原则为和原溶剂不互溶、不反应,且溶质在萃取剂中的溶解度大于原溶剂,所以步骤⑤中,选择用CCl4来萃取碘的理由为CCl4与水互不相溶且与水不反应,碘在CCl4中的溶解度比在水中大。
(5)碘在氢氧化钠溶液中发生反应的离子方程式为3I2+6OH- 5I-+I+3H2O,3 mol I2参加反应转移5 mol电子,所以每消耗1 mol I2转移电子数为NA。
(6)碘易升华,该装置对粗碘进行提纯采用的方法是升华法;为得到较多较高纯度的单质碘,需A容器中液体温度较低,故A容器中盛放的试剂可以为冷水。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁教版高中化学必修第二册
题型整合练 “位、构、性”在元素周期律中的综合应用
题型1 元素周期表片段型
1.(2024山东德州月考)甲~辛等主族元素在周期表中的相对位置如表。甲与戊的原子序数相差3,己是地壳中含量第二多的元素,丙与庚属同周期元素。下列判断正确的是( )
A.乙为K元素,庚为Ga元素
B.丙的焰色为黄色
C.丙与庚的原子核外电子数相差12
D.丁的最高价氧化物对应的水化物能与碱发生反应
2.已知短周期主族元素X、Y、Z、W的原子序数依次增大,其在元素周期表中的相对位置如图所示。下列说法正确的是( )
X
Y Z W
A.W元素的原子半径在同周期主族元素中是最小的
B.X元素原子的最高化合价为+6价
C.Z的原子序数是X的3倍
D.Y的氢氧化物的化学式为Y(OH)2
3.(经典题)(2023山东滨州北镇中学月考)W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的简单氢化物可与其最高价含氧酸反应生成一种正盐。下列说法正确的是 ( )
W X
Y Z
A.元素W、X的单质在放电条件下生成红棕色气体
B.Z的氧化物对应水化物的酸性一定强于Y的
C.X、Y两元素的最高正价相等
D.四种元素的简单氢化物中,X的简单氢化物沸点最高
4.(易错题)(2024四川绵阳月考)元素W、X、Y、Z、T在周期表中位置如图所示,其中W、X、Y、Z为短周期元素,X的一种氧化物是红棕色、有刺激性气味的有毒气体。下列说法正确的是 ( )
A.氢化物的稳定性:Y>X
B.Z的不同价态氧化物对应的水化物中,Z的化合价越高氧化性越强
C.W的氧化物是两性氧化物,因为它与碱、酸均能反应
D.T单质具有半导体特性,与Y元素可形成两种化合物TY和TY2
5.(2024河北衡水武强中学期末)短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的3倍。下列说法不正确的是( )
A.原子半径:Z>W>X>Y
B.简单氢化物的稳定性:X>Y>W>Z
C.最高价氧化物对应水化物的酸性:X>W>Z
D.非金属性:Z
A.Y元素位于第3周期ⅣA族
B.简单氢化物的热稳定性强弱顺序为X
D.简单离子的还原性由弱到强的顺序为A-
7.(2024湖北武汉期末)现有四种前20号元素的相关信息如表所示。
元素 相关信息
W 在前20号主族元素中,原子半径最大
X W+与X2-具有相同的电子层结构
Y 原子最外层电子数是内层电子数的2倍
Z 地壳中含量最多的元素
下列说法错误的是 ( )
A.简单氢化物的沸点:Z>X
B.W、X、Y都能与Z形成多种化合物
C.Y与Z组成的常见分子,均为酸性氧化物
D.W的最高价氧化物的水化物为强碱
8.(2024江西宜春宜丰中学期中)短周期主族元素X、Y、Z、W的原子序数依次增大。X的气态氢化物能使湿润的红色石蕊试纸变蓝,Z是地壳中含量第二的元素,Y、Z的最外层电子数之和为10,Y和W在元素周期表中相邻。下列说法正确的是 ( )
A.ZY2易溶于水
B.简单离子半径:X
题型3 特殊形状的元素周期表型
9.(2024黑龙江龙东五校期末)某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第1周期除外),每个“·”代表一种元素,“”相连代表同族元素。X、Y、Z、R、M为原子半径依次减小的五种短周期主族元素,Y的最外层电子数比最内层电子数多1,且Y为第3周期元素,下列说法正确的是( )
A.原子序数:X>Y>Z
B.Z与M形成的化合物,各原子均满足8电子稳定结构
C.在同一周期中,X最高价氧化物对应的水化物碱性最强
D.X、R形成的两种常见化合物中均只含有离子键
10.(2023山东枣庄八中月考)元素周期表的形式多种多样,如图是扇形元素周期表的一部分(①~⑩为前36号元素)。对比中学常见元素周期表,思考扇形元素周期表的填充规律。下列说法中正确的是( )
A.简单离子的半径:②>⑧>⑨
B.⑥的金属性比⑦的弱
C.元素⑩位于常见元素周期表第4周期Ⅷ族
D.①分别与③④⑤形成的简单化合物的稳定性依次减弱
微项目 海带提碘与海水提溴
基础过关练
1.(2024福建三明阶段练习)海洋是巨大的资源宝库,可以从中提取钾、镁、溴、氯、碘等元素。下列说法正确的是( )
A.海带中富含碘元素,在海带中碘以单质形式存在
B.空气吹出法提取溴利用了溴的挥发性
C.海带提碘和海水提溴的关键步骤只有氧化,无需富集
D.分别向碘水、溴水中加入CCl4,振荡后下层均呈现紫色
2.(2024河南郑州阶段练习)海水提溴常用“空气吹出法”,其流程如图:
下列说法错误的是( )
A.“吹出”步骤主要是利用了空气中O2的氧化性
B.“吸收”时发生主要反应的离子方程式为Br2+SO2+2H2O 4H++2Br-+S
C.从“氧化Ⅰ”至“吸收”这几步操作的目的是富集Br元素
D.“氧化Ⅱ”后分离出的溶液X可循环使用,其中溶质主要为H2SO4和HCl
3.(2024山东烟台开学考试)从干海带中提取碘的实验流程如图:
下列说法错误的是( )
A.氧化步骤中氯水可用双氧水代替
B.试剂X可以为浓NaOH溶液,反萃取涉及的离子方程式为3I2+6OH- 5I-+I+3H2O
C.CCl4循环利用可以有效提高干海带提碘的产率
D.操作Ⅰ要用到漏斗、烧杯和玻璃棒
4.(2024广东佛山开学考试)从海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )
A.将海带灼烧成灰 B.过滤得到含I-的溶液
C.萃取后从下口放出碘的苯溶液 D.分离碘并回收苯
5.(经典题)(2024山东青岛月考)下列各项操作错误的是( )
A.用CCl4萃取溴水中的溴单质,可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出
C.萃取、分液前需对分液漏斗检漏
D.为保证分液漏斗内的液体顺利流出,需将上面的塞子打开,或使漏斗上的凹槽对准塞子上的小孔
能力提升练
1.(不定项)(2024福建宁德阶段练习)海带提碘实验中,得到碘的四氯化碳溶液后可用“反萃取法”萃取、富集碘单质,实验步骤如下(已知:3I2+6NaOH 5NaI+NaIO3+3H2O)。下列说法错误的是( )
碘的四氯
化碳溶液含I-、I
的水溶液含I2的
悬浊液固态碘单质
A.步骤①还可以用酒精做萃取剂
B.分液时水层从分液漏斗下口放出
C.步骤②中发生反应的离子方程式为6H++5I-+I 3I2↓+3H2O
D.步骤③操作中需要的玻璃仪器为漏斗、烧杯和玻璃棒
2.(2024吉林长春月考)一种海水提溴的工艺流程如图所示。下列说法错误的是( )
A.“氧化”和“转化”工序中Cl2的主要作用相同
B.水相Ⅱ中含有H+和Cl-
C.“洗脱”工序可完成R3NCl的再生
D.保存液溴时加适量水的主要作用是防止溴单质被氧化
3.(2024北京师范大学附中统练)溴及其化合物广泛应用于医药、农药和阻燃剂等生产中。一种利用空气吹出法从海水中提取溴的工艺流程如图:
浓缩
海水酸化
海水含溴
空气含溴溶液…→产品溴
已知:ⅰ.与Na2CO3反应时,Br2转化为Br和Br-。
ⅱ.HBrO3为强酸。
下列说法不正确的是( )
A.酸化海水通入Cl2提取溴的反应为Cl2+2Br- 2Cl-+Br2
B.脱氯过程脱除1 mol Cl2可能消耗 mol FeBr2
C.用Na2CO3溶液吸收足量Br2蒸气后,所得产物中的含碳粒子主要是HC
D.H2SO4酸化时重新得到Br2的反应中氧化剂和还原剂的物质的量之比为1∶5
4.(不定项)(2024山东德州平原月考)利用离子交换法从海带中提取碘是一种较为先进的制碘工艺。如图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
已知:①I2+I- 。
②强碱性阴离子树脂(用R—Cl表示,Cl-可被其他更易被吸附的阴离子替代)对多碘离子()有很强的交换吸附能力;步骤“交换吸附”发生的反应为R—Cl+ R—I3+Cl-。
下列说法正确的是( )
A.在方框表示的六个过程中有2个是氧化还原反应
B.“氧化”过程可以加入过量H2O2
C.“洗脱”过程生成的NaI和NaIO3的物质的量之比为5∶1
D.“酸化氧化”过程若选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则NaNO2与NaI的质量比应不小于
5.(2024山东潍坊阶段练习)溴主要用于制造汽油抗爆剂、照相感光材料、药物、试剂和农药等。在生产中用下列方法制取液溴。
已知:吸收液中的溶质主要成分是NaBr、NaBrO3。
回答下列问题:
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含Br2的海水”中溴的质量分数 (填“高”或“低”)。
(2)步骤③的操作是 ;经过该操作获得含Br2的空气,利用了Br2 的性质。
步骤⑥的蒸馏过程中,溴出口温度要控制在80~90 ℃,温度过高或过低都不利于生产,请解释原因: 。
(3)步骤④和⑤的目的是 ;步骤④用浓的NaOH溶液发生反应的离子方程式为 。
(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是 ,然后操作名称是 。
6.(2024山东东营胜利第一中学阶段检测)碘元素在海带中以碘化物的形式存在,从海带中提取碘单质,工艺流程如图。
请回答下列问题:
(1)步骤①操作时,除需要酒精灯、三脚架、泥三角、玻璃棒外,还要用到的主要仪器是 (填名称)。
(2)步骤⑤操作中,静置、分层后,下层溶液的颜色为 。
(3)步骤④中的H2O2可用以下 (填字母)试剂代替。
a.Cl2 b.Na2SO3 c.NaCl
(4)步骤⑤中,选择用CCl4来萃取碘的理由是 。
(5)步骤⑥使用的是反萃取法,目的是富集碘元素,该步反应的离子方程式为 ,每消耗1 mol I2转移电子数为 (设NA为阿伏加德罗常数的值)。
(6)某同学制得的粗碘中含有少量Na2SO4,对粗碘进行提纯的装置如图所示,采用的分离方法是 ;为得到较多较高纯度的单质碘,A容器中可盛放的试剂为 (填字母)。
a.冷水 b.热水 c.热氢氧化钠溶液
答案与分层梯度式解析
题型整合练 “位、构、性”在元素周期律中的综合应用
1.C 己是地壳中含量第二多的元素,己为Si(破题关键);戊与己同主族,戊为C;甲与戊原子序数相差3,甲为Li;根据元素位置关系知乙为Na、丁为Mg、辛为Al、丙为K、庚为Ga。根据上述分析可知,A错误;丙为K,透过蓝色钴玻璃观察K的焰色为紫色,B错误;丙为K,原子序数为19,庚为Ga,原子序数为31,原子核外电子数相差12,C正确;丁为Mg,其最高价氧化物对应的水化物为氢氧化镁,不能与碱反应,D错误。
2.A 由这四种短周期主族元素在元素周期表中的相对位置可知:X为O元素,Y为Al元素,Z为S元素,W为Cl元素。同一周期主族元素,从左到右原子半径逐渐减小,氯元素的原子半径在同周期主族元素中是最小的,故A正确;氧元素没有最高正价,故B错误;硫的原子序数是16,氧的原子序数是8,16是8的2倍,故C错误;铝的氢氧化物的化学式为Al(OH)3,故D错误。
3.D 短周期元素W的简单氢化物可与其最高价含氧酸反应生成一种正盐,推知W是N元素(破题关键),根据元素的相对位置可知X是O元素,Y是S元素,Z是Cl元素。N2与O2在放电条件下发生反应生成无色气体NO,故A错误;没有说明是否是最高价氧化物对应的水化物,无法比较酸性强弱,故B错误;O元素没有最高正价,故C错误;四种元素形成的简单氢化物中,常温下,H2O为液体,其余为气体,H2O沸点最高,故D正确。
4.D X的一种氧化物是红棕色、有刺激性气味的有毒气体,X为N(破题关键),根据各元素在周期表中的位置可知,W为Si,T为Ge,Y为O,Z为Cl。非金属性越强,简单氢化物越稳定,因此稳定性:H2O>NH3,但O的另一种氢化物H2O2易分解,稳定性比NH3差(易错点),A错误;Cl的氧化物对应的水化物中,HClO氧化性最强,B错误;SiO2是酸性氧化物,不是两性氧化物,C错误;Ge位于周期表金属元素和非金属元素的交界处附近,其单质具有半导体特性,Ge与O能形成GeO和GeO2,D正确。
易错分析 遇到“氢化物的稳定性”问题时一定要注意,简单氢化物的稳定性与元素非金属性有关,而不是所有氢化物,比如O的氢化物有H2O和H2O2,后者稳定性较差,与O的非金属性强不相关。
5.B 根据元素在周期表中的位置可知W为第3周期元素,设W的最外层电子数为x,依据题意有2+8+x=3x,解得x=5,即W为P元素(破题关键);则X、Y、Z分别为N、O、Si。同周期从左到右,主族元素原子半径逐渐减小,同主族,自上而下,原子半径逐渐增大,则原子半径:Z>W>X>Y,A正确;根据非金属性:Y>X>W>Z,可知简单氢化物的稳定性:Y>X>W>Z,B错误、D正确;由非金属性可确定最高价氧化物对应水化物的酸性:X>W>Z,C正确。
6.BC 短周期主族元素X、Y、A、B、C在元素周期表中的位置如题图所示,其原子最外层电子数符合X+Y+C=A+B,设X最外层电子数为a,可得a+a+a+2=a+3+a+3,得a=4,X、Y、A、B、C分别为C、Si、F、Cl、S,据此解答。Y为Si元素,位于第3周期ⅣA族,A正确;非金属性:F>Cl>C>Si,简单氢化物的热稳定性强弱顺序为SiH4
8.D 根据X的气态氢化物能使湿润的红色石蕊试纸变蓝可知X为N元素;Z是地壳中含量第二的元素,Z为Si元素;由Y、Z的最外层电子数之和为10可知,Y的最外层电子数为6,Y的原子序数小于Z,则Y为O元素;由Y和W在周期表中相邻可知,W为S元素。ZY2为SiO2,SiO2不溶于水,A错误;微粒半径:O2-
9.C 根据Y的最外层电子数比最内层电子数多1,且Y为第3周期元素可知,Y为Al;根据八角星的结构,可知X为Na,Z为Cl,R为O;M位于第1周期,与Na同主族,M为H。原子序数:Z(Cl)>Y(Al)>X(Na),A错误;Cl与H形成的化合物为HCl,其中H原子没有达到8电子稳定结构,B错误;Na为第3周期元素,在第3周期中,Na的最高价氧化物对应的水化物碱性最强,C正确;Na2O2中含共价键,D错误。
名师点睛
10.C 根据扇形元素周期表的一部分可知,1、2、3、4代表周期,最外周的汉字数字代表纵列,与常见元素周期表对照,由元素在周期表中的位置可知,①为H元素,②为Na元素,③为C元素,④为N元素,⑤为O元素,⑥为Mg元素,⑦为Al元素,⑧为S元素,⑨为Cl元素,⑩为Fe元素;②、⑧、⑨分别是Na、S、Cl元素,简单离子半径的大小顺序是S2->Cl->Na+,故A错误;⑥、⑦分别是Mg、Al,金属性Mg>Al,故B错误;元素⑩是铁元素,位于常见元素周期表第4周期Ⅷ族,故C正确;①分别与③、④、⑤形成的简单化合物为CH4、NH3、H2O,元素的非金属性越强,简单氢化物越稳定,非金属性:C
基础过关练
1.B 海带中含有的碘元素以碘化物的形式存在,A错误;溴易挥发,可鼓入热空气使溴挥发出来,B正确;氧化与富集均为海带提碘和海水提溴的关键步骤,C错误;碘的CCl4溶液为紫色,溴的CCl4溶液为橙红色,D错误。
2.A 热空气吹出溴单质,主要是利用了溴易挥发的性质,与空气中O2的氧化性无关,故A错误;热空气吹出的溴单质用SO2、H2O吸收,发生的主要反应的离子方程式为Br2+SO2+2H2O 4H++2Br-+S,故B正确;“氧化Ⅰ”得到的溶液中Br2的浓度不高,需要富集,即从“氧化Ⅰ”至“吸收”这几步操作的目的是富集Br元素,故C正确;“吸收”中发生的主要反应为Br2+SO2+2H2O 2HBr+H2SO4,“氧化Ⅱ”发生的反应为Cl2+2HBr Br2+2HCl,“氧化Ⅱ”后分离出的溶液X可循环使用,其中溶质主要为H2SO4和HCl,故D正确。
3.C H2O2具有氧化性,氧化步骤中氯水可用双氧水代替,故A正确;试剂X可以为浓NaOH溶液,反萃取涉及的离子方程式为3I2+6OH- 5I-+I+3H2O,故B正确;CCl4可循环利用,但与提高干海带提碘的产率无关,故C错误;操作Ⅰ为过滤,需要用到的玻璃仪器有漏斗、烧杯和玻璃棒,故D正确。
4.D 将海带灼烧成灰应该在坩埚中进行,A错误;过滤时应该用玻璃棒引流,B错误;碘的苯溶液密度小于水的密度,在上层,进行分液时,分液漏斗中的下层液体先从下口流出,再将上层液体从上口倒出,C错误;碘与苯互溶,二者沸点相差较大,分离碘并回收苯,可以进行蒸馏操作,D正确。
5.D 往分液漏斗内的溴水中加入CCl4,振荡、静置后进行分液,A正确;进行分液时,分液漏斗中的下层液体先从下口流出,再将上层液体从上口倒出,B正确;使用分液漏斗前,需检查是否漏液,所以萃取、分液前需对分液漏斗检漏,C正确;保持分液漏斗内外压强相等,才能使分液漏斗内的液体顺利流出,操作时,需将上面的塞子打开,或使磨口塞上的凹槽对准漏斗上的小孔,D错误。
能力提升练
1.AB 酒精和水可以以任意比例互溶,所以酒精不能作为碘的萃取剂,故A错误;四氯化碳密度比水大,萃取后四氯化碳层在下、水层在上,分液时水层从分液漏斗上口倒出,故B错误;水层中含有的碘离子和碘酸根离子在加入45%的硫酸溶液后,发生反应生成单质碘,离子方程式为6H++5I-+I 3I2↓+3H2O,故C正确;过滤操作需要的玻璃仪器有漏斗、烧杯和玻璃棒,故D正确。
2.D “氧化”和“转化”工序中Cl2的主要作用相同,都是将溴离子氧化生成溴单质,故A正确;根据流程图可知,还原时二氧化硫与R3N[ClBr2]反应生成硫酸、HBr、R3NCl,R3NCl再与HBr反应生成HCl和R3NBr,故水相Ⅱ中含H+和Cl-,故B正确;用盐酸洗脱R3NBr生成HBr和R3NCl,“洗脱”工序可完成R3NCl的再生,故C正确;保存液溴时加适量水的主要作用是防止溴单质挥发,故D错误。
3.C 由流程可知,海水浓缩、酸化后通入氯气发生反应:2Br-+Cl2 Br2+2Cl-,用热空气吹出溴,得到含有溴的空气,将含溴空气通入FeBr2溶液脱氯,再与Na2CO3溶液反应,Br2转化为Br和Br-,再用硫酸酸化,Br和Br-在酸性环境下反应生成Br2,经过一系列操作得到产品溴,据此分析解答。酸化海水通入Cl2,Cl2将溴离子氧化为溴单质,发生反应:Cl2+2Br- 2Cl-+Br2,故A正确;脱氯过程中可能发生反应:3Cl2+2FeBr2 2FeCl3+2Br2,此时脱除1 mol氯气消耗 mol FeBr2,故B正确;Na2CO3溶液吸收足量Br2蒸气,反应生成Br、Br-,HBrO3为强酸,故吸收足量溴蒸气,所得产物中的含碳粒子主要是CO2,故C错误;H2SO4酸化时发生反应:Br+5Br-+6H+ 3Br2+3H2O,反应中Br做氧化剂,Br-做还原剂,氧化剂和还原剂的物质的量之比为1∶5,故D正确。
4.CD 在方框表示的六个过程中有4个是氧化还原反应,只有“交换吸附”“NaCl洗脱(树脂再生)”不是氧化还原反应,故A错误;若H2O2过量,H2O2会将I-全部氧化生成I2,无法发生反应I2+I- ,从而导致后续反应无法进行,故B错误;“洗脱”过程涉及反应:3I2+6NaOH 5NaI+NaIO3+3H2O,生成的NaI和NaIO3的物质的量之比为5∶1,故C正确;“酸化氧化”过程若选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,该无色气体为NO,反应为2N+2I-+4H+ 2NO↑+I2+2H2O,n(NaNO2)∶n(NaI)=1∶1,质量之比为69∶150=23∶50,为使碘化钠充分反应,NaNO2和NaI的质量比应不小于,故D正确。
5.答案 (1)高 (2)热空气吹出 易挥发 温度过高,大量水蒸气随之蒸出,溴蒸气中水分增加;温度过低,溴的产率低 (3)富集(增大溶液中溴单质的浓度) 3Br2+6OH- 5Br-+Br+3H2O (4)饱和NaBr溶液 分液
解析 海水提盐后的苦卤中含有溴离子,通入氯气,将溴离子氧化为溴单质,用热空气吹出溴单质,再用氢氧化钠溶液吸收溴单质,吸收液中的溶质主要成分是NaBr、NaBrO3,向其中加入稀硫酸,发生反应:5Br-+Br+6H+ 3Br2+3H2O,反应生成了溴单质,得到溴水混合物,此时经过溴的富集,“溴水混合物”中溴的质量分数比“含Br2的海水”中溴的质量分数要高,经过蒸馏,得到溴蒸气,冷凝分离后得到液溴和粗溴水,粗溴水可以循环利用。(1)经上述分析知,经过溴的富集,第⑤步后的“溴水混合物”中溴的质量分数比“含Br2的海水”中溴的质量分数高。(2)步骤③是从含溴单质的海水中得到含溴单质的空气,又因为Br2易挥发,所以步骤③的操作是热空气吹出。温度过高,大量水蒸气排出,溴蒸气中水分增加,温度过低,溴的产率低,所以溴出口温度要控制在80~90 ℃,温度过高或过低都不利于生产。(3)步骤①②之后并未直接用含Br2的海水进行蒸馏得到液溴,主要是因为步骤②后“含Br2的海水”中溴的浓度低,蒸馏时会消耗大量能量,而经过步骤③④⑤富集溴后再蒸馏,消耗的能量低,步骤④⑤实际上是溴的富集过程,与直接蒸馏“含溴的海水”相比,富集后再蒸馏效率更高,消耗能量更少,成本更低。(4)因为还原性:Cl-
(2)紫红色(或紫色)
(3)a
(4)CCl4与水互不相溶且与水不反应,碘在CCl4中的溶解度比在水中大
(5)3I2+6OH- 5I-+INA
(6)升华法 a
解析 (1)灼烧需要在坩埚中进行,所以步骤①操作时,除需要酒精灯、三脚架、泥三角、玻璃棒外,还要用到的主要仪器是坩埚。
(2)四氯化碳密度大于水,在下层,则静置、分层后,下层溶液的颜色为紫红色或紫色。
(3)步骤④中的H2O2的作用为将碘离子氧化为碘单质,Cl2可将I-氧化为I2,Na2SO3、NaCl均不能氧化碘离子。
(4)萃取剂的选用原则为和原溶剂不互溶、不反应,且溶质在萃取剂中的溶解度大于原溶剂,所以步骤⑤中,选择用CCl4来萃取碘的理由为CCl4与水互不相溶且与水不反应,碘在CCl4中的溶解度比在水中大。
(5)碘在氢氧化钠溶液中发生反应的离子方程式为3I2+6OH- 5I-+I+3H2O,3 mol I2参加反应转移5 mol电子,所以每消耗1 mol I2转移电子数为NA。
(6)碘易升华,该装置对粗碘进行提纯采用的方法是升华法;为得到较多较高纯度的单质碘,需A容器中液体温度较低,故A容器中盛放的试剂可以为冷水。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
