2025鲁教版高中化学必修第二册强化练习题--专题强化练2 图像分析在化学反应速率及化学平衡中的应用
文档属性
| 名称 | 2025鲁教版高中化学必修第二册强化练习题--专题强化练2 图像分析在化学反应速率及化学平衡中的应用 |  | |
| 格式 | docx | ||
| 文件大小 | 669.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-19 16:21:41 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025鲁教版高中化学必修第二册
专题强化练2 图像分析在化学反应速率及化学平衡中的应用
1.在一定条件下,某可逆反应X2+Y2 2XY的正反应速率和逆反应速率随时间变化的曲线如图所示。下列有关说法正确的是( )
A.t1时刻,反应逆向进行
B.t2时刻,反应停止进行
C.t3时刻,反应已达该条件下的限度
D.t1~t2,反应物的量逐渐增多
2.(2024江苏苏州月考)向容积为1 L的恒容密闭容器中通入一定量N2O4和NO2的混合气体,发生反应N2O4(g) 2NO2(g)。体系中各物质浓度随时间的变化如图所示。
下列有关说法正确的是( )
A.64 s时,反应达到化学平衡状态
B.达到化学平衡前,混合气体的颜色逐渐变深
C.容器中气体的总物质的量浓度最多为2.6 mol·L-1
D.当容器内气体密度不再改变时,反应达到平衡状态
3.(不定项)(2024江西南昌期中)在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )
A.t1 min时容器内气体的总压强比t2 min时的大
B.t2 min时,v正=v逆
C.t3 min时,升高温度平衡状态会发生改变
D.t3 min时,容器中c(Cl2)=0.4 mol·L-1
4.一定温度下,在2 L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
A.a点时,v正(A) =v逆(A)
B.反应开始到5 min,B增加了0.2 mol
C.反应的化学方程式为3A 2B+C
D.反应开始到5 min,v(C) =0.04 mol·L-1·min-1
5.(2024湖南常德期中)在恒温恒容条件下,通入A(g)、B(g),发生反应2A(g)+xB(g) 2C(g),其中两种物质的浓度(c)随时间(t)的变化如图中曲线甲、乙所示,已知x为整数。下列说法正确的是( )
A.x=3
B.曲线乙表示的是物质A在反应过程中的浓度变化
C.10~30 min内v(C)=0.05 mol·L-1·min-1
D.c点对应物质的浓度与d点对应物质的浓度相等
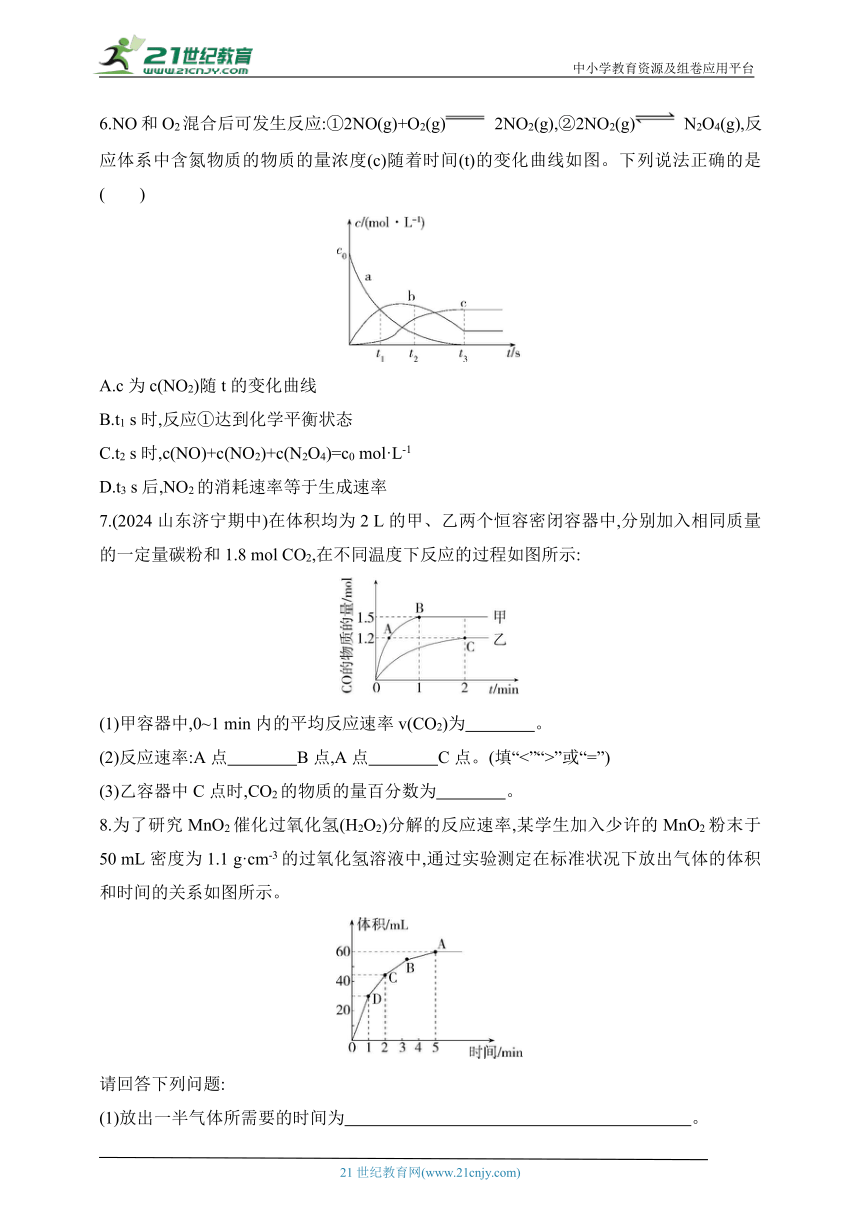
6.NO和O2混合后可发生反应:①2NO(g)+O2(g) 2NO2(g),②2NO2(g) N2O4(g),反应体系中含氮物质的物质的量浓度(c)随着时间(t)的变化曲线如图。下列说法正确的是( )
A.c为c(NO2)随t的变化曲线
B.t1 s时,反应①达到化学平衡状态
C.t2 s时,c(NO)+c(NO2)+c(N2O4)=c0 mol·L-1
D.t3 s后,NO2的消耗速率等于生成速率
7.(2024山东济宁期中)在体积均为2 L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量碳粉和1.8 mol CO2,在不同温度下反应的过程如图所示:
(1)甲容器中,0~1 min内的平均反应速率v(CO2)为 。
(2)反应速率:A点 B点,A点 C点。(填“<”“>”或“=”)
(3)乙容器中C点时,CO2的物质的量百分数为 。
8.为了研究MnO2催化过氧化氢(H2O2)分解的反应速率,某学生加入少许的MnO2粉末于50 mL密度为1.1 g·cm-3的过氧化氢溶液中,通过实验测定在标准状况下放出气体的体积和时间的关系如图所示。
请回答下列问题:
(1)放出一半气体所需要的时间为 。
(2)A、B、C、D各点反应速率大小的顺序是 。
(3)在5 min后,收集到的气体体积不再增加,原因是 。
(4)过氧化氢溶液的初始物质的量浓度为 。
9.(2024四川甘孜期中)某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
根据上图回答下列问题:
(1)该反应的化学方程式为 。
(2)反应开始至2 min,以气体Z表示的平均反应速率为 ;1 min时,正反应速率 (填“>”“<”或“=”)逆反应速率;X(g)的平衡转化率为 。
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的是 。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X)∶v(Y)=3∶1
A.①②⑤ B.①③④
C.②③④ D.③④⑤
(4)反应开始至2 min,以气体X表示的平均反应速率为 。
微项目 研究车用燃料及安全气囊
基础过关练
1.(2024山东日照实验高中开学考试)下列关于车用燃料及安全气囊的说法正确的是( )
A.选择车用燃料时,应选择热值高且燃点非常低的燃料
B.汽车排气系统使用三元催化器可使氮氧化物完全转化为无害气体
C.已知氮气分子非常稳定,所以2NaN3 2Na+3N2↑为吸热反应
D.甲醇可作新能源汽车燃料,完全燃烧等质量的甲醇和乙醇,甲醇的耗氧量低
2.(2023山东枣庄八中月考)汽车安全气囊内的气体发生剂主要是叠氮化钠(NaN3)、Fe2O3等物质。下列说法错误的是( )
A.强烈碰撞时,NaN3分解产生N2和Na的化学方程式是2NaN3 2Na+3N2↑
B.叠氮化钠中含有离子键和共价键
C.N2的电子式为··N N··
D.Fe2O3中O元素位于周期表ⅥA族、Fe元素位于ⅦB族
3.(2024福建龙岩阶段练习)汽车尾气已成为城市空气的污染源之一。SCR技术利用尿素[CO(NH2)2]水溶液转化NOx的示意图如下。下列说法错误的是( )
A.尿素水溶液“热分解”产生NH3的化学方程式为CO(NH2)2+H2O CO2↑+2NH3↑
B.SCR催化转化器中发生反应的NOx与NH3的物质的量之比为3∶2x
C.SCR催化转化器温度较高时一定会减弱汽车尾气转化的效果
D.SCR技术可以缓解光化学烟雾、酸雨、雾霾等环境问题
4.(2024安徽合肥六校联盟期中)三元催化器是重要的汽车尾气净化装置,其工作原理如图所示。下列说法错误的是( )
A.Pd、Rh、Pt能加快反应速率
B.三元催化器的使用可以减少光化学烟雾的产生
C.催化转化反应中,NOx、CO、碳氢化合物均做还原剂
D.该催化转化器中可能发生反应2NO+2CO N2+2CO2
5.汽车尾气中含有CO、NO等有害气体,两者在密闭容器中能发生反应2NO(g)+2CO(g) 2CO2(g)+N2(g)。为了验证温度对化学反应速率的影响,某同学设计了两组实验,如表所示,280 ℃的情况下,反应5 min后NO的浓度为8×10-4 mol/L。下列说法不正确的是( )
实验编号 Ⅰ Ⅱ
温度/℃ 280 350
NO的初始浓度/(mol/L) 1.2×10-3 a
CO的初始浓度/(mol/L) 5.80×10-3 5.80×10-3
催化剂的比表面积/(m2/g) 82 82
A.表中a为1.2 ×10-3
B.280 ℃时,前5 min内,用N2表示的平均反应速率为4×10-5 mol/(L·min)
C.若2v逆(NO)=v正(N2),说明反应已达到平衡状态
D.280 ℃时,5 min 时NO的转化率为33.3%
能力提升练
(经典题)化学在生产生活中无处不在。
(1)某汽车安全气囊的气体发生剂主要含有叠氮化钠(NaN3)、Fe2O3、NH4NO3等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
①NaN3是 (填“离子”或“共价”)化合物。
②汽车受到猛烈碰撞时,点火器点火引发NaN3迅速分解,生成氮气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是 (填字母)。
(2)以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键断裂时的能量变化如图所示。
①上述过程中,能量的转化形式是由 转化为化学能;
②根据数据计算,分解1 mol CO2需 (填“吸收”或“释放”) kJ的能量。
(3)一定条件下,在2 L密闭容器内,发生反应2NO2(g) N2O4(g),n(NO2)随时间变化如表:
时间/s n(NO2)/mol
0 0.040
1 0.020
2 0.010
3 0.005
4 0.005
5 0.005
①0~2 s内用N2O4表示该反应的平均速率为 。
②前2 s内,NO2的转化率为 。
(4)在恒温、恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的是 (填字母)。
A.反应速率v(NH3)=v(N2)
B.容器内压强不再随时间而发生变化
C.容器内N2的物质的量分数不再随时间而发生变化
D.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图。
图中b点对应的速率关系是v正 v逆(填“>”“<”或“=”,下同),d点对应的速率关系是v正 v逆。
答案与分层梯度式解析
专题强化练2 图像分析在化学反应速率及化学平衡中的应用
1.C t1时刻,正反应速率大于逆反应速率,反应正向进行,故A错误;t2时刻,反应达到平衡状态,正、逆反应速率相等且不等于0,反应没有停止进行,故B错误;t3时刻,反应达到平衡状态,反应已达该条件下的限度,故C正确;t1~t2,反应正向进行,反应物的量逐渐减少,故D错误。
2.B 由题图可知,64 s后NO2和N2O4的浓度依然发生改变,说明64 s时正、逆反应速率不相等,反应未达到化学平衡状态,A错误;NO2为红棕色气体,N2O4为无色气体,由题图可看出,随着反应的进行,NO2的浓度增大直至达到化学平衡状态,则达到化学平衡前,混合气体的颜色逐渐变深,B正确;可逆反应不能进行到底,容器内气体的总物质的量浓度不可能为2.6 mol·L-1,C错误;该反应反应前后密度一直不变,密度不变不能作为判断反应达到平衡状态的标志,D错误。
3.AC 该反应反应前后气体分子数减小,t1 min时气体总分子数较t2 min时多,故在恒温恒容密闭容器内,t1 min时气体的总压强比t2 min时的大,A项正确;t2 min时,反应还没有达到平衡状态,v正、v逆不相等,B项错误;t3 min时HCl和O2物质的量均不再发生变化,已经达到平衡状态,此时升高温度,平衡被破坏,一段时间后达到新的平衡,故升温平衡状态会发生改变,C项正确;t3 min时,容器中Δc(O2)==0.1 mol/L,则c(Cl2)=0.2 mol·L-1,D项错误。
名师点睛 恒温恒容条件下,气体总的物质的量之比等于压强之比。
4.C 由图可知,a点时,反应正向进行,v正(A)>v逆(A),故A错误;反应开始到5 min,B的物质的量由0变为0.4 mol,增加了0.4 mol,故B错误;反应从开始到达到化学平衡时,A的物质的量由0.8 mol减少到0.2 mol,变化量为0.6 mol,A为反应物,B的物质的量由0增加到0.4 mol,变化量为0.4 mol,C的物质的量由0增加到0.2 mol,变化量为0.2 mol,B、C为生成物,Δn(A)∶Δn(B) ∶Δn(C) =0.6 mol∶0.4 mol∶0.2 mol=3∶2∶1,所以反应的化学方程式为3A 2B+C,故C正确;反应开始到5 min,Δn(C)=0.2 mol,v(C) ==0.02 mol·L-1·min-1,故D错误。
5.A 随着反应进行,c(A)、c(B)都减小,c(C)增大,所以乙表示c(C)的变化;浓度变化量之比等于方程式中对应物质的化学计量数之比,反应从开始到第60 min,Δc(甲)=(3-0.6) mol·L-1=2.4 mol·L-1,Δc(乙)=1.6 mol·L-1,可知Δc(甲)∶Δc(乙)=2.4∶1.6=3∶2,所以甲表示c(B)的变化。3∶2=x∶2,x=3,故A正确;曲线乙表示的是物质C在反应过程中的浓度变化,故B错误;10~30 min内,Δc(B)=(2-1) mol·L-1=1 mol·L-1,v(B)==0.05 mol·L-1·min-1,则v(C)=×0.05 mol·L-1·min-1,故C错误;由图可知c点对应物质的浓度为1.6 mol·L-1,d点对应物质的浓度为0.6 mol·L-1,故D错误。
6.D 由题干信息可知,NO和O2混合后可发生反应:①2NO(g)+O2(g) 2NO2(g),②2NO2(g) N2O4(g),随着反应的进行NO2的浓度先增大后变小,最后达到平衡保持不变,所以a为c(NO)随t的变化曲线,b为c(NO2)随t的变化曲线,c为c(N2O4)随t的变化曲线,故A错误;t1 s时,c(NO)=c(NO2),但反应①不是可逆反应,不存在化学平衡状态,故B错误;若容器的容积保持不变,则根据N原子守恒可知,t2 s时有c(NO)+c(NO2)+2c(N2O4)=c0 mol·L-1,故C错误;由图像可知t3 s后,NO2、N2O4的浓度不再发生改变,说明反应达到平衡状态,所以NO2的消耗速率等于生成速率,故D正确。
7.答案 (1)0.375 mol/(L·min) (2)> > (3)50%
解析 (1)甲容器中,0~1 min内生成1.5 mol CO,则消耗了0.75 mol CO2,该时间段内的平均反应速率v(CO2)==0.375 mol/(L·min)。(2)A点斜率大于B点斜率,则反应速率A点>B点,甲容器首先达到平衡状态,说明反应速率快,温度高,乙容器温度低,A点和C点CO的物质的量相等,所以反应速率A点>C点。(3)乙容器中C点时生成1.2 mol CO,则消耗0.6 mol CO2,剩余1.2 mol CO2,CO2的物质的量百分数为×100%=50%。
8.答案 (1)1 min (2)D>C>B>A (3)过氧化氢已完全分解 (4)0.11 mol·L-1
解析 (1)由题图可知,放出一半气体所需要的时间为1 min。(2)由题图知A、B、C、D各点反应速率大小的顺序是D>C>B>A。(3)该反应为不可逆反应,在5 min后,收集到的气体体积不再增加,说明过氧化氢已完全分解。(4)由题中图像可知,生成氧气的体积为60 mL。
2H2O2 2H2O+O2↑
2 mol 22.4 L
n(H2O2) 0.06 L
n(H2O2)=≈0.005 36 mol,所以c(H2O2)=≈0.11 mol·L-1。
9.答案 (1)3X+Y 2Z
(2)0.05 mol/(L·min) > 30%
(3)B
(4)0.075 mol/(L·min)
解析 (1)由题图知,反应物为X和Y,生成物为Z,2 min后各组分的物质的量不再改变,所以该反应为可逆反应,0~2 min内,X、Y、Z物质的量变化量分别为0.3 mol、0.1 mol、0.2 mol,在化学方程式中X、Y、Z的化学计量数分别为3、1、2,故反应的化学方程式为3X+Y 2Z。(2)由题图知,反应开始至2 min,以气体Z表示的平均反应速率为v(Z)==0.05 mol/(L·min);1 min时,反应还在向正向进行,故正反应速率>逆反应速率;X(g)的平衡转化率为×100%=30%。(3)①恒温恒容条件下,该反应为反应前后气体体积减小的反应,所以其总压强不再变化可以作为判断反应达平衡状态的标志,正确;②组分均为气体,反应前后气体的总质量不变,恒容体系,体积不变,所以混合气体的密度不变不能作为反应达平衡状态的标志;③X的百分含量不再变化时,反应达到平衡状态;④反应前后气体总质量不变,总物质的量为变量,所以当混合气体的平均相对分子质量不再变化时,反应达到平衡状态;⑤v(X)∶v(Y)=3∶1,未指明正、逆反应,所以不能判断是否达平衡状态;故选B项。(4)反应开始至2 min,以气体X表示的平均反应速率为v(X)==0.075 mol/(L·min)。
微项目 研究车用燃料及安全气囊
基础过关练
1.D 燃点越低,越易燃烧,不安全,所以不能选择燃点非常低的燃料,A项错误;汽车排气系统使用三元催化器可使氮氧化物转化为无害气体,但由于是可逆反应,故不能完全转化,B项错误;该反应为放热反应,C项错误;2CH3OH+3O22CO2+4H2O
64 g 3 mol、CH3CH2OH+3O2 2CO2+3H2O
46 g 3 mol,由反应的化学方程式可知,完全燃烧等质量的甲醇和乙醇,甲醇的耗氧量低,D项正确。
2.D 汽车受到强烈碰撞时,NaN3迅速分解产生钠和氮气,化学方程式为2NaN3 2Na+3N2↑,故A正确;叠氮化钠中钠离子与叠氮离子间是离子键,叠氮离子内部氮原子间是共价键,故B正确;N2的电子式为··NN··,故C正确;Fe2O3中O元素位于周期表ⅥA族、Fe元素位于Ⅷ族,故D错误。
3.C 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,反应的化学方程式为CO(NH2)2+H2O CO2↑+2NH3↑,故A正确;NOx与NH3反应的化学方程式为3NOx+2xNH3 N2+3xH2O,发生反应的NOx与NH3的物质的量之比为3∶2x,故B正确;由于不知道该反应的催化剂的活性温度,无法判断温度较高时是否会影响尾气的转化效果,故C错误;该技术可以处理氮氧化物,可以缓解光化学烟雾、酸雨、雾霾等环境问题,故D正确。
4.C 根据工作原理图可知,Pd、Rh、Pt作为催化剂,能加快反应速率,故A正确;氮氧化物在三元催化器的作用下转化为氮气,可减少光化学烟雾的产生,故B正确;催化转化反应中,NOx中的N元素化合价降低,做氧化剂,CO、碳氢化合物中C元素化合价升高,做还原剂,故C错误;NOx可能为NO、NO2,所以该催化转化器中可能发生反应2NO+2CO N2+2CO2,故D正确。
5.C 根据实验目的“验证温度对化学反应速率的影响”,可知实验Ⅰ、Ⅱ除温度外,其他外界条件都应该相同,所以题表中a为1.2 ×10-3,故A正确;反应开始时NO的浓度为1.2×10-3 mol/L,反应5 min后NO的浓度为8×10-4 mol/L,Δc(NO)=4×10-4 mol/L,Δc(N2)=Δc(NO)=2×10-4 mol/L,所以用N2表示的平均反应速率v(N2)==4×10-5 mol/(L· min),故B正确;若2v逆(NO)=v正(N2),则正、逆反应速率不相等,反应未达到平衡状态,故C不正确;5 min 时NO的转化率为×100%≈33.3%,故D正确。
能力提升练
答案 (1)①离子 ②A
(2)①光能和热能 ②吸收 278
(3)①0.003 75 mol·L-1·s-1 ②75%
(4)①BC ②> =
解析 (1)①NaN3由Na+和构成,属于离子化合物。②由“NaN3迅速分解,生成氮气和金属钠,同时释放大量的热”可知,NaN3的分解为放热反应,即反应物的总能量大于生成物的总能量,故选A。
(2)①题图中以TiO2为催化剂,光和热条件下分解CO2反应生成CO和O2,根据能量守恒定律知,该反应中,光能和热能转化为化学能。②断裂化学键需要吸收能量,形成化学键释放能量,CO2分解为吸热反应,所以分解1 mol CO2需要吸收的能量为1 598 kJ-1 072 kJ-=278 kJ。
(3)①开始n(NO2)=0.040 mol,2 s时,n(NO2)=0.010 mol,v(NO2)==0.007 5 mol·L-1·s-1,v(N2O4)=×0.007 5 mol·L-1·s-1=0.003 75 mol·L-1·s-1。②2 s时,n(NO2)=0.010 mol,前2 s内NO2的转化率=×100%=75%。
(4)①A项,未指明反应的方向;B项,该反应的正反应是气体体积增大的可逆反应,容器内压强不随时间的变化而变化,能说明反应达到平衡状态;C项,容器内N2的物质的量分数不再随时间而发生变化说明各气体的浓度不再改变,说明反应已达平衡状态;D项,容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6不能说明正、逆反应速率相等,不能说明反应达到平衡状态;故选BC。②图中b点后NO继续减少,N2继续增多,所以b点对应的速率关系是v正>v逆;d点,反应已经达到化学平衡,此时v正与v逆相等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁教版高中化学必修第二册
专题强化练2 图像分析在化学反应速率及化学平衡中的应用
1.在一定条件下,某可逆反应X2+Y2 2XY的正反应速率和逆反应速率随时间变化的曲线如图所示。下列有关说法正确的是( )
A.t1时刻,反应逆向进行
B.t2时刻,反应停止进行
C.t3时刻,反应已达该条件下的限度
D.t1~t2,反应物的量逐渐增多
2.(2024江苏苏州月考)向容积为1 L的恒容密闭容器中通入一定量N2O4和NO2的混合气体,发生反应N2O4(g) 2NO2(g)。体系中各物质浓度随时间的变化如图所示。
下列有关说法正确的是( )
A.64 s时,反应达到化学平衡状态
B.达到化学平衡前,混合气体的颜色逐渐变深
C.容器中气体的总物质的量浓度最多为2.6 mol·L-1
D.当容器内气体密度不再改变时,反应达到平衡状态
3.(不定项)(2024江西南昌期中)在2.0 L恒温恒容密闭容器中充入1.0 mol HCl和0.3 mol O2,加入催化剂发生反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),HCl、O2的物质的量随时间的变化曲线如图所示。下列说法正确的是( )
A.t1 min时容器内气体的总压强比t2 min时的大
B.t2 min时,v正=v逆
C.t3 min时,升高温度平衡状态会发生改变
D.t3 min时,容器中c(Cl2)=0.4 mol·L-1
4.一定温度下,在2 L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
A.a点时,v正(A) =v逆(A)
B.反应开始到5 min,B增加了0.2 mol
C.反应的化学方程式为3A 2B+C
D.反应开始到5 min,v(C) =0.04 mol·L-1·min-1
5.(2024湖南常德期中)在恒温恒容条件下,通入A(g)、B(g),发生反应2A(g)+xB(g) 2C(g),其中两种物质的浓度(c)随时间(t)的变化如图中曲线甲、乙所示,已知x为整数。下列说法正确的是( )
A.x=3
B.曲线乙表示的是物质A在反应过程中的浓度变化
C.10~30 min内v(C)=0.05 mol·L-1·min-1
D.c点对应物质的浓度与d点对应物质的浓度相等
6.NO和O2混合后可发生反应:①2NO(g)+O2(g) 2NO2(g),②2NO2(g) N2O4(g),反应体系中含氮物质的物质的量浓度(c)随着时间(t)的变化曲线如图。下列说法正确的是( )
A.c为c(NO2)随t的变化曲线
B.t1 s时,反应①达到化学平衡状态
C.t2 s时,c(NO)+c(NO2)+c(N2O4)=c0 mol·L-1
D.t3 s后,NO2的消耗速率等于生成速率
7.(2024山东济宁期中)在体积均为2 L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量碳粉和1.8 mol CO2,在不同温度下反应的过程如图所示:
(1)甲容器中,0~1 min内的平均反应速率v(CO2)为 。
(2)反应速率:A点 B点,A点 C点。(填“<”“>”或“=”)
(3)乙容器中C点时,CO2的物质的量百分数为 。
8.为了研究MnO2催化过氧化氢(H2O2)分解的反应速率,某学生加入少许的MnO2粉末于50 mL密度为1.1 g·cm-3的过氧化氢溶液中,通过实验测定在标准状况下放出气体的体积和时间的关系如图所示。
请回答下列问题:
(1)放出一半气体所需要的时间为 。
(2)A、B、C、D各点反应速率大小的顺序是 。
(3)在5 min后,收集到的气体体积不再增加,原因是 。
(4)过氧化氢溶液的初始物质的量浓度为 。
9.(2024四川甘孜期中)某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
根据上图回答下列问题:
(1)该反应的化学方程式为 。
(2)反应开始至2 min,以气体Z表示的平均反应速率为 ;1 min时,正反应速率 (填“>”“<”或“=”)逆反应速率;X(g)的平衡转化率为 。
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的是 。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X)∶v(Y)=3∶1
A.①②⑤ B.①③④
C.②③④ D.③④⑤
(4)反应开始至2 min,以气体X表示的平均反应速率为 。
微项目 研究车用燃料及安全气囊
基础过关练
1.(2024山东日照实验高中开学考试)下列关于车用燃料及安全气囊的说法正确的是( )
A.选择车用燃料时,应选择热值高且燃点非常低的燃料
B.汽车排气系统使用三元催化器可使氮氧化物完全转化为无害气体
C.已知氮气分子非常稳定,所以2NaN3 2Na+3N2↑为吸热反应
D.甲醇可作新能源汽车燃料,完全燃烧等质量的甲醇和乙醇,甲醇的耗氧量低
2.(2023山东枣庄八中月考)汽车安全气囊内的气体发生剂主要是叠氮化钠(NaN3)、Fe2O3等物质。下列说法错误的是( )
A.强烈碰撞时,NaN3分解产生N2和Na的化学方程式是2NaN3 2Na+3N2↑
B.叠氮化钠中含有离子键和共价键
C.N2的电子式为··N N··
D.Fe2O3中O元素位于周期表ⅥA族、Fe元素位于ⅦB族
3.(2024福建龙岩阶段练习)汽车尾气已成为城市空气的污染源之一。SCR技术利用尿素[CO(NH2)2]水溶液转化NOx的示意图如下。下列说法错误的是( )
A.尿素水溶液“热分解”产生NH3的化学方程式为CO(NH2)2+H2O CO2↑+2NH3↑
B.SCR催化转化器中发生反应的NOx与NH3的物质的量之比为3∶2x
C.SCR催化转化器温度较高时一定会减弱汽车尾气转化的效果
D.SCR技术可以缓解光化学烟雾、酸雨、雾霾等环境问题
4.(2024安徽合肥六校联盟期中)三元催化器是重要的汽车尾气净化装置,其工作原理如图所示。下列说法错误的是( )
A.Pd、Rh、Pt能加快反应速率
B.三元催化器的使用可以减少光化学烟雾的产生
C.催化转化反应中,NOx、CO、碳氢化合物均做还原剂
D.该催化转化器中可能发生反应2NO+2CO N2+2CO2
5.汽车尾气中含有CO、NO等有害气体,两者在密闭容器中能发生反应2NO(g)+2CO(g) 2CO2(g)+N2(g)。为了验证温度对化学反应速率的影响,某同学设计了两组实验,如表所示,280 ℃的情况下,反应5 min后NO的浓度为8×10-4 mol/L。下列说法不正确的是( )
实验编号 Ⅰ Ⅱ
温度/℃ 280 350
NO的初始浓度/(mol/L) 1.2×10-3 a
CO的初始浓度/(mol/L) 5.80×10-3 5.80×10-3
催化剂的比表面积/(m2/g) 82 82
A.表中a为1.2 ×10-3
B.280 ℃时,前5 min内,用N2表示的平均反应速率为4×10-5 mol/(L·min)
C.若2v逆(NO)=v正(N2),说明反应已达到平衡状态
D.280 ℃时,5 min 时NO的转化率为33.3%
能力提升练
(经典题)化学在生产生活中无处不在。
(1)某汽车安全气囊的气体发生剂主要含有叠氮化钠(NaN3)、Fe2O3、NH4NO3等物质。当汽车发生碰撞时,气体发生剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
①NaN3是 (填“离子”或“共价”)化合物。
②汽车受到猛烈碰撞时,点火器点火引发NaN3迅速分解,生成氮气和金属钠,同时释放大量的热,关于该反应过程中的能量变化示意图正确的是 (填字母)。
(2)以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键断裂时的能量变化如图所示。
①上述过程中,能量的转化形式是由 转化为化学能;
②根据数据计算,分解1 mol CO2需 (填“吸收”或“释放”) kJ的能量。
(3)一定条件下,在2 L密闭容器内,发生反应2NO2(g) N2O4(g),n(NO2)随时间变化如表:
时间/s n(NO2)/mol
0 0.040
1 0.020
2 0.010
3 0.005
4 0.005
5 0.005
①0~2 s内用N2O4表示该反应的平均速率为 。
②前2 s内,NO2的转化率为 。
(4)在恒温、恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的是 (填字母)。
A.反应速率v(NH3)=v(N2)
B.容器内压强不再随时间而发生变化
C.容器内N2的物质的量分数不再随时间而发生变化
D.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图。
图中b点对应的速率关系是v正 v逆(填“>”“<”或“=”,下同),d点对应的速率关系是v正 v逆。
答案与分层梯度式解析
专题强化练2 图像分析在化学反应速率及化学平衡中的应用
1.C t1时刻,正反应速率大于逆反应速率,反应正向进行,故A错误;t2时刻,反应达到平衡状态,正、逆反应速率相等且不等于0,反应没有停止进行,故B错误;t3时刻,反应达到平衡状态,反应已达该条件下的限度,故C正确;t1~t2,反应正向进行,反应物的量逐渐减少,故D错误。
2.B 由题图可知,64 s后NO2和N2O4的浓度依然发生改变,说明64 s时正、逆反应速率不相等,反应未达到化学平衡状态,A错误;NO2为红棕色气体,N2O4为无色气体,由题图可看出,随着反应的进行,NO2的浓度增大直至达到化学平衡状态,则达到化学平衡前,混合气体的颜色逐渐变深,B正确;可逆反应不能进行到底,容器内气体的总物质的量浓度不可能为2.6 mol·L-1,C错误;该反应反应前后密度一直不变,密度不变不能作为判断反应达到平衡状态的标志,D错误。
3.AC 该反应反应前后气体分子数减小,t1 min时气体总分子数较t2 min时多,故在恒温恒容密闭容器内,t1 min时气体的总压强比t2 min时的大,A项正确;t2 min时,反应还没有达到平衡状态,v正、v逆不相等,B项错误;t3 min时HCl和O2物质的量均不再发生变化,已经达到平衡状态,此时升高温度,平衡被破坏,一段时间后达到新的平衡,故升温平衡状态会发生改变,C项正确;t3 min时,容器中Δc(O2)==0.1 mol/L,则c(Cl2)=0.2 mol·L-1,D项错误。
名师点睛 恒温恒容条件下,气体总的物质的量之比等于压强之比。
4.C 由图可知,a点时,反应正向进行,v正(A)>v逆(A),故A错误;反应开始到5 min,B的物质的量由0变为0.4 mol,增加了0.4 mol,故B错误;反应从开始到达到化学平衡时,A的物质的量由0.8 mol减少到0.2 mol,变化量为0.6 mol,A为反应物,B的物质的量由0增加到0.4 mol,变化量为0.4 mol,C的物质的量由0增加到0.2 mol,变化量为0.2 mol,B、C为生成物,Δn(A)∶Δn(B) ∶Δn(C) =0.6 mol∶0.4 mol∶0.2 mol=3∶2∶1,所以反应的化学方程式为3A 2B+C,故C正确;反应开始到5 min,Δn(C)=0.2 mol,v(C) ==0.02 mol·L-1·min-1,故D错误。
5.A 随着反应进行,c(A)、c(B)都减小,c(C)增大,所以乙表示c(C)的变化;浓度变化量之比等于方程式中对应物质的化学计量数之比,反应从开始到第60 min,Δc(甲)=(3-0.6) mol·L-1=2.4 mol·L-1,Δc(乙)=1.6 mol·L-1,可知Δc(甲)∶Δc(乙)=2.4∶1.6=3∶2,所以甲表示c(B)的变化。3∶2=x∶2,x=3,故A正确;曲线乙表示的是物质C在反应过程中的浓度变化,故B错误;10~30 min内,Δc(B)=(2-1) mol·L-1=1 mol·L-1,v(B)==0.05 mol·L-1·min-1,则v(C)=×0.05 mol·L-1·min-1,故C错误;由图可知c点对应物质的浓度为1.6 mol·L-1,d点对应物质的浓度为0.6 mol·L-1,故D错误。
6.D 由题干信息可知,NO和O2混合后可发生反应:①2NO(g)+O2(g) 2NO2(g),②2NO2(g) N2O4(g),随着反应的进行NO2的浓度先增大后变小,最后达到平衡保持不变,所以a为c(NO)随t的变化曲线,b为c(NO2)随t的变化曲线,c为c(N2O4)随t的变化曲线,故A错误;t1 s时,c(NO)=c(NO2),但反应①不是可逆反应,不存在化学平衡状态,故B错误;若容器的容积保持不变,则根据N原子守恒可知,t2 s时有c(NO)+c(NO2)+2c(N2O4)=c0 mol·L-1,故C错误;由图像可知t3 s后,NO2、N2O4的浓度不再发生改变,说明反应达到平衡状态,所以NO2的消耗速率等于生成速率,故D正确。
7.答案 (1)0.375 mol/(L·min) (2)> > (3)50%
解析 (1)甲容器中,0~1 min内生成1.5 mol CO,则消耗了0.75 mol CO2,该时间段内的平均反应速率v(CO2)==0.375 mol/(L·min)。(2)A点斜率大于B点斜率,则反应速率A点>B点,甲容器首先达到平衡状态,说明反应速率快,温度高,乙容器温度低,A点和C点CO的物质的量相等,所以反应速率A点>C点。(3)乙容器中C点时生成1.2 mol CO,则消耗0.6 mol CO2,剩余1.2 mol CO2,CO2的物质的量百分数为×100%=50%。
8.答案 (1)1 min (2)D>C>B>A (3)过氧化氢已完全分解 (4)0.11 mol·L-1
解析 (1)由题图可知,放出一半气体所需要的时间为1 min。(2)由题图知A、B、C、D各点反应速率大小的顺序是D>C>B>A。(3)该反应为不可逆反应,在5 min后,收集到的气体体积不再增加,说明过氧化氢已完全分解。(4)由题中图像可知,生成氧气的体积为60 mL。
2H2O2 2H2O+O2↑
2 mol 22.4 L
n(H2O2) 0.06 L
n(H2O2)=≈0.005 36 mol,所以c(H2O2)=≈0.11 mol·L-1。
9.答案 (1)3X+Y 2Z
(2)0.05 mol/(L·min) > 30%
(3)B
(4)0.075 mol/(L·min)
解析 (1)由题图知,反应物为X和Y,生成物为Z,2 min后各组分的物质的量不再改变,所以该反应为可逆反应,0~2 min内,X、Y、Z物质的量变化量分别为0.3 mol、0.1 mol、0.2 mol,在化学方程式中X、Y、Z的化学计量数分别为3、1、2,故反应的化学方程式为3X+Y 2Z。(2)由题图知,反应开始至2 min,以气体Z表示的平均反应速率为v(Z)==0.05 mol/(L·min);1 min时,反应还在向正向进行,故正反应速率>逆反应速率;X(g)的平衡转化率为×100%=30%。(3)①恒温恒容条件下,该反应为反应前后气体体积减小的反应,所以其总压强不再变化可以作为判断反应达平衡状态的标志,正确;②组分均为气体,反应前后气体的总质量不变,恒容体系,体积不变,所以混合气体的密度不变不能作为反应达平衡状态的标志;③X的百分含量不再变化时,反应达到平衡状态;④反应前后气体总质量不变,总物质的量为变量,所以当混合气体的平均相对分子质量不再变化时,反应达到平衡状态;⑤v(X)∶v(Y)=3∶1,未指明正、逆反应,所以不能判断是否达平衡状态;故选B项。(4)反应开始至2 min,以气体X表示的平均反应速率为v(X)==0.075 mol/(L·min)。
微项目 研究车用燃料及安全气囊
基础过关练
1.D 燃点越低,越易燃烧,不安全,所以不能选择燃点非常低的燃料,A项错误;汽车排气系统使用三元催化器可使氮氧化物转化为无害气体,但由于是可逆反应,故不能完全转化,B项错误;该反应为放热反应,C项错误;2CH3OH+3O22CO2+4H2O
64 g 3 mol、CH3CH2OH+3O2 2CO2+3H2O
46 g 3 mol,由反应的化学方程式可知,完全燃烧等质量的甲醇和乙醇,甲醇的耗氧量低,D项正确。
2.D 汽车受到强烈碰撞时,NaN3迅速分解产生钠和氮气,化学方程式为2NaN3 2Na+3N2↑,故A正确;叠氮化钠中钠离子与叠氮离子间是离子键,叠氮离子内部氮原子间是共价键,故B正确;N2的电子式为··NN··,故C正确;Fe2O3中O元素位于周期表ⅥA族、Fe元素位于Ⅷ族,故D错误。
3.C 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,反应的化学方程式为CO(NH2)2+H2O CO2↑+2NH3↑,故A正确;NOx与NH3反应的化学方程式为3NOx+2xNH3 N2+3xH2O,发生反应的NOx与NH3的物质的量之比为3∶2x,故B正确;由于不知道该反应的催化剂的活性温度,无法判断温度较高时是否会影响尾气的转化效果,故C错误;该技术可以处理氮氧化物,可以缓解光化学烟雾、酸雨、雾霾等环境问题,故D正确。
4.C 根据工作原理图可知,Pd、Rh、Pt作为催化剂,能加快反应速率,故A正确;氮氧化物在三元催化器的作用下转化为氮气,可减少光化学烟雾的产生,故B正确;催化转化反应中,NOx中的N元素化合价降低,做氧化剂,CO、碳氢化合物中C元素化合价升高,做还原剂,故C错误;NOx可能为NO、NO2,所以该催化转化器中可能发生反应2NO+2CO N2+2CO2,故D正确。
5.C 根据实验目的“验证温度对化学反应速率的影响”,可知实验Ⅰ、Ⅱ除温度外,其他外界条件都应该相同,所以题表中a为1.2 ×10-3,故A正确;反应开始时NO的浓度为1.2×10-3 mol/L,反应5 min后NO的浓度为8×10-4 mol/L,Δc(NO)=4×10-4 mol/L,Δc(N2)=Δc(NO)=2×10-4 mol/L,所以用N2表示的平均反应速率v(N2)==4×10-5 mol/(L· min),故B正确;若2v逆(NO)=v正(N2),则正、逆反应速率不相等,反应未达到平衡状态,故C不正确;5 min 时NO的转化率为×100%≈33.3%,故D正确。
能力提升练
答案 (1)①离子 ②A
(2)①光能和热能 ②吸收 278
(3)①0.003 75 mol·L-1·s-1 ②75%
(4)①BC ②> =
解析 (1)①NaN3由Na+和构成,属于离子化合物。②由“NaN3迅速分解,生成氮气和金属钠,同时释放大量的热”可知,NaN3的分解为放热反应,即反应物的总能量大于生成物的总能量,故选A。
(2)①题图中以TiO2为催化剂,光和热条件下分解CO2反应生成CO和O2,根据能量守恒定律知,该反应中,光能和热能转化为化学能。②断裂化学键需要吸收能量,形成化学键释放能量,CO2分解为吸热反应,所以分解1 mol CO2需要吸收的能量为1 598 kJ-1 072 kJ-=278 kJ。
(3)①开始n(NO2)=0.040 mol,2 s时,n(NO2)=0.010 mol,v(NO2)==0.007 5 mol·L-1·s-1,v(N2O4)=×0.007 5 mol·L-1·s-1=0.003 75 mol·L-1·s-1。②2 s时,n(NO2)=0.010 mol,前2 s内NO2的转化率=×100%=75%。
(4)①A项,未指明反应的方向;B项,该反应的正反应是气体体积增大的可逆反应,容器内压强不随时间的变化而变化,能说明反应达到平衡状态;C项,容器内N2的物质的量分数不再随时间而发生变化说明各气体的浓度不再改变,说明反应已达平衡状态;D项,容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6不能说明正、逆反应速率相等,不能说明反应达到平衡状态;故选BC。②图中b点后NO继续减少,N2继续增多,所以b点对应的速率关系是v正>v逆;d点,反应已经达到化学平衡,此时v正与v逆相等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
