2025鲁教版高中化学必修第二册强化练习题--第1章 原子结构 元素周期律(含答案)
文档属性
| 名称 | 2025鲁教版高中化学必修第二册强化练习题--第1章 原子结构 元素周期律(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 502.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-19 16:30:21 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁教版高中化学必修第二册
第1章 原子结构 元素周期律
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生产、生活、社会发展息息相关,下列说法错误的是( )
A.门捷列夫发现元素周期律并编制了第一张元素周期表,使化学研究有规律可循
B.近年来的材料新宠——石墨烯,与金刚石互为同位素
C.手机中芯片的主要成分是单质硅
D.盛装NaOH溶液的试剂瓶不能用磨口玻璃塞
2.下列有关化学用语表示正确的是( )
A.氯离子的结构示意图:
B.铀(U)的核素238U比234U的电子数多4
C.16O与18O互为同素异形体
D.M2+有a个电子,b个中子,M的原子符号为M
3.北斗导航中使用的铯原子钟具有极高的精度,其中一种铯核素为Cs,下列有关说法中正确的是( )
ACs具有放射性
B.铯的质子数为78
C.单质铯与水剧烈反应
D.CsOH难溶于水
4.下列关于元素周期表的叙述正确的是( )
A.原子的最外层电子数都等于该元素所在的族序数
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1~20号元素
D.现行元素周期表是按照相对原子质量的大小顺序对元素进行排列的
5.元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性质具有相似性,这种相似性被称为“对角线规则”。则下列叙述错误的是( )
A.Li在N2中燃烧生成Li3N
B.氧化铍的化学式为Be2O3
C.Be(OH)2既能溶于强酸又能溶于强碱溶液
D.硼酸属于弱酸
6.下列叙述不正确的是( )
①短周期元素中,若两种元素的原子序数相差8,则它们一定是同主族元素
②第ⅠA族元素称为碱金属元素
③用中文“镆”命名的第115号元素在周期表中位于第七周期第15列
④周期表中同周期第ⅡA族与第ⅢA族元素原子序数只能相差1或11
⑤除0族外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
⑥所含元素种数最多的族是第ⅢB族,所含元素形成化合物种类最多的族是第ⅣA族
⑦主族金属元素都符合原子的最外层电子数≤4
⑧同一主族元素原子的最外层电子数相同,最外层电子数相同的元素位于同一主族
A.①②⑤⑥ B.①②⑦⑧
C.①②④⑤⑦⑧ D.③④⑥⑦⑧
7.以下验证元素的金属性、非金属性强弱的实验,所用物品不合理的是( )
A.比较钾、钠:Na、K、H2O
B.比较镁、铝:Mg、Al、稀盐酸
C.比较硫、氯:浓硫酸、高氯酸、pH试纸
D.比较溴、碘:溴水、KI-淀粉试纸
8.原子序数依次增大的短周期主族元素X、Y、Z构成的化合物Y+[ZX6]-是一种新型电池内部导体,X、Y、Z的原子序数之和等于35,X的一种氢化物可用于雕刻玻璃。则下列说法不正确的是( )
A.X的单质可与NaCl溶液反应置换出Cl2
B.Y的一种氧化物可做潜水艇供氧剂
C.简单离子的半径:Z>X>Y
D.Z的最高价氧化物对应的水化物为三元酸
9.如图是部分短周期主族元素化合价与原子序数的关系图,下列说法不正确的是( )
A.简单气态氢化物的稳定性:WB.由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
C.Y和Z的最高价氧化物对应的水化物能发生反应
D.Y的一种氧化物可做供氧剂
10.a、b、c、d是四种短周期的主族元素,a、b、d同周期,c、d同主族,a的原子结构示意图为,b与c形成的化合物为b3c,且b、c的简单离子有相同的电子层结构。下列比较中,正确的是 ( )
A.原子序数:a>b>c
B.简单氢化物的稳定性:a>c>d
C.原子半径:c>a>d
D.最高价氧化物对应水化物的酸性:c>a>d
二、选择题(本题共5小题,每小题4分,共20分。每小题
有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分)
11.下列叙述不正确的是( )
A.同主族两相邻元素的原子序数之差可能为2、8、18、32
B.每个主族均包含金属元素和非金属元素
C.若某ⅢA族元素原子序数为x,则同周期ⅡA族元素原子序数可能为x-25
D.元素周期表中主族元素族序数后标A,过渡元素族序数后标B
12.根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
13.短周期元素A、B、C在元素周期表中的位置如图所示,已知三种元素最外层电子数之和为17,则下列说法错误的是( )
A
B C
A.A、B两种元素处在元素周期表的第15列
B.C元素所在主族所有元素都是非金属元素
C.B元素所在主族的下一周期元素次外层含有18个电子
D.C元素所在主族的第5周期元素原子序数为54
14.1919年,卢瑟福做了用α粒子(氦-4原子核)轰击X原子核的实验,实现了原子核的人工转变,发现了质子X H。其中Y的某种单质可用于自来水消毒。下列说法正确的是( )
A.X与Y均能与H元素组成含18电子的化合物
B.Y存在Y多种同素异形体
CY与X中子数相同
D.该转化过程属于化学反应
15.短周期主族元素X、Y、Z、W原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成二元化合物r、t、u,其中u能使品红溶液褪色;v的俗名为烧碱。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径大小:W>Y>Z>X
B.t和r反应时,r为氧化剂
C.生活中常用u使食物增白
D.由W、Y、Z三种元素组成的化合物不止一种
三、非选择题(本题共5小题,共60分)
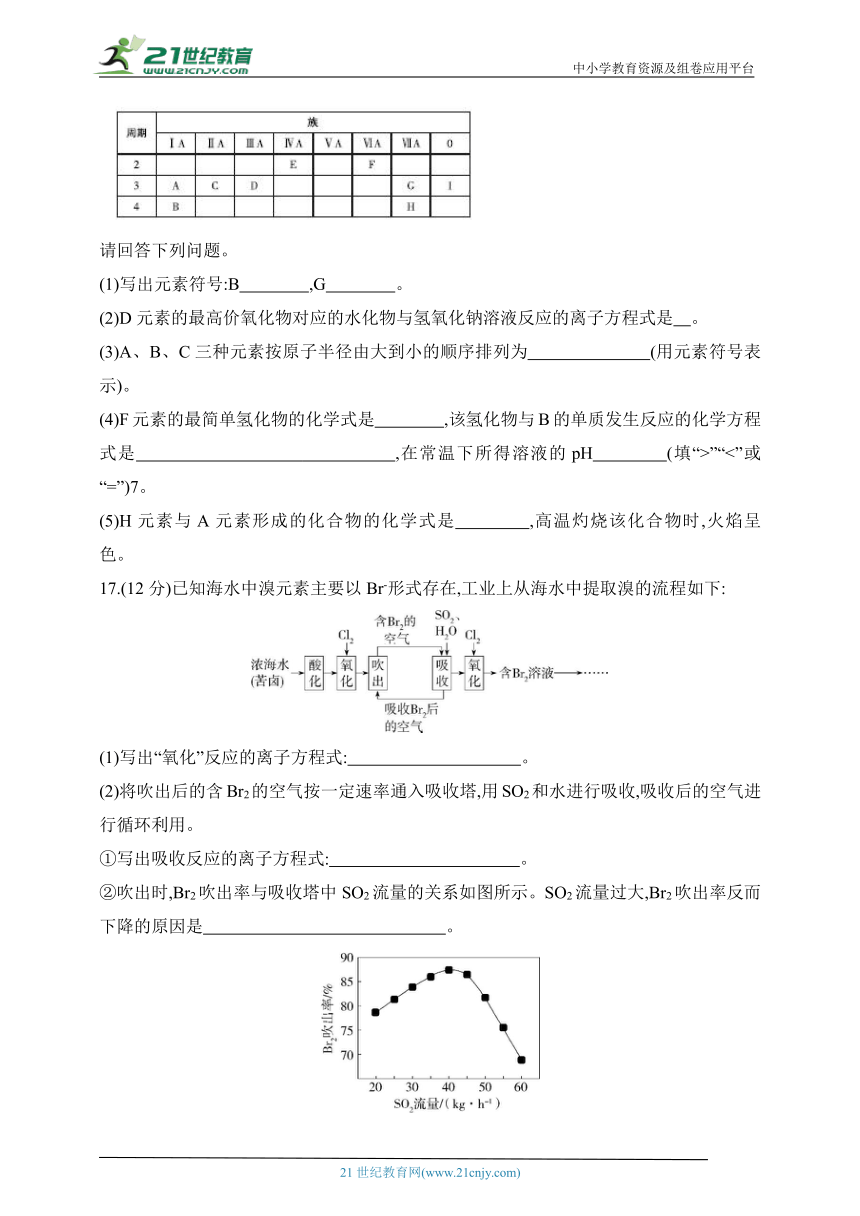
16.(12分)如表列出了A~I 9种元素在元素周期表中的位置:
请回答下列问题。
(1)写出元素符号:B ,G 。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为 (用元素符号表示)。
(4)F元素的最简单氢化物的化学式是 ,该氢化物与B的单质发生反应的化学方程式是 ,在常温下所得溶液的pH (填“>”“<”或“=”)7。
(5)H元素与A元素形成的化合物的化学式是 ,高温灼烧该化合物时,火焰呈 色。
17.(12分)已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:
(1)写出“氧化”反应的离子方程式: 。
(2)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式: 。
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。SO2流量过大,Br2吹出率反而下降的原因是 。
(3)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式: Br2+ Na2CO3 NaBrO3+ CO2↑+ ;当有1.204×1024个电子发生转移时,理论上参加反应的Br2的质量为 。
(4)对于较低浓度的溴水,可采用萃取的方法提取Br2。四氯化碳可作为Br2的萃取剂,其原因除四氯化碳不与溴反应外,还有 。
18.(12分)已知M、W、T、X、Y、Z是原子序数依次增大的短周期主族元素,M的单质是空气中含量最多的气体,W原子最外层电子数是6,W与Y同主族,含T元素的物质灼烧时火焰呈黄色,X是地壳中含量最多的金属元素。回答下列问题:
(1)W在元素周期表中的位置是 。
(2)T的单质与水反应的离子方程式为 。
(3)X和T的最高价氧化物对应的水化物中碱性较强的是 (填化学式)。
(4)W和Y的最简单氢化物中,稳定性较强的是 (填化学式)。
(5)过氧化氢有“绿色消毒剂”之称,若将过氧化氢与W、T、Z三种元素组成的某消毒剂混合使用,它们的消毒能力严重降低,原因是 (用离子方程式表示)。
(6)下列有关X及其化合物的描述正确的是 。
a.X单质的化学性质不活泼
b.X的最高价氧化物对应的水化物可以做药
c.X单质在反应中只能体现氧化性
d.用X制得的餐具宜长时间存放碱性食物
(7)化合物XM与T的最高价氧化物对应的水化物的水溶液反应生成一种盐和一种碱性气体,该反应的化学方程式为 。
19.(12分)某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。已知A装置的圆底烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)A中反应产生二氧化碳的离子方程式为 ,C中可观察到的现象是 。
(2)B装置的作用是 。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性由强到弱顺序是 ,由此得出碳、硅、氮三种元素非金属性由强到弱的顺序是 。(用化学符号表示)
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱,C装置中为NaOH溶液。
(4)写出B装置中发生反应的离子方程式: 。
(5)C装置的作用是 。
(6)实验结论:非金属性Cl Br。(填“>”或“<”)
20.(12分)Ⅰ.金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是 。
Ⅱ.GaAs是一种重要的半导体材料。As与Ga同周期,As与N同主族。
(2)下列事实不能用元素周期律解释的是 (填字母)。
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
(3)废弃的含GaAs的半导体材料可以用浓硝酸溶解GaAs,生成H3AsO4、Ga3+和NO2,写出该反应的化学方程式: 。
Ⅲ.高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图如图:
(4)电弧炉中发生反应的化学方程式为 。当有1 mol C参与反应时,该反应转移的电子数是 (设NA代表阿伏加德罗常数的值)。
(5)整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种气体单质,写出该反应的化学方程式: 。
(6)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,写出水玻璃和盐酸反应的离子方程式: 。
(7)关于硅及其相关化合物的叙述正确的是 。
A.自然界中存在天然游离的硅单质
B.已知C与Si在同一主族,由于CO2+H2O H2CO3,根据类推法可知SiO2+H2O H2SiO3
C.硅元素在金属元素与非金属元素的交界处附近,其单质具有弱导电性,单晶硅可用作半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
答案与解析
1.B 门捷列夫发现元素周期律,并编制出元素周期表,使化学学习和研究有规律可循,故A正确;石墨烯和金刚石是碳元素的不同单质,互为同素异形体,故B错误;Si单质是良好的半导体材料,手机中芯片的主要成分是单质硅,故C正确;二氧化硅能与NaOH溶液反应生成具有黏性的硅酸钠,所以盛装NaOH溶液的试剂瓶不能用磨口玻璃塞,故D正确。
2.D 氯离子核外有18个电子,故A错误;238U、234U的核外电子数一样多,故B错误;16O与18O互为同位素,故C错误;M2+有a个电子,则M原子应有a+2个质子,b个中子,所以其原子符号为M,D正确。
3.C 若Cs具有放射性,则铯原子钟的质量会减轻,铯原子钟不会具有极高的精度,A项错误;Cs的质子数为55,B项错误;铯与钠、钾同主族,钠、钾能与水发生剧烈反应,金属性Cs大于Na和K,则可推断单质铯也能与水发生剧烈反应,C项正确;由NaOH、KOH易溶于水知,CsOH也易溶于水,D项错误。
4.B 主族元素原子的最外层电子数都等于该元素所在的族序数,而副族元素不一定,A错误;目前使用的元素周期表中第六、七周期均含32种元素,B正确;短周期为第一、二、三周期,包含1~18号元素,C错误;现行元素周期表是按原子核电荷数递增的顺序对元素进行排列的,D错误。
5.B 镁和氮气反应生成氮化镁,根据对角线规则可知,Li和氮气反应生成Li3N,故A正确;铝位于ⅢA族,在氧气中燃烧生成氧化铝,Be位于ⅡA族,在氧气中燃烧生成氧化铍,化学式为BeO,故B错误;氢氧化铝能溶于强酸和强碱溶液,根据对角线规则可知,氢氧化铍也能溶于强酸和强碱溶液,故C正确;硅酸为弱酸,根据对角线规则可知,硼酸也为弱酸,故D正确。
6.C 短周期元素中,若两种元素的原子序数相差8,它们不一定是同主族元素,如F和H,①错误;第ⅠA族包括碱金属元素和H,②错误;用中文“镆”命名的第115号元素在周期表中位于第七周期第ⅤA族,即位于第七周期第15列,③正确;周期表中同周期第ⅡA族与第ⅢA族元素原子序数相差1(第二、三周期)、11(第四、五周期)、25(第六、七周期),④错误;除0族外,短周期元素的最高化合价在数值上一般等于该元素所属的族序数,O、F除外,⑤错误;所含元素种数最多的族是第ⅢB族(因为第ⅢB族包括镧系元素和锕系元素),形成化合物种类最多的元素是碳元素,则所含元素形成化合物种类最多的族是第ⅣA族,⑥正确;主族金属元素原子的最外层电子数不一定≤4,如Bi等,⑦错误;同一主族元素原子的最外层电子数相同,最外层电子数相同的元素不一定位于同一主族,如He和Be,⑧错误;故选C。
7.C A项,可以比较钾、钠与水反应的剧烈程度判断元素的金属性强弱,合理;B项,元素的金属性越强,其单质与稀盐酸反应越剧烈,分别将形状相同、大小相等的Mg与Al投入相同浓度的稀盐酸中,观察反应的剧烈程度,Mg与稀盐酸的反应较Al与稀盐酸的反应更剧烈,说明镁元素的金属性强于铝元素,合理;C项,浓硫酸可以使pH试纸脱水炭化,不能用pH试纸测定浓硫酸的酸性,不合理;D项,非金属单质的氧化性越强,元素的非金属性越强,Br2与碘化钾发生置换反应生成I2和KBr,淀粉遇生成的I2变蓝色,所以若观察到试纸变蓝色说明溴单质的氧化性大于碘单质,溴元素的非金属性强于碘元素,合理;故选C。
8.A 元素X、Y、Z为原子序数依次增大的短周期主族元素,X的一种氢化物可用于雕刻玻璃,该氢化物为HF,则X为F,X、Y、Z的原子序数之和等于35,结合化合物结构可知,Y+为+1价阳离子,则Y为Li或Na,若Y为Li,则Z为23号元素,不符合题意,若Y为Na,则Z为15号元素P,符合题意,X、Y、Z分别为F、Na、P。X的单质为F2,活泼性很强,与水剧烈反应生成HF与O2,不能从NaCl溶液中置换出Cl2,故A错误;Y为Na,Na2O2可做潜水艇供氧剂,故B正确;一般电子层数越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,即简单离子的半径:Z>X>Y,故C正确;Z的最高价氧化物对应的水化物为H3PO4,为三元酸,故D正确。
9.B 根据题图可知,X为O元素,Y为Na元素,Z为Al元素,W为S元素,R为Cl元素。非金属性:SCl->O2->Na+>Al3+,简单离子中半径最小的是Z3+,故B错误;Y和Z的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,氢氧化钠与氢氧化铝反应生成Na[Al(OH)4],故C正确;过氧化钠可做供氧剂,故D正确。
10.A a、b、c、d是四种短周期的主族元素,a的原子结构示意图为,K层最多排列2个电子,所以x=2,则a原子中质子数是14,故a为Si;a、b、d同周期,处于第三周期,c、d同主族,则c可能处于第二周期,b与c形成的化合物为b3c,且b、c的简单离子有相同的电子层结构,可推知b为Na、c为N,则d为P。由上述分析可知,原子序数:a(Si)>b(Na)>c(N),故A正确;元素的非金属性越强,其简单氢化物的稳定性越强,非金属性:c(N)>d(P)>a(Si),故简单氢化物的稳定性:c>d>a,故B错误;同周期主族元素自左而右原子半径减小,同主族元素自上而下原子半径增大,故原子半径:a(Si)>d(P)>c(N),故C错误;非金属性:c(N)>d(P)>a(Si),故最高价氧化物对应水化物的酸性:c>d>a,故D错误。
11.BD 同主族两相邻元素的原子序数之差可能为2、8、18、32,故A正确;在周期表中ⅡA族元素不包含非金属元素,故B错误;同周期ⅡA族与ⅢA族元素原子序数之差可以为1(二、三周期)、11(四、五周期)、25(六、七周期),故C正确;元素周期表中主族元素族序数后标A,过渡元素中第Ⅷ族序数后不标B,故D错误。
12.A F无正价,不存在最高价氧化物对应的水化物,故A错误;同周期主族元素从左到右非金属性增强,非金属性S>P>Si,所以P与H2在高温时能反应,故B正确;同主族元素从上至下金属性增强,与水反应剧烈程度增强,金属性:Ba>Ca>Mg,Ca与水反应较快,则Ba与水反应更快,故C正确;同主族元素从上到下非金属性减弱,简单氢化物的热稳定性减弱,非金属性:Cl>Br>I,所以HBr的分解温度介于HI与HCl的分解温度之间,故D正确。
13.D 设A、B最外层电子数为x,C最外层电子数为x+2,则2x+x+2=17,解得x=5,故A为N,B为P,C为Cl。N、P位于ⅤA族,处在元素周期表的第15列,A正确;Cl位于ⅦA族,ⅦA族元素都是非金属元素,B正确;与P同主族的下一周期元素是As,其原子次外层含18个电子,C正确;与Cl同主族的第5周期元素I的原子序数为53,D错误。
14.A 由Y的某种单质可用于自来水消毒可推知,Y可能是Cl或OY的质量数为17,故Y不可能是Cl,Y为OY的质子数为8,Z=7,则X为N。H2O2和N2H4均为含18电子的化合物,A正确;16O、17O、18O互为同位素,B错误;根据质量数守恒,W=14N中有7个中子O中有9个中子,C错误;题给转化过程中原子核发生了变化,不属于化学变化,D错误。
15.D u能使品红溶液褪色,推知u可能为SO2,v的俗名为烧碱,v为NaOH;根据短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q推知,X、Y、Z、W分别为H、O、Na、S,m为H2、n为O2、p为Na、q为S、r为H2O、t为Na2O2。四种元素中Na的原子半径最大,故A错误;在过氧化钠与水的反应中,过氧化钠既是氧化剂又是还原剂,水既不是氧化剂又不是还原剂,故B错误;二氧化硫有毒,生活中不能常用二氧化硫使食物增白,故C错误;由 W 、 Y 、 Z 三种元素组成的化合物可以是Na2SO3,也可以是Na2SO4,故D正确。
16.答案 (除标注外,每空2分)
(1)K(1分) Cl(1分)
(2)Al(OH)3+OH-[Al(OH)4]-
(3)K>Na>Mg
(4)H2O(1分) 2K+2H2O 2KOH+H2↑ >(1分)
(5)NaBr(1分) 黄(1分)
解析 根据题表,可推出A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl,H为Br,I为Ar。
(2)D为Al,其最高价氧化物对应的水化物为Al(OH)3,Al(OH)3为两性氢氧化物,能与氢氧化钠溶液发生反应。
(3)同周期主族元素从左向右原子半径依次减小,同主族元素从上到下原子半径依次增大。
(4)F为O,其最简单氢化物的化学式为H2O;K为活泼的金属,能与H2O反应,化学方程式为2K+2H2O 2KOH+H2↑;所得溶液为KOH溶液,显碱性,常温下pH>7。
(5)H为Br,A为Na,形成的化合物为NaBr;高温灼烧该化合物,因为含有钠元素,火焰呈黄色。
17.答案 (除标注外,每空2分)
(1)Cl2+2Br- Br2+2Cl- (1分)
(2)①SO2+Br2+2H2O 4H++2Br-+S
②过量的二氧化硫随“吸收Br2后的空气”进入“吹出”步骤,与溴反应,使Br2吹出率下降
(3) 3(0.5分) 3(0.5分) 1(0.5分) 3(0.5分) 5NaBr(1分) 192 g
(4)四氯化碳与水互不相溶,溴在四氯化碳中的溶解度远大于在水中的
解析 (1)浓海水中的溴元素主要以Br-形式存在,“氧化”反应的离子方程式为Cl2+2Br- Br2+2Cl-。
(2)①吸收反应即二氧化硫把溴单质还原为溴离子,离子方程式为SO2+Br2+2H2O 4H++2Br-+S。
(3)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据得失电子守恒、原子守恒可得化学方程式为3Br2+3Na2CO3 NaBrO3+ 3CO2↑ + 5NaBr;存在关系式:3Br2~5e-,当有1.204×1024个电子即2 mol电子发生转移时,理论上参加反应的Br2的物质的量为1.2 mol,质量为1.2 mol×160 g/mol=192 g。
18.答案 (除标注外,每空2分)
(1)第二周期第ⅥA族
(2)2Na+2H2O 2Na++2OH-+H2↑
(3)NaOH(1分)
(4)H2O(1分)
(5)H2O2+ClO- Cl-+O2↑+H2O
(6)b
(7)AlN+NaOH+3H2O Na[Al(OH)4]+NH3↑
解析 已知M、W、T、X、Y、Z是原子序数依次增大的短周期主族元素,M的单质是空气中含量最多的气体,则M为N元素;W原子最外层电子数是6,W与Y同主族,则W为O元素,Y为S元素;含T元素的物质灼烧时火焰呈黄色,则T为Na元素;X是地壳中含量最多的金属元素,则X为Al元素,Z的原子序数大于S,Z为Cl元素。
(1)W为O元素,则W在元素周期表中的位置是第二周期第ⅥA族。
(2)T为钠元素,钠与水反应生成氢氧化钠和氢气,其反应的离子方程式为2Na+2H2O 2Na++2OH-+H2↑。
(3)X和T的最高价氧化物对应的水化物分别为氢氧化铝和氢氧化钠,元素的金属性越强,最高价氧化物对应的水化物的碱性越强,则碱性较强的是NaOH。
(4)元素的非金属性越强,最简单氢化物越稳定,则W和Y的最简单氢化物中,稳定性较强的是H2O。
(5)W、T、Z三种元素组成的某消毒剂有效成分为次氯酸钠,若将过氧化氢与该消毒剂混合使用,两者反应生成氯化钠、O2和水,其反应的离子方程式为H2O2+ClO- Cl-+O2↑+H2O。
(6)X单质为铝,铝的化学性质较活泼,故a错误;X的最高价氧化物对应的水化物为氢氧化铝,可以中和胃酸,可以做药,故b正确;X单质为铝,在反应中化合价只能升高,只能体现还原性,故c错误;铝制得的餐具不宜长时间存放碱性食物,故d错误。
(7)化合物XM为AlN,T的最高价氧化物对应的水化物为NaOH,AlN、NaOH和H2O反应生成四羟基合铝酸钠和氨气,该反应的化学方程式为AlN+NaOH+3H2O Na[Al(OH)4]+NH3↑。
19.答案 (除标注外,每空2分)
(1)CaCO3+2H+ Ca2++CO2↑+H2O 产生白色沉淀(1分)
(2)除去二氧化碳中混有的硝酸蒸气
(3)HNO3>H2CO3>H2SiO3(1分) N>C>Si(1分)
(4)Cl2+2Br- Br2+2Cl-
(5)吸收尾气,防止氯气污染环境(1分)
(6)>
解析 (1)A中硝酸与碳酸钙反应产生二氧化碳的化学方程式为CaCO3+2HNO3 Ca(NO3)2+CO2↑+H2O;证明碳酸的酸性比硅酸强,C中发生的反应为Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O 2NaHCO3+H2SiO3↓,所以C中可观察到的现象为产生白色沉淀。
(2)由于硝酸具有挥发性,为避免硝酸与硅酸钠反应,必须将二氧化碳中的硝酸蒸气除去,利用饱和碳酸氢钠溶液吸收硝酸蒸气。
(3)由实验现象可知,三种酸中硝酸酸性最强,硅酸酸性最弱,即酸性:HNO3>H2CO3>H2SiO3;元素的非金属性越强,最高价含氧酸的酸性就越强,N、C、Si中氮的非金属性最强,硅的非金属性最弱,所以非金属性:N>C>Si。
(4)根据题意可知,探究氯与溴的非金属性强弱,所以B中应装溴化钾或溴化钠溶液,氯气能够置换出溴,反应的离子方程式为Cl2+2Br- Br2+2Cl-。
(5)氯气能够与碱反应,由于尾气中含有氯气,故要用碱溶液吸收,以避免污染环境。
(6)根据B装置中置换反应可得出单质的氧化性:Cl2>Br2,单质的氧化性越强,元素的非金属性越强,所以非金属性:Cl>Br。
20.答案 (除标注外,每空1分)
(1)第三周期第ⅢA族
(2)c
(3)GaAs+11HNO3(浓) Ga(NO3)3+8NO2↑+H3AsO4+4H2O(2分)
(4)SiO2+2C Si+2CO↑ 2NA
(5)SiHCl3+3H2O H2SiO3+H2↑+3HCl(2分)
(6)Si+2H+ H2SiO3(凝胶)(2分)
(7)CE(2分)
解析 (1)Al的原子序数为13,在元素周期表中的位置为第三周期第ⅢA族。
(2)同主族元素从上到下金属性增强,金属性:Ga>Al,则碱性:Ga(OH)3>Al(OH)3,a不符合题意;同周期主族元素从左向右非金属性增强,As与Ga同周期,且As的原子序数大于Ga,则非金属性:As>Ga,b不符合题意;同一元素的含氧酸的酸性,不能利用元素周期律解释,c符合题意。
(3)用浓硝酸溶解GaAs,生成H3AsO4、Ga3+和NO2,可知As元素的化合价升高,N元素的化合价降低,由得失电子守恒及原子守恒可得反应为GaAs+11HNO3(浓) Ga(NO3)3+8NO2↑+H3AsO4+4H2O。
(4)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为SiO2+2C Si+2CO↑;当有1 mol C参与反应时,该反应转移的电子数是2NA。
(5)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,反应的化学方程式为SiHCl3+3H2O H2SiO3+H2↑+3HCl。
(6)水玻璃和盐酸反应制备硅酸凝胶的离子方程式为Si+2H+ H2SiO3(凝胶)。
(7)自然界中不存在天然游离的硅单质,硅以二氧化硅和硅酸盐形式存在于自然界中,A错误;SiO2不溶于水,也不与水反应,B错误;在周期表中,硅元素在金属元素与非金属元素的交界处附近,单晶硅可用作半导体材料,C正确;SiO2既能和NaOH溶液反应,又能和氢氟酸反应,但SiO2为酸性氧化物,D错误;玻璃、水泥、陶瓷都是传统的硅酸盐产品,E正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁教版高中化学必修第二册
第1章 原子结构 元素周期律
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生产、生活、社会发展息息相关,下列说法错误的是( )
A.门捷列夫发现元素周期律并编制了第一张元素周期表,使化学研究有规律可循
B.近年来的材料新宠——石墨烯,与金刚石互为同位素
C.手机中芯片的主要成分是单质硅
D.盛装NaOH溶液的试剂瓶不能用磨口玻璃塞
2.下列有关化学用语表示正确的是( )
A.氯离子的结构示意图:
B.铀(U)的核素238U比234U的电子数多4
C.16O与18O互为同素异形体
D.M2+有a个电子,b个中子,M的原子符号为M
3.北斗导航中使用的铯原子钟具有极高的精度,其中一种铯核素为Cs,下列有关说法中正确的是( )
ACs具有放射性
B.铯的质子数为78
C.单质铯与水剧烈反应
D.CsOH难溶于水
4.下列关于元素周期表的叙述正确的是( )
A.原子的最外层电子数都等于该元素所在的族序数
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1~20号元素
D.现行元素周期表是按照相对原子质量的大小顺序对元素进行排列的
5.元素周期表中,某些主族元素与右下方的主族元素(如图)的有些性质具有相似性,这种相似性被称为“对角线规则”。则下列叙述错误的是( )
A.Li在N2中燃烧生成Li3N
B.氧化铍的化学式为Be2O3
C.Be(OH)2既能溶于强酸又能溶于强碱溶液
D.硼酸属于弱酸
6.下列叙述不正确的是( )
①短周期元素中,若两种元素的原子序数相差8,则它们一定是同主族元素
②第ⅠA族元素称为碱金属元素
③用中文“镆”命名的第115号元素在周期表中位于第七周期第15列
④周期表中同周期第ⅡA族与第ⅢA族元素原子序数只能相差1或11
⑤除0族外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
⑥所含元素种数最多的族是第ⅢB族,所含元素形成化合物种类最多的族是第ⅣA族
⑦主族金属元素都符合原子的最外层电子数≤4
⑧同一主族元素原子的最外层电子数相同,最外层电子数相同的元素位于同一主族
A.①②⑤⑥ B.①②⑦⑧
C.①②④⑤⑦⑧ D.③④⑥⑦⑧
7.以下验证元素的金属性、非金属性强弱的实验,所用物品不合理的是( )
A.比较钾、钠:Na、K、H2O
B.比较镁、铝:Mg、Al、稀盐酸
C.比较硫、氯:浓硫酸、高氯酸、pH试纸
D.比较溴、碘:溴水、KI-淀粉试纸
8.原子序数依次增大的短周期主族元素X、Y、Z构成的化合物Y+[ZX6]-是一种新型电池内部导体,X、Y、Z的原子序数之和等于35,X的一种氢化物可用于雕刻玻璃。则下列说法不正确的是( )
A.X的单质可与NaCl溶液反应置换出Cl2
B.Y的一种氧化物可做潜水艇供氧剂
C.简单离子的半径:Z>X>Y
D.Z的最高价氧化物对应的水化物为三元酸
9.如图是部分短周期主族元素化合价与原子序数的关系图,下列说法不正确的是( )
A.简单气态氢化物的稳定性:W
C.Y和Z的最高价氧化物对应的水化物能发生反应
D.Y的一种氧化物可做供氧剂
10.a、b、c、d是四种短周期的主族元素,a、b、d同周期,c、d同主族,a的原子结构示意图为,b与c形成的化合物为b3c,且b、c的简单离子有相同的电子层结构。下列比较中,正确的是 ( )
A.原子序数:a>b>c
B.简单氢化物的稳定性:a>c>d
C.原子半径:c>a>d
D.最高价氧化物对应水化物的酸性:c>a>d
二、选择题(本题共5小题,每小题4分,共20分。每小题
有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分)
11.下列叙述不正确的是( )
A.同主族两相邻元素的原子序数之差可能为2、8、18、32
B.每个主族均包含金属元素和非金属元素
C.若某ⅢA族元素原子序数为x,则同周期ⅡA族元素原子序数可能为x-25
D.元素周期表中主族元素族序数后标A,过渡元素族序数后标B
12.根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
13.短周期元素A、B、C在元素周期表中的位置如图所示,已知三种元素最外层电子数之和为17,则下列说法错误的是( )
A
B C
A.A、B两种元素处在元素周期表的第15列
B.C元素所在主族所有元素都是非金属元素
C.B元素所在主族的下一周期元素次外层含有18个电子
D.C元素所在主族的第5周期元素原子序数为54
14.1919年,卢瑟福做了用α粒子(氦-4原子核)轰击X原子核的实验,实现了原子核的人工转变,发现了质子X H。其中Y的某种单质可用于自来水消毒。下列说法正确的是( )
A.X与Y均能与H元素组成含18电子的化合物
B.Y存在Y多种同素异形体
CY与X中子数相同
D.该转化过程属于化学反应
15.短周期主族元素X、Y、Z、W原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成二元化合物r、t、u,其中u能使品红溶液褪色;v的俗名为烧碱。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径大小:W>Y>Z>X
B.t和r反应时,r为氧化剂
C.生活中常用u使食物增白
D.由W、Y、Z三种元素组成的化合物不止一种
三、非选择题(本题共5小题,共60分)
16.(12分)如表列出了A~I 9种元素在元素周期表中的位置:
请回答下列问题。
(1)写出元素符号:B ,G 。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为 (用元素符号表示)。
(4)F元素的最简单氢化物的化学式是 ,该氢化物与B的单质发生反应的化学方程式是 ,在常温下所得溶液的pH (填“>”“<”或“=”)7。
(5)H元素与A元素形成的化合物的化学式是 ,高温灼烧该化合物时,火焰呈 色。
17.(12分)已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:
(1)写出“氧化”反应的离子方程式: 。
(2)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式: 。
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。SO2流量过大,Br2吹出率反而下降的原因是 。
(3)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式: Br2+ Na2CO3 NaBrO3+ CO2↑+ ;当有1.204×1024个电子发生转移时,理论上参加反应的Br2的质量为 。
(4)对于较低浓度的溴水,可采用萃取的方法提取Br2。四氯化碳可作为Br2的萃取剂,其原因除四氯化碳不与溴反应外,还有 。
18.(12分)已知M、W、T、X、Y、Z是原子序数依次增大的短周期主族元素,M的单质是空气中含量最多的气体,W原子最外层电子数是6,W与Y同主族,含T元素的物质灼烧时火焰呈黄色,X是地壳中含量最多的金属元素。回答下列问题:
(1)W在元素周期表中的位置是 。
(2)T的单质与水反应的离子方程式为 。
(3)X和T的最高价氧化物对应的水化物中碱性较强的是 (填化学式)。
(4)W和Y的最简单氢化物中,稳定性较强的是 (填化学式)。
(5)过氧化氢有“绿色消毒剂”之称,若将过氧化氢与W、T、Z三种元素组成的某消毒剂混合使用,它们的消毒能力严重降低,原因是 (用离子方程式表示)。
(6)下列有关X及其化合物的描述正确的是 。
a.X单质的化学性质不活泼
b.X的最高价氧化物对应的水化物可以做药
c.X单质在反应中只能体现氧化性
d.用X制得的餐具宜长时间存放碱性食物
(7)化合物XM与T的最高价氧化物对应的水化物的水溶液反应生成一种盐和一种碱性气体,该反应的化学方程式为 。
19.(12分)某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。已知A装置的圆底烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)A中反应产生二氧化碳的离子方程式为 ,C中可观察到的现象是 。
(2)B装置的作用是 。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性由强到弱顺序是 ,由此得出碳、硅、氮三种元素非金属性由强到弱的顺序是 。(用化学符号表示)
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱,C装置中为NaOH溶液。
(4)写出B装置中发生反应的离子方程式: 。
(5)C装置的作用是 。
(6)实验结论:非金属性Cl Br。(填“>”或“<”)
20.(12分)Ⅰ.金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是 。
Ⅱ.GaAs是一种重要的半导体材料。As与Ga同周期,As与N同主族。
(2)下列事实不能用元素周期律解释的是 (填字母)。
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
(3)废弃的含GaAs的半导体材料可以用浓硝酸溶解GaAs,生成H3AsO4、Ga3+和NO2,写出该反应的化学方程式: 。
Ⅲ.高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图如图:
(4)电弧炉中发生反应的化学方程式为 。当有1 mol C参与反应时,该反应转移的电子数是 (设NA代表阿伏加德罗常数的值)。
(5)整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种气体单质,写出该反应的化学方程式: 。
(6)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,写出水玻璃和盐酸反应的离子方程式: 。
(7)关于硅及其相关化合物的叙述正确的是 。
A.自然界中存在天然游离的硅单质
B.已知C与Si在同一主族,由于CO2+H2O H2CO3,根据类推法可知SiO2+H2O H2SiO3
C.硅元素在金属元素与非金属元素的交界处附近,其单质具有弱导电性,单晶硅可用作半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
答案与解析
1.B 门捷列夫发现元素周期律,并编制出元素周期表,使化学学习和研究有规律可循,故A正确;石墨烯和金刚石是碳元素的不同单质,互为同素异形体,故B错误;Si单质是良好的半导体材料,手机中芯片的主要成分是单质硅,故C正确;二氧化硅能与NaOH溶液反应生成具有黏性的硅酸钠,所以盛装NaOH溶液的试剂瓶不能用磨口玻璃塞,故D正确。
2.D 氯离子核外有18个电子,故A错误;238U、234U的核外电子数一样多,故B错误;16O与18O互为同位素,故C错误;M2+有a个电子,则M原子应有a+2个质子,b个中子,所以其原子符号为M,D正确。
3.C 若Cs具有放射性,则铯原子钟的质量会减轻,铯原子钟不会具有极高的精度,A项错误;Cs的质子数为55,B项错误;铯与钠、钾同主族,钠、钾能与水发生剧烈反应,金属性Cs大于Na和K,则可推断单质铯也能与水发生剧烈反应,C项正确;由NaOH、KOH易溶于水知,CsOH也易溶于水,D项错误。
4.B 主族元素原子的最外层电子数都等于该元素所在的族序数,而副族元素不一定,A错误;目前使用的元素周期表中第六、七周期均含32种元素,B正确;短周期为第一、二、三周期,包含1~18号元素,C错误;现行元素周期表是按原子核电荷数递增的顺序对元素进行排列的,D错误。
5.B 镁和氮气反应生成氮化镁,根据对角线规则可知,Li和氮气反应生成Li3N,故A正确;铝位于ⅢA族,在氧气中燃烧生成氧化铝,Be位于ⅡA族,在氧气中燃烧生成氧化铍,化学式为BeO,故B错误;氢氧化铝能溶于强酸和强碱溶液,根据对角线规则可知,氢氧化铍也能溶于强酸和强碱溶液,故C正确;硅酸为弱酸,根据对角线规则可知,硼酸也为弱酸,故D正确。
6.C 短周期元素中,若两种元素的原子序数相差8,它们不一定是同主族元素,如F和H,①错误;第ⅠA族包括碱金属元素和H,②错误;用中文“镆”命名的第115号元素在周期表中位于第七周期第ⅤA族,即位于第七周期第15列,③正确;周期表中同周期第ⅡA族与第ⅢA族元素原子序数相差1(第二、三周期)、11(第四、五周期)、25(第六、七周期),④错误;除0族外,短周期元素的最高化合价在数值上一般等于该元素所属的族序数,O、F除外,⑤错误;所含元素种数最多的族是第ⅢB族(因为第ⅢB族包括镧系元素和锕系元素),形成化合物种类最多的元素是碳元素,则所含元素形成化合物种类最多的族是第ⅣA族,⑥正确;主族金属元素原子的最外层电子数不一定≤4,如Bi等,⑦错误;同一主族元素原子的最外层电子数相同,最外层电子数相同的元素不一定位于同一主族,如He和Be,⑧错误;故选C。
7.C A项,可以比较钾、钠与水反应的剧烈程度判断元素的金属性强弱,合理;B项,元素的金属性越强,其单质与稀盐酸反应越剧烈,分别将形状相同、大小相等的Mg与Al投入相同浓度的稀盐酸中,观察反应的剧烈程度,Mg与稀盐酸的反应较Al与稀盐酸的反应更剧烈,说明镁元素的金属性强于铝元素,合理;C项,浓硫酸可以使pH试纸脱水炭化,不能用pH试纸测定浓硫酸的酸性,不合理;D项,非金属单质的氧化性越强,元素的非金属性越强,Br2与碘化钾发生置换反应生成I2和KBr,淀粉遇生成的I2变蓝色,所以若观察到试纸变蓝色说明溴单质的氧化性大于碘单质,溴元素的非金属性强于碘元素,合理;故选C。
8.A 元素X、Y、Z为原子序数依次增大的短周期主族元素,X的一种氢化物可用于雕刻玻璃,该氢化物为HF,则X为F,X、Y、Z的原子序数之和等于35,结合化合物结构可知,Y+为+1价阳离子,则Y为Li或Na,若Y为Li,则Z为23号元素,不符合题意,若Y为Na,则Z为15号元素P,符合题意,X、Y、Z分别为F、Na、P。X的单质为F2,活泼性很强,与水剧烈反应生成HF与O2,不能从NaCl溶液中置换出Cl2,故A错误;Y为Na,Na2O2可做潜水艇供氧剂,故B正确;一般电子层数越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,即简单离子的半径:Z>X>Y,故C正确;Z的最高价氧化物对应的水化物为H3PO4,为三元酸,故D正确。
9.B 根据题图可知,X为O元素,Y为Na元素,Z为Al元素,W为S元素,R为Cl元素。非金属性:S
10.A a、b、c、d是四种短周期的主族元素,a的原子结构示意图为,K层最多排列2个电子,所以x=2,则a原子中质子数是14,故a为Si;a、b、d同周期,处于第三周期,c、d同主族,则c可能处于第二周期,b与c形成的化合物为b3c,且b、c的简单离子有相同的电子层结构,可推知b为Na、c为N,则d为P。由上述分析可知,原子序数:a(Si)>b(Na)>c(N),故A正确;元素的非金属性越强,其简单氢化物的稳定性越强,非金属性:c(N)>d(P)>a(Si),故简单氢化物的稳定性:c>d>a,故B错误;同周期主族元素自左而右原子半径减小,同主族元素自上而下原子半径增大,故原子半径:a(Si)>d(P)>c(N),故C错误;非金属性:c(N)>d(P)>a(Si),故最高价氧化物对应水化物的酸性:c>d>a,故D错误。
11.BD 同主族两相邻元素的原子序数之差可能为2、8、18、32,故A正确;在周期表中ⅡA族元素不包含非金属元素,故B错误;同周期ⅡA族与ⅢA族元素原子序数之差可以为1(二、三周期)、11(四、五周期)、25(六、七周期),故C正确;元素周期表中主族元素族序数后标A,过渡元素中第Ⅷ族序数后不标B,故D错误。
12.A F无正价,不存在最高价氧化物对应的水化物,故A错误;同周期主族元素从左到右非金属性增强,非金属性S>P>Si,所以P与H2在高温时能反应,故B正确;同主族元素从上至下金属性增强,与水反应剧烈程度增强,金属性:Ba>Ca>Mg,Ca与水反应较快,则Ba与水反应更快,故C正确;同主族元素从上到下非金属性减弱,简单氢化物的热稳定性减弱,非金属性:Cl>Br>I,所以HBr的分解温度介于HI与HCl的分解温度之间,故D正确。
13.D 设A、B最外层电子数为x,C最外层电子数为x+2,则2x+x+2=17,解得x=5,故A为N,B为P,C为Cl。N、P位于ⅤA族,处在元素周期表的第15列,A正确;Cl位于ⅦA族,ⅦA族元素都是非金属元素,B正确;与P同主族的下一周期元素是As,其原子次外层含18个电子,C正确;与Cl同主族的第5周期元素I的原子序数为53,D错误。
14.A 由Y的某种单质可用于自来水消毒可推知,Y可能是Cl或OY的质量数为17,故Y不可能是Cl,Y为OY的质子数为8,Z=7,则X为N。H2O2和N2H4均为含18电子的化合物,A正确;16O、17O、18O互为同位素,B错误;根据质量数守恒,W=14N中有7个中子O中有9个中子,C错误;题给转化过程中原子核发生了变化,不属于化学变化,D错误。
15.D u能使品红溶液褪色,推知u可能为SO2,v的俗名为烧碱,v为NaOH;根据短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q推知,X、Y、Z、W分别为H、O、Na、S,m为H2、n为O2、p为Na、q为S、r为H2O、t为Na2O2。四种元素中Na的原子半径最大,故A错误;在过氧化钠与水的反应中,过氧化钠既是氧化剂又是还原剂,水既不是氧化剂又不是还原剂,故B错误;二氧化硫有毒,生活中不能常用二氧化硫使食物增白,故C错误;由 W 、 Y 、 Z 三种元素组成的化合物可以是Na2SO3,也可以是Na2SO4,故D正确。
16.答案 (除标注外,每空2分)
(1)K(1分) Cl(1分)
(2)Al(OH)3+OH-[Al(OH)4]-
(3)K>Na>Mg
(4)H2O(1分) 2K+2H2O 2KOH+H2↑ >(1分)
(5)NaBr(1分) 黄(1分)
解析 根据题表,可推出A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl,H为Br,I为Ar。
(2)D为Al,其最高价氧化物对应的水化物为Al(OH)3,Al(OH)3为两性氢氧化物,能与氢氧化钠溶液发生反应。
(3)同周期主族元素从左向右原子半径依次减小,同主族元素从上到下原子半径依次增大。
(4)F为O,其最简单氢化物的化学式为H2O;K为活泼的金属,能与H2O反应,化学方程式为2K+2H2O 2KOH+H2↑;所得溶液为KOH溶液,显碱性,常温下pH>7。
(5)H为Br,A为Na,形成的化合物为NaBr;高温灼烧该化合物,因为含有钠元素,火焰呈黄色。
17.答案 (除标注外,每空2分)
(1)Cl2+2Br- Br2+2Cl- (1分)
(2)①SO2+Br2+2H2O 4H++2Br-+S
②过量的二氧化硫随“吸收Br2后的空气”进入“吹出”步骤,与溴反应,使Br2吹出率下降
(3) 3(0.5分) 3(0.5分) 1(0.5分) 3(0.5分) 5NaBr(1分) 192 g
(4)四氯化碳与水互不相溶,溴在四氯化碳中的溶解度远大于在水中的
解析 (1)浓海水中的溴元素主要以Br-形式存在,“氧化”反应的离子方程式为Cl2+2Br- Br2+2Cl-。
(2)①吸收反应即二氧化硫把溴单质还原为溴离子,离子方程式为SO2+Br2+2H2O 4H++2Br-+S。
(3)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据得失电子守恒、原子守恒可得化学方程式为3Br2+3Na2CO3 NaBrO3+ 3CO2↑ + 5NaBr;存在关系式:3Br2~5e-,当有1.204×1024个电子即2 mol电子发生转移时,理论上参加反应的Br2的物质的量为1.2 mol,质量为1.2 mol×160 g/mol=192 g。
18.答案 (除标注外,每空2分)
(1)第二周期第ⅥA族
(2)2Na+2H2O 2Na++2OH-+H2↑
(3)NaOH(1分)
(4)H2O(1分)
(5)H2O2+ClO- Cl-+O2↑+H2O
(6)b
(7)AlN+NaOH+3H2O Na[Al(OH)4]+NH3↑
解析 已知M、W、T、X、Y、Z是原子序数依次增大的短周期主族元素,M的单质是空气中含量最多的气体,则M为N元素;W原子最外层电子数是6,W与Y同主族,则W为O元素,Y为S元素;含T元素的物质灼烧时火焰呈黄色,则T为Na元素;X是地壳中含量最多的金属元素,则X为Al元素,Z的原子序数大于S,Z为Cl元素。
(1)W为O元素,则W在元素周期表中的位置是第二周期第ⅥA族。
(2)T为钠元素,钠与水反应生成氢氧化钠和氢气,其反应的离子方程式为2Na+2H2O 2Na++2OH-+H2↑。
(3)X和T的最高价氧化物对应的水化物分别为氢氧化铝和氢氧化钠,元素的金属性越强,最高价氧化物对应的水化物的碱性越强,则碱性较强的是NaOH。
(4)元素的非金属性越强,最简单氢化物越稳定,则W和Y的最简单氢化物中,稳定性较强的是H2O。
(5)W、T、Z三种元素组成的某消毒剂有效成分为次氯酸钠,若将过氧化氢与该消毒剂混合使用,两者反应生成氯化钠、O2和水,其反应的离子方程式为H2O2+ClO- Cl-+O2↑+H2O。
(6)X单质为铝,铝的化学性质较活泼,故a错误;X的最高价氧化物对应的水化物为氢氧化铝,可以中和胃酸,可以做药,故b正确;X单质为铝,在反应中化合价只能升高,只能体现还原性,故c错误;铝制得的餐具不宜长时间存放碱性食物,故d错误。
(7)化合物XM为AlN,T的最高价氧化物对应的水化物为NaOH,AlN、NaOH和H2O反应生成四羟基合铝酸钠和氨气,该反应的化学方程式为AlN+NaOH+3H2O Na[Al(OH)4]+NH3↑。
19.答案 (除标注外,每空2分)
(1)CaCO3+2H+ Ca2++CO2↑+H2O 产生白色沉淀(1分)
(2)除去二氧化碳中混有的硝酸蒸气
(3)HNO3>H2CO3>H2SiO3(1分) N>C>Si(1分)
(4)Cl2+2Br- Br2+2Cl-
(5)吸收尾气,防止氯气污染环境(1分)
(6)>
解析 (1)A中硝酸与碳酸钙反应产生二氧化碳的化学方程式为CaCO3+2HNO3 Ca(NO3)2+CO2↑+H2O;证明碳酸的酸性比硅酸强,C中发生的反应为Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O 2NaHCO3+H2SiO3↓,所以C中可观察到的现象为产生白色沉淀。
(2)由于硝酸具有挥发性,为避免硝酸与硅酸钠反应,必须将二氧化碳中的硝酸蒸气除去,利用饱和碳酸氢钠溶液吸收硝酸蒸气。
(3)由实验现象可知,三种酸中硝酸酸性最强,硅酸酸性最弱,即酸性:HNO3>H2CO3>H2SiO3;元素的非金属性越强,最高价含氧酸的酸性就越强,N、C、Si中氮的非金属性最强,硅的非金属性最弱,所以非金属性:N>C>Si。
(4)根据题意可知,探究氯与溴的非金属性强弱,所以B中应装溴化钾或溴化钠溶液,氯气能够置换出溴,反应的离子方程式为Cl2+2Br- Br2+2Cl-。
(5)氯气能够与碱反应,由于尾气中含有氯气,故要用碱溶液吸收,以避免污染环境。
(6)根据B装置中置换反应可得出单质的氧化性:Cl2>Br2,单质的氧化性越强,元素的非金属性越强,所以非金属性:Cl>Br。
20.答案 (除标注外,每空1分)
(1)第三周期第ⅢA族
(2)c
(3)GaAs+11HNO3(浓) Ga(NO3)3+8NO2↑+H3AsO4+4H2O(2分)
(4)SiO2+2C Si+2CO↑ 2NA
(5)SiHCl3+3H2O H2SiO3+H2↑+3HCl(2分)
(6)Si+2H+ H2SiO3(凝胶)(2分)
(7)CE(2分)
解析 (1)Al的原子序数为13,在元素周期表中的位置为第三周期第ⅢA族。
(2)同主族元素从上到下金属性增强,金属性:Ga>Al,则碱性:Ga(OH)3>Al(OH)3,a不符合题意;同周期主族元素从左向右非金属性增强,As与Ga同周期,且As的原子序数大于Ga,则非金属性:As>Ga,b不符合题意;同一元素的含氧酸的酸性,不能利用元素周期律解释,c符合题意。
(3)用浓硝酸溶解GaAs,生成H3AsO4、Ga3+和NO2,可知As元素的化合价升高,N元素的化合价降低,由得失电子守恒及原子守恒可得反应为GaAs+11HNO3(浓) Ga(NO3)3+8NO2↑+H3AsO4+4H2O。
(4)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为SiO2+2C Si+2CO↑;当有1 mol C参与反应时,该反应转移的电子数是2NA。
(5)SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,反应的化学方程式为SiHCl3+3H2O H2SiO3+H2↑+3HCl。
(6)水玻璃和盐酸反应制备硅酸凝胶的离子方程式为Si+2H+ H2SiO3(凝胶)。
(7)自然界中不存在天然游离的硅单质,硅以二氧化硅和硅酸盐形式存在于自然界中,A错误;SiO2不溶于水,也不与水反应,B错误;在周期表中,硅元素在金属元素与非金属元素的交界处附近,单晶硅可用作半导体材料,C正确;SiO2既能和NaOH溶液反应,又能和氢氟酸反应,但SiO2为酸性氧化物,D错误;玻璃、水泥、陶瓷都是传统的硅酸盐产品,E正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
