2025鲁教版高中化学必修第二册强化练习题--第2课时 化学反应与电能(含答案)
文档属性
| 名称 | 2025鲁教版高中化学必修第二册强化练习题--第2课时 化学反应与电能(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 737.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-19 16:34:17 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025鲁教版高中化学必修第二册
第2课时 化学反应与电能
基础过关练
题组一 原电池的构成条件
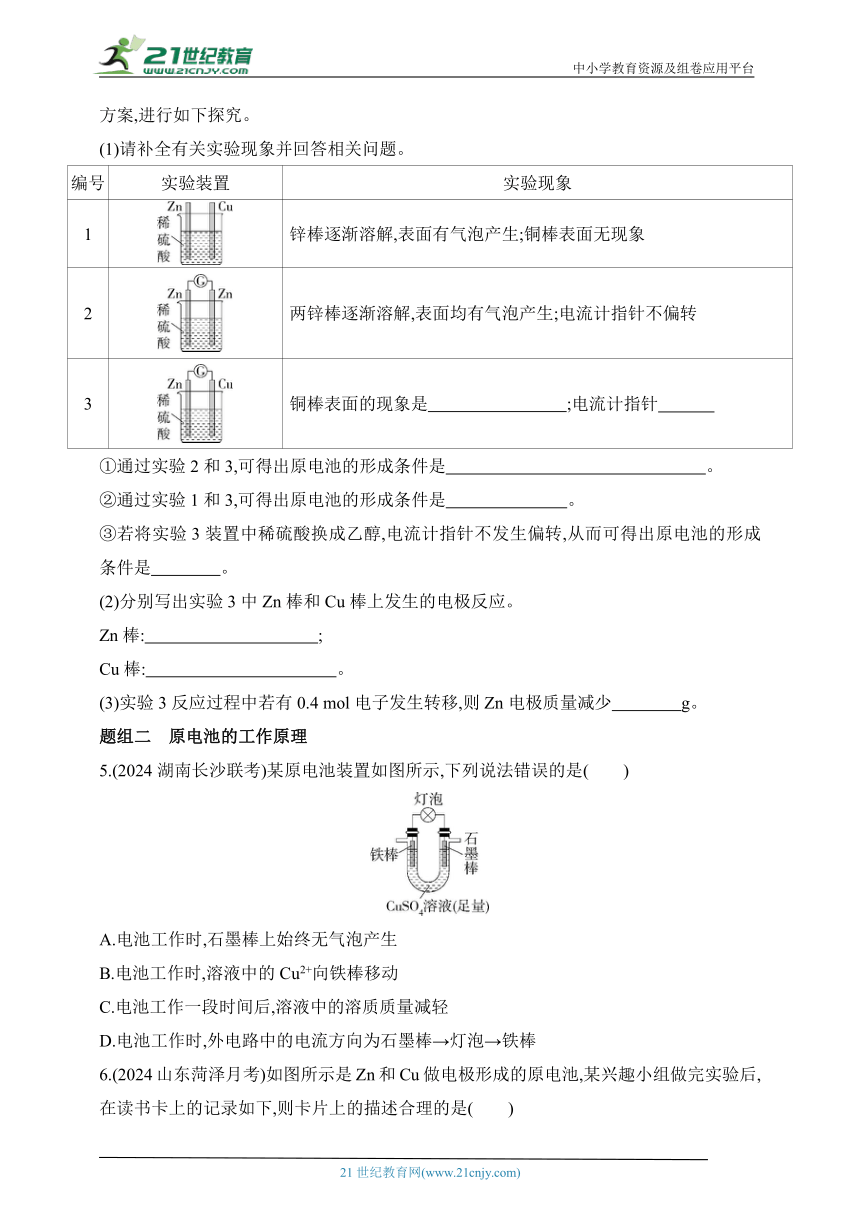
1.(2024江西抚州阶段练习)设计装置将反应2Al+6H+ 2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)( )
2.(2024福建厦门月考)理论上不能设计为原电池的化学反应是( )
A.2FeCl3+Fe 3FeCl2
B.HNO3+NaOH NaNO3+H2O
C.2H2+O2 2H2O
D.CH4+2O2 CO2+2H2O
3.(2024山东淄博期中)下列各组物质组成如图装置,能形成原电池且M是正极的是( )
选项 M N P
A Zn Cu 稀硫酸
B Ag Zn 蔗糖溶液
C Ag Fe FeCl3溶液
D Al Mg NaOH溶液
4.(2023北京一零一中学期中)某化学研究性学习小组针对原电池的形成条件,设计了实验方案,进行如下探究。
(1)请补全有关实验现象并回答相关问题。
编号 实验装置 实验现象
1 锌棒逐渐溶解,表面有气泡产生;铜棒表面无现象
2 两锌棒逐渐溶解,表面均有气泡产生;电流计指针不偏转
3 铜棒表面的现象是 ;电流计指针
①通过实验2和3,可得出原电池的形成条件是 。
②通过实验1和3,可得出原电池的形成条件是 。
③若将实验3装置中稀硫酸换成乙醇,电流计指针不发生偏转,从而可得出原电池的形成条件是 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应。
Zn棒: ;
Cu棒: 。
(3)实验3反应过程中若有0.4 mol电子发生转移,则Zn电极质量减少 g。
题组二 原电池的工作原理
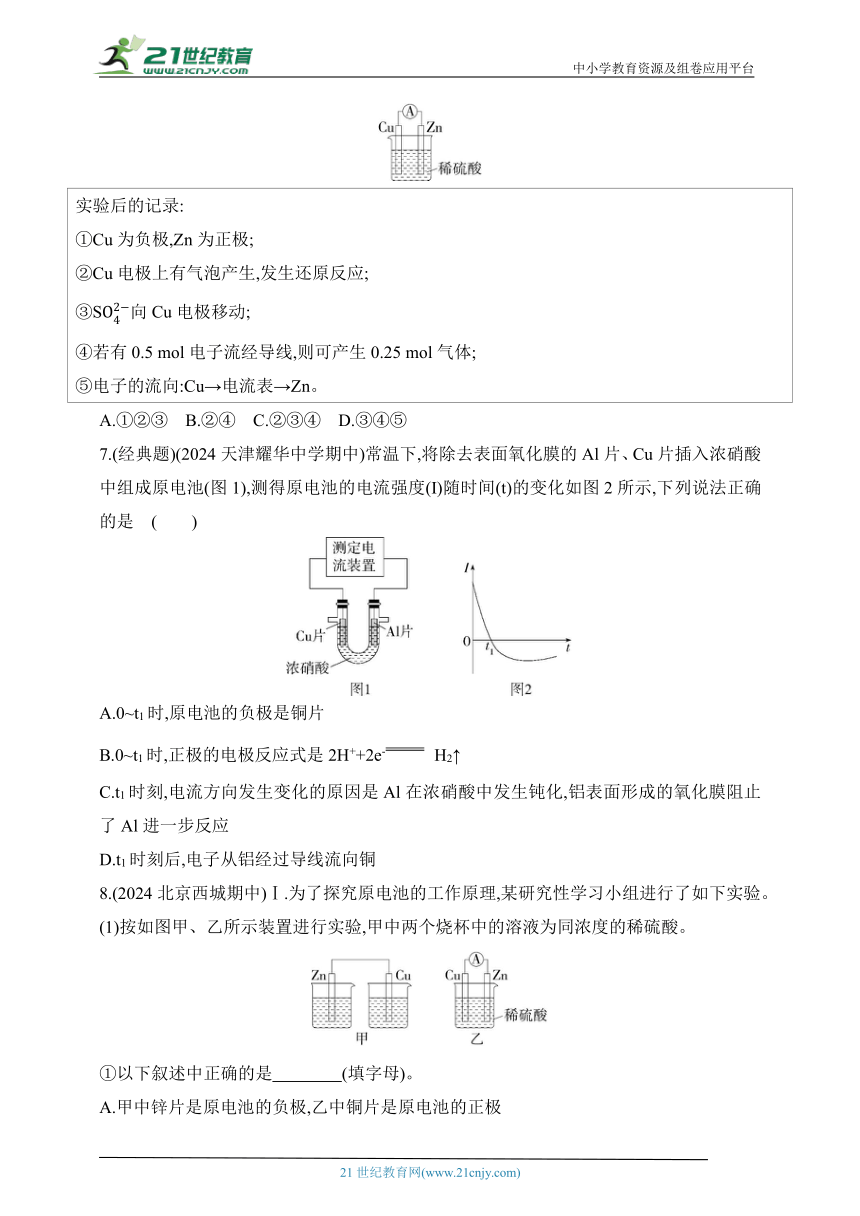
5.(2024湖南长沙联考)某原电池装置如图所示,下列说法错误的是( )
A.电池工作时,石墨棒上始终无气泡产生
B.电池工作时,溶液中的Cu2+向铁棒移动
C.电池工作一段时间后,溶液中的溶质质量减轻
D.电池工作时,外电路中的电流方向为石墨棒→灯泡→铁棒
6.(2024山东菏泽月考)如图所示是Zn和Cu做电极形成的原电池,某兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录: ①Cu为负极,Zn为正极; ②Cu电极上有气泡产生,发生还原反应; ③S向Cu电极移动; ④若有0.5 mol电子流经导线,则可产生0.25 mol气体; ⑤电子的流向:Cu→电流表→Zn。
A.①②③ B.②④ C.②③④ D.③④⑤
7.(经典题)(2024天津耀华中学期中)常温下,将除去表面氧化膜的Al片、Cu片插入浓硝酸中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是 ( )
A.0~t1时,原电池的负极是铜片
B.0~t1时,正极的电极反应式是2H++2e- H2↑
C.t1时刻,电流方向发生变化的原因是Al在浓硝酸中发生钝化,铝表面形成的氧化膜阻止了Al进一步反应
D.t1时刻后,电子从铝经过导线流向铜
8.(2024北京西城期中)Ⅰ.为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)按如图甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。
①以下叙述中正确的是 (填字母)。
A.甲中锌片是原电池的负极,乙中铜片是原电池的正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将乙装置中锌片换成铁片,则电路中的电流方向不变
②在乙装置中,如果把稀硫酸换成硫酸铜溶液,可观察到正极 (填实验现象),其对应的电极反应式为 。
Ⅱ.以下是常见的化学反应。
a.镁与盐酸反应
b.氢氧化钠与盐酸反应
c.盐酸与碳酸氢钠反应
d.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
(2)反应d的化学方程式是 。
(3)从以上反应中选择一个反应设计成原电池。
①将下图原电池装置补充完整。
②证实化学能转化为电能的实验现象是 。
③正极的电极反应式是 。
能力提升练
题组一 原电池原理的应用
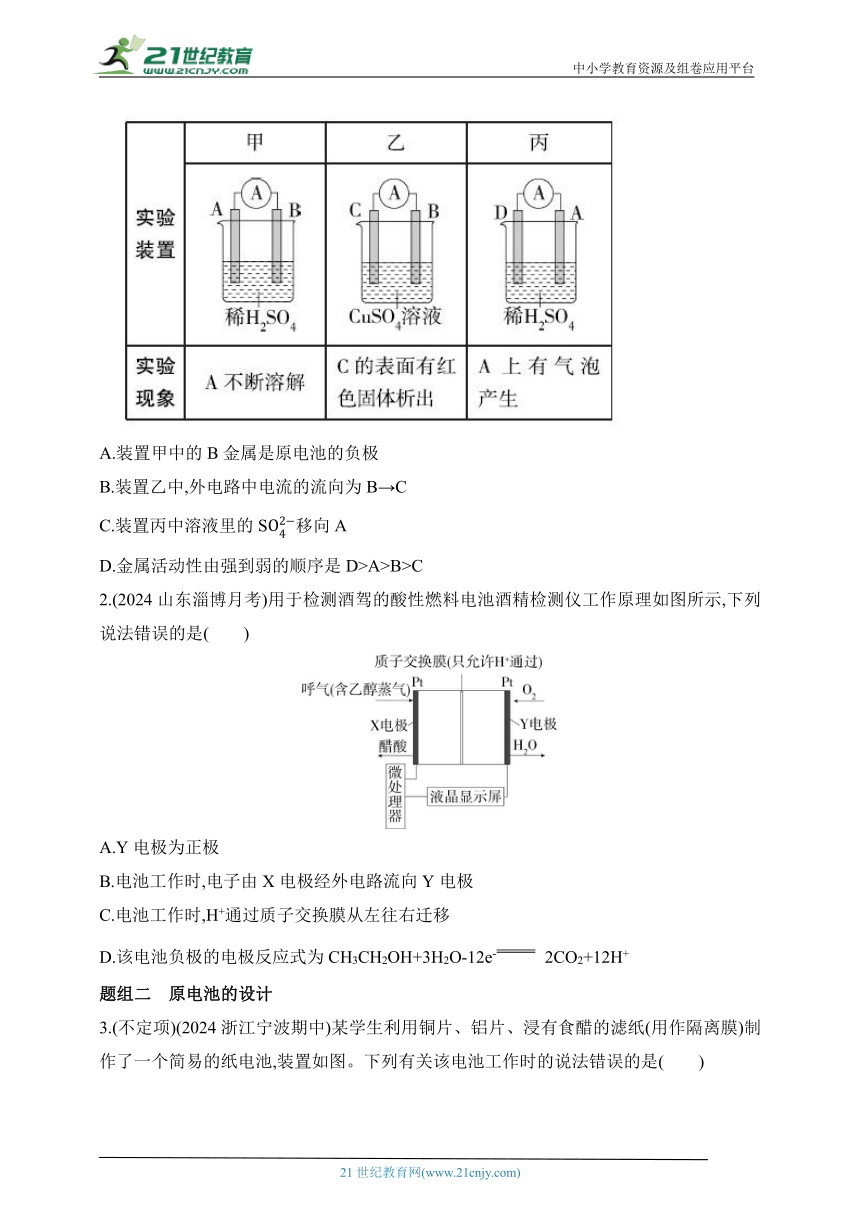
1.(2024安徽六安第一中学期中)用A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
A.装置甲中的B金属是原电池的负极
B.装置乙中,外电路中电流的流向为B→C
C.装置丙中溶液里的S移向A
D.金属活动性由强到弱的顺序是D>A>B>C
2.(2024山东淄博月考)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示,下列说法错误的是( )
A.Y电极为正极
B.电池工作时,电子由X电极经外电路流向Y电极
C.电池工作时,H+通过质子交换膜从左往右迁移
D.该电池负极的电极反应式为CH3CH2OH+3H2O-12e- 2CO2+12H+
题组二 原电池的设计
3.(不定项)(2024浙江宁波期中)某学生利用铜片、铝片、浸有食醋的滤纸(用作隔离膜)制作了一个简易的纸电池,装置如图。下列有关该电池工作时的说法错误的是( )
A.铜片上发生还原反应
B.铝片上发生的电极反应式为Al-3e- Al3+
C.电子由铝片流出经过隔离膜流向铜片
D.若将隔离膜改成浸有NaCl溶液的滤纸,不能构成原电池装置
4.(2024山西太原月考)从理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用反应“Cu+2Ag+ 2Ag+Cu2+”设计了一个原电池,如图所示,已知在外电路中,电流从a极流向b极。请回答下列问题:
(1)b极是电池的 极,材料是 ,写出该电极的电极反应式: 。
(2)a可以为 (填字母)。
A.铜 B.银 C.铁 D.石墨
(3)c是 (填字母)。
A.CuSO4溶液 B.AgNO3溶液 C.酒精溶液
(4)若该反应过程中有0.2 mol电子发生转移,则生成的Ag为 g。
5.(经典题)某兴趣小组在“简易电池的设计与制作”的实验探究中,记录如下:
序号 电极 电极间距 (cm) 果蔬 种类 电流表示数 (μA)
① Cu和Al 2.0 西红柿 78.5
② Cu和Fe a 西红柿 70.3
③ Al和Al 2.0 西红柿 0
④ Cu和Al 2.0 柠檬 45.7
⑤ Cu和Al 1.0 柠檬 98.4
⑥ 石墨棒和Al 1.0 柠檬 104.5
(1)设计实验①④的目的是
。
(2)a为 。
(3)对比实验①②③得出的结论是 。
(4)将实验①中的西红柿换成硫酸铜溶液,进行实验,电流表示数不为零,Cu片上发生的电极反应为 。
6.(2024福建厦门外国语学校期中)某实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 实验现象
上面装置电流计指针向右偏转,灯泡亮;下面装置电流计指针向右偏转,镁条、铝条表面产生无色气泡
(1)该实验中,镁条是原电池的 极。
【实验2】将实验1中的电解质溶液换为NaOH溶液进行实验。
(2)该小组同学认为,此时原电池的总反应为2Al+2NaOH+6H2O 2Na[Al(OH)4]+3H2↑,据此推测应该出现的实验现象为 。
实际观察到的现象如表:
装置 实验现象
ⅰ.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡; ⅱ.电流计指针逐渐归零,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出
(3)ⅰ中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为 。
(4)ⅱ中“电流计指针逐渐归零”的原因是 。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
实验 装置 实验现象
实验3 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少
实验4 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少
(5)根据实验3和实验4可获得的正确推论是 (填字母)。
A.上述两装置中,开始时铜片表面得电子的物质是O2
B.铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C.铜片表面产生的气泡为H2
D.由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与 等因素有关。
答案与分层梯度式解析
第2课时 化学反应与电能
基础过关练
1.B 铝与氢氧化钠溶液反应生成四羟基合铝酸钠和氢气,与题给离子方程式不相符,A不符合题意;铝与稀硫酸反应生成硫酸铝和氢气,铝为负极,铜为正极,该装置将化学能转化为电能,B符合题意;铝与稀硝酸反应不会生成H2,与题给离子方程式不相符,C不符合题意;两个电极相同,不能形成原电池,D不符合题意。
2.B 氯化铁和铁的反应是自发的氧化还原反应,可以设计成原电池,A不符合题意;硝酸和氢氧化钠反应无元素化合价变化,不是氧化还原反应,不能设计成原电池,B符合题意;氢气和氧气的反应是自发的氧化还原反应,可以设计成原电池,C不符合题意;甲烷和氧气的反应是自发的氧化还原反应,可以设计成原电池,D不符合题意。
3.C 锌、铜和稀硫酸构成的原电池中锌是负极,铜是正极,即M是负极,A不选;蔗糖不是电解质,不能形成原电池,B不选;银、铁和氯化铁溶液形成的原电池中铁是负极,银是正极,即M是正极,C选;铝和氢氧化钠溶液反应,镁、铝和氢氧化钠溶液形成的原电池中镁是正极,铝是负极,即M是负极,D不选。
4.答案 (1)有气泡产生 偏转 ①有活泼性不同的两个电极 ②形成闭合回路 ③有电解质溶液
(2)Zn-2e- Zn2+ 2H++2e- H2↑
(3)13
解析 (1)实验1和实验2均没有构成原电池,实验3中构成原电池,锌是负极,失电子,锌棒逐渐溶解,铜是正极,溶液中的氢离子得电子,产生氢气,铜棒表面的现象是有气泡产生,且电流计指针发生偏转。①实验2和3相比,可得出原电池的形成条件是有活泼性不同的两个电极;②实验1和3相比实验3中构成闭合回路,可得出原电池的形成条件是形成闭合回路;③若将实验3装置中稀硫酸换成乙醇,电流计指针不发生偏转,由乙醇不是电解质,硫酸是电解质,可得出原电池形成的条件是有电解质溶液。
(2)锌是负极,发生失去电子的氧化反应,电极反应为Zn-2e- Zn2+;铜是正极,溶液中的氢离子放电,电极反应为2H++2e- H2↑。
(3)实验3中锌是负极,铜是正极,反应过程中若有0.4 mol电子发生转移,根据Zn-2e- Zn2+可知消耗0.2 mol锌,Zn电极质量减轻0.2 mol×65 g/mol=13 g。
5.B 铁棒为负极,石墨棒为正极,正极上铜离子得电子生成单质铜,硫酸铜溶液足量,石墨棒上始终无气泡产生,A正确;石墨棒为正极,正极上铜离子得电子生成单质铜,溶液中的铜离子向石墨棒移动,B错误;电池总反应为Fe+Cu2+ Fe2++Cu,当溶液中有1 mol Cu2+变成单质铜时,会有1 mol Fe2+进入溶液中,电池工作一段时间后,溶液中的溶质质量减轻,C正确;铁棒为负极,石墨棒为正极,外电路中的电流方向为石墨棒→灯泡→铁棒,D正确。
6.B 该原电池中,Zn为负极,Cu为正极,①错误;铜电极上电极反应为2H++2e- H2↑,发生还原反应,②正确;硫酸根离子向负极(锌)移动,③错误;若有0.5 mol电子流经导线,则可产生气体的物质的量为=0.25 mol,④正确;电子由Zn电极经外电路流向Cu电极,⑤错误;B正确。
7.C 0~t1时,Al为负极,被氧化生成氧化铝,Cu为正极,硝酸根离子得电子生成二氧化氮;随着时间推移,铝表面的氧化膜阻碍反应进行,t1后,铜为负极,Al为正极。0~t1时,铜为正极,铝为负极,A错误;0~t1时,正极的电极反应式为2H++N+e- NO2↑+H2O,B错误;随着时间推移,铝表面形成的氧化膜阻止了Al进一步反应,因此t1时刻电流方向发生了变化,C正确;t1时刻后,铜为负极,电子从铜经导线流向铝,D错误。
8.答案 Ⅰ.(1)①CD ②有红色物质析出 Cu2++2e- Cu
Ⅱ.(2)Ba(OH)2·8H2O+2NH4Cl 2NH3↑+BaCl2+10H2O
(3)①
②电流表指针偏转,石墨电极上有气泡冒出
③2H++2e- H2↑
解析 Ⅰ.(1)①甲中未形成闭合回路,没有形成原电池,A错误;甲装置未形成原电池,铜不与稀硫酸反应,甲装置铜片表面无气泡,B错误;乙装置中Zn为负极,Cu为正极,外电路中电流从Cu流向Zn,C正确;将乙装置中的锌片换成铁片,Fe为负极,Cu为正极,则电路中的电流方向不变,D正确。②乙装置中,稀硫酸换成硫酸铜溶液,正极上发生反应Cu2++2e- Cu,观察到有红色物质析出。Ⅱ.(2)Ba(OH)2·8H2O晶体与NH4Cl晶体反应放出氨气,反应的化学方程式为Ba(OH)2·8H2O+2NH4Cl 2NH3↑+BaCl2+10H2O。(3)①所给4个反应中,只有镁与盐酸反应为放热的可自发进行的氧化还原反应,可设计成原电池,其中Mg失电子生成Mg2+,做负极,石墨做正极,装置如图。②该原电池工作时,Mg失电子生成Mg2+,做负极,石墨做正极,电路中电子由负极Mg经过导线流向正极石墨,则电流表指针发生偏转,在正极H+得电子生成H2,石墨电极上有气泡冒出。③正极的电极反应式为2H++2e- H2↑。
能力提升练
1.D 装置甲中A不断溶解,则A为负极,B为正极,A错误;装置乙中C的表面有红色固体析出,则C为正极,B为负极,外电路中电流方向:C→B,B错误;装置丙中A上有气泡产生,则A为正极,D为负极,溶液中S向D移动,C错误;根据实验现象可知金属活动性:A>B、B>C、D>A,故金属活动性:D>A>B>C,D正确。
2.D 由题图可知,乙醇酸性燃料电池中,乙醇发生失电子的氧化反应生成醋酸,则乙醇所在铂电极为负极,O2所在的铂电极为正极,发生得电子的还原反应,电极反应式为O2+4e-+4H+ 2H2O。由上述分析可知,Y电极是正极,A正确;该原电池中左侧Pt电极(X电极)为负极,右侧Pt电极(Y电极)为正极,放电时电子由负极经外电路流向正极,即电子由呼气的铂电极(X电极)经外电路流向O2所在的铂电极(Y电极),B正确;该原电池中H+通过质子交换膜从左往右迁移,C正确;乙醇发生失电子的氧化反应生成醋酸,负极的电极反应式为CH3CH2OH-4e-+H2O 4H++CH3COOH,D错误。
3.CD Al比Cu活泼,铝片为负极,铜片为正极,正极上发生得电子的还原反应,故A正确;原电池工作时,Al为负极,负极电极反应式为Al-3e- Al3+,故B正确;电子不能经过隔离膜,故C错误;若将隔离膜改成浸有NaCl溶液的滤纸,铝片为负极,铜片为正极,正极上O2发生得电子的还原反应,正极反应式为O2+4e-+2H2O 4OH-,也可以构成原电池,故D错误。
名师点津 本类题目考查原电池的工作原理,把握电极的判断、电极反应式书写是解题关键,尤其要注意电解质溶液中溶有的氧气可能参与反应。
4.答案 (1)负 Cu Cu-2e- Cu2+
(2)BD
(3)B
(4)21.6
解析 由题干信息可知,原电池中,电流从a极流向b极,则a为正极,得到电子,发生还原反应,b为负极,失去电子,发生氧化反应。(1)根据上述分析知,b是电池的负极,失去电子,反应Cu+2Ag+ 2Ag+Cu2+中Cu失去电子,故Cu做负极,发生的电极反应为Cu-2e- Cu2+。(2)a是电池的正极,电极材料可以是比铜活泼性差的Ag,也可以是石墨。(3)电解质溶液c是含有Ag+的溶液。(4)转移0.2 mol电子生成Ag的质量为108 g/mol×0.2 mol=21.6 g。
5.答案 (1)探究果蔬种类对电池效果的影响
(2)2.0
(3)其他条件相同时,电极材料活泼性差别越大,电池效果越好
(4)Cu2++2e- Cu
解析 (1)实验①④,除了果蔬种类不同,其他条件都相同,目的是探究果蔬种类对电池效果的影响。(2)实验①②电极材料有区别,应是探究电极材料对电池效果的影响,要控制变量,保证其他条件相同,所以a=2.0。(3)实验①②③中电极材料有区别,其他条件相同,探究的是电极材料对电池效果的影响,金属活动性顺序:Al>Fe>Cu,根据电流表示数可知,其他条件相同时,电极材料活泼性差别越大,电池效果越好。(4)铝比铜活泼,实验①中的西红柿换成硫酸铜溶液,铝做负极,铜做正极,正极上铜离子得电子生成单质铜,电极反应为Cu2++2e- Cu。
6.答案 (1)负 (2)电流计指针向左偏转,Al电极将不断减少,Mg电极上产生大量的气泡 (3)O2+2H2O+4e- 4OH- (4)Mg放电后生成Mg(OH)2,附着在镁条表面,使Mg的放电反应难以发生,导致指针归零 (5)ABC (6)另一电极材料、电解质溶液的酸碱性、电解质溶液中溶解的O2
解析 (1)Mg、Al均能与盐酸反应,Mg更活泼,做负极。(2)将电解质溶液换成NaOH溶液,Mg不与NaOH溶液反应,而Al能与NaOH溶液反应,此时原电池的总反应为2Al+2NaOH+6H2O 2Na[Al(OH)4]+3H2↑,据此推测应该出现的实验现象为Al电极将不断溶解,Mg电极上产生大量的气泡。(3)ⅰ中铝条表面放电的物质是溶解在溶液中的O2,即氧气在正极上发生得电子的还原反应,电极反应式为O2+2H2O+4e- 4OH-。(4)金属镁失电子得到的镁离子可以在碱性环境下生成难溶的氢氧化镁,附着在金属镁表面,阻止反应进行,导致指针归零。(5)根据实验3和实验4的实验现象可知,开始时铜片表面得电子的物质是O2,电极反应式为O2+2H2O+4e- 4OH-,故A正确;铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关,溶解的氧气越多,则铜片表面开始产生气泡的时间越长,故B正确;铜片表面产生的少量气泡为H2O得到电子生成的H2,即铜片表面产生的气泡为H2,故C正确;NaOH溶液中H+的量极少,正极得电子的物质应该是H2O,由“铝条表面气泡略有减少”能推测H2O在铜片表面得电子生成氢气,故D错误。(6)铝片做电极材料时的原电池反应受多种因素的影响,与另一电极材料、电解质溶液的酸碱性、电解质溶液中溶解的O2等有关。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁教版高中化学必修第二册
第2课时 化学反应与电能
基础过关练
题组一 原电池的构成条件
1.(2024江西抚州阶段练习)设计装置将反应2Al+6H+ 2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)( )
2.(2024福建厦门月考)理论上不能设计为原电池的化学反应是( )
A.2FeCl3+Fe 3FeCl2
B.HNO3+NaOH NaNO3+H2O
C.2H2+O2 2H2O
D.CH4+2O2 CO2+2H2O
3.(2024山东淄博期中)下列各组物质组成如图装置,能形成原电池且M是正极的是( )
选项 M N P
A Zn Cu 稀硫酸
B Ag Zn 蔗糖溶液
C Ag Fe FeCl3溶液
D Al Mg NaOH溶液
4.(2023北京一零一中学期中)某化学研究性学习小组针对原电池的形成条件,设计了实验方案,进行如下探究。
(1)请补全有关实验现象并回答相关问题。
编号 实验装置 实验现象
1 锌棒逐渐溶解,表面有气泡产生;铜棒表面无现象
2 两锌棒逐渐溶解,表面均有气泡产生;电流计指针不偏转
3 铜棒表面的现象是 ;电流计指针
①通过实验2和3,可得出原电池的形成条件是 。
②通过实验1和3,可得出原电池的形成条件是 。
③若将实验3装置中稀硫酸换成乙醇,电流计指针不发生偏转,从而可得出原电池的形成条件是 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应。
Zn棒: ;
Cu棒: 。
(3)实验3反应过程中若有0.4 mol电子发生转移,则Zn电极质量减少 g。
题组二 原电池的工作原理
5.(2024湖南长沙联考)某原电池装置如图所示,下列说法错误的是( )
A.电池工作时,石墨棒上始终无气泡产生
B.电池工作时,溶液中的Cu2+向铁棒移动
C.电池工作一段时间后,溶液中的溶质质量减轻
D.电池工作时,外电路中的电流方向为石墨棒→灯泡→铁棒
6.(2024山东菏泽月考)如图所示是Zn和Cu做电极形成的原电池,某兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录: ①Cu为负极,Zn为正极; ②Cu电极上有气泡产生,发生还原反应; ③S向Cu电极移动; ④若有0.5 mol电子流经导线,则可产生0.25 mol气体; ⑤电子的流向:Cu→电流表→Zn。
A.①②③ B.②④ C.②③④ D.③④⑤
7.(经典题)(2024天津耀华中学期中)常温下,将除去表面氧化膜的Al片、Cu片插入浓硝酸中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是 ( )
A.0~t1时,原电池的负极是铜片
B.0~t1时,正极的电极反应式是2H++2e- H2↑
C.t1时刻,电流方向发生变化的原因是Al在浓硝酸中发生钝化,铝表面形成的氧化膜阻止了Al进一步反应
D.t1时刻后,电子从铝经过导线流向铜
8.(2024北京西城期中)Ⅰ.为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)按如图甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。
①以下叙述中正确的是 (填字母)。
A.甲中锌片是原电池的负极,乙中铜片是原电池的正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将乙装置中锌片换成铁片,则电路中的电流方向不变
②在乙装置中,如果把稀硫酸换成硫酸铜溶液,可观察到正极 (填实验现象),其对应的电极反应式为 。
Ⅱ.以下是常见的化学反应。
a.镁与盐酸反应
b.氢氧化钠与盐酸反应
c.盐酸与碳酸氢钠反应
d.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
(2)反应d的化学方程式是 。
(3)从以上反应中选择一个反应设计成原电池。
①将下图原电池装置补充完整。
②证实化学能转化为电能的实验现象是 。
③正极的电极反应式是 。
能力提升练
题组一 原电池原理的应用
1.(2024安徽六安第一中学期中)用A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
A.装置甲中的B金属是原电池的负极
B.装置乙中,外电路中电流的流向为B→C
C.装置丙中溶液里的S移向A
D.金属活动性由强到弱的顺序是D>A>B>C
2.(2024山东淄博月考)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示,下列说法错误的是( )
A.Y电极为正极
B.电池工作时,电子由X电极经外电路流向Y电极
C.电池工作时,H+通过质子交换膜从左往右迁移
D.该电池负极的电极反应式为CH3CH2OH+3H2O-12e- 2CO2+12H+
题组二 原电池的设计
3.(不定项)(2024浙江宁波期中)某学生利用铜片、铝片、浸有食醋的滤纸(用作隔离膜)制作了一个简易的纸电池,装置如图。下列有关该电池工作时的说法错误的是( )
A.铜片上发生还原反应
B.铝片上发生的电极反应式为Al-3e- Al3+
C.电子由铝片流出经过隔离膜流向铜片
D.若将隔离膜改成浸有NaCl溶液的滤纸,不能构成原电池装置
4.(2024山西太原月考)从理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用反应“Cu+2Ag+ 2Ag+Cu2+”设计了一个原电池,如图所示,已知在外电路中,电流从a极流向b极。请回答下列问题:
(1)b极是电池的 极,材料是 ,写出该电极的电极反应式: 。
(2)a可以为 (填字母)。
A.铜 B.银 C.铁 D.石墨
(3)c是 (填字母)。
A.CuSO4溶液 B.AgNO3溶液 C.酒精溶液
(4)若该反应过程中有0.2 mol电子发生转移,则生成的Ag为 g。
5.(经典题)某兴趣小组在“简易电池的设计与制作”的实验探究中,记录如下:
序号 电极 电极间距 (cm) 果蔬 种类 电流表示数 (μA)
① Cu和Al 2.0 西红柿 78.5
② Cu和Fe a 西红柿 70.3
③ Al和Al 2.0 西红柿 0
④ Cu和Al 2.0 柠檬 45.7
⑤ Cu和Al 1.0 柠檬 98.4
⑥ 石墨棒和Al 1.0 柠檬 104.5
(1)设计实验①④的目的是
。
(2)a为 。
(3)对比实验①②③得出的结论是 。
(4)将实验①中的西红柿换成硫酸铜溶液,进行实验,电流表示数不为零,Cu片上发生的电极反应为 。
6.(2024福建厦门外国语学校期中)某实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 实验现象
上面装置电流计指针向右偏转,灯泡亮;下面装置电流计指针向右偏转,镁条、铝条表面产生无色气泡
(1)该实验中,镁条是原电池的 极。
【实验2】将实验1中的电解质溶液换为NaOH溶液进行实验。
(2)该小组同学认为,此时原电池的总反应为2Al+2NaOH+6H2O 2Na[Al(OH)4]+3H2↑,据此推测应该出现的实验现象为 。
实际观察到的现象如表:
装置 实验现象
ⅰ.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡; ⅱ.电流计指针逐渐归零,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出
(3)ⅰ中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为 。
(4)ⅱ中“电流计指针逐渐归零”的原因是 。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
实验 装置 实验现象
实验3 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少
实验4 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少
(5)根据实验3和实验4可获得的正确推论是 (填字母)。
A.上述两装置中,开始时铜片表面得电子的物质是O2
B.铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C.铜片表面产生的气泡为H2
D.由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与 等因素有关。
答案与分层梯度式解析
第2课时 化学反应与电能
基础过关练
1.B 铝与氢氧化钠溶液反应生成四羟基合铝酸钠和氢气,与题给离子方程式不相符,A不符合题意;铝与稀硫酸反应生成硫酸铝和氢气,铝为负极,铜为正极,该装置将化学能转化为电能,B符合题意;铝与稀硝酸反应不会生成H2,与题给离子方程式不相符,C不符合题意;两个电极相同,不能形成原电池,D不符合题意。
2.B 氯化铁和铁的反应是自发的氧化还原反应,可以设计成原电池,A不符合题意;硝酸和氢氧化钠反应无元素化合价变化,不是氧化还原反应,不能设计成原电池,B符合题意;氢气和氧气的反应是自发的氧化还原反应,可以设计成原电池,C不符合题意;甲烷和氧气的反应是自发的氧化还原反应,可以设计成原电池,D不符合题意。
3.C 锌、铜和稀硫酸构成的原电池中锌是负极,铜是正极,即M是负极,A不选;蔗糖不是电解质,不能形成原电池,B不选;银、铁和氯化铁溶液形成的原电池中铁是负极,银是正极,即M是正极,C选;铝和氢氧化钠溶液反应,镁、铝和氢氧化钠溶液形成的原电池中镁是正极,铝是负极,即M是负极,D不选。
4.答案 (1)有气泡产生 偏转 ①有活泼性不同的两个电极 ②形成闭合回路 ③有电解质溶液
(2)Zn-2e- Zn2+ 2H++2e- H2↑
(3)13
解析 (1)实验1和实验2均没有构成原电池,实验3中构成原电池,锌是负极,失电子,锌棒逐渐溶解,铜是正极,溶液中的氢离子得电子,产生氢气,铜棒表面的现象是有气泡产生,且电流计指针发生偏转。①实验2和3相比,可得出原电池的形成条件是有活泼性不同的两个电极;②实验1和3相比实验3中构成闭合回路,可得出原电池的形成条件是形成闭合回路;③若将实验3装置中稀硫酸换成乙醇,电流计指针不发生偏转,由乙醇不是电解质,硫酸是电解质,可得出原电池形成的条件是有电解质溶液。
(2)锌是负极,发生失去电子的氧化反应,电极反应为Zn-2e- Zn2+;铜是正极,溶液中的氢离子放电,电极反应为2H++2e- H2↑。
(3)实验3中锌是负极,铜是正极,反应过程中若有0.4 mol电子发生转移,根据Zn-2e- Zn2+可知消耗0.2 mol锌,Zn电极质量减轻0.2 mol×65 g/mol=13 g。
5.B 铁棒为负极,石墨棒为正极,正极上铜离子得电子生成单质铜,硫酸铜溶液足量,石墨棒上始终无气泡产生,A正确;石墨棒为正极,正极上铜离子得电子生成单质铜,溶液中的铜离子向石墨棒移动,B错误;电池总反应为Fe+Cu2+ Fe2++Cu,当溶液中有1 mol Cu2+变成单质铜时,会有1 mol Fe2+进入溶液中,电池工作一段时间后,溶液中的溶质质量减轻,C正确;铁棒为负极,石墨棒为正极,外电路中的电流方向为石墨棒→灯泡→铁棒,D正确。
6.B 该原电池中,Zn为负极,Cu为正极,①错误;铜电极上电极反应为2H++2e- H2↑,发生还原反应,②正确;硫酸根离子向负极(锌)移动,③错误;若有0.5 mol电子流经导线,则可产生气体的物质的量为=0.25 mol,④正确;电子由Zn电极经外电路流向Cu电极,⑤错误;B正确。
7.C 0~t1时,Al为负极,被氧化生成氧化铝,Cu为正极,硝酸根离子得电子生成二氧化氮;随着时间推移,铝表面的氧化膜阻碍反应进行,t1后,铜为负极,Al为正极。0~t1时,铜为正极,铝为负极,A错误;0~t1时,正极的电极反应式为2H++N+e- NO2↑+H2O,B错误;随着时间推移,铝表面形成的氧化膜阻止了Al进一步反应,因此t1时刻电流方向发生了变化,C正确;t1时刻后,铜为负极,电子从铜经导线流向铝,D错误。
8.答案 Ⅰ.(1)①CD ②有红色物质析出 Cu2++2e- Cu
Ⅱ.(2)Ba(OH)2·8H2O+2NH4Cl 2NH3↑+BaCl2+10H2O
(3)①
②电流表指针偏转,石墨电极上有气泡冒出
③2H++2e- H2↑
解析 Ⅰ.(1)①甲中未形成闭合回路,没有形成原电池,A错误;甲装置未形成原电池,铜不与稀硫酸反应,甲装置铜片表面无气泡,B错误;乙装置中Zn为负极,Cu为正极,外电路中电流从Cu流向Zn,C正确;将乙装置中的锌片换成铁片,Fe为负极,Cu为正极,则电路中的电流方向不变,D正确。②乙装置中,稀硫酸换成硫酸铜溶液,正极上发生反应Cu2++2e- Cu,观察到有红色物质析出。Ⅱ.(2)Ba(OH)2·8H2O晶体与NH4Cl晶体反应放出氨气,反应的化学方程式为Ba(OH)2·8H2O+2NH4Cl 2NH3↑+BaCl2+10H2O。(3)①所给4个反应中,只有镁与盐酸反应为放热的可自发进行的氧化还原反应,可设计成原电池,其中Mg失电子生成Mg2+,做负极,石墨做正极,装置如图。②该原电池工作时,Mg失电子生成Mg2+,做负极,石墨做正极,电路中电子由负极Mg经过导线流向正极石墨,则电流表指针发生偏转,在正极H+得电子生成H2,石墨电极上有气泡冒出。③正极的电极反应式为2H++2e- H2↑。
能力提升练
1.D 装置甲中A不断溶解,则A为负极,B为正极,A错误;装置乙中C的表面有红色固体析出,则C为正极,B为负极,外电路中电流方向:C→B,B错误;装置丙中A上有气泡产生,则A为正极,D为负极,溶液中S向D移动,C错误;根据实验现象可知金属活动性:A>B、B>C、D>A,故金属活动性:D>A>B>C,D正确。
2.D 由题图可知,乙醇酸性燃料电池中,乙醇发生失电子的氧化反应生成醋酸,则乙醇所在铂电极为负极,O2所在的铂电极为正极,发生得电子的还原反应,电极反应式为O2+4e-+4H+ 2H2O。由上述分析可知,Y电极是正极,A正确;该原电池中左侧Pt电极(X电极)为负极,右侧Pt电极(Y电极)为正极,放电时电子由负极经外电路流向正极,即电子由呼气的铂电极(X电极)经外电路流向O2所在的铂电极(Y电极),B正确;该原电池中H+通过质子交换膜从左往右迁移,C正确;乙醇发生失电子的氧化反应生成醋酸,负极的电极反应式为CH3CH2OH-4e-+H2O 4H++CH3COOH,D错误。
3.CD Al比Cu活泼,铝片为负极,铜片为正极,正极上发生得电子的还原反应,故A正确;原电池工作时,Al为负极,负极电极反应式为Al-3e- Al3+,故B正确;电子不能经过隔离膜,故C错误;若将隔离膜改成浸有NaCl溶液的滤纸,铝片为负极,铜片为正极,正极上O2发生得电子的还原反应,正极反应式为O2+4e-+2H2O 4OH-,也可以构成原电池,故D错误。
名师点津 本类题目考查原电池的工作原理,把握电极的判断、电极反应式书写是解题关键,尤其要注意电解质溶液中溶有的氧气可能参与反应。
4.答案 (1)负 Cu Cu-2e- Cu2+
(2)BD
(3)B
(4)21.6
解析 由题干信息可知,原电池中,电流从a极流向b极,则a为正极,得到电子,发生还原反应,b为负极,失去电子,发生氧化反应。(1)根据上述分析知,b是电池的负极,失去电子,反应Cu+2Ag+ 2Ag+Cu2+中Cu失去电子,故Cu做负极,发生的电极反应为Cu-2e- Cu2+。(2)a是电池的正极,电极材料可以是比铜活泼性差的Ag,也可以是石墨。(3)电解质溶液c是含有Ag+的溶液。(4)转移0.2 mol电子生成Ag的质量为108 g/mol×0.2 mol=21.6 g。
5.答案 (1)探究果蔬种类对电池效果的影响
(2)2.0
(3)其他条件相同时,电极材料活泼性差别越大,电池效果越好
(4)Cu2++2e- Cu
解析 (1)实验①④,除了果蔬种类不同,其他条件都相同,目的是探究果蔬种类对电池效果的影响。(2)实验①②电极材料有区别,应是探究电极材料对电池效果的影响,要控制变量,保证其他条件相同,所以a=2.0。(3)实验①②③中电极材料有区别,其他条件相同,探究的是电极材料对电池效果的影响,金属活动性顺序:Al>Fe>Cu,根据电流表示数可知,其他条件相同时,电极材料活泼性差别越大,电池效果越好。(4)铝比铜活泼,实验①中的西红柿换成硫酸铜溶液,铝做负极,铜做正极,正极上铜离子得电子生成单质铜,电极反应为Cu2++2e- Cu。
6.答案 (1)负 (2)电流计指针向左偏转,Al电极将不断减少,Mg电极上产生大量的气泡 (3)O2+2H2O+4e- 4OH- (4)Mg放电后生成Mg(OH)2,附着在镁条表面,使Mg的放电反应难以发生,导致指针归零 (5)ABC (6)另一电极材料、电解质溶液的酸碱性、电解质溶液中溶解的O2
解析 (1)Mg、Al均能与盐酸反应,Mg更活泼,做负极。(2)将电解质溶液换成NaOH溶液,Mg不与NaOH溶液反应,而Al能与NaOH溶液反应,此时原电池的总反应为2Al+2NaOH+6H2O 2Na[Al(OH)4]+3H2↑,据此推测应该出现的实验现象为Al电极将不断溶解,Mg电极上产生大量的气泡。(3)ⅰ中铝条表面放电的物质是溶解在溶液中的O2,即氧气在正极上发生得电子的还原反应,电极反应式为O2+2H2O+4e- 4OH-。(4)金属镁失电子得到的镁离子可以在碱性环境下生成难溶的氢氧化镁,附着在金属镁表面,阻止反应进行,导致指针归零。(5)根据实验3和实验4的实验现象可知,开始时铜片表面得电子的物质是O2,电极反应式为O2+2H2O+4e- 4OH-,故A正确;铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关,溶解的氧气越多,则铜片表面开始产生气泡的时间越长,故B正确;铜片表面产生的少量气泡为H2O得到电子生成的H2,即铜片表面产生的气泡为H2,故C正确;NaOH溶液中H+的量极少,正极得电子的物质应该是H2O,由“铝条表面气泡略有减少”能推测H2O在铜片表面得电子生成氢气,故D错误。(6)铝片做电极材料时的原电池反应受多种因素的影响,与另一电极材料、电解质溶液的酸碱性、电解质溶液中溶解的O2等有关。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
