北京市清华大学附属中学朝阳学校2024-2025学年高二上学期期中考试化学试卷(扫描版,无答案)
文档属性
| 名称 | 北京市清华大学附属中学朝阳学校2024-2025学年高二上学期期中考试化学试卷(扫描版,无答案) |

|
|
| 格式 | |||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-26 00:00:00 | ||
图片预览



文档简介
2024-2025学年度第一学期期中试卷
高二化学
2024年11月
(清华附中朝阳学校望京学校)
本试卷共9页,100分。考试时长90分钟。请将答案答在答题卡上,在试卷上作答无效。
可能用到的相对原子质量:N14016
第一部分
共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CSO4溶液,向地下深层渗透,遇到难
溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析不正确的是
A.CuS的溶解度小于PbS的溶解度
B.原生铜的硫化物、铜蓝均具有还原性
C.CuS04与ZnS反应的离子方程式是Cu4+S2-=CuSl
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
2.酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是
A.石墨作电池的负极材料
石墨电极
B.电池工作时,N向负极方向移动
二氧化:和炭黑
C.MnO2发生氧化反应
氯化校和氨化僻
锌筒
D.锌筒发生的电极反应为Zn-2e一Z+
3.下列实验事实不能用平衡移动原理解释的是
Mno
r℃
25
50
100
B
Kw/104
1.01
5.47
55.0
0剂液
一Hz0,溶液
c(氨水)/(molL)
0.1
0.01
冷水
热水
pH
11.1
10.6
C.将NO球汉泡在冷水和热水中
0
4.工业合成NH:N2(g)+3H(g)
高温、高压
2NH(g)△H<0。下列分析不正确的是
催化剂
A.使用催化剂可以提高反应物中活化分子百分数,但不能改变反应的△1
B.增大合成氨的反应速率与提高平衡混合物中氨的含量所采取的措施均一致
C.已知平衡体系中NH的沸点最高,则可通过液化的方法分离出NH3,从而提高其产率
D.断裂1molN2和3molH2的共价键所需能量小于断裂2 mol NH3的共价键所需能量
高二化学第1页(共9页)
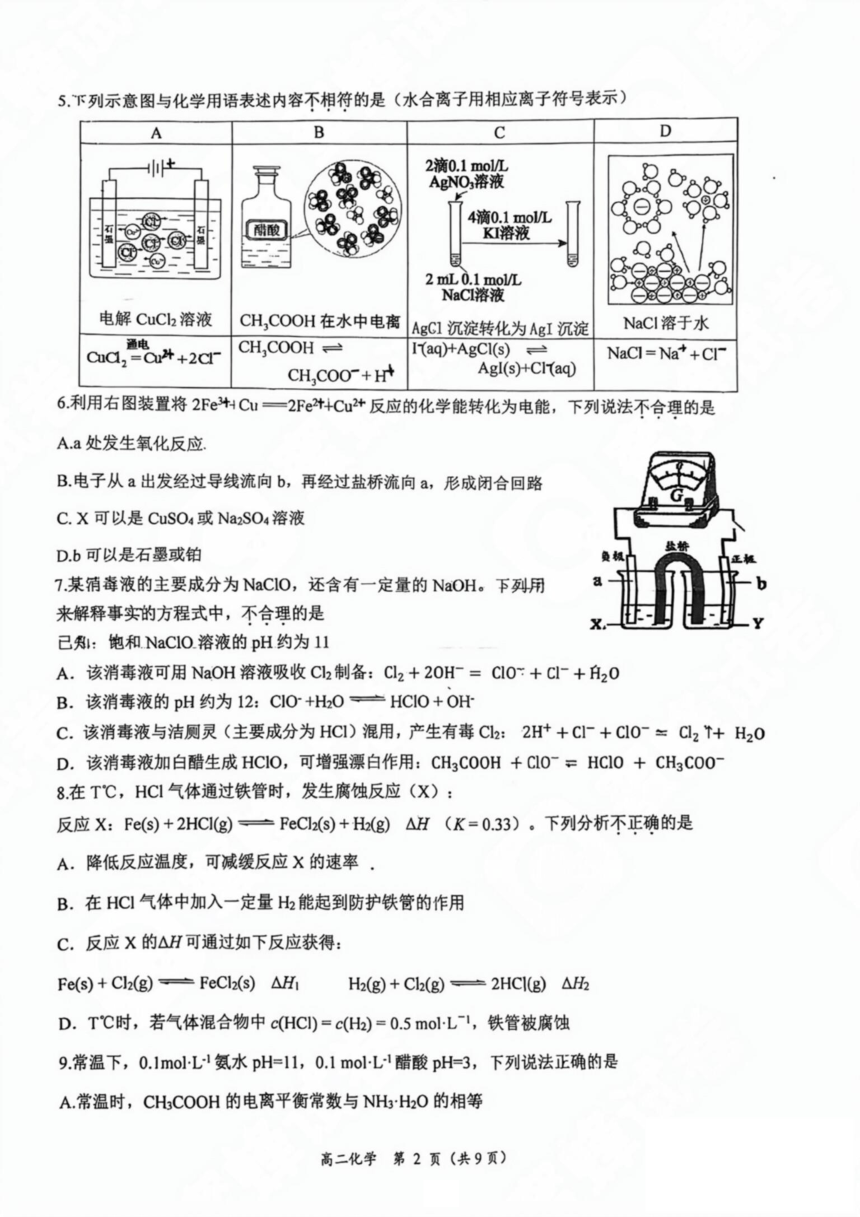
5.下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A
B
C
D
2滴0.1mol/L
AgNO,溶液
4滴0.1molL
酸
KI溶液
2 mL 0.1 mol/L
NaC溶液
电解CuCh溶液
CH,COOH在水中电离
AgCI沉淀转化为AgI沉淀
NaCl溶于水
通电
Cudl,=Cu++2cl-
CH,COOH≌
I(aq)+AgCl(s)≌
NaCI=Na*+CI-
CH,COO-+H
AgI(s)+CIaq)
6.利用右图装置将2FeHC1一2Fe2t+Cu2+反应的化学能转化为电能,下列说法不合理的是
A.a处发生氧化反应
B.电子从a出发经过导线流向b,再经过盐桥流向a,形成闭合回路
C.X可以是CuSO4或Na2SO4溶液
D.b可以是石墨或铂
7.某猜毒液的主要成分为NaCIo,还含有一定量的NaOH。下列用
来解释事实的方程式中,不合理的是
已:饱和NaCIo.溶液的pH约为11
A.该消毒液可用NaOH溶液吸收Ch制备:Cl2+20H=Cl0:+C+A20
B.该消毒液的pH约为12:CIO+HO产HCIO+OH
C.该消毒液与洁厕灵(主要成分为HCI)混用,产生有毒C2:2H++CI+C10~=Cl2↑+H20
D.该消毒液加白醋生成HCIO,可增强漂白作用:CH3C00H+Cl0~=HCI0+CH3C00
8.在T℃,HCI气体通过铁管时,发生腐蚀反应(X):
反应X:Fe(s)+2HCl(g)产FeCl2(s)+H(g)△H(K=0.33)。下列分析不正确的是
A.降低反应温度,可减缓反应X的速率
B.在HC!气体中加入一定量H能起到防护铁管的作用
C.反应X的△H可通过如下反应获得:
Fe(s)+Cl2(g)=FeCl2(s)AH
H2(g)+Cl2(g)=2HCI(g)AF2
D.T℃时,若气体混合物中c(HC)=c(Hh)=0.5molL1,铁管被腐蚀
9.常温下,0.1moL1氨水pH=11,0.1molL1醋酸pH=3,下列说法正确的是
A.常温时,CH3COOH的电离平衡常数与NHH2O的相等
高二化学第2页(共9页)
高二化学
2024年11月
(清华附中朝阳学校望京学校)
本试卷共9页,100分。考试时长90分钟。请将答案答在答题卡上,在试卷上作答无效。
可能用到的相对原子质量:N14016
第一部分
共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CSO4溶液,向地下深层渗透,遇到难
溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析不正确的是
A.CuS的溶解度小于PbS的溶解度
B.原生铜的硫化物、铜蓝均具有还原性
C.CuS04与ZnS反应的离子方程式是Cu4+S2-=CuSl
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
2.酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是
A.石墨作电池的负极材料
石墨电极
B.电池工作时,N向负极方向移动
二氧化:和炭黑
C.MnO2发生氧化反应
氯化校和氨化僻
锌筒
D.锌筒发生的电极反应为Zn-2e一Z+
3.下列实验事实不能用平衡移动原理解释的是
Mno
r℃
25
50
100
B
Kw/104
1.01
5.47
55.0
0剂液
一Hz0,溶液
c(氨水)/(molL)
0.1
0.01
冷水
热水
pH
11.1
10.6
C.将NO球汉泡在冷水和热水中
0
4.工业合成NH:N2(g)+3H(g)
高温、高压
2NH(g)△H<0。下列分析不正确的是
催化剂
A.使用催化剂可以提高反应物中活化分子百分数,但不能改变反应的△1
B.增大合成氨的反应速率与提高平衡混合物中氨的含量所采取的措施均一致
C.已知平衡体系中NH的沸点最高,则可通过液化的方法分离出NH3,从而提高其产率
D.断裂1molN2和3molH2的共价键所需能量小于断裂2 mol NH3的共价键所需能量
高二化学第1页(共9页)
5.下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A
B
C
D
2滴0.1mol/L
AgNO,溶液
4滴0.1molL
酸
KI溶液
2 mL 0.1 mol/L
NaC溶液
电解CuCh溶液
CH,COOH在水中电离
AgCI沉淀转化为AgI沉淀
NaCl溶于水
通电
Cudl,=Cu++2cl-
CH,COOH≌
I(aq)+AgCl(s)≌
NaCI=Na*+CI-
CH,COO-+H
AgI(s)+CIaq)
6.利用右图装置将2FeHC1一2Fe2t+Cu2+反应的化学能转化为电能,下列说法不合理的是
A.a处发生氧化反应
B.电子从a出发经过导线流向b,再经过盐桥流向a,形成闭合回路
C.X可以是CuSO4或Na2SO4溶液
D.b可以是石墨或铂
7.某猜毒液的主要成分为NaCIo,还含有一定量的NaOH。下列用
来解释事实的方程式中,不合理的是
已:饱和NaCIo.溶液的pH约为11
A.该消毒液可用NaOH溶液吸收Ch制备:Cl2+20H=Cl0:+C+A20
B.该消毒液的pH约为12:CIO+HO产HCIO+OH
C.该消毒液与洁厕灵(主要成分为HCI)混用,产生有毒C2:2H++CI+C10~=Cl2↑+H20
D.该消毒液加白醋生成HCIO,可增强漂白作用:CH3C00H+Cl0~=HCI0+CH3C00
8.在T℃,HCI气体通过铁管时,发生腐蚀反应(X):
反应X:Fe(s)+2HCl(g)产FeCl2(s)+H(g)△H(K=0.33)。下列分析不正确的是
A.降低反应温度,可减缓反应X的速率
B.在HC!气体中加入一定量H能起到防护铁管的作用
C.反应X的△H可通过如下反应获得:
Fe(s)+Cl2(g)=FeCl2(s)AH
H2(g)+Cl2(g)=2HCI(g)AF2
D.T℃时,若气体混合物中c(HC)=c(Hh)=0.5molL1,铁管被腐蚀
9.常温下,0.1moL1氨水pH=11,0.1molL1醋酸pH=3,下列说法正确的是
A.常温时,CH3COOH的电离平衡常数与NHH2O的相等
高二化学第2页(共9页)
同课章节目录
