2016年3月6日云南中考化学课件:初中学业水平研讨(共98张PPT)
文档属性
| 名称 | 2016年3月6日云南中考化学课件:初中学业水平研讨(共98张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-03-20 18:14:12 | ||
图片预览





文档简介
课件98张PPT。初中学业水平研讨昆明市第十中学
唐志刚2016.03一.云南省2016年初中学业水平考试展望1、考情变化
2、题目样式变化
3、命题趋势二.云南省2015年初中学业水平考试化学考试情况通报1、命题
2、平均分
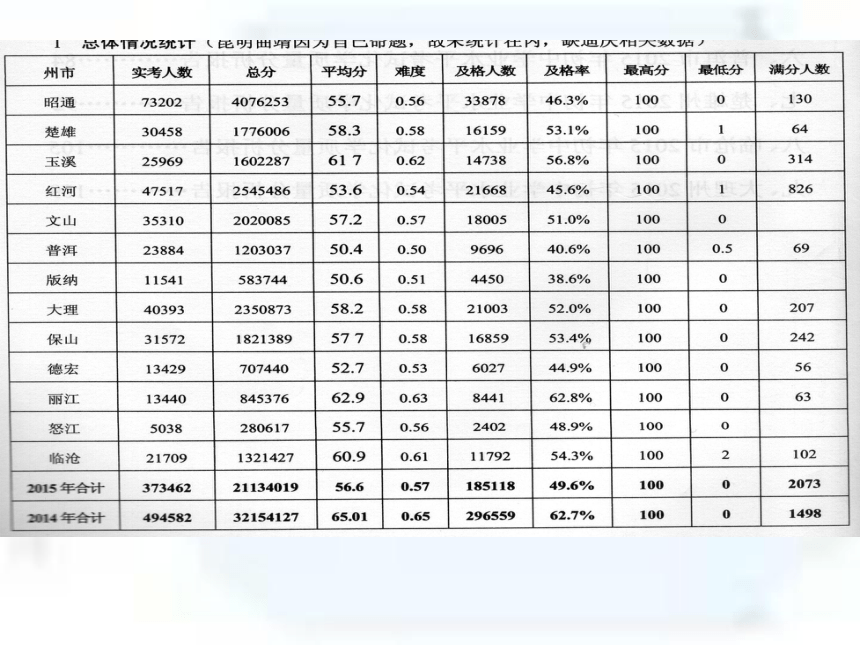
3、考试情况汇报
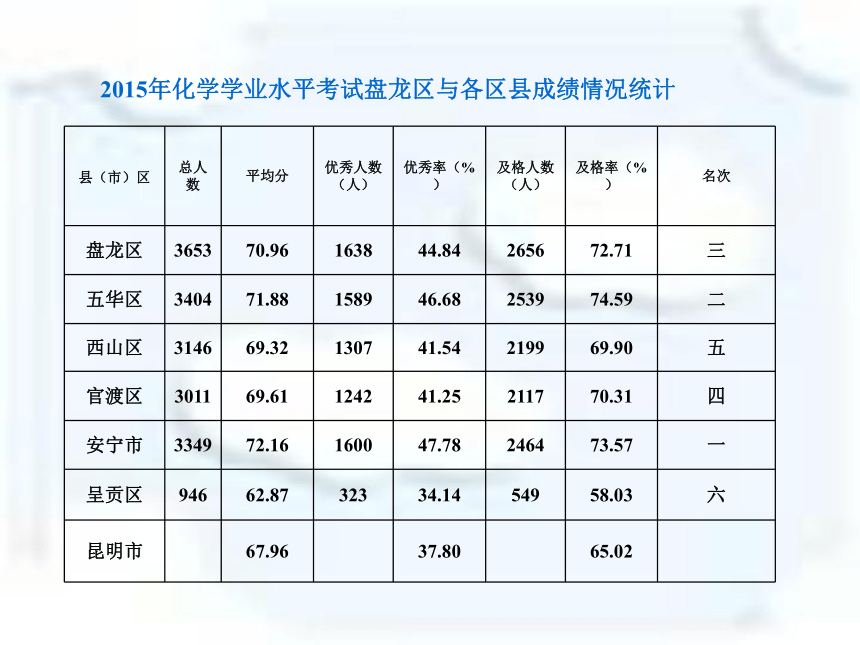
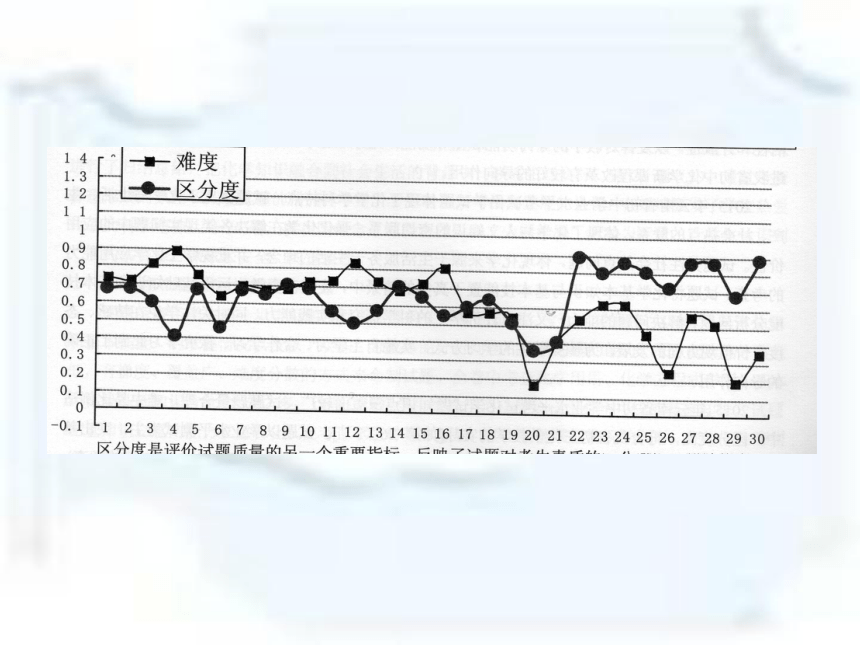
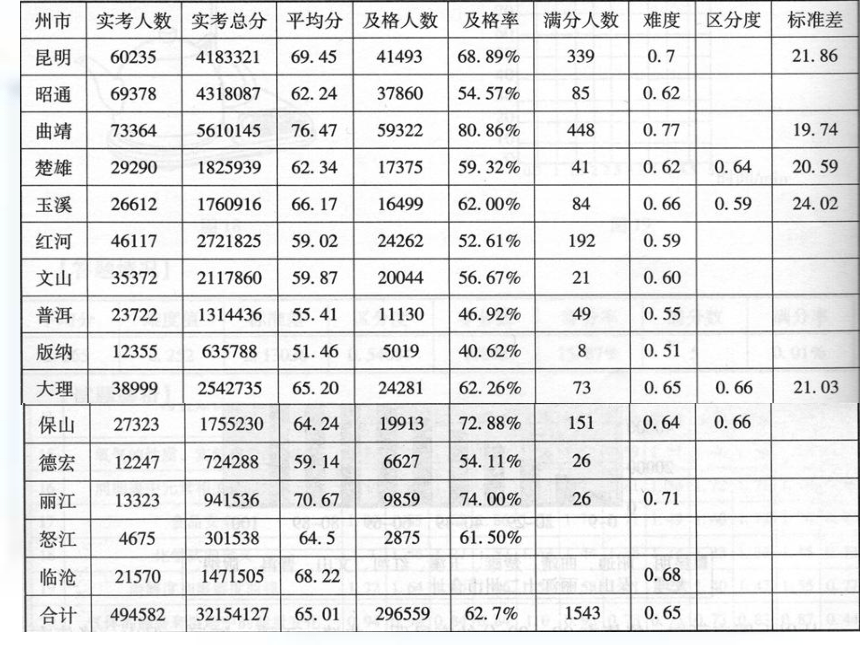
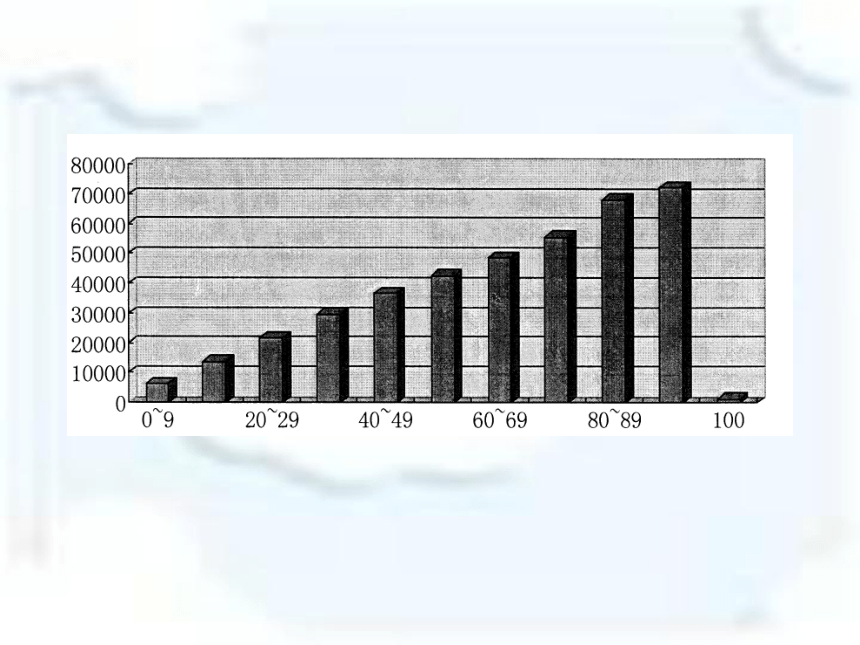
4、2015化学试卷官方评价 2015年化学学业水平考试盘龙区与各区县成绩情况统计20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
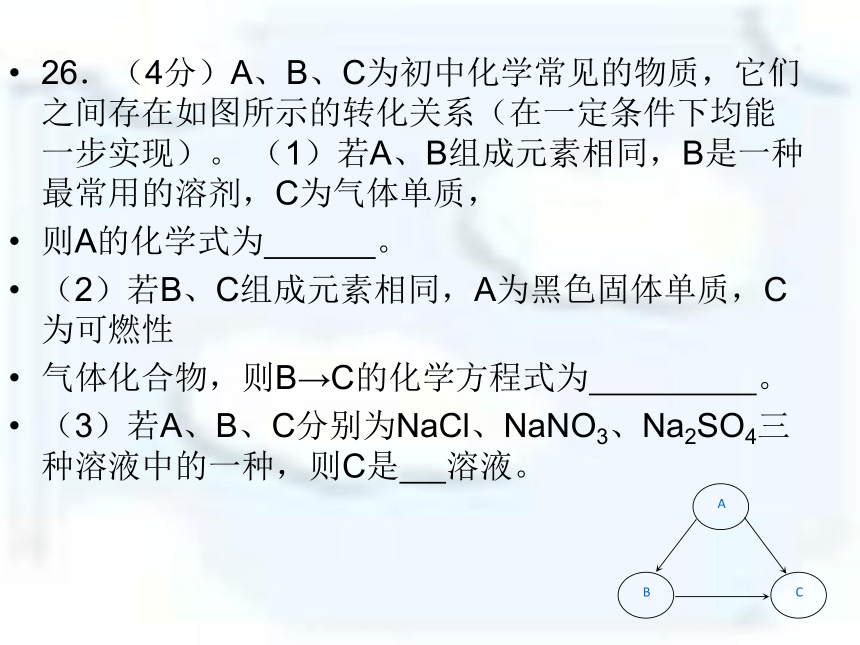
26.(4分)A、B、C为初中化学常见的物质,它们之间存在如图所示的转化关系(在一定条件下均能一步实现)。 (1)若A、B组成元素相同,B是一种最常用的溶剂,C为气体单质,
则A的化学式为 。
(2)若B、C组成元素相同,A为黑色固体单质,C为可燃性
气体化合物,则B→C的化学方程式为 。
(3)若A、B、C分别为NaCl、NaNO3、Na2SO4三种溶液中的一种,则C是 溶液。
三.云南省2014、2015年初中学业水平考试化学考试情况对比1、平均分
2、难易程度
3、试卷的延续性21.(2分)(2014?昆明)下列图象与对应的叙述相符合的是( ) 等质量的锌和铁放入足量的稀硫酸中产生氢气的关系图如下,正确的是 等质量的锌和铁放入足量的稀硫酸中产生氢气的关系图如下,正确的是时间 金属质量 酸的质量26.(4分)(2014?昆明)A、B、C、D、E、F都是初中化学中常见的物质,
A、C组成元素相同,D为红色固体单质,它们之间的相互转化如下:
(图中“→”表示物质间存在的转化关系,反应条件已略去)
(1)分别写出E、F的化学式: , ;
(2)写出A和B反应的化学方程式 .
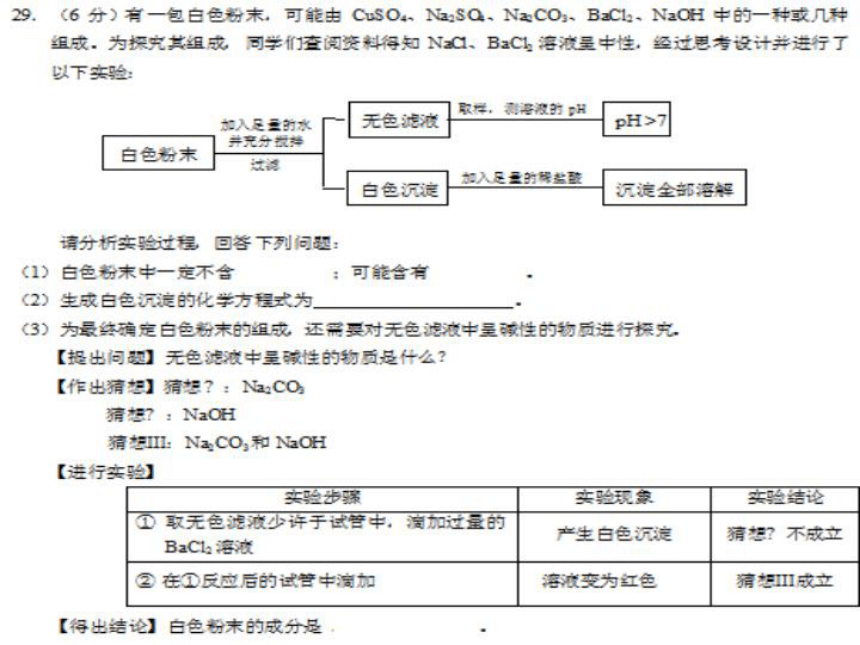
29.(6分)(2014?昆明)氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH .
【实验验证】【实验验证】
【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应
,产生的气体是 、 .②登山运动员常用CaH2作为能源提供
剂,与氢气相比,其优点
是 3、试卷的延续性 1.基础知识和基本技能高频考点分析 (1)物理变化和化学变化(2)物质的分类、材料问题(3)化学方程式和基本反应类型判断16.碳和一氧化碳都能与CuO反应,小林总结了两个反应的相同点,
其中错误的是
A.反应都需要加热 B.都有红色固体出现
C.反应的基本类型相同 D.产生的气体都能使澄清石灰水变浑浊OH2OO2-(4)化学用语:元素符号、化合价、化学式、化学反应方程式是每年的必考点 (5)构成物质的粒子的有关叙述,分子、原子、离子等粒子的区别(6)质量守恒定律(7)溶液、饱和溶液、溶解度、溶质质量分数等(8)金属活动性顺序19.(2分)(2015?昆明)根据金属活动性顺序判断,下列化学方程式正确的是( )(9)化学实验基本操作和基本技能(10)物质的分离与提纯1、酸碱度
2、酸碱盐的特性
3、离子共存、检验(10)酸碱盐的相关知识29.(6分)(2014?昆明)氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH .
【实验验证】【实验验证】
【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应
,产生的气体是 、 .②登山运动员常用CaH2作为能源提供
剂,与氢气相比,其优点
是 (11)化学计算化学计算解题思路:
1.明确发生的化学方程式,化学式不能错,配平
2.明确相关物质的质量比= 相对分子质量×化学计量数之比
3.明确纯净物和混合物。只有纯净物的质量才能直接代入方程式计算
4.纯净物质量的展现方式(主要有三种)
5. 明确 分子 分母 a%的关系 2.科学探究和实验探究获取高分的必争之地 (1) 常见气体的制取Zn + H2SO4== ZnSO4 + H2↑原料筛选原则
原料易得、成本低;
操作简便、反应条件容易达到;
反应速率适中、气体纯净并且便于收集;
安全环保,节能C+O2 == CO2
石蜡+O2 == CO2+H2O
2CO+O2 == 2CO2
CaCO3==CaO+ CO2 ↑
Na2CO3+2HCl ==2NaCl+H2O + CO2 ↑
CaCO3+2HCl ==CaCl2+H2O + CO2 ↑点燃点燃点燃高温 装置的选择选择原则: 发生装置:反应物的状态和反应条件是否加热 收集装置:气体密度、溶解性、是否反应装置的改进(云南) 26.下图是某同学设计的实验室制取气体的装置,请你回答下列问题:
(1)图中仪器a的名称__________;该装置中小试管的作用是_______________ 。
(2)若用该装置制取氧气,锥形瓶底部应放入少量_______a中加入_________,该反应的化学方程式是___________;检验该气体是否收集满的方法是__________。
(3)若用该装置制取H2,则收集装置中的C需做的改动是______________。 有位同学设计了如下图所示的装置制备二氧化碳气体.装置中A可上下移动,则A的作用是 ? 2、科学探究的基本环节的考查:四.复习计划的制定1、时间计算
2、复习方法五.对部分难点的处理方法1、变抽象为形象,变想象为图形20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
Zn +Cu(NO3)2 === Zn(NO3)2 +Cu
Zn+ AgNO3 === Zn(NO3)2 + Ag
Cu + AgNO3 === Cu(NO3)2 + Ag
20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
保留单质中最活泼的,将其他单质看作化合物。
等效于向Fe(NO3 )2和AgNO3溶液中加入一定质量Al的混合溶液A点表示饱和溶液并析出晶体与B点重合。
B点表示饱和溶液
C点表示不饱和溶液
点的移动:左右为温度,上下为浓度。将A移动到B五.对部分难点的处理方法1、变抽象为形象,变想象为图形
2、了解本质,学会方法“授生以渔”提出问题猜想假设设计实验方案得出结论2、科学探究的基本环节的考查:交流评价进行实验紧扣题目信息,突出主题合乎逻辑科学合理,对比实验注意控制变量规范地表达实验步骤与现象对猜想作出判断,对问题给出回答针对实验过程、方法和结论29.(6分)(2014?昆明)氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH .
【实验验证】【实验验证】
【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应
,产生的气体是 、 .②登山运动员常用CaH2作为能源提供
剂,与氢气相比,其优点
是 典型科学探究在各单元的分布情况:第一单元:
对蜡烛及其燃烧的探究
吸入和呼出空气成分的探究第二单元:
空气成分的探究
空气中氧气的体积分数的探究
氧气化学性质的探究
实验室制备氧气的探究
催化剂在化学反应中作用的探究第五单元
质量守恒定律的探究第三、四单元
水的组成的探究
水的净化
关于分子的性质(运动、有间隔)的探究第六单元
二氧化碳制取的探究
“汽水” 、“雪壁” 或“可乐” 中冒出气体成分的探究
(二氧化碳气体性质的探究)
一氧化碳性质的探究第七单元
物质燃烧条件的探究
燃料充分燃烧条件的探究第八单元
钢铁腐蚀条件的探究
金属活动性顺序的探究第九单元
条件的变化对溶解速率影响的探究第十、十一单元
自制指示剂判断溶液酸碱性的探究
酸、碱、盐化学性质的探究回归教材1.教材中习题举例
(1)常见仪器和基本操作
例1.九年级化学上册
1.下列图示实验操作中,正确的是( )
减负增质—— 深入挖掘教材 例2.九年级化学下册
某学生测定的下列数据中,不合理的是( )
A.用10mL量筒量取了7.5mL水
B.用图10-16所示的pH试纸测得某地水的pH为5.2
C.用托盘太平称得某小苏打样品的质量为16.7g
D.测得某粗盐中氯化钠的质量分数为90.5%(2)气体的制备
例3.九年级化学上册
3.结合“加热高锰酸钾制取氧气”的实验,回答下列问题:
(1)检查装置的气密性时,如果装置的气密性很好,在导管移出水面之前松开手,会有什么现象发生?
(2)固定装有高锰酸钾的试管时,为什么试管口要略向下倾斜?
(3)加热试管时应注意什么?
(4)停止加热时为什么要先把导管移出水面?
(5)如果某同学制得的氧气不纯,你认为可能的原因有哪些? 2. 右边实验室制取二氧化碳的装置图有哪些错误?为什么?例4.九年级化学上册1.实验室里制取二氧化碳的反应原理是_______(用化学方程式表示);收集二氧化碳的方法是______,因为______;检验二氧化碳的方法是_________。(3)物质的检验与鉴别例5.九年级化学上册页
3.用什么简单的方法检验一瓶无色气体是氧气?
例6.九年级化学上册页
4.有三瓶无色、无气味的气体A、B、C,它们分别是甲烷、氢气、一氧化碳中的一种。点燃每种气体,用干燥的冷烧杯罩在火焰上方,在B、C火焰上方的烧杯壁上有水滴出现,而A火焰上方的烧杯壁上没有水滴。燃烧后分别向烧杯中注入澄清石灰水,振荡,A、B烧杯内的石灰水变浑浊, C烧杯内没有变化。试推断A、B、C分别什么气体,写出有关反应的化学方程式。
例7.九年级化学下册
5.亚硝酸钠是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若误食会引起中毒,危害人体健康,甚至致人死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,如何操作?
(4)物质的分离与提纯例7.九年级化学下册
6.填写下列表格(“混合物”栏中括号为杂质)。
(5)综合探究、实验设计与评价例8.九年级化学下册
6.现有一瓶蒸馏水和一瓶稀氯化钾溶液,可用什么简单的办法把它们鉴别开?(注意:在实验室里,任何时候都不能尝溶液的味道)
例9.九年级化学上册
原于教材 能应用例10. 九年级化学下册2.科学探究的复习—— 回归教材知识网络[实验探究]提出问题二氧化碳溶解于水的过程中是否发生了化学变化?设计实验分析结论干燥的二氧化碳或水都不能使石蕊变红;使石蕊变红的是二氧化碳与水共同作用生成的其他物质,说明发生了化学反应且生成了一种酸。紫色石蕊变红H2OCO2还是有其他物质在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了下图所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。请将各实验的目的或结论填入下表空格中。 请判断:若仅做实验(Ⅳ),小芳得出的结论是____或____;
若不做实验(Ⅰ)小芳得出的结论是_________。[实验探究]课本P124装置改进后的装置[教材探究]探究: 铁生锈的条件FeO2 H2O潮湿 空气Fe2O3·x H2O迁移运用CuCu2(OH)2CO3O2H2OCO2(1)简明梳理基础知识,构筑知识体系。 CH4⑾化学与社会发展结束语1.不做偏题、怪题,不因为做难题而浪费大量的时间。紧扣《考试说明》,落实基础,回归教材。
2.注重对各类题型的归纳总结,注重解题思路的养成。
3.注重知识点的迁移、拓展,注重思维的延伸和逆向引导,注重错题的改错与反思,旨在解题能力的培养。
4.引导学生保证充足的睡眠,以充沛的精力和最佳的状态上好学校里的每一节课。
5. 给学生多一点信心,多一点鼓励。
唐志刚2016.03一.云南省2016年初中学业水平考试展望1、考情变化
2、题目样式变化
3、命题趋势二.云南省2015年初中学业水平考试化学考试情况通报1、命题
2、平均分
3、考试情况汇报
4、2015化学试卷官方评价 2015年化学学业水平考试盘龙区与各区县成绩情况统计20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
26.(4分)A、B、C为初中化学常见的物质,它们之间存在如图所示的转化关系(在一定条件下均能一步实现)。 (1)若A、B组成元素相同,B是一种最常用的溶剂,C为气体单质,
则A的化学式为 。
(2)若B、C组成元素相同,A为黑色固体单质,C为可燃性
气体化合物,则B→C的化学方程式为 。
(3)若A、B、C分别为NaCl、NaNO3、Na2SO4三种溶液中的一种,则C是 溶液。
三.云南省2014、2015年初中学业水平考试化学考试情况对比1、平均分
2、难易程度
3、试卷的延续性21.(2分)(2014?昆明)下列图象与对应的叙述相符合的是( ) 等质量的锌和铁放入足量的稀硫酸中产生氢气的关系图如下,正确的是 等质量的锌和铁放入足量的稀硫酸中产生氢气的关系图如下,正确的是时间 金属质量 酸的质量26.(4分)(2014?昆明)A、B、C、D、E、F都是初中化学中常见的物质,
A、C组成元素相同,D为红色固体单质,它们之间的相互转化如下:
(图中“→”表示物质间存在的转化关系,反应条件已略去)
(1)分别写出E、F的化学式: , ;
(2)写出A和B反应的化学方程式 .
29.(6分)(2014?昆明)氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH .
【实验验证】【实验验证】
【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应
,产生的气体是 、 .②登山运动员常用CaH2作为能源提供
剂,与氢气相比,其优点
是 3、试卷的延续性 1.基础知识和基本技能高频考点分析 (1)物理变化和化学变化(2)物质的分类、材料问题(3)化学方程式和基本反应类型判断16.碳和一氧化碳都能与CuO反应,小林总结了两个反应的相同点,
其中错误的是
A.反应都需要加热 B.都有红色固体出现
C.反应的基本类型相同 D.产生的气体都能使澄清石灰水变浑浊OH2OO2-(4)化学用语:元素符号、化合价、化学式、化学反应方程式是每年的必考点 (5)构成物质的粒子的有关叙述,分子、原子、离子等粒子的区别(6)质量守恒定律(7)溶液、饱和溶液、溶解度、溶质质量分数等(8)金属活动性顺序19.(2分)(2015?昆明)根据金属活动性顺序判断,下列化学方程式正确的是( )(9)化学实验基本操作和基本技能(10)物质的分离与提纯1、酸碱度
2、酸碱盐的特性
3、离子共存、检验(10)酸碱盐的相关知识29.(6分)(2014?昆明)氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH .
【实验验证】【实验验证】
【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应
,产生的气体是 、 .②登山运动员常用CaH2作为能源提供
剂,与氢气相比,其优点
是 (11)化学计算化学计算解题思路:
1.明确发生的化学方程式,化学式不能错,配平
2.明确相关物质的质量比= 相对分子质量×化学计量数之比
3.明确纯净物和混合物。只有纯净物的质量才能直接代入方程式计算
4.纯净物质量的展现方式(主要有三种)
5. 明确 分子 分母 a%的关系 2.科学探究和实验探究获取高分的必争之地 (1) 常见气体的制取Zn + H2SO4== ZnSO4 + H2↑原料筛选原则
原料易得、成本低;
操作简便、反应条件容易达到;
反应速率适中、气体纯净并且便于收集;
安全环保,节能C+O2 == CO2
石蜡+O2 == CO2+H2O
2CO+O2 == 2CO2
CaCO3==CaO+ CO2 ↑
Na2CO3+2HCl ==2NaCl+H2O + CO2 ↑
CaCO3+2HCl ==CaCl2+H2O + CO2 ↑点燃点燃点燃高温 装置的选择选择原则: 发生装置:反应物的状态和反应条件是否加热 收集装置:气体密度、溶解性、是否反应装置的改进(云南) 26.下图是某同学设计的实验室制取气体的装置,请你回答下列问题:
(1)图中仪器a的名称__________;该装置中小试管的作用是_______________ 。
(2)若用该装置制取氧气,锥形瓶底部应放入少量_______a中加入_________,该反应的化学方程式是___________;检验该气体是否收集满的方法是__________。
(3)若用该装置制取H2,则收集装置中的C需做的改动是______________。 有位同学设计了如下图所示的装置制备二氧化碳气体.装置中A可上下移动,则A的作用是 ? 2、科学探究的基本环节的考查:四.复习计划的制定1、时间计算
2、复习方法五.对部分难点的处理方法1、变抽象为形象,变想象为图形20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
Zn +Cu(NO3)2 === Zn(NO3)2 +Cu
Zn+ AgNO3 === Zn(NO3)2 + Ag
Cu + AgNO3 === Cu(NO3)2 + Ag
20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
20.某化学小组在AgNO3和Cu(NO3)2的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。他们对所得滤液和滤渣有如下描述:
①滤液中一定含有Zn(NO3)2
②滤渣中一定含有Ag,可能含有Cu和Zn
③若滤液呈蓝色,则向滤渣中滴加稀盐酸无明显现象
④若向滤渣中滴加稀盐酸有气泡产生,则滤液中一定没有AgNO3和Cu(NO3)2
上述四种描述中正确的个数为
A.1个 B.2个 C.3个 D.4个
保留单质中最活泼的,将其他单质看作化合物。
等效于向Fe(NO3 )2和AgNO3溶液中加入一定质量Al的混合溶液A点表示饱和溶液并析出晶体与B点重合。
B点表示饱和溶液
C点表示不饱和溶液
点的移动:左右为温度,上下为浓度。将A移动到B五.对部分难点的处理方法1、变抽象为形象,变想象为图形
2、了解本质,学会方法“授生以渔”提出问题猜想假设设计实验方案得出结论2、科学探究的基本环节的考查:交流评价进行实验紧扣题目信息,突出主题合乎逻辑科学合理,对比实验注意控制变量规范地表达实验步骤与现象对猜想作出判断,对问题给出回答针对实验过程、方法和结论29.(6分)(2014?昆明)氢化钙固体是登山运动员常用的能源提供剂.某探究小组的同学通过查阅资料得知,氢化钙(CaH2)遇水反应生成氢氧化钙和氧气.探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液.经检验滤渣的成分是碳酸钙.
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH .
【实验验证】【实验验证】
【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应
,产生的气体是 、 .②登山运动员常用CaH2作为能源提供
剂,与氢气相比,其优点
是 典型科学探究在各单元的分布情况:第一单元:
对蜡烛及其燃烧的探究
吸入和呼出空气成分的探究第二单元:
空气成分的探究
空气中氧气的体积分数的探究
氧气化学性质的探究
实验室制备氧气的探究
催化剂在化学反应中作用的探究第五单元
质量守恒定律的探究第三、四单元
水的组成的探究
水的净化
关于分子的性质(运动、有间隔)的探究第六单元
二氧化碳制取的探究
“汽水” 、“雪壁” 或“可乐” 中冒出气体成分的探究
(二氧化碳气体性质的探究)
一氧化碳性质的探究第七单元
物质燃烧条件的探究
燃料充分燃烧条件的探究第八单元
钢铁腐蚀条件的探究
金属活动性顺序的探究第九单元
条件的变化对溶解速率影响的探究第十、十一单元
自制指示剂判断溶液酸碱性的探究
酸、碱、盐化学性质的探究回归教材1.教材中习题举例
(1)常见仪器和基本操作
例1.九年级化学上册
1.下列图示实验操作中,正确的是( )
减负增质—— 深入挖掘教材 例2.九年级化学下册
某学生测定的下列数据中,不合理的是( )
A.用10mL量筒量取了7.5mL水
B.用图10-16所示的pH试纸测得某地水的pH为5.2
C.用托盘太平称得某小苏打样品的质量为16.7g
D.测得某粗盐中氯化钠的质量分数为90.5%(2)气体的制备
例3.九年级化学上册
3.结合“加热高锰酸钾制取氧气”的实验,回答下列问题:
(1)检查装置的气密性时,如果装置的气密性很好,在导管移出水面之前松开手,会有什么现象发生?
(2)固定装有高锰酸钾的试管时,为什么试管口要略向下倾斜?
(3)加热试管时应注意什么?
(4)停止加热时为什么要先把导管移出水面?
(5)如果某同学制得的氧气不纯,你认为可能的原因有哪些? 2. 右边实验室制取二氧化碳的装置图有哪些错误?为什么?例4.九年级化学上册1.实验室里制取二氧化碳的反应原理是_______(用化学方程式表示);收集二氧化碳的方法是______,因为______;检验二氧化碳的方法是_________。(3)物质的检验与鉴别例5.九年级化学上册页
3.用什么简单的方法检验一瓶无色气体是氧气?
例6.九年级化学上册页
4.有三瓶无色、无气味的气体A、B、C,它们分别是甲烷、氢气、一氧化碳中的一种。点燃每种气体,用干燥的冷烧杯罩在火焰上方,在B、C火焰上方的烧杯壁上有水滴出现,而A火焰上方的烧杯壁上没有水滴。燃烧后分别向烧杯中注入澄清石灰水,振荡,A、B烧杯内的石灰水变浑浊, C烧杯内没有变化。试推断A、B、C分别什么气体,写出有关反应的化学方程式。
例7.九年级化学下册
5.亚硝酸钠是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若误食会引起中毒,危害人体健康,甚至致人死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,如何操作?
(4)物质的分离与提纯例7.九年级化学下册
6.填写下列表格(“混合物”栏中括号为杂质)。
(5)综合探究、实验设计与评价例8.九年级化学下册
6.现有一瓶蒸馏水和一瓶稀氯化钾溶液,可用什么简单的办法把它们鉴别开?(注意:在实验室里,任何时候都不能尝溶液的味道)
例9.九年级化学上册
原于教材 能应用例10. 九年级化学下册2.科学探究的复习—— 回归教材知识网络[实验探究]提出问题二氧化碳溶解于水的过程中是否发生了化学变化?设计实验分析结论干燥的二氧化碳或水都不能使石蕊变红;使石蕊变红的是二氧化碳与水共同作用生成的其他物质,说明发生了化学反应且生成了一种酸。紫色石蕊变红H2OCO2还是有其他物质在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了下图所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。请将各实验的目的或结论填入下表空格中。 请判断:若仅做实验(Ⅳ),小芳得出的结论是____或____;
若不做实验(Ⅰ)小芳得出的结论是_________。[实验探究]课本P124装置改进后的装置[教材探究]探究: 铁生锈的条件FeO2 H2O潮湿 空气Fe2O3·x H2O迁移运用CuCu2(OH)2CO3O2H2OCO2(1)简明梳理基础知识,构筑知识体系。 CH4⑾化学与社会发展结束语1.不做偏题、怪题,不因为做难题而浪费大量的时间。紧扣《考试说明》,落实基础,回归教材。
2.注重对各类题型的归纳总结,注重解题思路的养成。
3.注重知识点的迁移、拓展,注重思维的延伸和逆向引导,注重错题的改错与反思,旨在解题能力的培养。
4.引导学生保证充足的睡眠,以充沛的精力和最佳的状态上好学校里的每一节课。
5. 给学生多一点信心,多一点鼓励。
同课章节目录
