第八单元 海洋化学资源的利用复习题(含答案)----2024--2025学年九年级化学鲁教版(2024)下册
文档属性
| 名称 | 第八单元 海洋化学资源的利用复习题(含答案)----2024--2025学年九年级化学鲁教版(2024)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 599.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-11-19 00:00:00 | ||
图片预览



文档简介
第八单元 海洋化学资源的利用复习题----2024--2025学年九年级化学鲁教版(2024)下册
一、单选题
1.下列各组混合物可用过滤操作进行分离的是
A.酒精和水 B.泥沙和水 C.食盐和水 D.铁粉和铜粉
2.有关过滤操作正确的是
A.玻璃棒要紧靠三层滤纸 B.漏斗下端高于烧杯上沿
C.液面要低于漏斗边缘 D.先放置烧杯,再调整铁圈高度
3.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t2℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2C时,甲物质的饱和溶液降温至t1℃,溶液中溶质质量一定减小
4.“侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是:。如图是三种物质的溶解度曲线,下列叙述正确的是
A.NH4Cl的溶解度大于NaCl的溶解度
B.NH4Cl中含有少量NaCl,可用降温结晶的方法提纯NH4Cl
C.T1℃时,NH4Cl、NaCl两饱和溶液中溶质的质量相等
D.20℃时,将9.6gNaHCO3加入到90.4g水中,可得到100g饱和溶液
5.如图所示,甲、乙是两种物质的溶解度曲线,下列叙述正确的是下是
A.60℃时,在100g水中加入100g甲,充分溶解后溶液的质量是200g
B.40℃时,甲、乙两种物质的溶解度相等
C.20℃时甲的溶解度大于乙的溶解度
D.采用降温的方法可将乙的不饱和溶液转化为饱和溶液
6.某化工厂废水池中的溶液是无色透明的,用pH试纸检测废液,废液pH=3,则废液中存在物质合理的一组是( )
A.ZnCl2、KNO3、KMnO4 B.K2SO4、Al(NO3)3、BaCl2
C.Na2CO3、NaNO3、KCl D.Na2SO4、KNO3、MgCl2
7.向一定质量的、混合溶液中先后滴加溶液和一定质量的溶液,产生沉淀的质量与加入溶液的质量关系如下图所示。
下列说法错误的是
A.图中a到b点的变化过程中,溶液的pH先不变后增大
B.图中a、b、c三点对应溶液中的溶质均为两种
C.图中沉淀质量与的关系为
D.混合溶液中、的质量比为49:71
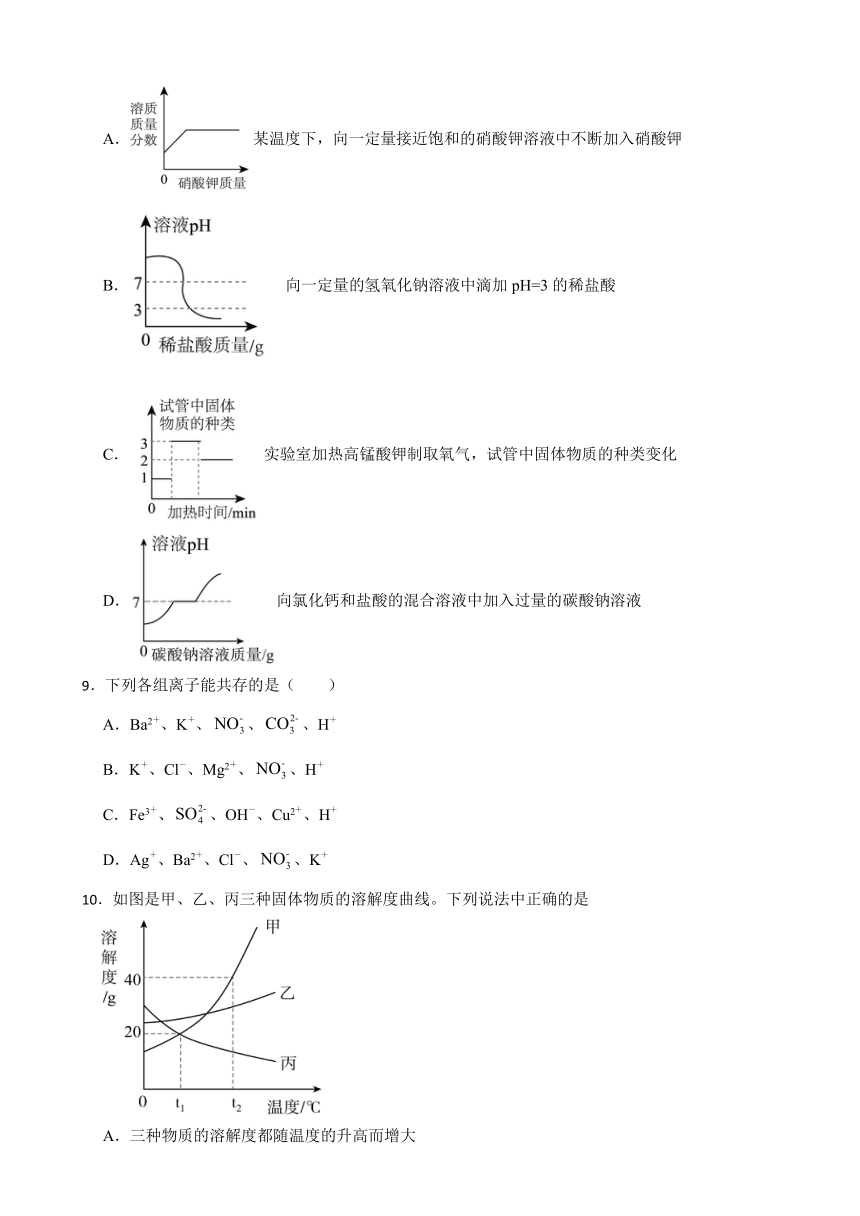
8.下列四个图像不能正确反映对应变化关系的是
A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾
B. 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C.实验室加热高锰酸钾制取氧气,试管中固体物质的种类变化
D.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
9.下列各组离子能共存的是( )
A.Ba2+、K+、、、H+
B.K+、Cl-、Mg2+、、H+
C.Fe3+、、OH-、Cu2+、H+
D.Ag+、Ba2+、Cl-、、K+
10.如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法中正确的是
A.三种物质的溶解度都随温度的升高而增大
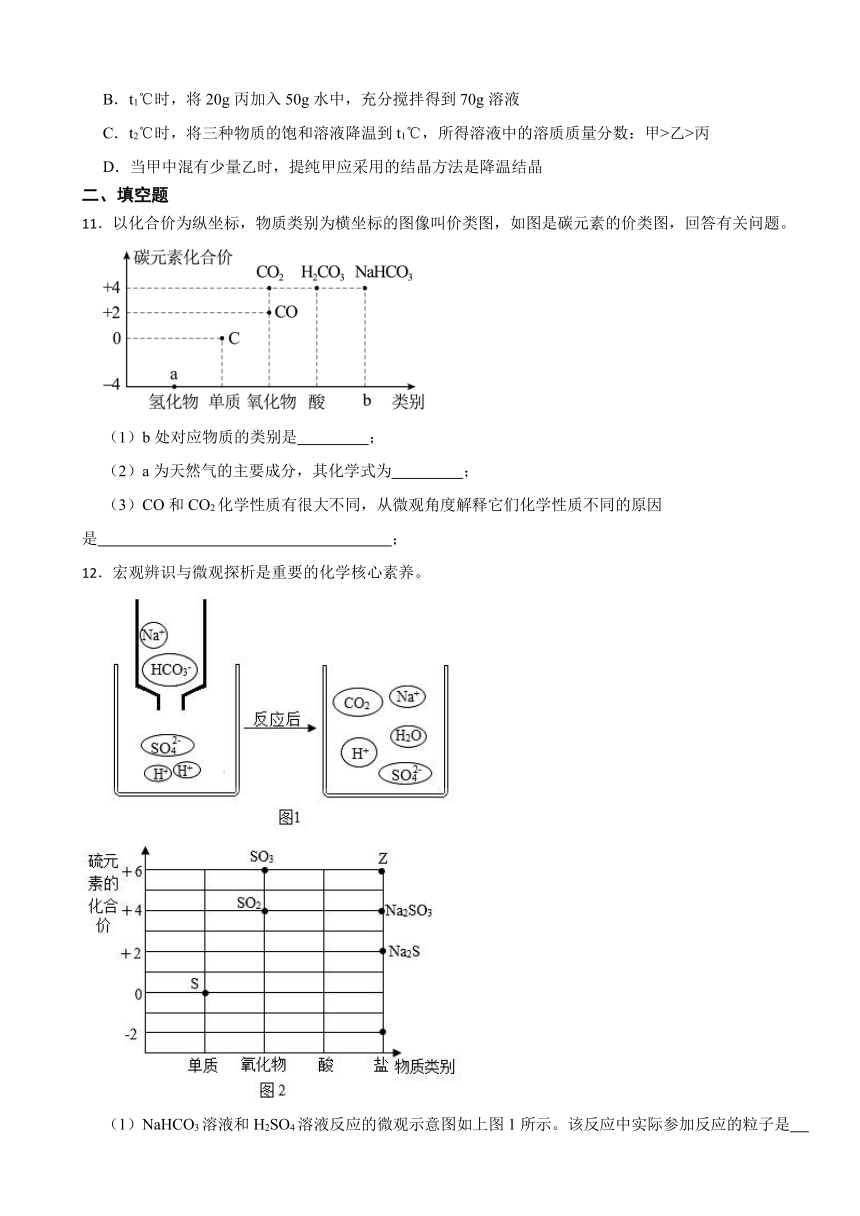
B.t1℃时,将20g丙加入50g水中,充分搅拌得到70g溶液
C.t2℃时,将三种物质的饱和溶液降温到t1℃,所得溶液中的溶质质量分数:甲>乙>丙
D.当甲中混有少量乙时,提纯甲应采用的结晶方法是降温结晶
二、填空题
11.以化合价为纵坐标,物质类别为横坐标的图像叫价类图,如图是碳元素的价类图,回答有关问题。
(1)b处对应物质的类别是 ;
(2)a为天然气的主要成分,其化学式为 ;
(3)CO和CO2化学性质有很大不同,从微观角度解释它们化学性质不同的原因是 ;
12.宏观辨识与微观探析是重要的化学核心素养。
(1)NaHCO3溶液和H2SO4溶液反应的微观示意图如上图1所示。该反应中实际参加反应的粒子是 (填粒子符号)。
(2)硫及其化合物的“化合价一物质类别”关系图如上图2所示。
①请画出硫离子的结构示意图: 。
②请写出SO3与NaOH反应生成物质Z的化学方程式: 。
③关系图中有一种物质放错了位置,它是: (填物质名称)。
13.从身边的事物来看,化学就在我们的身边。
(1)医药上常用碘酒来抑制和杀灭细菌、病毒等,碘酒的溶剂是 。
(2)餐后,乐乐主动清洗碗筷,用洗洁精去除碗筷上的油污,利用的原理是 。他用肥皂水检验得知家中的井水为硬水,可用 的方法将硬水软化。
(3)如图是甲、乙、丙三种固体物质的溶解度曲线,看图并回答下列问题。
①M点表示的含义是 (合理即可)。
②t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 。
③t3℃时,将35g甲物质加入到50g水中,充分溶解后所得溶液的质量是 。
④t3℃时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温至t2℃,所得溶液中溶质质量分数由大到小的顺序是 。
三、实验探究题
14.某同学发现药品柜中盛有过氧化钠的塑料试剂瓶破裂,该同学认为过氧化钠发生了变质,对此进行以下探究。
【查阅资料】过氧化钠一般是淡黄色固体,能与水反应生成氢氧化钠和氧气;氢氧化钠和碳酸钠是白色粉末。
【进行实验】
(1)该同学观察到粉末全部变为白色,故认为粉末全部变质,请设计实验证明该同学的猜想是正确的。
实验步骤 实验现象 实验结论
取适量粉末于试管中,滴加少量的 并放入带火星的小木条 该粉末不含过氧化钠
于是同学们对变质的白色粉末的成分展开探究。
【提出问题】白色粉末的成分是什么?
【作出猜想】
(2)猜想1:氢氧化钠;
猜想2:碳酸钠;
猜想3: 。
请写出猜想2的依据: (用化学方程式表示)。
【实验探究】
(3)
实验步骤 实验现象 实验结论
①取少量溶液于试管中,向试管中滴加足量的 溶液; ②在反应后的溶液中滴入 ①有白色沉淀生成; ② 猜想3成立
【反思与评价】
(4)实验步骤①中滴加足量某溶液的目的是 。
【拓展延伸】
(5)过氧化钠可用在潜水艇或宇宙飞船等缺氧的场所,原因是 (用化学方程式表示,一个即可)。
15.碳酸钠俗称“纯碱”,兴趣小组的同学根据认识物质化学性质的思路与方法进行如表实验探究。
(1)【实验探究】
预测碳酸钠 的化学性质 ①碳酸钠能使酸 碱指示剂变色 ②碳酸钠能 与酸反应 ③碳酸钠能 与碱反应 ④碳酸钠能 与盐溶液反应
实验过程
预期现象及分析 溶液变为 色 产生气泡 产生白色沉淀,原因是 (用化学方程式表示) 产生白色沉淀
反思与评价 实验 (填序号)证明纯碱是一种水溶液呈碱性的盐
【拓展延伸】小明在进行实验②时,将稀盐酸逐滴加入碳酸钠溶液,一段时间后仍未观察到明显现象,与上述【实验探究】中的预期现象不一致,为证明该反应是否发生,他又进行如下实验:
【查阅资料】a.碳酸钠与盐酸反应是分步进行的,当盐酸不足时发生的反应为,当盐酸过量时发生的反应为;
b.碳酸氢钠溶液呈碱性,碳酸氢钠与稀氯化钙、稀氯化钡溶液不反应。
(2)【进行实验】
步骤 实验操作 实验现象
步骤1 取小明实验后的溶液于另一试管中,向其中加入过量稀氯化钙溶液 产生白色沉淀
步骤2
【实验结论】通过上述实验得出小明的实验发生了化学反应。
(3)【交流讨论】为确定步骤1中所加稀氯化钙溶液已足量,可进行的实验是 。
(4)【实验反思】通过以上探究,小明实验中产生与预期现象不一致的原因是 。
16.某学习小组的同学在整理归纳反应规律时发现,有些化学反应发生时没有伴随明显的现象,他们就此进行了以下探究。
【提出问题】怎样证明NaOH溶液分别与CO2及稀盐酸发生了反应?
【分析讨论】
(1)同学们讨论后认为,可以用两种思路探究上述反应是否发生。
思路I:验证有________。
思路Ⅱ:验证反应物减少或消失。
【实验探究】同学们分两组分别设计方案选行究。
【实验结论】
(2)第一组同学将充满CO2气体的试管倒扣在NaOH溶液中,观察到________,认为NaOH溶液和CO2发生了反应。但有同学指出,还应进行CO2与________反应的对比实验才能得出这一结论。
(3)第一组同学向反应后的溶液中加入某无色盐溶液,观察到有白色沉淀生成,也得出了NaOH溶液与CO2发生了反应的结论,生成白色沉淀的化学方程式为________(只写一个)。
(4)第二组的小明同学向丙中滴入无色酚酞溶液后,观察到________,得出NaOH溶液与稀盐酸发生了反应的结论。小亮同学向丁中滴入AgNO3溶液后,观察到有白色沉淀生成,由此他认为NaOH溶液与稀盐酸反应生成了NaCl,但小红认为小亮的结论不合理,理由是________。
(5)第二组同学进一步讨论后认为,如果将乙中的溶液蒸发结晶,再将得到的晶体溶于水,若在室温下测得该溶液的pH________(填“>”“<”或“=”)7时,则能证明有氯化钠生成。
【反思与拓展】
(6)氢氧化钠在空气中易变质,为了防止该药品变质,该药品要________保存。
(7)仅仅使用下列某种物质,能进一步证明第二组的实验中“氢氧化钠溶液与稀盐酸是否恰好完全反应”的是______(填字母)。
A. 锌片
B. 氧化铜
C. 紫色石蕊溶液
D. 硫酸铜溶液
E. pH试纸
四、计算题
17.实验室现有一包硫酸钠和氯化钠的固体混合物20g,为测定固体混合物中氯化钠的质量分数,将固体加入足量水溶解,向其中不断加入氯化钡溶液,测得生成沉淀的质量随加入氯化钡溶液的质量变化情况如图所示。
请分析并计算:
(1)a点对应溶液中的溶质为 。
(2)计算固体混合物中氯化钠的质量分数。
18.家庭食用碱的主要成分是Na2CO3,为测定该食用碱中Na2CO3的质量分数,某同学进行了以下实验:取48g食用碱,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见如表(假设该食用碱中不含难溶性杂质且杂质均不与CaCl2溶液产生沉淀)。请分析表中数据回答并计算:
实验一 实验二 实验三 实验四
食用碱的质量 12g 12g 12g 12g
加入CaCl2溶液的质量 20g 40g 60g 80g
生成沉淀的质量 4g m 10g 10g
(1)m= g。
(2)48g该食用碱与足量加入CaCl2溶液反应,最多生成沉淀质生成沉淀的质量为多少g。
(3)该食用碱中Na2CO3的质量分数是多少?(写出计算过程,答案精确到0.1%)
(4)根据表中实验数据以及适当的计算,请画出生成沉淀的质量和加入CaCl2溶液的质量的坐标关系图,请标出拐点数据。
答案解析部分
1.【答案】B
2.【答案】C
3.【答案】D
4.【答案】B
5.【答案】B
6.【答案】D
7.【答案】A
8.【答案】B
9.【答案】B
10.【答案】D
11.【答案】(1)盐
(2)
(3)一氧化碳和二氧化碳的分子构成不同
12.【答案】(1)
(2);;硫化钠
13.【答案】(1)酒精(或乙醇)
(2)乳化作用;煮沸
(3)在t2℃时,甲和丙两种物质的溶解度相等;丙>乙>甲;80;乙>甲>丙
14.【答案】水;带火星的小木条不复燃;碳酸钠和氢氧化钠;;氯化钙;酚酞试液(合理即可);溶液变为红色(与前空对应);除去溶液中的碳酸钠,防止对氢氧化钠的检验产生干扰;
15.【答案】红;;①;另取步骤1中少量上层清液于另一试管中,滴加无色酚酞溶液;溶液变红;取步骤1中少量上层清液于另一试管中,滴加碳酸钠溶液,有白色沉淀产生;因为盐酸不足,碳酸钠与盐酸反应生成碳酸氢钠和氯化钠,所以观察不到明显现象
16.【答案】(1) 生成物生成
(2) 试管中的液面升高 水
(3) (合理即可)
(4) 溶液为无色 盐酸和硝酸银反应也能生成氯化银白色沉淀
(5) =
(6) 密封
(7) CE
17.【答案】(1)NaCl、BaCl2
(2)设参加反应的Na2SO4质量为x。
解得:
固体混合物中氯化钠的质量分数=
答:固体混合物中氯化钠的质量分数29%。
18.【答案】(1)8
(2)解:实验四,当氯化钙足量的时候,反应充分发生生成沉淀为10g,48g的食用碱就可以产生 10g×4=40g的沉淀。
(3)解:设该食用碱中 Na2CO3的质量分数为x
x≈88.3%
答:该食用碱中Na2CO3的质量分数为88.3%。
(4)解:如图所示
一、单选题
1.下列各组混合物可用过滤操作进行分离的是
A.酒精和水 B.泥沙和水 C.食盐和水 D.铁粉和铜粉
2.有关过滤操作正确的是
A.玻璃棒要紧靠三层滤纸 B.漏斗下端高于烧杯上沿
C.液面要低于漏斗边缘 D.先放置烧杯,再调整铁圈高度
3.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t2℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2C时,甲物质的饱和溶液降温至t1℃,溶液中溶质质量一定减小
4.“侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是:。如图是三种物质的溶解度曲线,下列叙述正确的是
A.NH4Cl的溶解度大于NaCl的溶解度
B.NH4Cl中含有少量NaCl,可用降温结晶的方法提纯NH4Cl
C.T1℃时,NH4Cl、NaCl两饱和溶液中溶质的质量相等
D.20℃时,将9.6gNaHCO3加入到90.4g水中,可得到100g饱和溶液
5.如图所示,甲、乙是两种物质的溶解度曲线,下列叙述正确的是下是
A.60℃时,在100g水中加入100g甲,充分溶解后溶液的质量是200g
B.40℃时,甲、乙两种物质的溶解度相等
C.20℃时甲的溶解度大于乙的溶解度
D.采用降温的方法可将乙的不饱和溶液转化为饱和溶液
6.某化工厂废水池中的溶液是无色透明的,用pH试纸检测废液,废液pH=3,则废液中存在物质合理的一组是( )
A.ZnCl2、KNO3、KMnO4 B.K2SO4、Al(NO3)3、BaCl2
C.Na2CO3、NaNO3、KCl D.Na2SO4、KNO3、MgCl2
7.向一定质量的、混合溶液中先后滴加溶液和一定质量的溶液,产生沉淀的质量与加入溶液的质量关系如下图所示。
下列说法错误的是
A.图中a到b点的变化过程中,溶液的pH先不变后增大
B.图中a、b、c三点对应溶液中的溶质均为两种
C.图中沉淀质量与的关系为
D.混合溶液中、的质量比为49:71
8.下列四个图像不能正确反映对应变化关系的是
A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾
B. 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C.实验室加热高锰酸钾制取氧气,试管中固体物质的种类变化
D.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
9.下列各组离子能共存的是( )
A.Ba2+、K+、、、H+
B.K+、Cl-、Mg2+、、H+
C.Fe3+、、OH-、Cu2+、H+
D.Ag+、Ba2+、Cl-、、K+
10.如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法中正确的是
A.三种物质的溶解度都随温度的升高而增大
B.t1℃时,将20g丙加入50g水中,充分搅拌得到70g溶液
C.t2℃时,将三种物质的饱和溶液降温到t1℃,所得溶液中的溶质质量分数:甲>乙>丙
D.当甲中混有少量乙时,提纯甲应采用的结晶方法是降温结晶
二、填空题
11.以化合价为纵坐标,物质类别为横坐标的图像叫价类图,如图是碳元素的价类图,回答有关问题。
(1)b处对应物质的类别是 ;
(2)a为天然气的主要成分,其化学式为 ;
(3)CO和CO2化学性质有很大不同,从微观角度解释它们化学性质不同的原因是 ;
12.宏观辨识与微观探析是重要的化学核心素养。
(1)NaHCO3溶液和H2SO4溶液反应的微观示意图如上图1所示。该反应中实际参加反应的粒子是 (填粒子符号)。
(2)硫及其化合物的“化合价一物质类别”关系图如上图2所示。
①请画出硫离子的结构示意图: 。
②请写出SO3与NaOH反应生成物质Z的化学方程式: 。
③关系图中有一种物质放错了位置,它是: (填物质名称)。
13.从身边的事物来看,化学就在我们的身边。
(1)医药上常用碘酒来抑制和杀灭细菌、病毒等,碘酒的溶剂是 。
(2)餐后,乐乐主动清洗碗筷,用洗洁精去除碗筷上的油污,利用的原理是 。他用肥皂水检验得知家中的井水为硬水,可用 的方法将硬水软化。
(3)如图是甲、乙、丙三种固体物质的溶解度曲线,看图并回答下列问题。
①M点表示的含义是 (合理即可)。
②t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 。
③t3℃时,将35g甲物质加入到50g水中,充分溶解后所得溶液的质量是 。
④t3℃时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温至t2℃,所得溶液中溶质质量分数由大到小的顺序是 。
三、实验探究题
14.某同学发现药品柜中盛有过氧化钠的塑料试剂瓶破裂,该同学认为过氧化钠发生了变质,对此进行以下探究。
【查阅资料】过氧化钠一般是淡黄色固体,能与水反应生成氢氧化钠和氧气;氢氧化钠和碳酸钠是白色粉末。
【进行实验】
(1)该同学观察到粉末全部变为白色,故认为粉末全部变质,请设计实验证明该同学的猜想是正确的。
实验步骤 实验现象 实验结论
取适量粉末于试管中,滴加少量的 并放入带火星的小木条 该粉末不含过氧化钠
于是同学们对变质的白色粉末的成分展开探究。
【提出问题】白色粉末的成分是什么?
【作出猜想】
(2)猜想1:氢氧化钠;
猜想2:碳酸钠;
猜想3: 。
请写出猜想2的依据: (用化学方程式表示)。
【实验探究】
(3)
实验步骤 实验现象 实验结论
①取少量溶液于试管中,向试管中滴加足量的 溶液; ②在反应后的溶液中滴入 ①有白色沉淀生成; ② 猜想3成立
【反思与评价】
(4)实验步骤①中滴加足量某溶液的目的是 。
【拓展延伸】
(5)过氧化钠可用在潜水艇或宇宙飞船等缺氧的场所,原因是 (用化学方程式表示,一个即可)。
15.碳酸钠俗称“纯碱”,兴趣小组的同学根据认识物质化学性质的思路与方法进行如表实验探究。
(1)【实验探究】
预测碳酸钠 的化学性质 ①碳酸钠能使酸 碱指示剂变色 ②碳酸钠能 与酸反应 ③碳酸钠能 与碱反应 ④碳酸钠能 与盐溶液反应
实验过程
预期现象及分析 溶液变为 色 产生气泡 产生白色沉淀,原因是 (用化学方程式表示) 产生白色沉淀
反思与评价 实验 (填序号)证明纯碱是一种水溶液呈碱性的盐
【拓展延伸】小明在进行实验②时,将稀盐酸逐滴加入碳酸钠溶液,一段时间后仍未观察到明显现象,与上述【实验探究】中的预期现象不一致,为证明该反应是否发生,他又进行如下实验:
【查阅资料】a.碳酸钠与盐酸反应是分步进行的,当盐酸不足时发生的反应为,当盐酸过量时发生的反应为;
b.碳酸氢钠溶液呈碱性,碳酸氢钠与稀氯化钙、稀氯化钡溶液不反应。
(2)【进行实验】
步骤 实验操作 实验现象
步骤1 取小明实验后的溶液于另一试管中,向其中加入过量稀氯化钙溶液 产生白色沉淀
步骤2
【实验结论】通过上述实验得出小明的实验发生了化学反应。
(3)【交流讨论】为确定步骤1中所加稀氯化钙溶液已足量,可进行的实验是 。
(4)【实验反思】通过以上探究,小明实验中产生与预期现象不一致的原因是 。
16.某学习小组的同学在整理归纳反应规律时发现,有些化学反应发生时没有伴随明显的现象,他们就此进行了以下探究。
【提出问题】怎样证明NaOH溶液分别与CO2及稀盐酸发生了反应?
【分析讨论】
(1)同学们讨论后认为,可以用两种思路探究上述反应是否发生。
思路I:验证有________。
思路Ⅱ:验证反应物减少或消失。
【实验探究】同学们分两组分别设计方案选行究。
【实验结论】
(2)第一组同学将充满CO2气体的试管倒扣在NaOH溶液中,观察到________,认为NaOH溶液和CO2发生了反应。但有同学指出,还应进行CO2与________反应的对比实验才能得出这一结论。
(3)第一组同学向反应后的溶液中加入某无色盐溶液,观察到有白色沉淀生成,也得出了NaOH溶液与CO2发生了反应的结论,生成白色沉淀的化学方程式为________(只写一个)。
(4)第二组的小明同学向丙中滴入无色酚酞溶液后,观察到________,得出NaOH溶液与稀盐酸发生了反应的结论。小亮同学向丁中滴入AgNO3溶液后,观察到有白色沉淀生成,由此他认为NaOH溶液与稀盐酸反应生成了NaCl,但小红认为小亮的结论不合理,理由是________。
(5)第二组同学进一步讨论后认为,如果将乙中的溶液蒸发结晶,再将得到的晶体溶于水,若在室温下测得该溶液的pH________(填“>”“<”或“=”)7时,则能证明有氯化钠生成。
【反思与拓展】
(6)氢氧化钠在空气中易变质,为了防止该药品变质,该药品要________保存。
(7)仅仅使用下列某种物质,能进一步证明第二组的实验中“氢氧化钠溶液与稀盐酸是否恰好完全反应”的是______(填字母)。
A. 锌片
B. 氧化铜
C. 紫色石蕊溶液
D. 硫酸铜溶液
E. pH试纸
四、计算题
17.实验室现有一包硫酸钠和氯化钠的固体混合物20g,为测定固体混合物中氯化钠的质量分数,将固体加入足量水溶解,向其中不断加入氯化钡溶液,测得生成沉淀的质量随加入氯化钡溶液的质量变化情况如图所示。
请分析并计算:
(1)a点对应溶液中的溶质为 。
(2)计算固体混合物中氯化钠的质量分数。
18.家庭食用碱的主要成分是Na2CO3,为测定该食用碱中Na2CO3的质量分数,某同学进行了以下实验:取48g食用碱,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见如表(假设该食用碱中不含难溶性杂质且杂质均不与CaCl2溶液产生沉淀)。请分析表中数据回答并计算:
实验一 实验二 实验三 实验四
食用碱的质量 12g 12g 12g 12g
加入CaCl2溶液的质量 20g 40g 60g 80g
生成沉淀的质量 4g m 10g 10g
(1)m= g。
(2)48g该食用碱与足量加入CaCl2溶液反应,最多生成沉淀质生成沉淀的质量为多少g。
(3)该食用碱中Na2CO3的质量分数是多少?(写出计算过程,答案精确到0.1%)
(4)根据表中实验数据以及适当的计算,请画出生成沉淀的质量和加入CaCl2溶液的质量的坐标关系图,请标出拐点数据。
答案解析部分
1.【答案】B
2.【答案】C
3.【答案】D
4.【答案】B
5.【答案】B
6.【答案】D
7.【答案】A
8.【答案】B
9.【答案】B
10.【答案】D
11.【答案】(1)盐
(2)
(3)一氧化碳和二氧化碳的分子构成不同
12.【答案】(1)
(2);;硫化钠
13.【答案】(1)酒精(或乙醇)
(2)乳化作用;煮沸
(3)在t2℃时,甲和丙两种物质的溶解度相等;丙>乙>甲;80;乙>甲>丙
14.【答案】水;带火星的小木条不复燃;碳酸钠和氢氧化钠;;氯化钙;酚酞试液(合理即可);溶液变为红色(与前空对应);除去溶液中的碳酸钠,防止对氢氧化钠的检验产生干扰;
15.【答案】红;;①;另取步骤1中少量上层清液于另一试管中,滴加无色酚酞溶液;溶液变红;取步骤1中少量上层清液于另一试管中,滴加碳酸钠溶液,有白色沉淀产生;因为盐酸不足,碳酸钠与盐酸反应生成碳酸氢钠和氯化钠,所以观察不到明显现象
16.【答案】(1) 生成物生成
(2) 试管中的液面升高 水
(3) (合理即可)
(4) 溶液为无色 盐酸和硝酸银反应也能生成氯化银白色沉淀
(5) =
(6) 密封
(7) CE
17.【答案】(1)NaCl、BaCl2
(2)设参加反应的Na2SO4质量为x。
解得:
固体混合物中氯化钠的质量分数=
答:固体混合物中氯化钠的质量分数29%。
18.【答案】(1)8
(2)解:实验四,当氯化钙足量的时候,反应充分发生生成沉淀为10g,48g的食用碱就可以产生 10g×4=40g的沉淀。
(3)解:设该食用碱中 Na2CO3的质量分数为x
x≈88.3%
答:该食用碱中Na2CO3的质量分数为88.3%。
(4)解:如图所示
同课章节目录
